第五章 晶体结构1教材
- 格式:ppt
- 大小:3.76 MB
- 文档页数:52

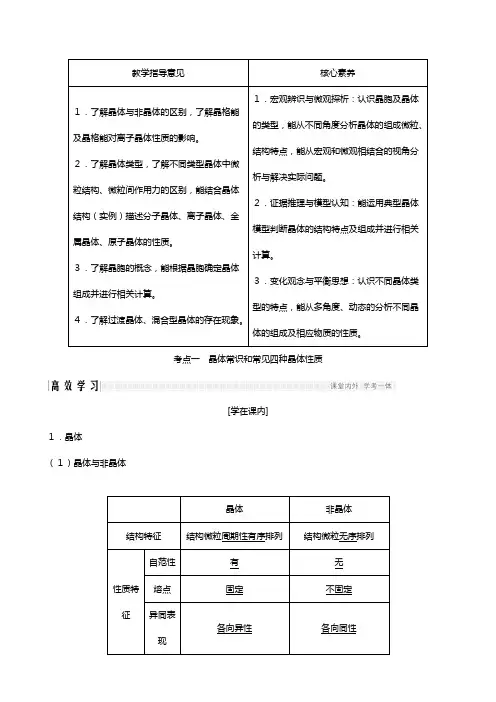
教学指导意见核心素养1.了解晶体与非晶体的区别,了解晶格能及晶格能对离子晶体性质的影响。
2.了解晶体类型,了解不同类型晶体中微粒结构、微粒间作用力的区别,能结合晶体结构(实例)描述分子晶体、离子晶体、金属晶体、原子晶体的性质。
3.了解晶胞的概念,能根据晶胞确定晶体组成并进行相关计算。
4.了解过渡晶体、混合型晶体的存在现象。
1.宏观辨识与微观探析:认识晶胞及晶体的类型,能从不同角度分析晶体的组成微粒、结构特点,能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:能运用典型晶体模型判断晶体的结构特点及组成并进行相关计算。
3.变化观念与平衡思想:认识不同晶体类型的特点,能从多角度、动态的分析不同晶体的组成及相应物质的性质。
考点一晶体常识和常见四种晶体性质[学在课内]1.晶体(1)晶体与非晶体晶体非晶体结构特征结构微粒周期性有序排列结构微粒无序排列性质特征自范性有无熔点固定不固定异同表现各向异性各向同性对固体进行X射线衍射实验(2)得到晶体的途径1熔融态物质凝固。
2气态物质冷却不经液态直接凝固(凝华)。
3溶质从溶液中析出。
(3)晶胞1概念:描述晶体结构的基本单元。
2晶体中晶胞的排列——无隙并置A.无隙:相邻晶胞之间没有任何间隙。
B.并置:所有晶胞平行排列、取向相同。
(4)晶格能1定义:气态离子形成1摩尔离子晶体释放的能量,通常取正值,单位:kJ·mol—1。
2影响因素A.离子所带电荷数:离子所带电荷数越多,晶格能越大。
B.离子的半径:离子的半径越小,晶格能越大。
3与离子晶体性质的关系晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
[名师点拨](1)具有规则几何外形的固体不一定是晶体,如玻璃。
(2)晶胞是从晶体中“截取”出来具有代表性的“平行六面体”,但不一定是最小的“平行六面体”。
2.四种晶体类型的比较[考在课外]教材延伸判断正误(1)晶体和非晶体的本质区别是晶体中粒子在微观空间里呈周期性的有序排列。



第五章 晶体结构安徽师范大学化学与材料科学学院§51晶体的点阵理论晶体具有按一定几何规律排列的内部结构,即晶 体由原子(离子、原子团或离子团)近似无限地、在三 维空间周期性地呈重复排列而成。
这种结构上的长 程有序,是晶体与气体、液体以及非晶态固体的本 质区别。
晶体的内部结构称为晶体结构。
1. 晶体的结构特征(1)均匀性(2) 各向异性(3) 自发形成多面体外形(4) 具有确定的熔点(5) 对称性(6) X射线衍射2.周期性下面两个图形均表现出周期性:沿直线方向,每 隔相同的距离,就会出现相同的图案。
如果在图形 中划出一个最小的重复单位(阴影部分所示),通 过平移,将该单位沿直线向两端周期性重复排列, 就构成了上面的图形。
最小重复单位的选择不是唯一的,例如,在图(a) 中,下面任何一个图案都可以作为最小的重复单位。
点的位置可以任意指定,可以在单位中或边缘的任 何位置,但一旦指定后,每个单位中的点的位置必须 相同。
如,不论点的位置如何选取,最后得到的一组点在空间 的取向以及相邻点的间距不会发生变化。
3.结构基元在晶体中,原子(离子、原子团或离子团)周期性地重 复排列。
上面我们在图形找出了最小的重复单位,类似 的,可以在晶体中划出结构基元。
结构基元是指晶体中 能够通过平移在空间重复排列的基本结构单位。
【例1】一维实例:在直线上等间距排列的原子。
一个原子组成一个结构基元,它同时也是基本的化学组成单位。
结构基元必须满足如下四个条件:化学组成相同;空间结构相 同;排列取向相同;周围环境相同。
【例2】一维实例:在伸展的聚乙烯链中,CH2CH2组成一个 结构基元,而不是CH2。
【例3】二维实例:层状石墨分子,其结构基元由两个C原子组 成(相邻的2个C原子的周围环境不同)。
结构基元可以有不同的选法,但其中的原子种类和数目应保 持不变。






晶面间距与晶格常数第五章 晶体的质点堆积与缺陷¾ 密堆积原理 ¾ 配位数和配位多面体 ¾ 化学键和晶格类型¾ 晶体的缺陷晶体化学晶体化学:研究晶体结构和晶体化学组成与其性质之间的关系和规律性的分支学科。
材料科学:晶体结构=空间点阵+基元Na+Cl-•晶体结构中的质点(阵点或基元)可以是原子、离子 或分子。
•晶体化学主要阐述这些质点的特性:离子类型、离子 和原子半径等; •讨论质点在组成晶体结构时的相互作用和规律:离子 或原子相互结合时的堆积方式和配位形式、键和晶格 类型。
z 理论半径:将原子或离子的电子云分布视为球形,其半 径为原子或离子的理论半径。
• 原子在形成化学键时,总要有一定程度的轨道重叠,而且 与不同的原子分别成化学键时,原子轨道重叠的程度又各 有不同,因此单纯地把原子半径理解成原子最外层电子到 原子核的距离是不严格的。
z 有效半径:以键长数据为基础,由实验方法得到的原子或 离子的半径,称为原子或离子的有效半径。
共价半径、金 属半径、范德华半径。
• 原子或离子半径的影响因素:价态、配位数、电子自旋态• 原子和离子半径的大小,特别是相对大小对晶体结构中的质 点的排列方式影响很大。
其对理解和阐明晶体结构类型的变化、 晶体化学组成的变异以及有关物理性质的变化都是非常重要的。
元素的原子半径和共价半径原子或离子半径的基本规律原子或离子半径的影响因素:价态、配位数、电子自旋态z 同种元素原子半径: 共价半径 < 金属原子半径 z 同种元素离子半径:阳离子半径小于原子半径,价态高半径小; 阴离子半径大于原子半径,负价高半径大; 氧化态相同,配位数高半径大; z 同族元素: 原子和离子半径随周期数增加而增大 z 同周期元素: 原子和离子半径随Z的增加而减小 z 从周期表左上到右下对角线上,阳离子半径近于相等 z 镧系和锕系:阳离子半径随Z增加而略有减小 z 通常, 阳离子半径都小于阴离子半径。