物理化学第二章3
- 格式:ppt
- 大小:928.00 KB
- 文档页数:39
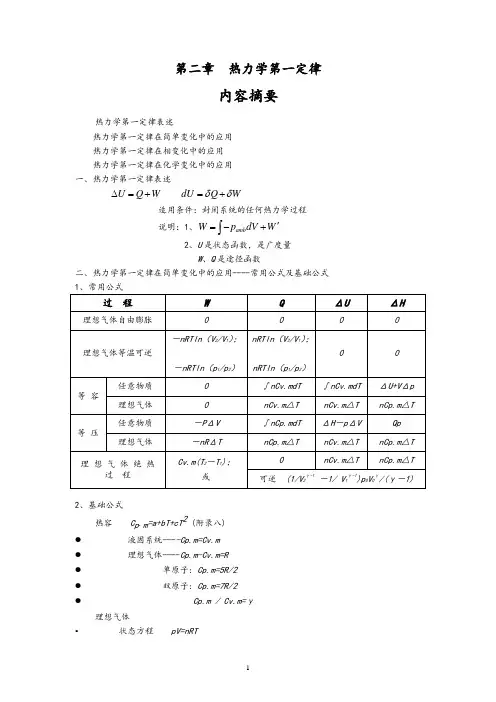
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。


第二章 主要公式及适用条件热力学第一定律dU = δQ + δW 或 ∆U = Q + W一.体积功WdV p W amb -=⎰或 dV p W amb -=δ 适用于任何系统、任何过程的体积功的计算。
1.自由膨胀过程(向真空膨胀): W = 02.恒外压过程: )(12V V p W amb --=3.恒容过程:4. 恒压过程: )(12V V p W --= 一定量理想气体恒压过程 T nR W ∆-=5.一定量理想气体恒温可逆过程:1221lnln p p nRT V V nRT W ==6.一定量理想气体绝热可逆过程W = ΔU = n C v.m (T 2-T 1) 或)11(1111211----=γγγγV V V p W(其中 γ = C p.m / C v.m 称为绝热指数 也称热容商。
)7.恒温恒压相变过程: W = - p (V β-V α )若β相为理想气体: W = - p V g = -nRT8.恒温恒压化学反应;且气体视为理想气体W = - R T(g ) (式中为反应计量系数,反应物为“-”,产物为“+”。
)二.热容热容定义 C = Q / ΔT = δQ / d TC v. m = δQ v / d T = (әU m / әT )vC p. m =δQ p / d T = (әH m /әT )p对理想气体 C p.m – C v.m = R单原子分子 C v.m = 3R /2 , C p.m = 5R / 2双原子分子 C v.m = 5R/2, C p.m =7R /2多原子分子 C v.m = 3 R , C p.m = 4 R三. 热1.封闭体系无非体积功恒容变温过程:dT nC Q T T m V V ⎰=21, 若常数=m V C ,,则)(12,T T nC Q m V V -=2.封闭体系无非体积功恒压变温过程: dT nC Q T T m p V ⎰=21,若常数=m p C ,,则)(12,T T nC Q m p p -=3.绝热过程及理想气体自由膨胀过程:Q = 04.恒温恒压无非体积功的相变过程:Q p = n ΔH m5.恒温恒压与恒温恒容化学反应 Q p 与Q v 关系:Q p –Q v = Δr H – Δr U = R T Δn或Q p.m –Q v.m = Δr H m – Δr U m = R T四.热力学能(内能):ΔU = Q + W1.一定量理想气体恒温过程或隔离体系任何过程 ΔU = 02.封闭体系无非体积功恒容变化或一定量理想气体任何过程dT nC U T T m V ⎰=∆21, 3.绝热过程:ΔU = W (Q =0)五.焓:定义: H = U + p V1. 封闭体系任何过程ΔH = ΔU + Δ(p V ) = ΔU + (p 2V 2 – p 2V 2 )2.封闭体系无非体积功的恒压变化或一定量理想气体任何状态变化过程dT nC H T T m p ⎰=∆21, 3.一定量理想气体恒温、实际气体节流膨胀及恒压无非体积功的绝热化学反应过程 ΔH = 0 。





第一章 气体本章小结1.理想气体状态方程 pV =nRT pV m =RT pV =(m /M ) RT气体的密度 ρ =m /V =pM /(RT ) 2. 道尔顿分压定律 B p p =∑B B n RTp V =BB p x p= B B p x p = 3. 实际气体的液化和临界点实际气体在临界温度以下通过加压可以被液化。
理想气体则不能。
临界温度T c 是实际气体能被液化的最高温度,在临界温度时使气体液化所需要的最小压力叫临界压力p c 。
在描述实际气体液化的p -V 图上,临界温度和临界压力所对应的点称为临界点。
0cT p V ∂⎛⎫= ⎪∂⎝⎭ 220cT p V ⎛⎫∂= ⎪∂⎝⎭ 临界温度和临界压力时所对应的体积称为临界摩尔体积V m,c 。
临界温度、临界压力和临界摩尔体积统称为临界参数,各种实际气体的临界参数可以在各类物理化学数据手册中查得。
4. 实际气体的范德华方程范德华研究了实际气体与理想气体产生偏差的两个因素-分子本身占有体积和分子间存在作用力,由此引入两个校正项,得适用于1mol 气体的范德华方程为()2m m a p V b RT V ⎛⎫+-= ⎪⎝⎭适用于n mol 气体的范德华方程为()22an p V nb nRT V ⎛⎫+-= ⎪⎝⎭公式中的a 和b 称为范德华常数,可以通过气体的临界参数计算2227,648c c ccR T RT a b p p == 符合范德华方程的气体称为范德华气体,范德华气体的玻意尔温度为,00B m B T p pV a T p Rb →⎛⎫∂=⇒=⎪∂⎝⎭5. 压缩因子与压缩因子图m pV pV Z RT nRT ==Z 称为压缩因子,Z >1,气体较难压缩,Z <1,气体较易压缩,Z =1,还原为理想气体。
Z 值可由对比温度(/c T T τ=)和对比压力(/c p p π=)通过压缩因子图查得。
查得Z 值后可用上述方程求算实际气体的p -V -T 。



第二章2.1 1mol 理想气体在恒定压力下温度升高1℃,求过程中系统与环境交换的功。
解:理想气体n = 1mol恒压升温p 1, V 1, T 1 p 2, V2, T 2 对于理想气体恒压过程,应用式(2.2.3)W =-p amb ΔV =-p(V 2-V 1) =-(nRT 2-nRT 1) =-8.314J2.2 2.2 1mol 1mol 水蒸气(H 2O,g)在100℃,101.325kPa 下全部凝结成液态水。
求过程的功。
假设:相对于水蒸气的体积,液态水的体积可以忽略不计。
解: n = 1mol H 2O(g) H 2O(l)恒温恒压相变过程,水蒸气可看作理想气体, 应用式(2.2.3)W =-p amb ΔV =-p(V l -V g ) ≈ pVg = nRT = 3.102kJ 2.3 在25℃及恒定压力下,电解1mol 水(H 2O,l),求过程的体积功。
H 2O(l) = H 2(g) + 1/2O 2(g) 解: n = 1mol H 2O(l) H 2(g) + + O 2(g) n 1=1mol 1mol + 0.5mol = n 0.5mol = n 2V 1 = V l V(H 2) + V (O V(O 2) = V2 恒温恒压化学变化过程, 应用式(2.2.3)W=-p amb ΔV =-(p 2V 2-p 1V 1)≈-p 2V 2 =-n 2RT=-3.718kJ100℃,101.325kPa25℃,101.325kPa2.4 系统由相同的始态经过不同途径达到相同的末态。
若途径a 的Q a =2.078kJ ,Wa=-4.157kJ ;而途径b 的Q b =-0.692kJ 。
求W b 解: 热力学能变只与始末态有关,与具体途径无关,故 ΔU a = ΔU b由热力学第一定律可得 Qa + Wa = Q b + W b ∴ W b = Q a + W a -Q b = -1.387kJ2.6 4mol 4mol 某理想气体,温度升高20℃, 求ΔH -ΔU 的值。
第二三章例题例题 ( P199 第3题)指出下列过程中,∆U 、∆H 、∆S 、∆A 、∆G 何者为零(1) 理想气体真空膨胀 ∆U=∆H=0(2) 理想气体的等温可逆膨胀 ∆U=∆H=0(3) 理想气体绝热流膨胀 ∆U=∆H=0(4) 实际气体绝热可逆膨胀 ∆S=0(5) 实际气体绝热节流膨胀 ∆H=0(6) H 2(g) 和 O 2(g) 在绝热钢瓶中发生反应生成水 ∆U=0(7) H 2(g) 和 Cl 2(g) 在绝热钢瓶中发生反应生成HCl(g) ∆H= ∆U=0(8 ) 液态水在373.15K 和101325Pa 下蒸发为气 ∆G=0(9) 在等温、等压、 不作非膨胀功的条件下,下列反应达到平衡 ∆G=03H 2(g) + N 2(g) = 2 N H 3(g )(10) 在绝热、恒压、 不作非膨胀功的条件下,发生了一个化学反应 ∆H= Q p =0(11) 理想气体的卡诺循环: ∆U=∆H=∆S=∆A=∆G=0(12) 理想气体的绝热可逆膨胀 ∆S=0例题2. 在下列结论中,正确的划 √,错误的划 × ,下列的过程可应用公式 ΔS =nR ln(V 2/V 1) 进行计算:(1) 理想气体恒温可逆膨胀 (2) 理想气体绝热可逆膨胀 (3) 理想气体向真空膨胀答:(1)例题3. 选择“>”、“<”、“=”中的一个填入下列空格:理想气体经节流膨胀ΔU _____ 0,ΔS _____ 0,ΔG _____ 0。
答:理想气体的焦-汤系数为零,膨胀后温度补不变 ΔU=0,ΔH=0 ; 流膨胀是绝热不可逆过程ΔS>0 节ΔG=ΔH-T ΔS= -T ΔS < 0例题在绝热条件下,用大于气缸内的压力迅速推动活塞压缩气体,此过程的熵变(A) 大于零 (B) 小于零 (C) 等于零 (D) 不能确定答 (A)例题4 在Op 下,C(石墨) + O 2 (g)─→CO 2(g) 的反应热为O ∆m r H ,下列哪种说法是错误的?(A) O ∆m r H 是CO 2(g)的标准生成热(B) O ∆m r H = O ∆m r U(C) O ∆m r H 是石墨的燃烧热(D) O ∆m r H > O ∆m r U答:(D) 因为0)(=∑g B B ν O O O ∆=+∆=∆∑m r BB m r m r U RT g U H )(ν例题 5.在一定温度范围内,某化学反应的∆r H 不随温度而变,故此化学反应在该温度范围内的∆r S 随温度而( )。