物理化学第二章热力学第二定律练习题及答案
- 格式:doc
- 大小:75.50 KB
- 文档页数:11


物理化学测验(二)2003-04-12一、填空题。
在题中“____”处填上答案。
1、(本小题1分)公式的适用条件是 , 。
2、(本小题1分)理想气体节流膨胀时, 0。
(选填 >,=,<) 3、(本小题2分)按系统与环境之间物质及能量的传递情况,系统可分为 系统、 系统、 系统。
4、(本小题2分)已知∆f H (FeO , s , 298 K) =-226.5 kJ ·mol -1; ∆f H (CO 2 , g , 298 K) =-393.51 kJ ·mol -1; ∆f H (Fe 2O 3 , s , 298 K) =-821.32 kJ ·mol -1; ∆f H (CO , g , 298 K) =-110.54 kJ ·mol -1;则 Fe 2O 3(s) + CO(g) == 2FeO(s) + CO 2(g)反应的∆r H (298 K) = 。
5、(本小题2分)某气体的C p ,m = 29.16 J ·K -1·mol -1,1 mol 该气体在等压下,温度由20℃变为10℃,则其熵变∆S = 。
6、(本小题2分)绝热不可逆膨胀过程系统的∆S 0,绝热不可逆压缩过程系统的∆S 0。
(选填 >,< 或 = )7、(本小题5分)5 mol 某理想气体由27℃,10 kPa 恒温可逆压缩到100 kPa ,则该过程的∆U = ,∆H = ,Q = ,∆S = 。
8、(本小题2分)公式∆A=W’的适用条件是 , 。
9、(本小题2分)1 mol 理想气体在绝热条件下向真空膨胀至体积变为原体积的10倍,则此过程的∆S = 。
10、(本小题2分)一绝热气缸带有一无磨擦无质量的活塞,内装理想气体,气缸内壁绕有电阻为R 的电阻丝,以电流I 通电加热,气体慢慢膨胀,这是一个 过程,当通电时间t 后,∆H = 。


热力学第二定律练习题1.关于热力学第二定律,下列说法不正确的是:A. 第二类永动机是不可能制造出来的B. 把热从低温物体传到高温物体,不引起其它变化 是不可能的C. 一切实际过程都是热力学不可逆过程D. 功可以全部转化为热,但热一定不能全部转化为功2.应用克劳修斯不等式 Q dS T δ≥环判断,下列不正确的是: A.QdS T δ=环必为可逆过程或处于平衡状态 B.Q dS T δ>环必为不可逆过程 C.Q dS T δ>环必为自发过程 D.QdS T δ<环违反卡诺定理和第二定律,过程不可能发生3.下列计算熵变公式中,错误的是:A. 水在25℃、p ө下蒸发为水蒸气:T G H S Δ−Δ=Δ B. 任意可逆过程: RT Q δdS ⎟⎠⎞⎜⎝⎛= C. 环境的熵变:环体系环境T Q S −=ΔD. 在等温等压下,可逆电池反应:T H S Δ=Δ4.一理想气体与温度为T 的热源接触,分别做 等温可逆膨胀和等温不可逆膨胀到达同一终态, 已知 ,下列式子中不正确的是:Ir R 2W W =A.B .Ir R S S Δ>ΔIr R S S Δ=ΔC. T Q S Ir R 2=Δ D. (等温可逆)总S Δ0=Δ+Δ=环体S S 总S Δ(等温不可逆)0>Δ+Δ=环体S S5.在一定速度下发生变化的孤立体系,其总熵的变化:A .不变 B. 可能增大或减小C .总是增大 D. 总是减小6.某系统经历一个不可逆循环后,下列正确的是A. ΔS体>0,ΔS环>0B. ΔS体=0,ΔS环=0C. ΔS体>0,ΔS环=0D. ΔS体=0,ΔS环>07.一定量理想气体经绝热恒外压压缩至终态,这时系统和环境的熵变应为A. ΔS体>0,ΔS环>0B. ΔS体<0,ΔS环<0C. ΔS体>0,ΔS环=0D. ΔS体<0,ΔS环=08.实际气体CO2经节流膨胀后温度下降,则:A. ∆S(体) > 0,∆S(环) > 0B. ∆S(体) < 0,∆S(环) > 0C. ∆S(体) > 0,∆S(环) = 0D. ∆S(体) < 0,∆S(环) = 09.实际气体进行绝热自由膨胀,ΔU和ΔS的变化为A. ΔU=0,ΔS>0B. ΔU<0,ΔS<0C. ΔU=0,ΔS=0D. ΔU>0,ΔS>010.1mol理想气体从p1、V1、T1分别经:(a) 绝热可逆膨胀到p2、V2、T2;(b) 绝热恒外压膨胀到p3、V3、T3,若p2 = p3,则A. T3=T2,V3=V2,S3=S2B. T3>T2,V3<V2,S3<S2C. T3>T2,V3>V2,S3>S2D. T3<T2,V3>V2,S3<S211.n mol某气体的恒容下由T1加热到T2,其熵变为ΔS1,相同量的气体在恒压下由T1加热到T2,其熵变为ΔS2,则ΔS1与ΔS2的关系为A. ΔS1 >ΔS2B. ΔS1 =ΔS2C. ΔS1 <ΔS2D. ΔS1 =ΔS2 = 012.当理想气体在等温(500K)下进行膨胀时,求得体系的熵变∆S = l0 J·K-1,若该变化中所做的功仅为相同终态最大功的1/10,该变化中从热源吸热:A. 5000JB. 500JC. 50JD. 100J13.由1mol理想气体A[C V,m(A)=2.5R]与1mol理想气体B[C V,m(B)=3.5R]组成理想气体混合物。

热力学第二定律练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、热力学第二定律的克劳修斯说法是:热从低温物体传给高温物体是不可能的 ( )2、组成可变的均相系统的热力学基本方程 d G =-S d T +V d p +d n B ,既适用于封闭系统也适用于敞开系统。
( )3、热力学第三定律的普朗克说法是:纯物质完美晶体在0 K 时的熵值为零。
( )4、隔离系统的熵是守恒的。
( )5、一定量理想气体的熵只是温度的函数。
( )6、一个系统从始态到终态,只有进行可逆过程才有熵变。
( )7、定温定压且无非体积功条件下,一切吸热且熵减少的反应,均不能自发发生。
( )8、系统由状态1经定温、定压过程变化到状态2,非体积功W ’<0,且有W ’>∆G 和∆G <0,则此状态变化一定能发生。
( )9、绝热不可逆膨胀过程中∆S >0,则其相反的过程即绝热不可逆压缩过程中∆S <0。
( ) 10、克-克方程适用于纯物质的任何两相平衡。
( )11、如果一个化学反应的∆r H 不随温度变化,则其∆r S 也不随温度变化, ( )12、在多相系统中于一定的T ,p 下物质有从化学势较高的相自发向化学势较低的相转移的趋势。
( ) 13、在-10℃,101.325 kPa 下过冷的H 2O ( l )凝结为冰是一个不可逆过程,故此过程的熵变大于零。
( ) 14、理想气体的熵变公式只适用于可逆过程。
( )15、系统经绝热不可逆循环过程中∆S = 0,。
( )二、选择题1 、对于只做膨胀功的封闭系统的(∂A /∂T )V 值是:( ) (1)大于零 (2) 小于零 (3)等于零 (4)不确定 2、 从热力学四个基本过程可导出VU S ∂⎛⎫⎪∂⎝⎭=( ) (1) (2) (3) (4) T p S pA H U G V S V T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫ ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭3、1mol 理想气体(1)经定温自由膨胀使体积增加1倍;(2)经定温可逆膨胀使体积增加1倍;(3)经绝热自由膨胀使体积增加1倍;(4)经绝热可逆膨胀使体积增加1倍。


物理化学第二章热力学第二定律练习题及答案第二章 热力学第二定律练习题一、判断题(说法正确否):1.自然界发生的过程一定是不可逆过程。
2.不可逆过程一定是自发过程。
3.熵增加的过程一定是自发过程。
4.绝热可逆过程的∆S = 0,绝热不可逆膨胀过程的∆S > 0,绝热不可逆压缩过程的∆S < 0。
5.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条绝热可逆途径来计算。
6.由于系统经循环过程后回到始态,∆S = 0,所以一定是一个可逆循环过程。
7.平衡态熵最大。
8.在任意一可逆过程中∆S = 0,不可逆过程中∆S > 0。
9.理想气体经等温膨胀后,由于∆U = 0,所以吸的热全部转化为功,这与热力学第二定律矛盾吗?10.自发过程的熵变∆S > 0。
11.相变过程的熵变可由T H S ∆=∆计算。
12.当系统向环境传热时(Q < 0),系统的熵一定减少。
13.一切物质蒸发时,摩尔熵都增大。
14.冰在0℃,p 下转变为液态水,其熵变TH S ∆=∆>0,所以该过程为自发过程。
15.自发过程的方向就是系统混乱度增加的方向。
16.吉布斯函数减小的过程一定是自发过程。
17.在等温、等压下,吉布斯函数变化大于零的化学变化都不能进行。
18.系统由V 1膨胀到V 2,其中经过可逆途径时做的功最多。
19.过冷水结冰的过程是在恒温、恒压、不做其他功的条件下进行的,由基本方程可得∆G = 0。
20.理想气体等温自由膨胀时,对环境没有做功,所以 -p d V = 0,此过程温度不变,∆U = 0,代入热力学基本方程d U = T d S - p d V ,因而可得d S = 0,为恒熵过程。
21.是非题:⑴“某体系处于不同的状态,可以具有相同的熵值”,此话对否?⑵“体系状态变化了,所有的状态函数都要变化”,此话对否?⑶ 绝热可逆线与绝热不可逆线能否有两个交点?⑷ 自然界可否存在温度降低,熵值增加的过程?举一例。
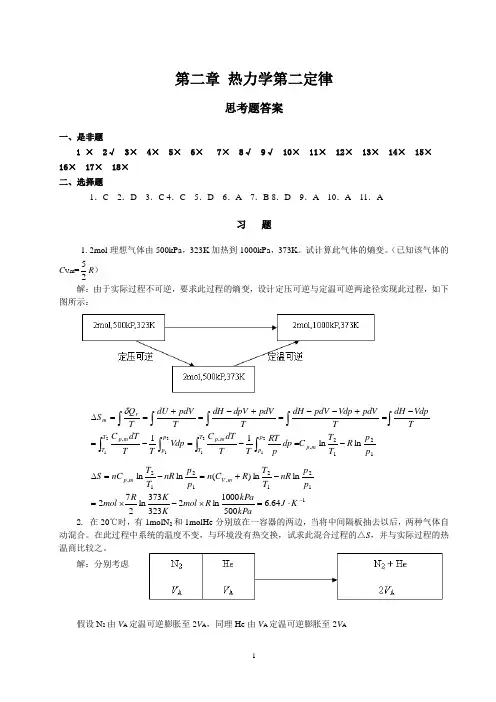
第二章 热力学第二定律思考题答案一、是非题1 × 2√ 3× 4× 5× 6× 7× 8√ 9√ 10× 11× 12× 13× 14× 15× 16× 17× 18× 二、选择题1.C 2.D 3.C 4.C 5.D 6.A 7.B 8.D 9.A 10.A 11.A习 题1. 2mol 理想气体由500kPa ,323K 加热到1000kPa ,373K 。
试计算此气体的熵变。
(已知该气体的C V ,m =25R ) 解:由于实际过程不可逆,要求此过程的熵变,设计定压可逆与定温可逆两途径实现此过程,如下图所示:1212,,,ln ln 1121212121p pR T T C dp p RT T T dT C Vdp TTdT C TVdpdH T pdV Vdp pdV dH T pdV dpV dH TpdVdU T Q S m p p p T T m p p p T T m p rm -=-=-=-=+--=+-=+==∆⎰⎰⎰⎰⎰⎰⎰⎰⎰δ11212,1212,64.65001000ln 2323373ln 272ln ln )(ln ln -⋅=⨯-⨯=-+=-=∆K J kPakPa R mol K K R mol p pnR T T R C n p p nR T T nC S m V m p2. 在20℃时,有1molN 2和1molHe 分别放在一容器的两边,当将中间隔板抽去以后,两种气体自动混合。
在此过程中系统的温度不变,与环境没有热交换,试求此混合过程的△S ,并与实际过程的热温商比较之。
解:分别考虑假设N 2由V A 定温可逆膨胀至2V A ,同理He 由V A 定温可逆膨胀至2V A△S 1 = n (N 2)R ln2 △S 2 = n (He)R ln2所以系统的 △S = △S 1+△S 2 = n (N 2) R ln2 + n (He) R ln2= 2×1mol×8.314 J ·mol -1·K -1×ln2 = 11.52J.K -1而实际过程系统没有与环境交换热和功,则 TQ= 0 即 △S >TQ 3. 1 mol 双原子理想气体,温度为298.15 K ,压强为p θ,分别进行:(1)绝热可逆膨胀至体积增加1倍;(2)绝热自由膨胀至体积增加1倍。

热力学第二定律课后习题答案习题1在300 K ,100 kPa 压力下,2 mol A 和2 mol B 的理想气体定温、定压混合后,再定容加热到600 K 。
求整个过程的∆S 为若干?已知C V ,m ,A = 1.5 R ,C V ,m ,B = 2.5 R[题解]⎪⎩⎪⎨⎧B(g)2mol A(g)2mol ,,纯态 3001001K kPa,()−→−−−−混合态,,2mol A 2mol B100kPa 300K 1+==⎧⎨⎪⎪⎩⎪⎪p T 定容()−→−−2混合态,,2mol A 2mol B 600K 2+=⎧⎨⎪⎩⎪T ∆S = ∆S 1 + ∆S 2,n = 2 mol∆S 1 = 2nR ln ( 2V / V ) = 2nR ln2 ∆S 2 = ( 1.5nR + 2.5nR ) ln (T 2 / T 1)= 4nR ln2 所以∆S = 6nR ln2= ( 6 ⨯ 2 mol ⨯ 8.314 J ·K -1·mol -1 ) ln2 = 69.15 J ·K -1 [导引]本题第一步为理想气体定温定压下的混合熵,相当于发生混合的气体分别在定温条件下的降压过程,第二步可视为两种理想气体分别进行定容降温过程,计算本题的关键是掌握理想气体各种变化过程熵变的计算公式。
习题22 mol 某理想气体,其定容摩尔热容C v ,m =1.5R ,由500 K ,405.2 kPa 的始态,依次经历下列过程:(1)恒外压202.6 kPa 下,绝热膨胀至平衡态; (2)再可逆绝热膨胀至101.3 kPa ; (3)最后定容加热至500 K 的终态。
试求整个过程的Q ,W ,∆U ,∆H 及∆S 。
[题解] (1)Q 1 = 0,∆U 1 = W 1, nC V ,m (T 2-T 1))(1122su p nRT p nRT p --=, K400546.2022.405)(5.11221211212====-=-T T kPa p kPa p T p T p T T ,得,代入,(2)Q 2 = 0,T T p p 3223111535325=-=-=--()γγγγ,, T T 320.42303==-()K(3)∆V = 0,W 3 = 0,Q U nC T T V 3343232831450030314491==-=⨯⨯⨯-=∆,()[.(.)].m J kJp p T T 434350030310131671==⨯=(.).kPa kPa 整个过程:Q = Q 1 + Q 2+ Q 3 =4.91kJ ,∆U = 0,∆H = 0,Q + W = ∆U ,故W =-Q =-4.91 kJ∆S nR p p ==⨯=--ln (.ln ..).141128314405616711475J K J K ··[导引]本题的变化过程为单纯pVT 变化,其中U 、H 和S 是状态函数,而理想气体的U 和H 都只是温度的函数,始终态温度未变,故∆U = 0,∆H = 0。

第二章热力学第二定律物化试卷(一)1.理想气体绝热向真空膨胀,则:(A) ΔS = 0 , W = 0 (B) ΔH = 0,ΔU = 0(C) ΔG = 0,ΔH = 0 (D) ΔU = 0,ΔG =02.熵变ΔS是: (1) 不可逆过程热温商之和 (2) 可逆过程热温商之和 (3) 与过程无关的状态函数 (4) 与过程有关的状态函数 以上说法正确的是:(A) 1,2 (B) 2,3 (C) 2 (D) 43. 理想气体经可逆与不可逆两种绝热过程:(A) 可以从同一始态出发达到同一终态(B) 从同一始态出发,不可能达到同一终态(C) 不能断定 (A)、(B) 中哪一种正确(D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定4. 在标准压力,273.15 K下水凝结为冰,判断体系的下列热力学量中何者一定为零?(A) ΔU (B) ΔH (C) ΔS (D) ΔG5. 水在 100℃,标准压力下沸腾时,下列各量何者增加?(A) 熵 (B) 汽化热 (C) 吉布斯自由能 (D) 蒸气压6. 在 N2和 O2混合气体的绝热可逆压缩过程中,体系的热力学函数变化值在下列结论中正确的是:(A) ΔU = 0 (B) ΔF = 0(C) ΔS = 0 (D) ΔG = 07. 在 270 K,101.325 kPa 下,1 mol过冷水经等温等压过程凝结为同样条件下的冰,则体系及环境的熵变应为:(A) ΔS(体系)< 0 , ΔS(环境)< 0 (B) ΔS(体系)< 0 , ΔS(环境)> 0(C) ΔS(体系)> 0 , ΔS(环境)< 0 (D) ΔS(体系)> 0 , ΔS(环境)> 08. 理想气体在等温条件下,经恒外压压缩至稳定, 此变化中的体系熵变ΔS(体)及环境熵变ΔS(环)应为:(A) ΔS(体)> 0 , ΔS(环)< 0 (B)ΔS(体)< 0 , ΔS(环)> 0(C) ΔS(体)> 0 , ΔS(环)= 0 (D)ΔS(体)< 0 , ΔS(环)= 09.一个由气相变为凝聚相的化学反应,在恒温恒容下自发进行,问下列各组答案中,哪一个是正确的?(A) ΔS(体)>0, ΔS(环)<0 (B) ΔS(体)<0, ΔS(环)>0(C) ΔS(体)<0, ΔS(环)=0 (D) ΔS(体)>0, ΔS(环)=010. 在一简单的(单组分,单相,各向同性)封闭体系中,恒压只做膨胀功的条件下,吉布斯自由能值随温度升高如何变化?(A) (TG/TT)p> 0 (B) (TG/TT)p< 0(/(C) (TG/TT)p= 0 (D) 视具体体系而定11. 某气体的状态方程为p V(m) = RT +αp,其中α为大于零的常数,该气体经恒温膨胀,其热力学能:(A) 不变 (B) 增大 (C) 减少 (D) 不能确定12. 下列四个关系式中,哪一个不是麦克斯韦关系式?(A) (TT/TV)s=(TV/TS)p (B) (TT/Tp)s=(TV/TS)p(C) (TS/TV)T=(Tp/TT)v (D) (TS/Tp)T= -(TV/TT)p13. 下列各式中哪个是化学势?(A) (?T H/?T n(B))T,S, (B) (?T F/?T n(B))T,p,(C) (?T G/?T n(B))T,V, (D) (?T U/?T n(B))S,V,14. 298 K,标准压力下,有两瓶萘的苯溶液,第一瓶为 2 dm3(溶有 0.5 mol 萘), 第二瓶为 1 dm3(溶有 0.25 mol 萘),若以μ1,μ2分别表示两瓶中萘的化学势,则:(A)μ1 = 10μ2 (B)μ2= 2μ2(C) μ1 = μ2(D) μ1= 0.5μ215. 重结晶制取纯盐的过程中,析出的 NaCl 固体的化学势与母液中 NaCl 的化学势比较,高低如何?(A) 高 (B) 低 (C) 相等 (D) 不可比较16. 热力学第三定律可以表示为:(A) 在0 K 时,任何晶体的熵等于零 (B) 在0 K 时,任何完整晶体的熵等于零(C) 在0 ℃时,任何晶体的熵等于零(D) 在0 ℃时,任何完整晶体的熵等于零17.下列四种表述: (1) 等温等压下的可逆相变过程中,体系的熵变ΔS =ΔH 相变/T 相变(2) 体系经历一自发过程总有 ΔS > 0(3) 自发过程的方向就是混乱度增加的方向 (4) 在绝热可逆过程中,体系的熵变为零 两者都不正确者为:(A) (1),(2) (B) (3),(4)(C) (2),(3)(D) (1),(4)18. 在绝热条件下,用大于气筒内的压力迅速推动活塞压缩气体,此过程的熵变为:(A) 大于零 (B) 等于零 (C) 小于零 (D) 不能确定19. 在263 K的过冷水凝结成263 K的冰,则:(A) ΔS<0 (B) ΔS>0 (C) ΔS=0 (D) 无法确定20. 在标准压力和268.15 K下,冰变为水,体系的熵变ΔS体应:(A) 大于零 (B) 小于零 (C) 等于零 (D) 无法确定第二章热力学第二定律物化试卷(二)1. 2 mol H2和 2 mol Cl2在绝热钢筒内反应生成 HCl 气体,起始时为常温常压。

《物理化学》热力学第二定律练习题1.在两个不同温度的热源之间工作的热机以卡诺热机的效率最大。
判断正确和错误:________。
(√)2.卡诺热机的效率只与两个热源的温度有关而与工作物质无关。
判断正确和错误:________。
(√)3.卡诺热机在T 1=600K 的高温热源和T 2=300K 的低温热源间工作,其热机效率________。
(η=0.5)30011600L R H T T η=-=-卡诺定律:R ηη≤4.改正下列错误(1)在一可逆过程中熵值不变; (2)在一过程中熵变是QS Tδ∆=⎰;(3)亥姆赫兹函数是系统能做非体积功的能量; (4)吉布斯函数是系统能做非体积功的能量; (5)焓是系统以热的方式交换的能量。
答:(1)在绝热可逆过程中熵值不变。
(绝热可逆过程即为等熵过程)(2)在一过程中熵变是rQ S Tδ∆=⎰;(QS Tδ∆≥⎰)(3)在恒温恒容条件下,亥姆赫兹函数是系统能做非体积功的能量;,T V A W '∆≤(=:可逆;>:不可逆) ; ,T V A W '∆≥(=:可逆;>:不可逆)在恒温条件下,亥姆赫兹函数是系统能做功的能量T A W ∆≤(=:可逆;<:不可逆) ; T A W ∆≥(=:可逆;>:不可逆)(4)在恒温恒压条件下,吉布斯函数是系统能做非体积功的能量;,T p G W '∆≤(=:可逆;<:不可逆) ,T p G W '∆≥(=:可逆;>:不可逆)(5)焓没有明确的物理意义。
在封闭系统、恒压且不做非体积功的情况下,焓的增量等于恒压热,即∆H =Qp 。
5指出下列过程中△U ,△H , △S , △A , △G 何者为零。
⑴ 理想气体不可逆恒温压缩; ⑵ 理想气体节流膨胀;⑶ 实际流体节流膨胀; ⑷ 实际气体可逆绝热膨胀; ⑸ 实际气体不可逆循环过程; ⑹ 饱和液体变为饱和蒸气; ⑺ 绝热恒容没有非体积功时发生化学变化; ⑻ 绝热恒压没有非体积功时发生化学反应。
第二章 热力学第二定律习题1. 1L 理想气体在3000 K 时压力为1519.9 kPa ,经等温膨胀最后体积变到10 dm 3,计算该过程的W max 、ΔH 、ΔU 及ΔS 。
解:22max 1111210lnln 1519.91ln103499.73499.7ln1.167/3000H U V V W nRT p V V V J V S nR J K V ∆∆=-=-=-⨯=-∆===等温膨胀,==当等温可逆膨胀时,体系对环境做功最大:2. 1mol H 2在300K 从体积为1dm 3向真空膨胀至体积为10 dm 3,求体系的熵变。
假设使该H 2在300K 从1dm 3经恒温可逆膨胀至10 dm 3其熵变又是多少?由此得到怎样的结论?解:真空膨胀为不可逆过程,要计算熵变,必须先设计可逆过程,即等温可逆膨胀过程,ΔS = nR ln(V 2/V 1)=1×8.314×ln10 = 19.14J/K对于等温可逆膨胀,不需设计可逆过程,直接计算,由于两步的始态和终态一样,所以等温可逆膨胀的熵变也等于19.14J/K 。
结论:只要体系的始态和终态一样,不管是可逆过程还是不可逆过程,体系熵变一样。
3. 0.5 dm 3 343K 水与0.1 dm 3 303K 水混合,求熵变。
解:水的混合过程为等压变化过程,用ΔS = n C p,m ln(T 2/T 1)计算,同时熵是广度性质的状态函数,具加和性,熵变ΔS 等于高温水的熵变ΔS h 加上低温水的熵变ΔS c 。
先计算水终态温度,根据高温水放出的热量等于低温水吸收的热量来计算,设终态水温为T 终。
Q = n C p,m (T 2 - T 1) = (0.1ρ/M ) C p,m (T 终-303) = (0.5ρ/M ) C p,m (343-T 终) T 终 = 336.3KΔS = ΔS h +ΔS c = (0.5ρ/M ) C p,m ln(336.3/343) + (0.1ρ/M ) C p,m ln(336.3/303) = (0.5×103/18)×75.31 ln(336.3/343) + (0.1×103/18)×75.31 ln(336.3/303) = 2.35J/K4. 有473K 的锡0.25kg,落在283K1kg 的水中,略去水的蒸发,求到达平衡时此过程的熵变。
第二章 热力学第二定律 一、基本公式和基本概念 基本公式1. 热力学第二定律的数学表达式----克劳修斯不等式 ()0A B A B QS Tδ→→∆-≥∑2. 熵函数的定义 ()R QdS Tδ=, ln S k =Ω3. 熵变的计算理想气体单纯,,p V T 变化22,1122,1122,,11ln ln ln ln lnln V m p m p m V m T V S C R T V T p S C R T p V p S C C V p ∆=+∆=-∆=+理想气体定温定压混合过程ln i i iS R n x ∆=-∑封闭系统的定压过程21,d T p m T C S n T T∆=⎰封闭系统定容过程 21,d T V m T C S n T T∆=⎰可逆相变 m n H S T∆∆=标准状态下的化学反应 ,()r m Bm B BS S T θθν∆=∑定压下由1T 温度下的化学反应熵变求2T 温度下的熵变 21,21()()d T p m r m r m T C S T S T T T∆∆=∆+⎰4. 亥姆霍兹函数 A U TS ≡-5. 吉布斯函数 G H TS ≡-6. G ∆和A ∆的计算(A ∆的计算原则与G ∆相同,做相应的变换即可)定温过程G H T S ∆=∆-∆组成不变的均相封闭系统的定温过程 21d p p G V p ∆=⎰理想气体定温过程 21ln p G nRT p ∆= 7. 热力学判据熵判据:,()0U V dS ≥亥姆霍兹函数判据:,,'0(d )0T V W A =≤ 吉布斯函数判据:,,'0(d )0T p W G =≤8. 热力学函数之间的关系组成不变,不做非体积功的封闭系统的基本方程d d d d d d d d d d d d U T S p V H T S V pA S T p V G S T V p=-=+=--=-+麦克斯韦关系S VpS T Vp TT p V S T V p S S p V T S V p T ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭⎛⎫∂∂⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭⎛⎫∂∂⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭9. 吉布斯-亥姆霍兹方程2()pG HT T T ∆⎡⎤∂⎢⎥∆=-⎢⎥∂⎢⎥⎣⎦ 基本概念1. 热力学第二定律在研究化学或物理变化驱动力来源的过程中,人们注意到了热功交换的规律,抓住了事物的共性,提出了具有普遍意义的熵函数。
第二章热力学第二定律返回上一页1. 5 mol He(g)从273.15 K和标准压力变到298.15K和压力p=10×, 求过程的ΔS。
(已知C(V,m)=3/2 R)2. 0.10 kg 283.2 K的水与0.20 kg 313.2 K 的水混合,求ΔS。
设水的平均比热为4.184kJ/(K·kg)。
3. 实验室中有一大恒温槽(例如是油浴)的温度为400 K,室温为300 K。
因恒温槽绝热不良而有4000 J的热传给空气,用计算说明这一过程是否为可逆?4. 在298.15K的等温情况下,两个瓶子中间有旋塞连通。
开始时,一放0.2 mol O2,压力为0.2×101.325kPa,另一放0.8 mol N2,压力为0.8×101.325 kPa,打开旋塞后,两气体互相混合。
计算:(1)终了时瓶中的压力。
(2)混合过程中的Q,W,ΔU,ΔS,ΔG;(3)如果等温下可逆地使气体回到原状,计算过程中的Q和W。
5.(1)在298.2 K时,将1mol O2从101.325 kPa 等温可逆压缩到6×101.325 kPa,求Q,W,ΔU m,ΔH m,ΔF m,ΔG m,ΔS m,ΔS iso(2)若自始至终用6×101.325 kPa的外压等温压缩到终态,求上述各热力学量的变化值。
6. 在中等的压力下,气体的物态方程可以写作p V(1-βp)=nRT。
式中系数β与气体的本性和温度有关。
今若在273K时,将0.5 mol O2由1013.25kPa的压力减到101.325 kPa,试求ΔG。
已知氧的β=-0.00094。
7. 在298K及下,一摩尔过冷水蒸汽变为同温同压下的水,求此过程的ΔG m。
已知298.15K时水的蒸汽压为3167Pa。
8. 将298.15K 1 mol O2从绝热可逆压缩到6×,试求Q,W,ΔU m, ΔH m, ΔF m, ΔG m, ΔS m和ΔS iso(C(p,m)=7/2 R)。
物理化学练习(热力学第二定律2006.4)一、选择题( 共18题)1. 公式d G = -S d T + V d p可适用下述哪一过程:( )(A) 298K、101325Pa 下的水蒸发过程(B) 理想气体真空膨胀(C) 电解水制取氢(D) N2(g) + 3H2(g)=2NH3(g) 未达平衡2. 理想气体在等温条件下,经恒外压压缩至稳定, 此变化中的体系熵变∆S体及环境熵变∆S 环应为:( )(A) ∆S体> 0 , ∆S环< 0 (B) ∆S体< 0 , ∆S环> 0(C) ∆S体> 0 , ∆S环= 0 (D) ∆S体< 0 , ∆S环= 03. 在101.3 kPa下,110℃的水变为110℃水蒸气,吸热Q p,在该相变过程中下列哪个关系式不成立?( )(A) ∆S体> 0(B) ∆S环不确定(C) ∆S体+∆S环> 0(D) ∆S环< 04. 某体系分A,B两部分,这两部分的热力学概率分别为ΩA和ΩB,则整个体系的微观状态数Ω与ΩA,ΩB的关系为:()(A)Ω=ΩAΩB(B)Ω=ΩB /ΩA(C)Ω=ΩA +ΩB(D)Ω=ΩB–ΩA5. 下列对物质临界点性质的描述哪一个是错误的? ( )(A) 液相摩尔体积与气相摩尔体积相等(B) 液相与气相的临界面消失(C) 汽化热为零(D) 固、液、气三相共存6.2 mol液态苯在其正常沸点(353.2 K)和101.325 kPa下蒸发为苯蒸气,该过程的Δvap F 等于( )(A) 23.48 kJ (B) 5.87 kJ(C) 2.94 kJ (D) 1.47 kJ7. 下列四种表述:(1) 等温等压下的可逆相变过程中,体系的熵变ΔS =ΔH相变/T相变(2) 体系经历一自发过程总有d S > 0(3) 自发过程的方向就是混乱度增加的方向(4) 在绝热可逆过程中,体系的熵变为零两者都不正确者为:( )(A) (1),(2) (B) (3),(4)(C) (2),(3) (D) (1),(4)8.将氧气分装在同一气缸的两个气室内,其中左气室内氧气状态为p1=101.3 kPa ,V1=2 dm3,T1=273.2 K;右气室内状态为p2=101.3 kPa,V2=1 dm3,T2=273.2 K;现将气室中间的隔板抽掉,使两部分气体充分混合。
第二章热力学第二定律练习题一、判断题(说法正确否):1.自然界发生的过程一定是不可逆过程。
2.不可逆过程一定是自发过程。
3.熵增加的过程一定是自发过程。
4.绝热可逆过程的∆S= 0,绝热不可逆膨胀过程的∆S> 0,绝热不可逆压缩过程的∆S< 0。
5.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条绝热可逆途径来计算。
6.由于系统经循环过程后回到始态,∆S = 0,所以一定是一个可逆循环过程。
7.平衡态熵最大。
8.在任意一可逆过程中∆S = 0,不可逆过程中∆S > 0。
9.理想气体经等温膨胀后,由于∆U = 0,所以吸的热全部转化为功,这与热力学第二定律矛盾吗10.自发过程的熵变∆S > 0。
11.相变过程的熵变可由计算。
12.当系统向环境传热时(Q < 0),系统的熵一定减少。
13.一切物质蒸发时,摩尔熵都增大。
14.冰在0℃,p下转变为液态水,其熵变>0,所以该过程为自发过程。
15.自发过程的方向就是系统混乱度增加的方向。
16.吉布斯函数减小的过程一定是自发过程。
17.在等温、等压下,吉布斯函数变化大于零的化学变化都不能进行。
18.系统由V1膨胀到V2,其中经过可逆途径时做的功最多。
19.过冷水结冰的过程是在恒温、恒压、不做其他功的条件下进行的,由基本方程可得∆G = 0。
20.理想气体等温自由膨胀时,对环境没有做功,所以 -p d V= 0,此过程温度不变,∆U= 0,代入热力学基本方程d U = T d S - p d V,因而可得d S = 0,为恒熵过程。
21.是非题:⑴“某体系处于不同的状态,可以具有相同的熵值”,此话对否⑵“体系状态变化了,所有的状态函数都要变化”,此话对否⑶绝热可逆线与绝热不可逆线能否有两个交点⑷自然界可否存在温度降低,熵值增加的过程举一例。
⑸ 1mol理想气体进行绝热自由膨胀,体积由V1变到V2,能否用公式:计算该过程的熵变22.在100℃、p时,1mol水与100℃的大热源接触,使其向真空容器中蒸发成100℃、p的水蒸气,试计算此过程的∆S、∆S(环)。
23.的适用条件是什么24.指出下列各过程中,物系的∆U、∆H、∆S、∆A、∆G中何者为零⑴理想气体自由膨胀过程;⑵实际气体节流膨胀过程;⑶理想气体由(p1,T1)状态绝热可逆变化到(p2,T2)状态;⑷ H2和Cl2在刚性绝热的容器中反应生成HCl;⑸ 0℃、p时,水结成冰的相变过程;⑹理想气体卡诺循环。
25.a mol A与b mol B的理想气体,分别处于(T,V,p A)与(T,V,p B)的状态,等温等容混合为(T,V,p)状态,那么∆U、∆H、∆S、∆A、∆G何者大于零,小于零,等于零26.一个刚性密闭绝热箱中,装有H2与Cl2混合气体,温度为298K,今用光引发,使其化合为HCl(g),光能忽略,气体为理想气体,巳知(HCl) = ·mol-1,试判断该过程中∆U、∆H、∆S、∆A、∆G是大于零,小于零,还是等于零27.在一绝热恒容箱内,有一绝热板将其分成两部分,隔板两边各有1mol N2,其状态分别为298K、p0与298K、10p0,若以全部气体为体系,抽去隔板后,则Q、W、∆U、∆H、∆S中,哪些为零二、单选题:1.适合于下列过程中的哪一个(A) 恒压过程;(B) 绝热过程;(C) 恒温过程; (D) 可逆相变过程。
2.可逆热机的效率最高,因此由可逆热机带动的火车:(A) 跑的最快; (B) 跑的最慢;(C) 夏天跑的快;(D) 冬天跑的快。
3.在一定速度下发生变化的孤立体系,其总熵的变化是什么(A) 不变;(B) 可能增大或减小;(C) 总是增大;(D) 总是减小。
4.对于克劳修斯不等式,判断不正确的是:(A) 必为可逆过程或处于平衡状态;(B) 必为不可逆过程;(C) 必为自发过程;(D) 违反卡诺定理和第二定律,过程不可能自发发生。
5.下列计算熵变公式中,哪个是错误的:(A) 水在25℃、p0下蒸发为水蒸气:;(B) 任意可逆过程:;(C) 环境的熵变:;(D) 在等温等压下,可逆电池反应:。
6.当理想气体在等温(500K)下进行膨胀时,求得体系的熵变∆S= l0 J·K-1,若该变化中所做的功仅为相同终态最大功的,该变化中从热源吸热多少(A) 5000 J ;(B) 500 J ;(C) 50 J ;(D) 100 J 。
7.1mol双原子理想气体的是:(A) ;(B) ;(C) ;(D) 2R。
8.理想气体在绝热条件下,在恒外压下被压缩到终态,则体系与环境的熵变:(A) ∆S(体) > 0,∆S(环) > 0 ;(B) ∆S(体) < 0,∆S(环) < 0 ;(C) ∆S(体) > 0,∆S(环) = 0 ;(D) ∆S(体) > 0,∆S(环) < 0 。
9.一理想气体与温度为T的热源接触,分别做等温可逆膨胀和等温不可逆膨胀到达同一终态,已知,下列式子中不正确的是:(A) ;(B) ;(C) ;(D) (等温可逆),(不等温可逆)。
10.计算熵变的公式适用于下列:(A) 理想气体的简单状态变化;(B) 无体积功的封闭体系的简单状态变化过程;(C) 理想气体的任意变化过程;(D) 封闭体系的任意变化过程;11.实际气体CO2经节流膨胀后,温度下降,那么:(A) ∆S(体) > 0,∆S(环) > 0 ;(B) ∆S(体) < 0,∆S(环) > 0 ;(C) ∆S(体) > 0,∆S(环) = 0 ;(D) ∆S(体) < 0,∆S(环) = 0 。
12.2mol理想气体B,在300K时等温膨胀,W = 0时体积增加一倍,则其∆S(J·K-1)为:(A) ;(B) 331 ;(C) ;(D) 。
13.如图,可表示理想气体卡诺循环的示意图是:(A) 图⑴;(B) 图⑵;(C) 图⑶;(D) 图⑷。
14.某体系等压过程A→B的焓变∆H与温度T无关,则该过程的:(A) ∆U与温度无关;(B) ∆S与温度无关;(C) ∆F与温度无关;(D) ∆G与温度无关。
15.等温下,一个反应a A + b B = d D + e E的∆r C p = 0,那么:(A) ∆H与T无关,∆S与T无关,∆G与T无关;(B) ∆H与T无关,∆S与T无关,∆G与T有关;(C) ∆H与T无关,∆S与T有关,∆G与T有关;(D) ∆H与T无关,∆S与T有关,∆G与T无关。
16.下列过程中∆S为负值的是哪一个:(A) 液态溴蒸发成气态溴;(B) SnO2(s) + 2H2(g) = Sn(s) + 2H2O(l) ;(C) 电解水生成H2和O2;(D) 公路上撤盐使冰融化。
17.熵是混乱度(热力学微观状态数或热力学几率)的量度,下列结论中不正确的是:(A) 同一种物质的;(B) 同种物质温度越高熵值越大;(C) 分子内含原子数越多熵值越大;(D) 0K时任何纯物质的熵值都等于零。
18.25℃时,将升O2与升N2混合成升的混合气体,该过程:(A) ∆S > 0,∆G < 0 ;(B) ∆S < 0,∆G < 0 ;(C) ∆S = 0,∆G = 0 ;(D) ∆S = 0,∆G < 0 。
19.有一个化学反应,在低温下可自发进行,随温度的升高,自发倾向降低,这反应是:(A) ∆S > 0,∆H > 0 ;(B) ∆S > 0,∆H < 0 ;(C) ∆S< 0,∆H> 0 ;(D)∆S < 0,∆H < 0 。
20.∆G = ∆A的过程是:(A) H2O(l,373K,p0)H2O(g,373K,p0) ;(B) N2(g,400K,1000kPa)N2(g,400K,100kPa) ;(C) 等温等压下,N2(g) + 3H2(g)NH3(g) ;(D) Ar(g,T,p0)Ar(g,T+100,p0) 。
21.等温等压下进行的化学反应,其方向由∆r H m和∆r S m共同决定,自发进行的反应应满足下列哪个关系式:(A) ∆r S m = ∆r H m/T;(B) ∆r S m> ∆r H m/T ;(C) ∆r S m≥∆r H m/T;(D) ∆r S m≤∆r H m/T。
22.等容等熵条件下,过程自发进行时,下列关系肯定成立的是:(A) ∆G < 0 ;(B) ∆F < 0 ;(C) ∆H < 0 ;(D) ∆U < 0 。
23.实际气体节流膨胀后,其熵变为:(A);(B);(C);(D)。
24.一个已充电的蓄电池以 V输出电压放电后,用 V电压充电使其回复原状,则总的过程热力学量变化:(A) Q < 0,W > 0,∆S > 0,∆G < 0 ;(B) Q < 0,W < 0,∆S < 0,∆G < 0 ;(C) Q > 0,W > 0,∆S = 0,∆G = 0 ;(D) Q < 0,W > 0,∆S = 0,∆G = 0 。
25.下列过程满足的是:(A) 恒温恒压(273 K,101325 Pa)下,1mol 的冰在空气升华为水蒸气;(B) 氮气与氧气的混合气体可逆绝热膨胀;(C)理想气体自由膨胀;(D) 绝热条件下化学反应。
26.吉布斯自由能的含义应该是:(A) 是体系能对外做非体积功的能量;(B) 是在可逆条件下体系能对外做非体积功的能量;(C) 是恒温恒压可逆条件下体系能对外做非体积功的能量;(D) 按定义理解G = H - TS 。
27.在 -10℃、下,1mol水凝结成冰的过程中,下列哪个公式可以适用:(A) ∆U = T∆S; (B) ; (C) ∆H = T∆S + V∆p; (D) ∆G T,p = 0。
28.对于封闭体系的热力学,下列各组状态函数之间的关系中正确的是:(A) A > U;(B) A < U;(C) G < U;(D)H < A。
29.、101325Pa的水,使其与大热源接触,向真空蒸发成为、101325Pa下的水气,对这一个过程,应选用哪一个作为过程方向的判据:(A) ∆U;(B) ∆A;(C) ∆H;(D) ∆G。
30.热力学基本方程 d G = -S d T + V d p,可适应用下列哪个过程:(A) 298K、标准压力下,水气化成蒸汽;(B) 理想气体向真空膨胀;(C) 电解水制取氢气;(D) N2 + 3H22NH3未达到平衡。
31.下列过程可用计算的是:(A) 恒温恒压下无非体积功的化学反应;(B) 恒温恒压下可逆原电池反应;(C) 恒温恒压下任意相变;(D) 恒温恒压下任意可逆相变。