蛙离体神经干生物电信号与兴奋性的检测1
- 格式:ppt
- 大小:3.38 MB
- 文档页数:21
神经干动作电位、兴奋传导速度和不应期测定试验汇报课程:机能试验基础医学院系临床班姓名学号组员:【试验目】1.了解电生理仪器使用。
2.观察蟾蜍坐骨神经动作电位基础波形;学习神经干动作电位统计方法以及潜伏期、幅值、时程测量;3.学习神经干动作电位传导速度测定方法。
加深了解神经兴奋传导概念及意义。
4.了解神经干兴奋后兴奋性改变。
学习测定不应期方法。
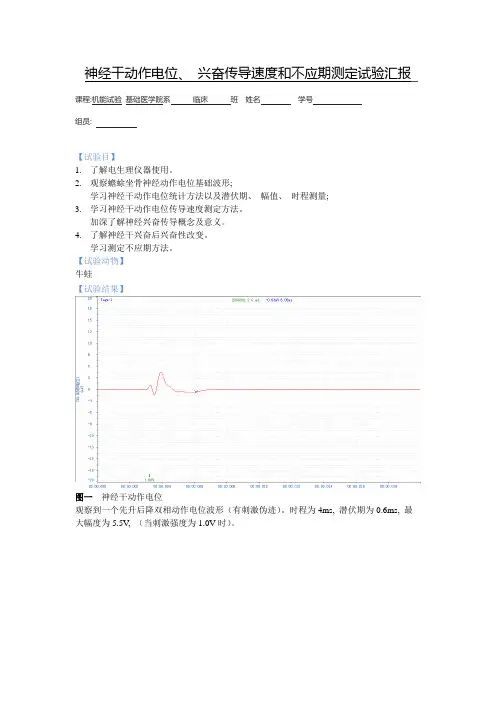
【试验动物】牛蛙【试验结果】图一神经干动作电位观察到一个先升后降双相动作电位波形(有刺激伪迹)。
时程为4ms, 潜伏期为0.6ms, 最大幅度为5.5V, (当刺激强度为1.0V时)。
图二神经干兴奋传导速度测定每个电极间距25mm, 时间约为 1.37ms, 速度测定为18.2m/s图三神经不应期测定(按时间次序, 从上到下、从左到右排列)【试验讨论】神经动作电位观察神经细胞产生兴奋客观标志是神经细胞动作电位。
当神经纤维未受刺激时, 膜外与电极所接触两点之间没有电位差, 所以两电极之间也无电位差存在, 扫描线为一水平基线。
处于兴奋部位膜外电位低于静息部位, 当动作电位经过后, 兴奋部位膜外电位又恢复到静息水平, 用电生理学方法能够引导并统计到此电位改变过程。
将一对引导电极置于神经干表面, 当神经冲动经过时, 两电极之间将产生一短暂电位改变过程, 即为神经干动作电位。
神经干动作电位是复合动作电位, 可沿细胞膜做不衰减传导, 它幅度在一定范围内与刺激强度成正比。
因为引导方法不一样, 统计到神经干动作电位有双相和单相之分, 假如在引导两个电极之间将神经干麻醉或损坏, 阻断其兴奋传导能力, 此时能够统计到单相动作电位。
在神经干左端给与电刺激后, 则产生一个向右传导冲动(负电位), 当冲动传导1电极(负电极)下方时, 此处电位较2处低, 产生了电位差, 扫描线向上偏转, 统计出一个向上波形(在电生理试验中, 要求负波向上)。
随即, 冲动继续向右侧传导, 离开1电极传向2电极处。


中央民族大学生命与环境科学学院实验报告生理学实验报告蛙的坐骨神经—腓肠肌的标本制作及神经干的性质实验姓名:唐胜华学号:0941063学院:生环学院班级:09生科指导老师:覃筱燕完成时间:2011.10.17组别:十一、十二组成员:韩旭思关晴月唐胜华一、实验目的1、学习蛙类动物单毁髓和双挥髓的处死办法。
2、学习并掌握坐骨神经-腓肠肌标本以及腓肠肌标本制备的方法。
3、学习电刺激方法及肌肉收缩的记录方法。
4、观察刺激强度与肌肉收缩反应的关系。
5、观察肌肉收缩的总和以及强直收缩现象。
6、观察蛙坐骨神经干复合动作电位的基本波形,并了解其产生的原理。
7学习蛙和蟾蜍离体神经干上神经冲动传导速度的方法和原理。
二、实验原理腓肠肌由许多的纤维组成,刺激腓肠肌时,不同的刺激强度会引起肌肉的不同反应,。
当刺激强度过小时,不应期肌肉发生收缩反应,此时的刺激为阈下刺激。
而能引起肌肉发生收缩的最小刺激强度,为域刺激,但全部肌纤维同时收缩时,则出现最大的收缩反应。
这时,即使再加大刺激强度,肌肉的收缩强度也不会随之而增大。
可以引起肌肉发生最大收缩反应的最小刺激强度为最适刺激。
肌肉组织对于一个域上强度的刺激,发生一次迅速地收缩反应,即单收缩。
单收缩的过程分为三个时期,潜伏期、收缩期、舒张期。
两个同等强度的域上刺激,相继作用与神经-腓肠肌标本,如果刺激间隔大于单个收缩的时程,肌肉则出现两个单独的单收缩;如果刺激间隔小于单收缩的过程而大于不应期,则出现两个收缩反应的重叠,及收缩的总和。
如果第二次刺激在第一个收缩反映的不应期内,则第二次刺激不产生收缩反应。
但同等强度的连续域上刺激作用于标本时,则出现多个反应的叠加,及强直收缩。
但第一手所发生在第一收缩的舒张期,即发生不完全强直收;后一收缩发生在第一次收缩的收缩期时,各自的收缩完全融合,肌肉出现持续的收缩状态,即发生完全的强直收缩。
神经干在收到有效刺激以后可以产生复合动作电位,标志着神经发生兴奋。

第四章动物机能学实验实验 4. 1 神经干动作电位及其传导速度的测定【实验目的】1. 学习神经干复合动作电位(action potential)的记录方法和神经兴奋传导速度的测定方法;2. 了解蛙类坐骨神经干动作电位的基本波形(单相和双相动作电位);3. 观察不同刺激强度对神经干动作电位的影响。
【实验原理】神经纤维的兴奋表现为动作电位的产生和传导,神经干动作电位是神经兴奋的客观标志。
处于兴奋部位的膜外电位负于未兴奋部位,呈现外负内正的反极化状态。
因此,兴奋部位与未兴奋部位产生电位差。
当神经冲动通过后,兴奋处的膜内外电位又恢复到静息时水平。
神经干兴奋过程所发生的这种膜电位变化称神经干动作电位。
用电生理学方法可引导出此电位差及其变化,并加以显示。
如果将两引导电极置于正常完整的神经干表面,当神经干一端兴奋后,兴奋波先后通过两个引导电极处,可记录到两个方向相反的电位偏转波形,称为双相动作电位。
如果两个引导电极之间的神经组织有损伤,兴奋波只通过第一个引导电极,不能传导到第二个引导电极,则记录到一个方向的电位偏转波形,称为单相动作电位。
由于神经干动作电位是由不同兴奋阈值、传导速度和幅值的动作电位总和而成,故又称为神经干复合动作电位,其幅度在一定范围内可随刺激强度的变化而变化。
动作电位在神经纤维上的传导具有一定的速度。
不同类型的神经纤维,其传导速度(V)各不相同,取决于神经纤维的直径、内阻、有无髓鞘、温度等因素。
类纤维为主,传导速度为35m/s ~40m/s。
测定神经冲动在蛙类坐骨神经干中以Aα神经干上传导的距离(d)与通过这些距离所需的时间(t),即可根据v= d/t,求出神经冲动的传导速度。
【实验对象】 蟾蜍或蛙【实验器材和药品】BL-420E 生物机能实验系统、蛙类手术器械一套、神经干标本屏蔽盒、动作电位引导输入线、电刺激输出线、棉球、任氏液(Ringer solution)。
【实验方法和步骤】1.制备坐骨神经-腓神经标本(sciatic nerve- peroneal nerve specimen )(1) 破坏脑、脊髓 取蛙一只,用自来水冲洗干净。



⽣理学实验神经⼲动作电位的测定实验四神经⼲动作电位的测定【实验⽬的】学习⽣物电活动的细胞外记录法;观察坐⾻神经⼲动作电位的基本波形、潜伏期、幅值以及时程。
【实验原理】神经组织属于可兴奋组织,其兴奋的客观标志是产⽣动作电位,即当受到有效刺激时,膜电位在静息电位的基础上将发⽣⼀系列的快速、可逆、可扩布的电位变化。
动作电位可以沿着神经纤维传导。
在神经细胞外表⾯,已兴奋的部位带负电,未兴奋的部位带正电。
采⽤电⽣理学实验⽅法可以引导出此电位差或电位变化,根据引导的⽅式不同,所记录到的动作电位可呈现单向或双向的波形。
由于坐⾻神经⼲是由许多神经纤维组成的,所以其产⽣的动作电位是众多神经纤维动作电位的叠加,即为⼀个复合动作电位。
这些神经纤维的兴奋性是不同的,所以在⼀定范围内增⼤刺激强度可以使电位幅度增⼤。
这和单⼀细胞产⽣的动作电位是有区别的。
本实验所引导出的动作电位即为坐⾻神经⼲的复合动作电位。
【实验对象】蛙或蟾蜍。
【实验材料】两栖类⼿术器械 1 套、滴管、BL-410⽣物机能实验系统、神经屏蔽盒、刺激电极、接收电极、任⽒液。
【实验步骤】1.制备坐⾻神经⼲标本坐⾻神经⼲标本的制备⽅法与制备坐⾻神经-腓肠肌标本相似。
⾸先按照制备坐⾻神经- 腓肠肌标本的⽅法分离坐⾻神经,当游离⾄膝关节处时,在腓肠肌两侧找到胫神经和腓神经,任选其⼀剪断,然后分离留下的⼀⽀直⾄⾜趾并剪断。
保留与坐⾻神经相连的⼀⼩段脊柱,其余组织均剪除。
此时,即制成了坐⾻神经⼲标本。
将标本浸于任⽒液中,待其兴奋性稳定后开始实验。
2.接标本与实验仪器1)棉球沾任⽒液擦拭神经标本屏蔽盒内的电极,将标本的脊柱端置于屏蔽盒的刺激电(图 4-1 屏蔽盒)极端(即 0刻度端),其神经部分横搭在各个电极上。
2)取出 BL-410 ⽣物机能实验系统专⽤刺激电极,将其插头插在与主机“刺激”插⼝中,另⼀端的两个鳄鱼夹分别夹在屏蔽盒左侧的两个刺激接⼝上。
红⾊接正极,⿊⾊接负极。

第1篇一、实验目的1. 学习蛙的解剖结构,掌握青蛙坐骨神经-腓肠肌标本的制备方法。
2. 了解神经和肌肉的兴奋、兴奋性,刺激与反应的规律和肌肉收缩的特征。
3. 掌握蛙心灌流实验方法,观察心脏活动的影响因素。
二、实验原理1. 蛙的坐骨神经-腓肠肌标本制备:蛙的坐骨神经和腓肠肌在生理条件下具有兴奋性和传导性,通过制备坐骨神经-腓肠肌标本,可以观察神经和肌肉的兴奋、兴奋性,刺激与反应的规律和肌肉收缩的特征。
2. 蛙心灌流实验:离体心脏灌流实验是研究心脏生理功能的重要方法,通过改变灌流液的成分,可以观察其对心脏活动的影响,了解心脏的正常节律性活动。
三、实验材料与仪器1. 实验材料:青蛙、任氏液、生理盐水、剪刀、手术剪、眼科镊、金属探针、玻璃分针、蛙板、蛙钉、细线、培养皿、滴管、电子刺激器、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、套管夹、65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸。
2. 实验仪器:蛙类解剖台、显微镜、电生理实验系统、刺激器、数据采集系统、蛙心灌流装置。
四、实验方法与步骤1. 蛙的坐骨神经-腓肠肌标本制备:(1)取青蛙一只,用生理盐水冲洗干净,左手握住蛙,使其背部向上。
(2)用眼科镊和剪刀在青蛙的坐骨神经和腓肠肌处剪开,分离出坐骨神经和腓肠肌。
(3)将坐骨神经和腓肠肌置于任氏液中,用玻璃分针轻轻拨动腓肠肌,观察肌肉收缩情况。
2. 蛙心灌流实验:(1)将青蛙的左心耳和左肺静脉用细线结扎,然后剪断,使心脏与体循环分离。
(2)将心脏置于蛙心灌流装置中,连接计算机采集系统和刺激器。
(3)将灌流液(任氏液)通过灌流装置注入心脏,观察心脏搏动情况。
(4)改变灌流液的成分,如加入肾上腺素、乙酰胆碱、乳酸等,观察心脏活动的影响。
五、实验结果与分析1. 蛙的坐骨神经-腓肠肌标本制备成功,腓肠肌在刺激下产生明显的收缩反应。
2. 蛙心灌流实验成功,心脏在灌流液的作用下保持节律性搏动。

实验一神经干动作电位的引导,兴奋传导速度及不应期的测定神经干动作电位、传导速度及不应期的测定【目的和原理】神经纤维的兴奋表现为动作电位的产生和传导,神经纤维上传导的动作电位通常称为神经冲动。
在神经细胞外表面,已兴奋部位带“负电”,未兴奋部位带“正电”,用引导电极引导出此电位差,输入到示波器,则可记录到动作电位的波形。
本实验用细胞外记录法,可引导出坐骨神经的复合动作电位。
神经纤维兴奋的标志是产生一个可以传导的动作电位,它依局部电流或跳跃传导的方式沿神经纤维传导。
其传导速度取决于神经纤维的直径、内阻、有无髓鞘等因素,可用电生理学方法来记录和测量。
神经纤维在一次兴奋过程中,其兴奋性可发生周期性变化,包括绝对不应期、相对不应期、超常期和低常期。
本实验主要目的是学习电生理仪器的使用方法,掌握离体神经干动作电位的细胞外记录法及其基本波形的判断和测量。
掌握神经干动作电位传导速度及其不应期的测定方法,通过调整条件刺激和测试刺激之间的时间间隔,来测定坐骨神经干的绝对不应期。
【实验对象】蟾蜍或蛙。
【实验器材和药品】蛙类手术器械一套、电子刺激器、示波器(或计算机实时分析系统)、神经屏蔽盒、任氏液。
【实验步骤】1(制备坐骨神经——胫、腓神经标本操作方法详见3(8。
2(连接装置(见图8-1-1)。
3(准备仪器:(1)刺激器:调节刺激器各项参数:刺激方式连续刺激,频率16Hz,刺激强度0.5v,波宽0.1ms。
调节延迟使动作电位的图像位于示波器荧光屏的中央。
(2)示波器:灵敏度:1,2mv/cm,扫描速度:1,2ms/cm,引导电极输入到示波器的“AC”端,双边输入,刺激器的“同步输出”接示波器“外触发输入”,触发选择设置为“同步触发”。
4(观察项目:屏蔽盒S1 S2 R1 R2 R3 R4N输出上线下线刺示激波器器图8-1-1 神经干动作电位引导装置图(1)测量单、双相动作电位的潜伏期、时程和振幅,填入下表:时程振幅潜伏期动作电位格毫秒格毫伏格毫秒第一相双相动作电位第二相(2)测算动作电位的传导速度:V=S/?t (米/秒)式中:S为R1到R3的神经干长度,以米为单位。

实验3 神经干动作电位及其传导速度的测定【目的】应用微机生物信号采集处理系统和电生理实验方法,测定蛙类坐骨神经干的单相、双相动作电位和其中A类纤维冲动的传导速度,并观察机械损伤、药物对神经兴奋和传导的的影响。
【原理】用电刺激神经,在负刺激电极下的神经纤维膜内外产生去极化,当去极化达到阈电位时,膜产生一次在神经纤维上可传导的快速电位反转,此即为动作电位(action potential, AP)。
神经纤维膜外,兴奋部位膜外电位相对静息部位呈负电性质,当神经冲动通过以后,膜外电位又恢复到静息时水平。
如果两个引导电极置于兴奋性正常的神经干表面,兴奋波先后通过两个电极处,便引导出两个方向相反的电位波形,称为双相动作电位。
如果两个引导电极之间的神经纤维完全损伤,兴奋波只通过第一个引导电极,不能传至第二个引导电极,则只能引导出一个方向的电位偏转波形,称为单相动作电位。
神经干由许多神经纤维组成,故神经干动作电位与单根神经纤维的动作电位不同,神经干动作电位是由许多不同直径和类型的神经纤维动作电位叠加而成的综合性电位变化,称复合动作电位,神经干动作电位幅度在一定范围内可随刺激强度的变化而变化。
动作电位在神经干上传导有一定的速度。
不同类型的神经纤维传导速度不同,神经纤维越粗则传导速度越快。
蛙类坐骨神经干以Aa类纤维为主,传导速度大约30~40m/s。
测定神经冲动在神经干上传导的距离(s)与通过这段距离所需时间(t),可根据n=s/t求出神经冲动的传导速度。
【预习要求】1.仪器设备知识参见第二章第三节 RM6240微机生物信号采集处理系统(或第四节PcLab和MedLab微机生物信号采集处理系统)。
2.实验理论实验动物知识参见第三章第一节生理科学实验常用实验动物的种类,第四章第一节动物实验的基本操作;统计学知识参见第五章第四节常用统计指标和方法;生理学教材中兴奋性、兴奋的概念,静息电位和动作电位的形成机制,动作电位传导原理及神经纤维的分类。

实验二低温、局麻药对蟾蜍坐骨神经干动作电位、传导速度及不应期的影响一、实验目的1.学会用细胞外电刺激诱发神经干动作电位的方法。
2.观察分析低温、局麻药对蟾蜍坐骨神经干动作电位、传导速度及不应期的影响。
3.掌握生物电记录的一般原则和方法。
二、实验原理神经纤维静息时,处于细胞内负外正的电位差,即静息电位。
将两个刺激电极与神经干接触,当刺激器发出脉冲刺激时,负电极处发生去极化,去极化达阈电位时爆发动作电位,使负电极处发生内正外负的倒极化,使已兴奋的电极处电位低于邻近未兴奋处而出现电位差而产生局部电流。
此局部电流依次扩布引起整个神经纤维的兴奋。
依据这样的原理推论,发出刺激脉冲时,细胞膜发生去极化兴奋的部位在负电极处,而正电极处则发生膜的超极化。
这样就造成两电极间存在电位差。
而且随着兴奋在神经干的扩布,放置在膜外的两电极可记录出电位差的动态变化。
如图所示。
本实验方法为细胞外记录法。
若把微电极插入细胞内记录单细胞动作电位,为细胞内记录法。
两种方法记录的动作电位波形有所不同。
蟾蜍坐骨神经干由众多的神经纤维组成。
不同的纤维其兴奋性不尽相同,当给予神经干一个电刺激时,刺激强度不同会引起一个至多个纤维兴奋,记录电极会把多个动作电位同时记录下来,形成的动作电位图形,称为复合动作电位。
学习和掌握低温、局麻药对动作电位幅度、时程、传导速度及不应期的影响,对从事临床工作有一定的指导意义。
三、实验材料1、实验动物:蟾蜍(身长约15cm)2、器械、药品:BL-410生物机能实验系统、蛙板、刺蛙针、玻璃分针、锌铜弓、眼科剪、眼科镊(直、弯)、手术剪、中式剪刀、组织镊、神经标本盒、滴管、培养皿、丝线、室温及低温任氏液、2%普鲁卡因。
四、实验方法和步骤a)、标本制备流程b)、仪器安装及调试c)、观察项目现象及解释a)标本制备流程:①坐骨神经干标本制备→②备好神经标本屏蔽盒→③将神经放于盒内电极上坐骨神经干标本制备:1.破坏脑脊髓左手握蛙,用拇指按压背部,食指按压头部前端,使头前俯;用右手食指的指甲由头端沿正中线向下滑动,至耳鼓膜后缘连线前约3 mm处可触及一横沟,其中点相当于枕骨大孔位置。
坐骨神经腓肠肌标本的制备和神经干动作电位的观察与传导速度的测定一、实验目的:1.学习蛙类动物双毁髓的实验方法。
2.学习并掌握坐骨神经-腓肠肌标本的制备方法。
3.观察蛙坐骨神经干复合动作电位的基本波形,并了解其产生的原理。
4.学习蛙和蟾蜍离体神经干上神经冲动传导速度的方法和原理。
二、实验材料:1.实验对象:蟾蜍2.实验器材:常规手术器械(粗剪刀、手术剪、眼科剪、手术镊、眼科镊)蛙板、蛙钉、探针、锌铜弓、玻璃分针、培养皿、任氏液、滴管、手术线、PC机、信号采集处理系统、神经屏蔽盒等。
三、实验原理:神经干在受到有效刺激以后可以产生复合动作电位,标志着神经发生兴奋。
如果在离体神经干的一段施加刺激,从另一端引导传来的神兴奋冲动,可以记录出双相电位,加入在引导的两个电极之间将神经干麻醉或损伤,阻断其兴奋传导能力,这时候记录出的动作电位就成为单相电位。
神经细胞的动作电位是以全或无的方式产生的。
但是,复合动作电位的幅值在一定刺激强度下是随刺激强度的增加而增大的。
如果在远离刺激点的不同距离处分别引导离体神经干动作电位,两引导点之间的距离为m,在两引导点分别引导出的动作电位的时相差为s。
即可按照公式v=m/s来计算出兴奋的传导速度。
蛙类的坐骨神经干属于混合性神经,其中包含有粗细不等的各种纤维,其直径一般为3-29um,其中直径最粗的有髓纤维为A类纤维,传导速度在正常室温下为35-40 m/s。
神经每兴奋一次极其在兴奋以后的回复过程中,其兴奋性都要经历一次周期性的变化,其全过程依次包括绝对不应期、相对不应期、超常期和低常期4个时期。
为了测定坐骨神经在发生一次兴奋以后兴奋性所发生的周期性变化,首先要给神经施加一个条件性刺激引起神经兴奋,然后在前一兴奋及其恢复过程不同时相再施加一个测试性刺激,用于检查神经的兴奋阈值和所引起的动作电位的幅度,以判定神经兴奋性的变化。
四、实验方法及步骤:1、坐骨神经干标本制备(1)破坏脑与脊髓:取蛙一只,用自来水冲洗干净,左手持蛙,用食指下压其吻部,拇指按压在其骶髂关节下方,使其头尽量前俯,右手持探针沿两眼之间中线向后方轻划,至触及头颈部正中的凹陷处,即为枕骨大孔的位置。
神经干动作电位的引导及神经兴奋传导速度的测定【实验目的】1. 引导蟾蜍坐骨神经动作电位,并观察其基本波形(包括双相和单相动作电位)。
2. 学习和掌握神经干动作电位传导速度测定的原理和方法。
3. 学习和掌握蟾蜍坐骨神经-腓神经标本制备方法。
【实验原理】动作电位是神经细胞兴奋的客观标志,当神经纤维或神经干受到有效刺激时,必然会产生可传导的动作电位,也称为神经冲动。
由于神经干动作电位是许多单根神经纤维动作电位的复合,所以它的特征不同于单根神经纤维的动作电位。
本实验采用离体细胞外记录法,记录神经干兴奋时不同位置记录电极之间的电位变化。
动作电位可沿神经纤维进行双向传导,其传导速度取决于纤维直径、内阻、有无髓鞘等因素。
通过测定动作电位传导的距离和时间,可算出动作电位在神经纤维上的传导速度。
【实验材料】1. 动物蛙或蟾蜍。
2. 试剂和药品任氏液3. 装置和器材计算机、蛙类手术器械、神经屏蔽盒、直尺、圆规、培养皿。
【实验方法】1. 神经干动作电位的引导1)制备坐骨神经-腓神经标本制备方法与制备坐骨神经-腓肠肌标本基本相同,只是当把坐骨神经游离至膝关节后,在腓肠肌一侧继续分离腓神经至足趾,用线结扎,并在结扎线远端剪断。
将制备好的坐骨神经-腓神经标本浸入盛有任氏液的培养皿内备用。
2)将神经标本置于神经屏蔽盒的电极上。
将神经的近中枢端置于刺激电极一侧,外周端置于记录电极侧。
3)进入BL-420生物信号采集、处理系统,单击菜单栏中实验项目,在肌肉、神经实验中选择神经干动作电位的引导,观察所引导出的动作电位。
4)观察刺激强度对动作电位幅度的影响。
实验项目(单击)——>肌肉、神经实验——>阈强度与动作电位的关系——>设置起始刺激强度、刺激增量与时间间隔——>单击OK——>观察显示器所显示的随着刺激强度大增大,双向动作电位从无到有、到随着刺激强度的增大而增大、再到刺激强度增大到某一值时,动作电位不再随之增大的变化过程。
蛙心电图的描述与离体蛙心溶剂导体心电描述实验一、实验目的1.初步了解心电图的描记方法2. 熟悉正常心电图,观察QRS波群3. 了解心电图记录的原理及其生理意义二、实验原理心电图概念及波形,记录的原理及其生理意义,导联概念容积导体概念三、实验用品蟾蜍、培养皿、手术器械、蛙板、任氏液、解剖针、大头针、生物机能处理系统四、实验步骤1.在体心电图描记对蛙行双毁髓,用大头针将其仰卧位固定在蛙板上。
2.打开系统,选择项目:心电图记录,根据对话框连接电极。
3.描记正常心电图。
4.变换电极位置,描记正常心电图5.结扎,并取出蛙心,观察描记出的曲线的变化6.放回蛙心,观察描记出的曲线的变化7.将蛙心倒置放入心腔,观察描记出的曲线的变化离体心电图步骤1、用培养皿盛一些任氏液,将心电引导线的三个鳄鱼夹夹在培养皿边缘的不同位置2、放入蛙心,改变蛙心的朝向和与不同鳄鱼夹的距离,观察描记出的曲线的变化。
五、注意事项剪取心脏时,切忌伤及静脉窦容积导体实验,电极要与溶液接触好蛙心离体时间不宜太长六、实验结果观察心电图:处理后分析:p波是一小波,反应了兴奋在心房传导过程中的电位变化,p波终点说明左右心房已全部兴奋QRS波群反应了兴奋在心室各部位传导过程中的电位变化T波呈一持续时间较长,幅度也比较大的波,反应心室肌复极化过程中电位的变化,终点表示复极化完毕Q-T间期反应心室开始兴奋到心室全部复极化结束所需时间P-R间期反应心房开始兴奋到心室开始兴奋所用时间蛙心溶剂导体心电图体倒置心电体正位心电离体倒置心电离体正位心电分析:正置峰值向上,倒置峰值向下,离体后心率减慢无心脏蛙分析:无电图波动。
神经干动作电位及其传导速度的测定[适用对象]应用心理学专业[实验学时] 3学时一、实验目的运用电生理实验技术测定蛙类坐骨神经的单相、双相动作电位和其中A类纤维冲动的传导速度,并观察神经损伤,药物的影响。
二、实验原理可兴奋组织如神经纤维在受刺激而兴奋时,细胞膜电位将发生一系列短暂的变化。
由安静状态下的膜外正膜内负的静息电位变为兴奋状态下的膜外负膜内正的去极化状态。
因此,在膜外兴奋区相对于未兴奋区来说电位为负。
这种电位差所产生的局部电流又引起邻近未兴奋区的去极化,使兴奋沿细胞膜传向整个细胞,而原来的兴奋区的膜电位又恢复到膜外正膜内负的静息水平。
这种可传播的、短暂的膜电位变化称之为动作电位。
可兴奋组织在一次兴奋之后,其兴奋性要经历一个规律的时相变化,依次是绝对不应期、相对不应期、超常期和低常期,然后才恢复到正常的兴奋性水平。
三、仪器设备蟾蜍或蛙、蛙板、探针、粗剪刀、细剪刀、尖镊子、玻璃分针、大头针、培养皿、滴管、瓷碗、锌铜弓或铝银电极、任氏液。
四、相关知识点1、神经干标本分离越长越好且要剥离干净,但又不能损伤神经主干。
分离时应用眼科剪小心剪去神经分支及周围结缔组织,切忌撕拉。
2、神经干标本应与记录电极紧密接触,特别要注意与中间接地电极的接触。
神经干不能打折,并经常保持湿润,又要注意防止电极间短路。
3、刺激强度要从最小的强度开始,逐步增加刺激强度,且持续刺激时间不宜过长,防止损伤神经干。
五、实验步骤(一)准备仪器装置准备好生物信号记录分析系统及相关电极。
(二)手术操作制作坐骨神经腓肠肌标本,将其浸泡在任氏液中数分钟,待其兴奋性稳定。
然后,将神经标本屏蔽盒内所有的电极用任氏液棉球擦拭,用镊子夹住神经标本两端扎线,将标本横搭在神经标本屏蔽盒的电极上,盖好标本盒盖,并将刺激电极、引导电极及地线等接线连好(神经干粗端置于刺激电极处,细端置于记录电极)。
(二)观察与纪录1、寻找阈刺激和最大刺激先将刺激强度设为零,再逐渐增大,直至出现动作电位时(此时的刺激强度即为阈强度);逐渐增大至动作电位幅度达到最大值为止,该强度的刺激为最大刺激(记下该强度值)。