医用基础化学无机及分析化学综合练习(附答案)
- 格式:docx
- 大小:731.85 KB
- 文档页数:18

高一下学期有机化学基础知识综合练习
一、单选题
1.现代家庭室内装潢日益受到人们的推崇,由此引起的室内空气污染也成为人们关注的焦点,其中出装潢材料和家具的黏合剂等挥发出的甲醛是造成室内空气污染的主要污染物,根据甲醛的性质,下列说法做法正确的是( )
A.装修完接着就入住
B.装修尽可能选择在温度较低的冬季进行,以减少甲醛的挥发
C.尽可能选择绿色环保的装饰材料进行装修
D.通风后甲醛可以释放完全
2.不法商贩利用“豆浆粉精”勾兑新鲜豆浆被媒体曝光。据悉,这种豆浆完全没有营养价值,"豆浆粉精"中的乙基香兰素()过量食用还可能导致头痛、恶心、呕吐、呼吸困难,甚至能够损伤肝、肾,对人体有较大的危害。则下列关于乙基香兰素的说法错误的是( )
A.乙基香兰素的分子式为C9H10O3
B.乙基香兰素与苯甲醛互为同系物
C.乙基香兰素的同分异构体可能含有酯基
D.乙基香兰素能与FeCl3溶液发生显色反应
3.已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在于同一平面上的是( )
A.苯乙烯 B.苯甲酸
C.苯甲醛 D.苯乙酮
4.橙花醛是一种香料,结构简式为:(CH3)2C=CHCH2CH2C(CH3)=CHCHO,下列说法中正确的是( )
A.橙花醛不可以与溴发生加成反应
B.橙花醛可以发生银镜反应
C.1mol橙花醛最多可以与2mol H2发生加成反应
D.橙花醛是乙烯的同系物
5.某饱和一元醛发生银镜反应时,生成21.6g银,再将等质量的醛完全燃烧生成CO2为13.14L,(标准状况),则该醛为( )
A.丙醛 B.丁醛 C.3-甲基丁醛 D.己醛
6.3g某醛跟足量的银氨溶液反应,结果析出43.2g银,则该醛是( )
A.甲醛 B.乙醛 C.丙醛 D.丁醛
7.根据柠檬醛的结构简式(),判断下列各有关说法中,不正确的是( )
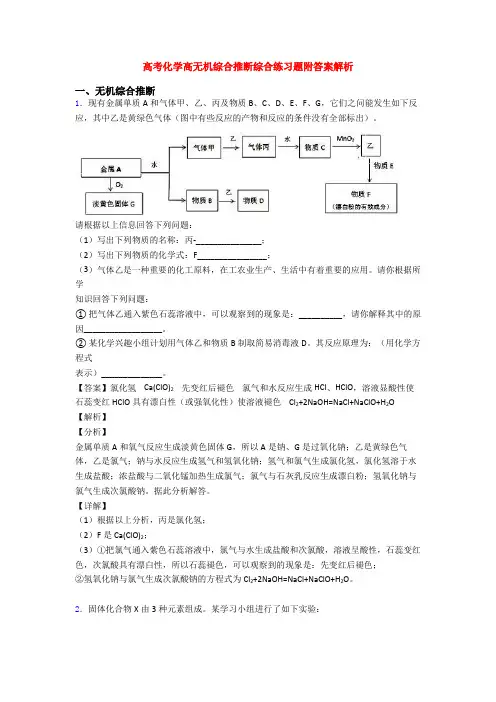
高考化学高无机综合推断综合练习题附答案解析
一、无机综合推断
1.现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的名称:丙-_______________;
(2)写出下列物质的化学式:F________________;
(3)气体乙是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学
知识回答下列问题:
① 把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因__________________。
② 某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。其反应原理为:(用化学方程式
表示)______________。
【答案】氯化氢 Ca(ClO)2 先变红后褪色 氯气和水反应生成HCl、HClO,溶液显酸性使石蕊变红HClO具有漂白性(或强氧化性)使溶液褪色 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
【分析】
金属单质A和氧气反应生成淡黄色固体G,所以A是钠、G是过氧化钠;乙是黄绿色气体,乙是氯气;钠与水反应生成氢气和氢氧化钠;氢气和氯气生成氯化氢,氯化氢溶于水生成盐酸;浓盐酸与二氧化锰加热生成氯气;氯气与石灰乳反应生成漂白粉;氢氧化钠与氯气生成次氯酸钠。据此分析解答。
【详解】
(1)根据以上分析,丙是氯化氢;
(2)F是Ca(ClO)2;
(3)①把氯气通入紫色石蕊溶液中,氯气与水生成盐酸和次氯酸,溶液呈酸性,石蕊变红色,次氯酸具有漂白性,所以石蕊褪色,可以观察到的现象是:先变红后褪色;
②氢氧化钠与氯气生成次氯酸钠的方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
2.固体化合物X由3种元素组成。某学习小组进行了如下实验:

化学高无机综合推断的专项培优练习题(含答案)附详细答案
一、无机综合推断
1.无机化合物X与Y均由三种相同短周期的非金属元素组成(X比Y的相对分子质量大),常温下均为无色液体,易水解,均产生酸性白雾。取1.35gX与足量水完全反应,向反应后的溶液中滴加1.00 mol·L-1的NaOH溶液40.0mL恰好反应,溶液呈中性,继续滴加BaCl2溶液至过量,产生不溶于稀盐酸的2.33g白色沉淀。Y水解得到两种产物,其物质的量之比1:2,且产物之一能使品红溶液褪色。请回答:
(1)X的化学式______________。白色沉淀属于_____________ (填“强”、“弱”或“非”)电解质。
(2)Y与水反应的化学方程式_________________。
(3)二元化合物Z能与X化合生成Y。一定条件下,0.030 mol Z与足量氨反应生成0.92gA(原子个数之比1:1,其相对分子量为184)和淡黄色单质B及离子化合物M,且M的水溶液的pH<7。将0.92gA隔绝空气加强热可得到0.64gB和气体单质C。
①写出Z与足量氨反应的化学方程式____________。
②亚硝酸钠和M固体在加热条件下_____________(填“可能”或“不能”)发生反应,判断理由是_________________。
③请设计检验离子化合物M中阳离子的实验方案:_________________。
【答案】SO2Cl2或SCl2O2 强 SOCl2+H2O=2HC1+SO2↑ 6SCl2+ 16NH3=S4N4+2S+ 12NH4Cl
可能 NaNO2中N元素化合价为+3价,NH4C1中N元素化合价为-3价,发生氧化还原反应生成N2 取少量M固体加水溶解,加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+
【解析】
【分析】
X、Y常温下为无色液体,且水解产生白雾,证明产生氯化氢,1.35gX的水解产物能与0.04mol的NaOH,恰好完全反应,滴加氯化钡能产生难溶于酸的沉淀,则产生0.01mol的硫酸钡沉淀,Y的水解产物能使品红褪色,有二氧化硫产生,1.35gX中含有S:0.01mol,Cl:0.02mol,则氧元素的物质的量是(1.35g-0.32g-0.71g)÷16g/mol=0.02mol,故X为SO2Cl2;Y水解得到两种产物,其物质的量之比1:2,且产物之一能使品红溶液褪色,因此Y为SOCl2;二元化合物Z能与X化合生成Y。一定条件下,0.030 mol

【化学】化学高无机综合推断的专项培优易错试卷练习题附答案
一、无机综合推断
1.固体X由四种元素组成,为探究其组成和性质,设计并完成如下实验:
(1)固体X中含有H、O、______和______元素。
(2)写出固体X受热分解的化学方程式______。
(3)取少量固体B溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子方程式______。
【答案】C Cu Cu3(OH)2(CO3)23CuO+H2O+2CO2↑ 2Cu2++4I-=2CuI↓+I2
【解析】
【分析】
由固体隔绝空气加热生成1.8g水可知,含H原子的物质的量n=1.8g/18g∙mol-1×2=0.2mol,质量为0.2g;气体A与石灰水反应生成白色沉淀为碳酸钙,其物质的量n=20.0g/100g∙mol-1=0.2mol,所以碳原子的物质的质量为m=0.2mol×12g/mol=2.4g;固体B与CO反应生成紫红色固体为Cu,则B为CuO,其物质的量为24.0g/80g∙mol-1=0.3mol,所以铜的质量为m=0.3mol×64g/mol=19.6g;剩余质量为34.6g-0.2g-2.4g-19.6g=12.4g,所以X中含O为n=12.4g/16g∙mol-1=0.8mol,则n(Cu):n(C):n(H):n(O)=3:2:2:8,X为Cu3(OH)2(CO3)2,以此来解答。
【详解】
(1)由上述分析可知,固体X中含有H、O、C、Cu元素,故答案为:C;Cu;
(2)固体X受热分解的化学方程式为Cu3(OH)2(CO3)23CuO+H2O+2CO2↑,故答案为:Cu3(OH)2(CO3)23CuO+H2O+2CO2↑;
(3)取少量固体B溶于稀硫酸,生成硫酸铜,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,可知生成碘和CuI,产生该现象的离子方程式为2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2。

高二有机化学基础第二章综合练习题
学校:___________姓名:___________班级:___________考号:___________
题号 一 二
总分
得分
注意事项:注意事项:1、答题前填写好自己的姓名、班级、考号等信息 2、请将答案正确填写在答题卡上
第1卷
评卷人 得分
一、单选题
1.下列化合物在一定条件下既能发生消去反应,又能发生水解反应的是( )
A.CH3Cl
B.
C.
D.
2.为探究一溴环己烷()与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案,其中正确的是( )
甲:向反应后的混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应
乙:向反应后的混合液中滴入溴水,若溶液颜色很快退去,则可证明发生了消去反应
丙:向反应后的混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应
A.甲的方案 B.乙的方案
C.丙的方案 D.上述实验方案都不正确
3.工业上以石油裂解气E为原料,通过下列化学反应制取1,3-丙二醇。
已知E能使酸性高锰酸钾溶液退色;同温同压下,E的密度是H2的21倍;E分子中有3种不同化学环境的氢原子,其个数比为1:2:3。下列关于E的叙述不正确的是( )
A.E的相对分子质量为42
B.E的结构简式为CH2=CHCH3
C.E分子中所有的碳原子在同一平面上
D.反应①是将E通入溴的四氯化碳溶液中
4.下列反应中,CH3-CH=CH-Cl能发生的有( )
①取代反应 ②加成反应 ③消去反应 ④聚合反应
A.①②③④ B.仅②③④ C.仅①②④ D.仅①②③ 5.某有机化合物D的结构为,是一种常见的有机溶剂,它可以通过下列三步反应制得:

个人收集整理-仅供参考
1 / 15 《无机与分析化学》综合练习题及答案
(本综合练习题及答案与中国农业出版社出版,张凤、王耀勇、余德润主编地
《无机与分析化学》教材配套使用)
《无机与分析化学》综合练习题
一、选择题
1.与难挥发非电解质稀溶液地蒸气压降低、沸点升高、凝固点下降有关地因素为().
A. 溶质地本性B. 溶液中溶质地粒子数C. 剂地体积 D. 溶液地体积
2. 高原地区水地沸点一般( ).
A. 等于100℃B. 高于100℃C. 低于100℃D. 无法确定
3.在常压下,海水地沸点一般( ).
A. 等于100℃ B. 高于100℃ C. 低于100℃D. 无法确定
4. 在常压下,海水地凝固点一般( ).
A. 等于0℃ B. 高于0℃C. 低于0℃ D. 无法确定
5.溶液地凝固点总是( )纯溶剂地凝固点.
A. 等于B.高于 C.低于 D. 无法确定
6.静脉注射时,注射液应与血液是( ).
A. 等渗溶液B.高渗溶液 C. 低渗溶液 D. 无法确定
7.常量分析地称量一般在( ).
A. 0.1g以上 B. 10g以上 C. 0.01~0.001g D. 1~10g
8. 确定样品中各组分地相对含量属于().
A. 定性分析 B. 定量分析 C. 结构分析 D. 滴定分析
9.对微量成分进行分析一般采用().
A. 滴定分析B. 重量分析 C. 气体分析D. 仪器分析
10.下列叙述错误地是().
A. 方法误差属于系统误差B. 系统误差呈正态分布 个人收集整理-仅供参考
2 / 15 C. 系统误差具有重现性D. 系统误差包括操作误差
11.下列()种情况可引起系统误差.
A. 天平零点突然有变动 B. 看错滴定管读数
C. 加错试剂 D. 使用地蒸馏水不纯

医用基础化学试题及答案
一、选择题(每题2分,共20分)
1. 以下哪种元素不属于人体必需微量元素?
A. 铁
B. 锌
C. 钙
D. 铜
答案:C
2. 人体中含量最多的无机盐是?
A. 钙
B. 钠
C. 钾
D. 镁
答案:A
3. 以下哪种物质不属于糖类?
A. 葡萄糖
B. 果糖
C. 半乳糖
D. 氨基酸
答案:D
4. 以下哪种维生素是水溶性的?
A. 维生素A
B. 维生素D
C. 维生素E
D. 维生素B
答案:D
5. 以下哪种物质不是蛋白质?
A. 血红蛋白 B. 胰岛素
C. 胆固醇
D. 胶原蛋白
答案:C
6. 以下哪种物质不是脂类?
A. 甘油三酯
B. 磷脂
C. 胆固醇
D. 氨基酸
答案:D
7. 以下哪种物质属于核酸?
A. DNA
B. RNA
C. 蛋白质
D. 糖类
答案:A
8. 以下哪种物质不属于酶?
A. 淀粉酶
B. 蛋白酶
C. 脂肪酶
D. 维生素C
答案:D
9. 以下哪种物质不是激素?
A. 胰岛素
B. 甲状腺素
C. 肾上腺素
D. 葡萄糖
答案:D
10. 以下哪种物质是人体必需的微量元素?
A. 钠
B. 钾 C. 铁
D. 钙
答案:C
二、填空题(每题2分,共20分)
1. 人体必需的微量元素包括铁、锌、铜、碘等。
2. 人体中含量最多的无机盐是钙。
3. 糖类包括单糖、双糖和多糖,其中葡萄糖是最重要的单糖。
4. 水溶性维生素包括维生素B族和维生素C。
5. 蛋白质是生命活动的主要承担者,包括酶、激素、抗体等。
6. 脂类包括脂肪、磷脂和固醇,其中胆固醇是固醇的一种。
7. 核酸包括DNA和RNA,是遗传信息的携带者。
8. 酶是生物催化剂,具有高效性和专一性。
9. 激素是调节生命活动的生物活性物质,包括胰岛素、甲状腺素等。
10. 人体必需的微量元素还包括硒、铬等。
三、简答题(每题10分,共40分)
1. 请简述人体必需微量元素的作用。

第一章 物质的聚集状态(部分)
1-3.用作消毒剂的过氧化氢溶液中过氧化氢的质量分数为0.030,这种水溶液的密度为1.0gmL1,请计算这种水溶液中过氧化氢的质量摩尔浓度、物质的量浓度和摩尔分数。
解:1L溶液中,m( H2O2) = 1000mL1.0gmL10.030 = 30g
m( H2O) = 1000mL1.0gmL1(10.030) = 9.7102g
n( H2O2) = 30g/34gmoL1=0.88mol
n( H2O) = 970g/18g.mol1=54mol
b( H2O2)= 0.88mol /0.97kg = 0.91molkg1
c( H2O2)= 0.88mol/1L = 0.88molL1
x( H2O2) = 0.88/(0.88.+54) = 0.016
1-4.计算5.0%的蔗糖(C12H22O11)水溶液与5.0%的葡萄糖(C6H12O6)水溶液的沸点。
解: b(C12H22O11)=5.0g/(342g.mol10.095kg)=0.15molkg1
b(C6H12O6)=5.0g/(180g.mol10.095kg)=0.29molkg1
蔗糖溶液沸点上升
Tb=Kbb(C12H22O11)= 0.52Kkgmol10.15molkg1=0.078K
蔗糖溶液沸点为:373.15K+0.078K=373.23K
葡萄糖溶液沸点上升
Tb=Kbb(C6H12O6)= 0.52Kkgmol10.29molkg1=0.15K
葡萄糖溶液沸点为:373.15K + 0.15K = 373.30K
1-5.比较下列各水溶液的指定性质的高低(或大小)次序。
(l)凝固点: 0.1molkg1 C12H22O11溶液,0.1molkg1 CH3COOH溶液,0.1molkg1 KCl溶液。

无机及分析化学(下)_华东师范大学中国大学mooc课后章节答案期末考试题库2023年
1. 国内生产总值表示一定时期内的某一国家或地区领土范围内( )的市场价值总和。
答案:
生产的所有最终商品和劳务
2. 在四部门经济中,如果用支出法衡量,国内生产总值等于( )。
答案:
C+I+G+X-M
3. 如果A国2000年(基期)的GDP为2000亿元,该国2001年GDP平减指数为2,实际GDP比2000年增加了50%,那么2OO1年的名义GDP等于( )。
答案:
6000亿元
4. 某经济某一时期有1.9亿成年人,其中1.2亿人有工作,0.1亿人在寻找工作,0.45亿人没有工作,但也没找工作。该经济中劳动参与率为( ),失业率为( )。
答案:
0.68;7.7%
5. 如果消费函数为c=100+0.8(y-t),并且税收和政府购买支出同时增加1美元,则均衡收入将( )。
答案:
增加1美元
6. 假定其他条件不变,厂商增加投资将引起( )。
答案:
国民收入的增加,同时消费水平也提高了
7. 在某封闭经济体中,已知充分就业的国民收入是2000亿美元,消费支出在充分就业的国民收入水平上是1700亿美元,投资支出和政府购买支出的总和在任何国民收入水平上都等于200亿美元,边际消费倾向为3/4。要使国民收入达到充分就业的均衡,投资的增量应该( )。
答案:
等于100亿美元
8. 投资乘数在哪一种情况下较大? ( )。
答案:
边际储蓄倾向较小
9. 引起IS曲线向左移动的原因是( )。
答案:
政府决定取消原有的冬季采暖补贴
10. 当利率很低时,购买债券的风险( ).
答案:
很大
11. 在LM古典区域,下面哪种情况会引起收入增加?( )

《无机及分析化学》作业答案
第一章(P25)
1—8 (1)26.44% (2) 6.14mol·Kg-1; (3) 5.42 mol·L-1; (4) x(NaCl)=0.0995, x(H2O)=0.9005
1—9 ⊿tb=Kb·bB 相同则bB相等,1.5g/(60g·mol-1×200g)=42.8g/(Mx×1000g)
Mx =342 g·mol-1
1—11 ⊿tf=Kf·bB =1.86℃·kg·mol-1×19g/(Mx×100×10-3Kg) Mx =1606 g·mol-1
1—13 П=cBRT≈bBRT R=8.314kPa·L·mol-1·K-1 ≈8.314kPa·kg·mol-1·K-1(ρ≈1.0 kg·L-1稀溶液)
⊿tf==0.56℃=Kf·bB =1.86℃·kg·mol-1×bB
П=8.314kPa·kg ·mol-1·K-1×309.65K×0.56℃/1.86℃·kg·mol-1=775.09 kPa
1—14 过量AgNO3过量 胶团结构式:[(AgI)m·n Ag+·(n-x) NO3-]x+·xNO3- 正溶胶,负极移动
1—15 三硫化二砷溶胶胶团结构式:[ (As2S3) m·nHS-·(n-x) H+]x-·x H+, 负溶胶,
聚沉能力:NaCl﹤Mg Cl2﹤AlCl3,
第二章(P57)
2—17 rHmθ=3fHmθ(N2,g)+4fHmθ(H2O,g)- fHmθ(N2O4,g)- 2fHmθ(N2H4,l)
=3×0+ 4×(-241.84kJ·mol-1)-(9.661kJ·mol-1)- 2×(50.63kJ·mol-1)
= -1078.28 kJ·mol-1
1078.28×103 J=mgh=100kg×9.8×h h=1100m

.
精选范本 第三章 定量分析基础
3-1.在标定NaOH的时,要求消耗0.1 mol×L-1NaOH溶液体积为20~30 mL,问:
(1)应称取邻苯二甲酸氢钾基准物质(KHC8H4O4)多少克?
(2)如果改用草酸(H2C2O4·2H2O)作基准物质,又该称多少克?
(3)若分析天平的称量误差为±0.0002g,试计算以上两种试剂称量的相对误差。
(4)计算结果说明了什么问题?
解:(1) NaOH + KHC8H4O4 = KNaC8H4O4 + H2O
滴定时消耗0.1 mol×L-1NaOH溶液体积为20 mL所需称取的KHC8H4O4量为:
m1=0.1 mol×L-1´20mL´10-3´204 g×mol-1=0.4g
滴定时消耗0.1 mol×L-1NaOH溶液体积为30 mL所需称取的KHC8H4O4量为:m2=0.1 mol×L-1´30mL´10-3´204
g×mol-1=0.6g
因此,应称取KHC8H4O4基准物质0.4~0.6g。
(2) 2NaOH + H2C2O4 = Na2C2O4 + 2H2O
滴定时消耗0.1 mol×L-1NaOH溶液体积为20和30 mL,则所需称的草酸基准物质的质量分别为:
m1=210.1 mol×L-1´20mL´10-3´126 g×mol-1=0.1g
m2=210.1 mol×L-1´30mL´10-3´126g×mol-1=0.2g
(3) 若分析天平的称量误差为±0.0002g,则用邻苯二甲酸氢钾作基准物质时,其称量的相对误差为:
RE1=g4.0g0002.0= ±0.05%
RE2=g6.0g0002.0= ±0.03%
用草酸作基准物质时,其称量的相对误差为:
RE1=g1.0g0002.0= ±0.2%
RE2=g2.0g0002.0= ±0.1%
(4) 通过以上计算可知,为减少称量时的相对误差,应选择摩尔质量较大的试剂作为基准物质。
无机及分析化学习题参考答案
1 第六章 酸碱平衡和酸碱滴定法
6-1根据下列反应,标出共轭酸碱对。
(1) H
2O + H
2O == H
3O+ + OH-
(2) HAc + H
2O == H
3O+ + Ac-
(3) H
3PO
4 + OH- == H
2PO
4- + H
2O
(4) CN- + H
2O == HCN + OH-
共轭酸碱对为:
(1)H
3O+—H
2O H
2O—OH-
(2)HAc—Ac- H
3O+—H
2O
(3)H
3PO
4—H
2PO
4- H
2O—OH-
(4)HCN—CN- H
2O—OH-
6-2 指出下列物质中的共轭酸、共轭碱,并按照强弱顺序排列起来:HAc,Ac-
;NH
4+
,
NH
3;HF,F-
;H
3PO
4,H
2PO
4-
;H
2S,HS-
。
共轭酸为:HAc、NH
4+
、HF、H
3PO
4、H
2S
共轭碱为:Ac- 、NH
3、 F-
、H
2PO
4-
、HS-
共轭酸强弱顺序为:H
3PO
4、HF、HAc、H
2S、NH
4+
共轭碱强弱顺序为:NH
3、HS-
、Ac-
、F-
、H
2PO
4-
6-3已知下列各弱酸的pK
a和弱碱的pK
b值,求它们的共轭碱和共轭酸的pK
b和pK
a。
(1) pK
b = 4.69 (2) pK
b = 4.75 (3) pK
b = 10.25 (4) pK
a = 4.66
6-4 计算0.10mol
• L-1
甲酸(HCOOH)溶液的pH及其离解度。
解:c/K
a>500
134
aLmol102.41077.11.0)H(
cKc
pH=2.38 %2.4%100
10.0102.4
%100)H(3
cc无机及分析化学习题参考答案
2 6-5 计算下列溶液的pH。
(1) 0.05 mol
• L-1 HCl (2) 0.10 mol
• L-1 CH
2ClCOOH (3) 0.10 mol
• L-1 NH
3•
H
2O
(4) 0.10 mol
百度文库 - 让每个人平等地提升自我
1 第一章 物质的聚集状态(部分)
1-3.用作消毒剂的过氧化氢溶液中过氧化氢的质量分数为,这种水溶液的密度为mL1,请计算这种水溶液中过氧化氢的质量摩尔浓度、物质的量浓度和摩尔分数。
解:1L溶液中,m( H2O2) = 1000mLmL1 = 30g
m( H2O) = 1000mLmL1(1 = 102g
n( H2O2) = 30g/34gmoL1=
n( H2O) = 970g/18g.mol1=54mol
b( H2O2)= / = kg1
c( H2O2)= 1L = L1
x( H2O2) = .+54) =
1-4.计算%的蔗糖(C12H22O11)水溶液与%的葡萄糖(C6H12O6)水溶液的沸点。
解: b(C12H22O11)=(342g.mol1=kg1
b(C6H12O6)=(180g.mol1=kg1
蔗糖溶液沸点上升
Tb=Kbb(C12H22O11)= kgmol1kg1=
蔗糖溶液沸点为:+=
葡萄糖溶液沸点上升
Tb=Kbb(C6H12O6)= kgmol1kg1=
葡萄糖溶液沸点为: + =
1-5.比较下列各水溶液的指定性质的高低(或大小)次序。
(l)凝固点: kg1 C12H22O11溶液,kg1 CH3COOH溶液,kg1 KCl溶液。
(2)渗透压:L1 C6H12O6溶液,L1CaCl2溶液,L1 KCl溶液,1molL1 CaCl2溶液。(提示:从溶液中的粒子数考虑。)
解:凝固点从高到低:
kg1 C12H22O11溶液>kg1 CH3COOH溶液>kg1 KCl溶液
渗透压从小到大:
L1 C6H12O6溶液<L1 KCl溶液<L1 CaCl2 溶液<1molL1CaCl2溶液
………. ………. ……….…………….….装………. ………. ……….…………….….订………. ………. ……….…………….…. ………. ………. ……….…………….….线………. ………. ……….…………….….
《无机及分析化学》第 1 页共 4 页
此处不能书写 此处不能书写 此处不能书写 此处不能书写 此处不能书写
西南石油大学
2019-2020学年第2学期
《无机及分析化学》期末试卷(A卷)
班级名称: 学号: 姓名:
题号 一 二 三 四 总分
分数
得 分
一、单选题(每小题1.5分,共45分)
1. OH-的共轭酸是
(A) H+ (B) H2O
(C) H3O+ (D) O2-
2. 同温同浓度的下列水溶液中, 使溶液沸点升高最多的溶质是
(A) CuSO4 (B) K2SO4
(C) Al2(SO4)3 (D) KAl(SO4)2
3. 下列反应中释放能量最大的是
(A) CH4(l) + 2O2(g)CO2(g) + 2H2O(g)
(B) CH4(g) + 2O2(g)CO2(g) + 2H2O(g)
(C) CH4(g) + 2O2(g)CO2(g) + 2H2O(l)
(D) CH4(g) +23O2(g)CO(g) + 2H2O(l)
4. EDTA相当于一个六元酸,可与金属离子形成螯合物,所形成的多个环为
(A) 五元环 (B) 六元环 (C) 四元环 (D) 不成环
无机及分析化学_西北农林科技大学中国大学mooc课后章节答案期末考试题库2023年
1. 氢键包括分子间氢键和分子内氢键两种类型。
参考答案:
正确
2. 鲍林近似能级顺序并不总是能代表原子中电子的实际能级。
参考答案:
正确
3. 光子、电子、原子等微粒均具有波粒二象性。
参考答案:
正确
4. 氢原子光谱是一种连续光谱。
参考答案:
错误
5. 液态Br2只需克服色散力就能沸腾。
参考答案:
正确
6. NH3的中心原子的杂化类型和分子构型为
参考答案:
sp3不等性杂化,三角锥形
7. BF3的中心原子的杂化类型和分子构型为
参考答案:
sp2杂化,平面三角形
8. 将0.02 mol∙L-1的KCl溶液12 ml和0.05 mol∙L-1的AgNO3溶液100 ml混合以制备AgCl溶胶,此溶胶的胶团结构式为
参考答案:
[(AgCl)m∙nAg +∙(n-x)NO3-]x+∙x NO3-
9. 两个相应的原子轨道以“肩并肩”方式进行重叠的是
参考答案:
π 键
10. 下列四种电子构型的原子中(n=2、3、4)第一电离能最低的是
参考答案:
ns2np4
11. 现代量子力学理论中,原子轨道是指
参考答案:
波函数ψ
12. 某元素原子的价电子构型为3d54s2,则该元素在周期表的位置为
参考答案:
第四周期ⅦB族
13. 莫尔法测定Cl-含量时,要求介质的pH=6.5~10.0范围内,若pH过高,则
参考答案:
形成 Ag2O 沉淀
14. 莫尔法测定Cl-含量时,要求介质的pH在6.5~10范围内,若酸度过高,则
参考答案:
Ag2CrO4 沉淀不易形成
15. 佛尔哈德法中使用的指示剂是
参考答案:
铁铵矾
16. 对于沉淀滴定法,沉淀滴定反应必须具备的条件不包括
参考答案:
沉淀的溶解度为0
17. 下列有关分步沉淀的叙述中正确的
参考答案:
沉淀时所需沉淀试剂浓度小者先沉淀出来
精品文档
. 第1章
1. 下列各测量值含有的有效数字是几位?(定量化学分析简明教程(北大编第3版)P38-2.8)
解:
0.0030;2
6.023 1023;4
64.120;5
4.80 10-10;3
0.998;3(也可认为是四位)
1000;不明确
1.1 103;2
pH=5.23。2
2. 按有效数字计算下列结果:(定量化学分析简明教程(北大编第3版)P38-2.9,有修改)
解:
(1)213.64+4.4+0.3244;
=213.6+4.4+0.3
=218.3
(2)10004182.1)1003206.16239.1400.20(0982.0(注:3、100、1000为自然数)
=0.0982×(20.00-7.780)/(1.4182×1000)
=0.0982×12.22/(1.4182×1000)
=0.0982×12.2/(1.42×1000)
=8.44×10-4
(3)pH=12.00 溶液的[H+]
1.0×10-12mol/L
3. 甲乙二人同时分析一矿物试样中含硫量,每次称取试样4.7克,分析结果报告为:
甲: 0.062% , 0.061% ;乙: 0.06099% , 0.06201%;
问哪一份报告是合理的,为什么?(定量化学分析简明教程(北大编第3版)P37—思考题5,有修改)
解:有效数字
精品文档
. 第9章
1. 定量分析过程中出现下面的情况,试回答它造成什么性质的误差,如何改进?
(1) 过滤时错用了定性滤纸,最后灰份加大;
(2) 过滤时沉淀发生穿滤;
(3) 试剂中含有少量被测组分;
(4) 滴定管读数时,最后一位估计不准;
(5) 天平砝码锈蚀;
(6) 天平零点稍有偏移;
(7) 双臂天平臂长不等;
(8) 容量仪器未经校正;
(9) 指示剂的变色点于化学计量点不一致;
医用基础化学无机及分析化学综合练习
一、选择题
1.化学反应速度随反应物浓度增加而增加的原因是( )
A.活化分子数增加,有效碰撞次数增加
B.活化分子百分数增加,有效碰撞次数增加
C.活化能降低
D.反应速率常数增大
2.对于反应(g)ON (g)2NO422的标准平衡常数K,下列说法正确的是( )
A. (g)2NO (g)ON 242的标准平衡常数等于1/K
B.(g)ON 2 (g)4NO422的标准平衡常数与K相同
C. (g)2NO (g)ON 242的标准平衡常数与K相同
D.K值大小与温度无关
3.关于催化剂,下列说法正确的是( )
A.催化剂可以催化0mrG△的反应,它可以促使不能发生的反应发生
B.催化剂可以改变平衡常数
C.催化剂参与反应,改变了反应路线,降低了活化能,因而加快了反应
D.催化剂只能催化正向反应,不催化逆向反应
4.碳酸钙的分解反应:(g)CO CaO(s) CaCO23,其标准平衡常数表达式为( )
A.)/CaCO()/CO)(/CaO(32cpcK B.ppK/2CO
C.)/CaCO()/)(/CaO(3CO2cppcK D.pK/CO2
5.硫化氢在水溶液中的解离平衡为:
(aq)S (aq)O2H O(l)2H S(aq)H2322
其标准平衡常数表达式为( )
A.)/SH()/S()/OH(2223cccK B.)/SH()/S)(/OH(223cccK
C.)/SH()/S()/OH2(2223cccK D.222223)/OH()/SH()/S()/OH(ccccK
6.25℃,4BaSO的摩尔溶解度为15Lmol100.1,则4BaSO的spK为( )
A.10100.2 B.8100.5 C.5100.3 D.10100.1
7.下列沉淀可溶于ClNH4溶液的是( )
A.CuS B.AgCl C.2Mg(OH) D.4BaSO
8.3CaCO在下列溶液中溶解度最大的是( )
A.纯水 B.32CONa C.NaCl D.2CaCl
9.2PbI的溶度积spK与溶解度的关系是( )
A.3sp4KSo B.spKSo C.3sp2KSo D.4spKSo
10.AgCl的溶度积为101056.1,欲使每升含有4100.2molAg的溶液产生AgCl沉淀,所需Cl离子的浓度为( )
A.14101.31Lmol B.12101.31Lmol
C.7108.71Lmol D.10100.11Lmol
11.以2sp杂化轨道成键的3BF分子的空间构型是( )
A.三角锥形 B.平面三角形 C.直线性 D.四面体型
12.已知2BeCl是直线分子,肯定Be的成键杂化轨道是( )
A.sp B.2sp C.3sp D.2dsp
13.下列分子中能形成氢键的是( )
A.SH2 B.3PH C.HCl D.3NH
14.下列分子中,中心原子采取3sp不等性杂化的是( )
A.3PH B.4CH C.3BCl D.2BeCl
15.OH2分子和2O分之间存在着( )
A.取向力,诱导力 B.诱导力,色散力 C.取向力,色散力 D.氢键
16.在标定NaOH溶液浓度时,某一学生的测定结果分别为0.1023、0.1024、0.1022、0.10231Lmol,而实际结果应为0.10381Lmol,该学生的测定结果( )
A.准确度较好,但精密度较差 B.准确度较好,精密度也好
C.准确度较差,但精密度较好 D.准确度较差,精密度也较差
17.某学生在做酸碱滴定测定时,看滴定管中液体弯月面所指的刻度总是比真实值偏高,这种误差属( )
A.偶然误差 B.系统误差 C.仪器误差 D.过失误差
18.下列哪一条不是一级标准物质(基准物质)所应具备的条件( )
A.与化学式相符的物质组成 B.不应含有结晶水
C. 纯度应达99.9% D.在通常条件下应具有相当的稳定性
19.有滴定反应aA + bB = dD +eE,在化学计量点,其反应物间物质的量的关系错误的是( )
A.n(aA) = n(bB) = n(dD) = n(eE) B.(A)1na(B)1nb(D)1nd(E)1ne
C.bann(B)(A);dann(D)(A) D.an(A)=bn(B)=dn(D)=en(E)
20.在滴定分析中,化学计量点与滴定终点间的关系是( )
A.两者含义相同 B.两者必须吻合
C.两者互不相干 D.两者愈接近,滴定误差愈小
21.由于指示剂选择不当而造成的误差属于( )
A.方法误差 B.试剂误差 C.仪器误差 D.偶然误差
22.溴酚绿指示剂的5In101K,未离解的HIn显黄色,阴离子In显蓝色。它在pH=7和3的溶液中分别呈现( )
A.黄色和蓝色 B.蓝色和黄色 C.绿色和黄色 D.黄色和绿色
23.已知准确浓度的试剂溶液称为( )
A.分析试剂 B.标定溶液 C.标准溶液 D.基准试剂
24.在定量分析中,减小偶然误差的方法是( )
A.空白实验 B.对照试验 C.校正仪器 D.增加平行测定次数
25.某学生为了确定HAc溶液的浓度,他取了25.00mLHAC溶液,加入2滴酚酞指示剂并用标准NaOH溶液滴定。为了校正测定结果,他取25.00mL蒸馏水进行同样的滴定,此学生所作的后一滴定实验为( )
A.空白实验 B.对照试验 C.校正仪器 D.平行测定
二、问答题
1.将Ni Zn Nin 22Z氧化还原反应设计成原电池,分别写出他们的反应和电池符号。
2.将Fe+Cu2+=Fe2++Cu氧化还原反应设计成原电池,分别写出他们的反应和电池符号。
3.将2222245O O8H 2Mn6H O5H 2MnO氧化还原反应设计成原电池,分别写出他们的反应和电池符号。
4.将O2H 4Cr 4H O 4Cr2322氧化还原反应设计成原电池,分别写出他们的反应和电池符号。
5.将Ni+Pb2+=Ni2++Pb氧化还原反应设计成原电池,分别写出他们的反应和电池符号。
6.将Cu+2Ag+=Cu2++2Ag氧化还原反应设计成原电池,分别写出他们的反应和电池符号。
7.将Sn+2H+=Sn2++H2氧化还原反应设计成原电池,分别写出他们的反应和电池符号。
8.命名363Cl)Co(NH配合物,并指出中心原子、配体、配位原子和配位数。
9.命名ClO)Cl(H)Co(NH2233配合物,并指出中心原子、配体、配位原子和配位数。
10.命名OH)Ag(NH23配合物,并指出中心原子、配体、配位原子和配位数。
11.命名443SO)Cu(NH配合物,并指出中心原子、配体、配位原子和配位数。
12.命名443SO)Zn(NH配合物,并指出中心原子、配体、配位原子和配位数。
13.命名42HgIK配合物和配离子,并指出中心原子、配体、配位原子和配位数。
14.命名253Cl)Co(NH配合物和配离子,并指出中心原子、配体、配位原子和配位数。
15.命名243(OH))Cu(NH配合物和配离子,并指出中心原子、配体、配位原子和配位数。
16.命名62Pt(SCN)K配合物和配离子,并指出中心原子、配体、配位原子和配位数。
17.命名3243CO)Cl(NO)Pt(NH配合物和配离子,并指出中心原子、配体、配位原子和配位数。
18.命名ClONOCl)Co(en2配合物和配离子,并指出中心原子、配体、配位原子和配位数。
三、计算题
1.临床上纠正酸中毒的针剂乳酸钠(C3H5O2Na),其规格为30.0mL/支,每支含3.36gC3H5O2Na,求其质量浓度。
2.将15g NaCl 溶于130g 水中配成溶液,计算此溶液中NaCl 的质量分数。
3.市售98.0%的42SOH的密度为1.841Lkg,求它的质量浓度和物质的量浓度c(42SOH)和c(1/242SOH)。
4.正常人血浆中每100mL含Na 0.356g,求其物质的量浓度(用mol·L1表示)。(M(Na)=
23.0g/mol)
5.150mL3NaHCO注射液中含有7.50g3NaHCO,计算此注射液的质量浓度和物质的量浓度。(M(3NaHCO)=84.01molg)
6.计算1Lg0 10.蔗糖(112212OHC)溶液在37℃时的渗透压。(1OHCmolg324112212M)
7.计算1Lg0 10.KCl溶液在37℃时的渗透压。(1KClmolg6.74M)
8.计算1Lg0 10.2CaCl溶液在37℃时的渗透压。(1CaClmolg1112M)
9.计算医院补液时常用1Lg0 50.葡萄糖(6126OHC)溶液和1Lg0 9.NaCl溶液(生理盐水)的渗透压浓度(单位用1Lmmol)。
10.将0.650g某蛋白质溶于水,制备成100mL溶液,在25℃测得此溶液的渗透压0.737kPa,试求此蛋白质的相对分子量。
11.计算0.45mol·L1ClNH4溶液的pH值。(已知53b101.8)(NH-K)
12.计算0.10mol·L12NaNO溶液的pH值。(已知4HNO107.242K)
13.计算0.25mol·L1NaAc溶液的pH值。(已知5a101.7(HAc)-K)