元素离子半径数据
- 格式:pdf
- 大小:104.75 KB
- 文档页数:6
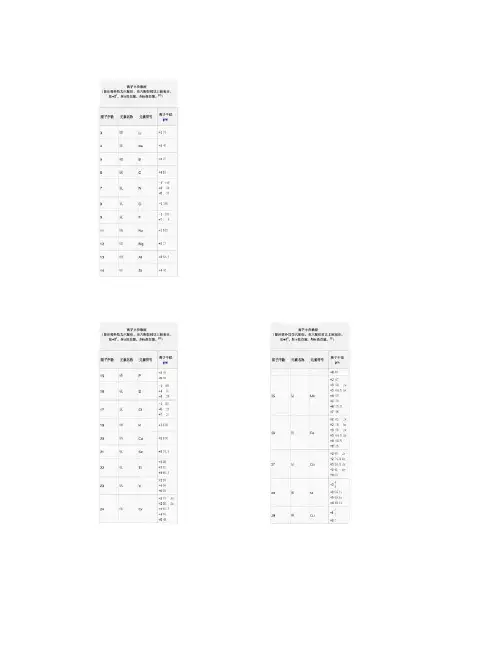
离子半径数据(除注明外均为六配位,非六配位时以上标标注,如+34。
ls =低自旋,hs=高自旋。
[2])原子序数元素名称元素符号离子半径 pm +4 85 96 锔+3 97 Cm +4 85 +3 96 Bk +4 83 +3 95 Cf +4 82.1 97 锫 98 锎刀尖半径与进给量、表面粗糙度的关系newmaker车削时,刀尖半径与进给量、表面粗糙度的理论值存在一定关系,我们选择进给量时一般不应超过此值。
h=rε-(rε²-(0.5×f)²)0.5h为残留高度,而:Ra=(0.25~0.33)h因此:f max=(R a×rε/50)½标题:图1单根避雷针滚球法计算保护半径示意图篇名:智能建筑雷电电磁脉冲防护系统探讨说明:接闪器金属体(或者单根避雷针)在hx高度的水平面上的保护半径。
rx=h(2hr-h)-hx(2hr-hx)式中:rx 为避雷针在hx高度的水平面上的保护半径(m);hCJFD2001标题:图1折线法确定的避雷针保护范围2滚球法确定避雷针的保护范围篇名:折线法和滚球法确定避雷针保护范围的安全性分析说明:以单支避雷针的保护范围为例进行分析说明。
单支避雷针的保护范围如同一顶草帽,由折线构成上下两个圆锥形的保护空间[1],如图1所示。
若避雷CJFD2001标题:图2滚球法确定的避雷针保护范围3折线法与滚球法保护范围比较篇名:折线法和滚球法确定避雷针保护范围的安全性分析说明:单支避雷针的保护范围按下列方法确定[4](见图2):若避雷针高度为h,在距地面高度hr(hr为滚球半径,根据不同建筑物的防雷等级而确定,第一类防CJFD2001标题:图2“滚球法”单支避雷针的保护范围篇名:避雷针保护范围的计算方法说明:应用滚球法,避雷针在地面上的保护半径的计算可见以下方法及图2。
a)避雷针高度h≤hR时的计算距地面hR处作1条平行于地面的平行线。

各类元素离子半径最全版
元素离子半径是指化学元素以及它的离子存在时存在的原子核外围的平均半径。
它由电离度、半径幅度和氧化数决定,能反映物质特性。
一、阳离子半径
1、一价阳离子(Li+、Na+、K+、Rb+、Cs+):这些离子只有一个价,它们的离子半径为:Li+的半径0.76Å,Na+的半径1.02Å,K+的半径1.33Å,Rb+的半径1.48Å,Cs+的半径1.67Å。
3、三价阳离子(Fe3+、Al3+):这些离子具有三个电荷,其半径为:Fe3+的半径0.64Å,Al3+的半径0.51Å。
2、二价阴离子(O2-、S2-):这些离子具有两个负电荷,它们的离子半径分别是:O2-的半径1.30Å,S2-的半径1.84Å。
1、氫离子(H+):氫离子只有一个电荷,其离子半径为0.37Å。
总之,元素离子半径是物质特性的重要反映,它可以帮助我们更好地理解化学元素和它们的离子。

同主族的离子半径比较
离子半径是指离子的半径大小,一般以离子在晶体中的距离计算。
同一族元素
的离子半径有一定的规律性,通常在周期表中向下一周期移动时,阳离子(失去电子形成正电荷离子)的半径逐渐变大,阴离子(获得电子形成负电荷离子)的半径逐渐变小。
在同一族元素的离子中,通常是阳离子半径最小,阴离子半径最大。
锂族元素的离子半径比较
锂(Li)、钠(Na)、钾(K)、铷(Rb)和铯(Cs)均属于同一族元素,它
们的原子序数依次增加。
在同主族中,锂的阳离子半径最小,铯的阳离子半径最大。
锂和铯是周期表中离子半径差异较大的元素。
氯族元素的离子半径比较
氟(F)、氯(Cl)、溴(Br)和碘(I)属于氯族元素,原子序数依次增加。
在这些元素中,氟的阴离子半径最小,碘的阴离子半径最大。
氟和碘是氯族元素中离子半径最大差异的两个元素。
结论
在同一族元素中,离子半径随着原子序数的增加而呈现一定的规律。
阳离子的
半径通常随着原子序数增加而增大,而阴离子的半径通常随着原子序数增加而减小。
这种规律性是由于原子结构和离子结构之间的电子排布关系所致,并在元素化学性质和离子配合物形成等方面具有重要意义。
总的来说,同一族元素的离子半径比较并非单一规律,需通过具体元素的实际
情况来分析。
对于化学研究和应用具有重要指导意义。
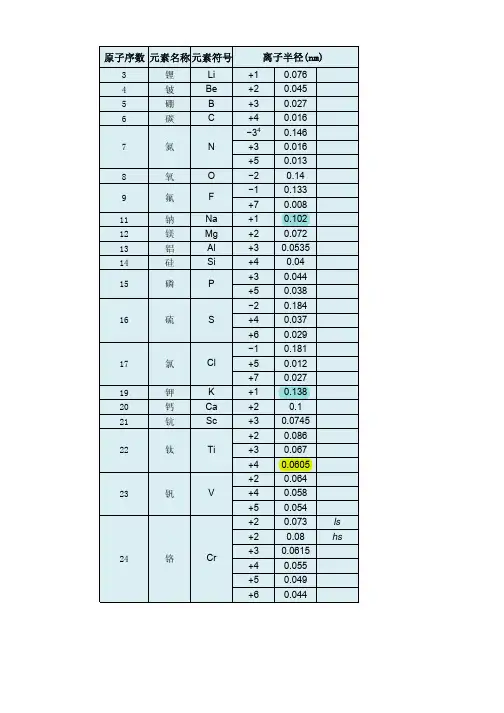

1—36号元素离子半径1. 介绍离子半径的概念和意义离子半径是指离子在晶体中所占据的空间大小,是离子的一个重要物理性质。
离子半径的大小与离子的电荷、电子层排布和晶体结构有关。
离子半径的研究对于理解化学反应、晶体结构和物质性质具有重要意义。
2. 1号元素氢的离子半径氢原子的离子半径很小,约为37.1 pm。
这是因为氢原子只有一个电子,电子云较为紧密包围在核周围,所以离子半径很小。
3. 2号元素氦的离子半径氦原子的离子半径也很小,约为32.0 pm。
与氢原子类似,氦原子只有两个电子,电子云也较为紧密包围在核周围。
4. 3号元素锂的离子半径锂原子失去一个电子形成Li+离子,离子半径约为76.4 pm。
锂离子的离子半径较大,是因为其核电荷仍然很小,电子云的排布比较松散。
5. 4号元素铍的离子半径铍原子失去两个电子形成Be2+离子,离子半径约为45.0 pm。
铍离子的离子半径较小,是因为铍原子的核电荷比较大,电子云较紧密。
6. 5号元素硼的离子半径的离子半径很小,是因为其核电荷很大,电子云非常紧密。
7. 6号元素碳的离子半径碳原子失去四个电子形成C4+离子,离子半径约为16.3 pm。
碳离子的离子半径非常小,是因为其核电荷非常大,电子云非常紧密。
8. 7号元素氮的离子半径氮原子失去三个电子形成N3-离子,离子半径约为171 pm。
氮离子的离子半径较大,是因为其核电荷相对较小,电子云的排布比较松散。
9. 8号元素氧的离子半径氧原子失去两个电子形成O2-离子,离子半径约为140 pm。
氧离子的离子半径较大,是因为核电荷较小,电子云排布较松散。
10. 9号元素氟的离子半径氟原子失去一个电子形成F-离子,离子半径约为133 pm。
氟离子的离子半径较大,是因为其核电荷相对较小,电子云的排布比较松散。
11. 10号元素氖的离子半径氖原子失去两个电子形成Ne2+离子,离子半径约为154 pm。
氖离子的离子半径较大,是因为其核电荷较小,电子云排布较松散。

元素离子半径大小比较元素的离子半径大小是一个非常重要的性质,它影响着元素在化学反应和结构中的行为。
离子半径的大小是由元素的核电荷数和电子排布所决定的。
在化学中,我们经常需要比较不同元素的离子半径大小,以便更好地理解它们之间的化学性质和反应规律。
在化学中,通常使用纳米米(nm)来表示元素的离子半径大小,1纳米等于百万分之一毫米。
下面将通过对一些元素的离子半径大小进行比较,来更深入地了解这个概念。
首先我们来看最简单的一类元素,即氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)和氖(Ne)。
这些元素的原子序数依次递增,它们的离子半径大小也呈现类似的规律。
在这些元素中,氢的离子半径最小,氦的离子半径最大。
在氢、氦两种元素中,氦由于多了一层电子,其离子半径要大于氢。
接下来我们再来看一组元素,即钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)和氩(Ar)。
这些元素的原子序数也是依次递增的,它们的离子半径大小变化较为明显。
在这些元素中,氯的离子半径最小,铝的离子半径最大。
在这些元素中,氯由于多了一层电子,其离子半径要大于氢。
铝的离子半径相对较大,是因为它属于金属元素,其原子结构比较松散。
再来看一组元素,即钾(K)、钙(Ca)、锰(Mn)、铁(Fe)、铜(Cu)、锌(Zn)、溴(Br)和氪(Kr)。
这些元素的原子序数依次递增,它们的离子半径大小也呈现不同的变化趋势。
在这些元素中,氪的离子半径最小,钙的离子半径最大。
钙的离子半径较大,是因为它的原子结构比较紧密,电子排布较复杂。
最后再来看一组元素,即钡(Ba)、锶(Sr)、铍(Sc)、镭(Ra)、铈(Ce)、镨(Pr)、钷(Pa)和镆(Md)。
这些元素的原子序数依次递增,它们的离子半径大小也呈现不同的变化趋势。
在这些元素中,镆的离子半径最小,钡的离子半径最大。
镆的离子半径较小,是因为它的原子结构比较稳定,电子排布较紧密。
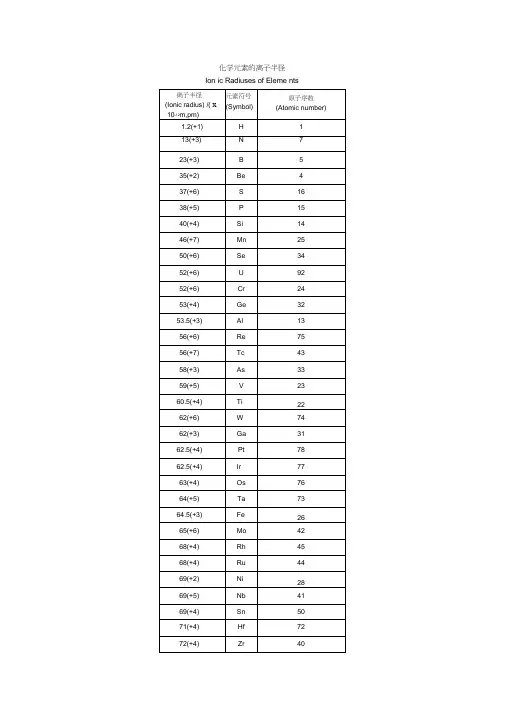
化学元素的离子半径Ion ic Radiuses of Eleme nts离子半径数据(除注明外均为六配位,非六配位时以上标标注, 如+34。
Is =低自旋,hs=高自旋。
⑵)原子序数因元素名称回元素符号回离子半径pmHl3 锂Li +1 764 铍Be +2 455 硼 B +3 276 碳 C +4 16-34 146 7 氮N +3 16+5 13 8 氧O -2 140氟-1 1339 F+7 811 钠Na +1 10212 镁Mg +2 7213 铝Al +3 53.514 硅Si +4 40+3 4415 磷P+5 38硫S +4 37+6 29-1 181 氯Cl +5 12+7 27 钾K +1 138 钙Ca +2 100-2 184钪ScTi 铬CrMn 铁Fe +3 74.5+2 86+3 67+4 60.5+2 64+4 58+5 54+2 73 Is+2 80 hs +3 61.5+4 55+5 49+6 44+2 67+3 58 ls+3 64.5 hs +4 53+54 33+64 25.5+7 46+2 61 ls +2 78 hs +3 55 ls16171920212223242526+3 64.5 hs27 钴Co +4 58.5+64 25+2 65 ls +2 74.5 hs +3 54.5 ls28 镍Ni +3 61 hs +4 53+26+3 56 ls29 铜Cu +3 60 hs +4 48 ls7+17+2730 锌Zn +3 54 ls +2 7431 傢Ga +3 6232 锗Ge+2 7333 砷As +4 53 +3 5834 硒Se +5 46 -2 198 +4 5035 溴Br +6 42-1 196 +34sq 59437 铷Rb +5 31 +7 39+1 15238 锶Sr +2 11839 钇Y +3 9040 锆Zr +4 72+3 72 41 铌Nb +4 68+5 64+3 69钼+4 6542 Mo+5 61+6 59+4 64.5 43 锝Tc +5 60+7 56+3 68+4 62 44 钌Ru +5 56.5+74 38+84 36+3 66.5 45 铑Rh +4 60+5 55+1259钯+2 8646 Pd+3 76+4 61.5+1 115 47 银Ag +2 94+3 75 48 镉Cd +2 95铟In +3 80锡+2 112 Sn+4 69锑+3 76 Sb+5 60-2 221碲Te +4 97+6 56-1 220 碘I +5 95+7 53 氙Xe +8 48铯Cs +1 167 钡Ba +2 135 镧La +3 103.2铈+3 102 Ce+4 87+3 99错Pr+4 85钕8+2 129 Nd+3 98.3钷Pm +3 97钐4+2 122 Sm+3 95.8铕+2 117 Eu+3 94.749505152535455565758596061626364钆Gd+3 93.8铽+3 92.3 65Tb+4 76镝+2 107 66Dy+3 91.267 钬 Ho +3 90.1 68铒Er+3 89铥+2 10369Tm+3 88镱+2 10270Yb+3 86.8 71 镥 Lu +3 86.1 72铪Hf+4 71+3 72 73钽Ta+4 68+5 64+4 6674钨W+5 62+6 60+4 63 铼+5 5875Re+6 55+7 53+4 63+5 57.5 76 锇Os+6 54.5+7 52.5 +84 39+3 68 77 铱Ir +4 62.5+5 57+2 86 78 铂Pt +4 62.5+5 57+1 137 79 金Au +3 85+5 57+1 119 80 汞Hg +2 102铊+1 15081Tl+3 88.5 铅+2 11982Pb+4 77.5 铋+3 10383 Bi+5 76钋+4 9484 Po+6 67 85 砹At +7 6287 钫Fr +1 18088 镭Ra +2814889 锕Ac +3 11290 钍Th +4 94+3 104 91 镤Pa +4 90+5 78+3 102.5铀+4 8992 U+5 78+6 73+2 110+3 101镎+4 8793 Np+5 75+6 72+7 71+3 100+4 86 94 钚Pu+5 74+6 71+28126 95 镅Am +3 97.5+4 85锔+3 9796 Cm+4 85锫+3 9697 Bk+4 83锎+3 9598 Cf+4 82.1。

同一主族离子半径大小比较在无机化学中,主族元素的离子是常见的化学物质。
主族元素是周期表中1A~8A族的元素,它们在化学反应中常常失去或获得电子,形成带电荷的离子。
离子的大小是化学性质和反应活性的重要参数之一,下面将就同一主族不同元素的离子半径大小进行比较。
主族元素的离子半径大小1.碱金属离子:碱金属是周期表中1A族的元素,如锂(Li)、钠(Na)、钾(K)等。
碱金属失去一个电子后形成+1价离子,其离子半径逐渐增大。
在周期表中,随着周期数的增加,碱金属的离子半径也逐渐增大,例如钾的离子半径大于钠,钠的离子半径大于锂。
2.碱土金属离子:碱土金属是周期表中2A族的元素,如镁(Mg)、钙(Ca)、锶(Sr)等。
碱土金属失去两个电子后形成+2价离子,其离子半径也随着周期数增加而增大。
在同一主族内,离子半径递增的规律依然存在,例如锶的离子半径大于钙,钙的离子半径大于镁。
3.卤素离子:卤素是周期表中7A族的元素,如氟(F)、氯(Cl)、溴(Br)等。
卤素的负一价离子经常参与化合物的形成,离子半径会随着周期数增加而增大。
在主族元素中,卤素的离子半径呈现类似的递增规律,例如溴的离子半径大于氯,氯的离子半径大于氟。
4.氧族元素离子:氧族元素是周期表中6A族的元素,如氧(O)、硫(S)、硒(Se)等。
氧族元素常形成-2价离子,其离子半径也随着周期数增加而略有增大。
在同一主族内,氧族元素的离子半径也会有所差异,但一般规律是离子半径随着周期数增大而增大。
结语通过以上对同一主族不同元素的离子半径大小进行比较可以得出,同一主族内的元素离子半径大小具有一定的规律性,通常随周期数的增加而增大。
这种规律性对于了解元素的化学性质和反应活性具有指导作用,同时也为化学实验和应用提供了重要参考依据。
对主族元素离子半径大小的研究有助于深入理解元素的化学行为,为材料设计和反应机理的探究提供基础支持。

离子半径排序离子半径是描述离子大小的重要物理性质之一,它直接影响着化学反应和晶体结构的稳定性。
随着原子结构的不同,离子的大小也会有所不同。
在化学元素中,离子半径大小的顺序会直接影响到化学反应的进行和物质的性质。
下面将按照离子半径的大小顺序来介绍几种常见的化学元素。
1. 氢离子:氢原子是最简单的原子,它失去一个电子后形成氢离子,此时氢离子的半径非常小。
由于氢离子只有一个质子,没有电子,因此其半径非常接近于零。
2. 氟离子:氟原子是氟族元素中的一员,当它接受一个电子形成氟离子时,其半径会略微增大。
氟离子是一种非常小的阴离子,但相比氢离子来说,其半径已经有了一定的大小。
3. 氯离子:氯原子同样是氟族元素,当氯原子接受一个电子形成氯离子时,其半径会比氟离子稍大一些。
氯离子在溶液中常见,具有较强的化学活性。
4. 氧离子:氧原子是氧族元素中的代表,当氧原子接受两个电子形成氧离子时,其半径会进一步增大。
氧离子在许多化合物中都起着重要作用,如氧化物。
5. 硫离子:硫原子是硫族元素,当硫原子接受两个电子形成硫离子时,其半径会略大于氧离子,但仍然比较小。
硫离子在许多硫化物中广泛存在。
6. 铝离子:铝原子是典型的金属元素,当铝原子失去三个电子形成铝离子时,其半径会变得比较大。
铝离子在许多矿物和合金中都有着重要应用。
7. 钾离子:钾原子是碱金属元素,当钾原子失去一个电子形成钾离子时,其半径会比铝离子更大。
钾离子在生物体内起着重要作用,是维持神经和肌肉功能的关键离子之一。
8. 钙离子:钙原子同样是碱土金属元素,当钙原子失去两个电子形成钙离子时,其半径会比钾离子更大。
钙离子在生物体内参与骨骼和牙齿的形成,是维持细胞功能的重要离子之一。
通过以上介绍,我们可以看到不同离子的半径大小存在一定的顺序性,这种顺序性直接反映了原子结构和离子之间的相互作用。
在化学反应中,离子的大小会影响到离子之间的相互作用力,进而影响到反应的进行和产物的稳定性。