2021学年高中化学专题二第二单元化学反应中的热量学案苏教版必修2.doc
- 格式:doc
- 大小:987.50 KB
- 文档页数:15

专题2 第二单元化学反应中的热量(课时1)时间:2011/3/15 班级姓名_____________【学习目标】1、区分吸热反应与需要加热引发的化学反应。
3、认识化学键的断裂和形成是化学反应中能量变化的主要原因;4、了解化学反应中热量变化的实质;通过生产生活中的实例,了解化学能和热能的相互转化;【教学重点】化学能与热能之间的内在联系以及化学能与热能的相互转化。
【教学难点】从本质上(微观结构角度)理解化学反应中能量的变化,从而建立起科学的能量变化观。
【学习过程】化学反应中的热量变化你能回答课本P34 “你知道吗”栏目中的问题吗,请进行交流、讨论1、化学反应中总伴随有______________在某些化学反应中吸收的_______、________、_________转化为化学能,在某些化学反应中,化学能又_______、_______、________等形式释放出来活动与探究:课本P35探究下列变化过程中的温度变化,并回答表格所提问题(1).放热反应定义___________________________________________________ 吸热反应定义___________________________________________________P35[交流与讨论]总结:(2)常见的放热反应__________________________________________________ _________________________________________________(3)常见的吸热反应_______________________________________________________________________________________________(4)放热反应、吸热反应与键能、能量的关系放热反应:∑E(反应物) ∑E(生成物)其实质是,反应物断键吸收的能量_____于放出热量,整个体系能量_____吸热反应:∑E(反应物) ∑E(生成物)其实质是:反应物断键吸收的能量____吸收热量,整个体系能量______。

第二单元化学反应中的热量变化2-2-1化学反应中的热量变化【目标要求】1.通过实验探究认识不同的化学反应其能量变化不同;2.了解放热反应和吸热反应;3.认识化学键的断裂和形成是化学反应中能量变化的主要原因;4.学会用图表表示吸热反应和放热反应中能量变化的方法,培养观察分析实验、阅读图表的能力;5. 培养学生节约能源及环境保护等意识。
【教学重点】吸热反应和放热反应。
【教学难点】吸热反应和放热反应。
【教学过程】[引入]在化学反应中,反应物转化为生成物的同时,必然发生能量的变化。
我们可以通过研究化学反应中的能量变化,更好地利用化学反应为生产和生活服务。
[你知道吗]1、举例说明化学反应中伴随着能量的转化。
2、图2-3给出了几种常见的化学反应实例,请说出反应中能量转化的方式。
你还知道哪些应用能量转化的事例?[解析]课本第32页图2-3中涉及的能量转化方式:① 镁条的燃烧:转化为;② 石油气的燃烧:转化为;③ 闪电时产生氮氧化物:转化为;④ 原电池放电:转化为;⑤ 高温冶炼铁:转化为。
[活动与探究]【实验1】向一支试管中放入用砂纸打磨光亮的镁条,加入5mL2mol/L盐酸,用手触摸试管外壁,有什么感觉?【实验2】在100mL小烧杯中加入约20g经研磨的氢氧化钠晶体[Ba(OH)2·8H2O],然后加入约10g氯化铵晶体,用玻璃棒搅拌,使之充分混合。
用手触摸烧杯外壁,反应混合物的温度有什么变化?根据上述实验现象,回忆并联系生活实验和所学化学知识,谈谈你对化学反应中能量变化的看法。
现象:结论:现象:结论:[板书]一、化学反应伴随着能量的变化1、放热反应:有热量放出的化学反应;2、吸热反应:吸收热量的化学反应。
[交流与讨论]根据你的生活经验和已学知识,举出一些放热反应和吸热反应的例子,并判断下列反应是放热反应还是吸热反应。
(1)镁条的燃烧(2)高温煅烧石灰石(3)氧化钙与水的反应(4)盐酸和氢氧化钠溶液反应[板书]二、热化学方程式1、定义:表示化学反应中放出或吸收的热量的化学式。

化学反应中的热量一、燃料燃烧释放的能量燃料燃烧的条件:(1)使燃料充分燃烧需要考虑两点:①尽可能使燃料充分燃烧,提高能量的转化率;②尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
空气不足:①燃料不能充分燃烧,浪费资源;②产生大量一氧化碳污染空气,危害人体健康。
空气过量:过量空气会带走部分热量,浪费能源。
增大接触面:改变燃料的状态。
如固体燃料粉碎、将液体燃料以雾状喷出、固体燃料液化等。
(2)大量使用化石燃料:①能引起温室效应;②会造成化石燃料蕴藏量的枯竭;③煤燃烧排放二氧化硫,导致酸雨;④煤燃烧会产生大量的烟尘。
二、化学反应的热效应1.建立化学反应中能量变化的观点,了解吸热反应和放热反应【例1】下列选项中说明乙醇作为燃料的优点的是①燃烧时发生氧化反应②充分燃烧的产物不污染环境③乙醇是一种再生能源④燃烧时放出大量热量A.①②③B.①②④C.①③④D.②③④【分析】物质燃烧时都发生氧化反应,并不是乙醇作为燃料的优点。
【答案】D[例2]下列措施中不能提高固体燃料利用率的是()A.粉碎固体燃烧,增大反应接触面积B.鼓入足量空气,使燃料与氧气充分接触C.使煤洁净(气化和液化),减少污染物的排放D.鼓入大量空气(远远过量),使燃料完全燃烧[解析]提高固体燃料利用率,通常可以通过增大反应接触面积或增大空气量来实现。
空气远远过量,会带去部分热量,不利于燃料的充分利用。
[答案]D[例3]下列物质加入水中显著放热的是A.固体NaOHB.生石灰C.无水乙醇D.固体NH4NO3解析:物质溶解于水中的热效应属于了解的内容,也是最基本的感应化学现象的一个方面。
如NaOH、CaO、浓H2SO4溶于水都是典型的放热过程;NH4NO3溶于水是吸热的;C2H5OH、NaCl等溶于水热效应不明显。
答案:AB[例4]下列说法正确的是A.需要加热方能发生的反应一定是吸热反应B.放热的反应在常温下一定很容易发生C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小D.吸热反应在一定的条件下也能发生解析:从能量变化的角度来认识化学反应,有助于加深对反应的全面理解。

专题二第二单元化学反应中的热量第1课时化学反应中的热量变化【学习目标】1.了解吸热反应和放热反应,了解化学反应中热量变化的实质;2.掌握热化学方程式的书写方法和应用;【重难点】学习重点:放热反应和吸热反应,热化学方程式的书写方法和应用。
学习难点:从微观结构理解化学反应中能量的变化。
【学习方法】学思导练【课时安排】1课时【学习过程】【自主探究】1.化学反应中除了发生物质变化外,还同时伴随着______变化。
有些反应需要吸收能量,反应中能、能、能等转化为能,有些反应能够放出能量,反应中能转化为能、能、能等。
2.化学反应中的能量变化主要表现为的放出或吸收。
一、放热反应和吸热反应1.定义:放热反应:热量的反应,吸热反应:热量的反应【过渡】怎样来表示化学反应中放出或吸收的热量呢?2.热化学方程式:(1)定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
(2)意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的变化。
如热化学方程式CaCO3(s)===CaO(s)+CO2(g)ΔH=+178.5 kJ·mol-1表示1 mol CaCO3178.5 kJ热量,完全分解生成(3)书写热化学方程式时应注意:①不需注明反应条件,但要注明反应物和生成物的状态。
(g: l:s:aq:);②△H表示,“ —”表示,“ + ”表示,单位一般采用kJ/mol;③热化学方程式中的系数表示该物质的物质的量,可以取分数,数值与ΔH数值要对应;④应注明反应时的温度和压强,如不注明则指25 ℃、101 kPa。
【练习】完成书本P35 [问题解决]【设疑】化学反应过程中为什么会伴随能量的变化呢?阅读教材P36页完成以下内容3.化学反应中能量变化与化学键的关系(1)化学反应的本质是旧化学键和新化学键的过程。
反应物化学键的需要能量;生成物化学键的需要能量。
(2)键能:1m ol 物质中某种共价键需要的能量。
键能越大,共价键越(“容易”或“不容易”)断裂,形成的物质越(“稳定”或“不稳定”),该物质本身所具有的能量越(“高”或“低”)。

苏教版化学2专题二第二单元《化学反应中的热量变化》教学设计第1篇:苏教版化学2专题二第二单元《化学反应中的热量变化》教学设计【教学背景及教材分析】认识化学反应中能量变化并不等同于化学反应中热量的释放与吸收。
化学反应中的能量变化,可以以不同的能量形式呈现,如热、光的释放和吸收,电能、电磁波的释放和吸收等。
许多化学反应伴随有热量的放出和吸收,在这些反应中,能量的变化也不一定全都以热量的形式呈现。
注意帮助学生区分吸热反应与需要加热引发的化学反应。
认识可逆反应的正反应和逆反应在能量变化上的区别。
不要求学习热效应、燃烧热、中和热、焓变等概念。
利用热化学方程式进行有关化学反应中热量的计算时,不涉及盖斯定律的内容。
教材通过“你知道吗”栏目,让学生交流和讨论,利用日常生活中观察到的现象认识物质能量转化四处可见、形式多样。
在探讨化学反应放热、吸热本质时,要使学生明确三点:1.热量变化是化学反应中能量变化的主要表现形式;2.化学反应过程中的能量守恒;3.化学反应在发生过程中是吸热还是放热,决定于反应物的总能量与生成物的总能量的相对大小。
引导学生从能量变化的高度来学习节内容。
【学习目标】1、认识化学键的断裂和形成是化学反应中能量变化的主要原因;2、了解化学反应中热量变化的实质;3、通过生产生活中的实例,了解化学能和热能的相互转化;【重点】化学能与热能之间的内在联系以及化学能与热能的相互转化。
【难点】从本质上(微观结构角度)理未完,继续阅读 >第2篇:化学反应中的能量变化教学设计一、教学目的要求1、使学生了解化学反应中的能量变化,了解吸热反应和放热反应。
2、常识*介绍燃料充分燃烧的条件,培养学生节约能源及环境保护等意识。
二、教学重点难点1、重点:化学反应解其能量变化,放热反应和吸热反应。
2、难点:化学反应中能量变化观点的建立。
三、教学方法步骤本节教学应在教师的指导下,通过录像、影碟等多媒体手段,加强学生对化学反应中的能量观的认识,让学生通过阅读、观摩、讨论等学习形式,主动了解和掌握有关知识。
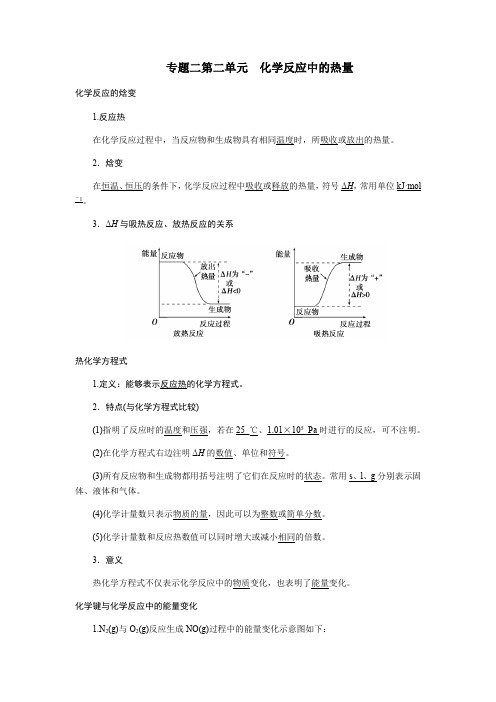
专题二第二单元化学反应中的热量化学反应的焓变1.反应热在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量。
2.焓变在恒温、恒压的条件下,化学反应过程中吸收或释放的热量,符号ΔH,常用单位kJ·mol -1。
3.ΔH与吸热反应、放热反应的关系热化学方程式1.定义:能够表示反应热的化学方程式。
2.特点(与化学方程式比较)(1)指明了反应时的温度和压强,若在25_℃、1.01×105_Pa时进行的反应,可不注明。
(2)在化学方程式右边注明ΔH的数值、单位和符号。
(3)所有反应物和生成物都用括号注明了它们在反应时的状态。
常用s、l、g分别表示固体、液体和气体。
(4)化学计量数只表示物质的量,因此可以为整数或简单分数。
(5)化学计量数和反应热数值可以同时增大或减小相同的倍数。
3.意义热化学方程式不仅表示化学反应中的物质变化,也表明了能量变化。
化学键与化学反应中的能量变化1.N2(g)与O2(g)反应生成NO(g)过程中的能量变化示意图如下:由图可知: N 2(g)与O 2(g)反应的化学方程式为N 2(g)+O 2(g)===2NO(g),该反应的反应热等于946kJ·mol -1+498kJ·mol -1-2×632kJ·mol -1=180kJ·mol -1,热化学方程式为N 2(g)+O 2(g)===2NO(g) ΔH =180 kJ·mol -1。
2.化学反应中能量变化的本质原因:化学反应中化学键的断裂和形成是反应过程中能量变化的本质原因。
例1 已知:H 2(g)+12O 2(g)===H 2O(g),反应过程中能量变化如图所示,问:(1)a 、b 、c 分别代表什么意义? a ________;b ________;c ________。
(2)该反应是放热反应还是吸热反应?________。
ΔH 大于零还是小于零?________。
第二单元化学反应中的热量《拯救大兵瑞恩》里面有一个美军用燃烧弹烧死坑道中敌兵的镜头,这就是燃烧弹在现代坑道战、堑壕战中的作用之一。
由于汽油密度较小,发热热量高,所以广泛用做燃料弹原料。
加入能与汽油结合成胶状物的黏合剂,就制成了凝固汽油弹。
为了攻击水中目标,有的还在汽油弹里添加活泼的碱金属和碱土金属,为了对付装甲坦克,还用铝粉和氧化铁制成了燃烧弹,燃烧弹为什么具有如此威力呢?化学能与热能之间存在着什么关系呢?就让我们在这一节中一起探讨吧!1.了解化学能与热能的相互转化。
了解吸热反应、放热反应等概念。
2.知道化学键的断裂和形成是化学反应中能量变化的主要原因,能说出常见的能量转化形式。
3.了解热化学方程式的含义,学会热化学方程式的书写和简单计算。
4.了解能源是人类生存和社会发展的重要基础。
认识提高燃料的燃烧效率、开发高能清洁燃料的重要性。
5.了解化学在解决能源危机中的重要作用。
一、化学反应中的能量变化1.化学反应的实质化学反应的实质是原子(或原子团)的重新组合,即反应物中化学键的断裂和生成物中化学键的形成。
2.化学反应中能量变化的原因(微观角度)(1)物质中的原子(或原子团)之间是通过化学键相结合的。
(2)当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
(3)化学键的断裂与形成是化学反应中能量变化的主要原因。
3.化学反应中能量变化的决定因素(宏观角度)(1)反应物的总能量大于生成物的总能量,则化学反应释放能量,如图甲所示; (2)反应物的总能量小于生成物的总能量,则化学反应吸收能量,如图乙所示。
二、反应热1.定义:在化学反应过程中放出或吸收的热量,通常叫做反应热。
2.表示方法:用ΔH 表示,它既有数值的大小,又有正负。
其中放热反应,规定ΔH 为“-”或ΔH <0; 吸热反应,规定ΔH 为“+”或ΔH >0。
单位一般采用kJ·mol -1。
三、吸热反应和放热反应1.定义吸热反应:吸收热量的化学反应。
高中化学专题2 化学反应与能量转化第二单元化学反应中的热量教学设计苏教版必修2编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学专题 2 化学反应与能量转化第二单元化学反应中的热量教学设计苏教版必修2)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学专题2化学反应与能量转化第二单元化学反应中的热量教学设计苏教版必修2的全部内容。
化学反应中的热量一、教学内容分析本设计使用的教材是苏教版《化学2》,教学内容是专题2“化学反应与能量转化”中第二单元“化学反应中的热量”。
高中化学新课程强调能源问题的学习,把化学反应与能量转化联系起来,让学生从中了解能源问题与化学科学的密切关系,认识能源对社会发展的重要性.二、学生学习情况分析学生通过初中化学的学习,初步有了化学与能源和资源的利用的知识,已经知道燃料完全燃烧的重要性,初步懂得使用氢气、天然气、石油液化气、酒精和煤等燃料对环境的影响,懂得如何选择对环境污染小的燃料。
同时通过学习一些物质性质(如生石灰)及化学反应,对通过实验判断化学反应过程中的热量变化有一定的认识,为本节的学习奠定了基础.以学生已知知识为平台,通过设置有趣的实验,让学生在探究中学习,调动学生的学习热情,培养学生的学习兴趣。
提供生产、生活中的应用实例,让学生认识学习本节的价值。
本节的难点是热化学方程式,但关于热化学方程式的具体内容将在选修《化学反应原理》中具体介绍,因此,本节课对热化学方程式只要求懂得用它来判定放热反应和吸热反应即可。
学生对化学反应中能量变化与反应物和生成物总能量的关系(如下图)的理解可能存在一些困难,特别对反应物的总能量和生成物的总能量的理解会存在偏差,这里的教学需要教师语言表达的艺术性,深入浅出.三、教学设计思想化学课程标准要求学生,(1)知道化学键的断裂和形成是化学反应中能量变化的主要原因。
专题2 第二单元 化学反应中的热量一.吸热反应和放热反应1.定义:化学上把有热量放出的化学反应叫做放热反应,而吸收热量的化学反应叫做吸热反应。
2.常见的放热、吸热反应放热反应(1)所有燃烧反应;(2)酸碱中和反应;(3)金属与酸生成气体的反应; (4)大多数的化合反应吸热反应:(1)大多数分解反应;(2)电离反应;(3)硝酸铵的溶解 ;(4)氢氧化钡或氢氧化钙与氯化铵的反应(5)二氧化碳与碳化合。
注意:需加热的反应不一定是吸热反应,要持续加热的反应才是吸热反应。
很多放热反应都需要加热才能进行。
放热反应未必不需要加热,如铝热反应。
二.热化学方程式。
1.定义:表明反应所放出或吸收的热量多少的化学方程式,叫做热化学方程式。
例如: H2(g)+Cl2(g) === 2HCl(g);△H=-184.6 kJ/mol2.反应热:(1)定义:在化学反应中放出或吸收的热量(2)符号: △H (3)单位:kJ/mol(4) △H>0----吸热反应 △H<0----放热反应(5)相关计算:△H=生成物的总能量—反应物的总能量或△H=反应物的总键能—生成物的总键能3.书写热化学方程式的注意事项:①要标出反应物和产物的聚集状态(气体用“g”,液体用“l”,固体用“s”,溶液用“aq”)。
热化学方程式中不标“↑”和“↓”若为同素异形体,还要注明名称。
②热化学方程式的化学计量数可以是整数,也可以是分数。
因为该化学计量数表示物质的物质的量,不表示物质的分子或原子数。
③ΔH 只能写在化学方程式的右边。
④反应热ΔH 与测定条件(温度、压强)有关,因此要注明ΔH 的测定条件。
若是在25 ℃、101 k Pa 下测定的,可不注明条件。
⑤ΔH 与反应完成的物质的量有关,因此化学计量数必须与ΔH 相对应,若化学计量数加倍,则ΔH 也要加倍;当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
如氢气在氧气中燃烧生成液态水(298 K 、1.01×105 Pa)的热化学方程式可表示为: 2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1 H2(g)+21O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1(3)热化学方程式的意义和读法①意义:热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
高中化学专题2 化学反应与能量转化2.2 化学反应中的热量1教案苏教版必修2编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学专题 2 化学反应与能量转化 2.2 化学反应中的热量1教案苏教版必修2)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学专题2化学反应与能量转化 2.2 化学反应中的热量1教案苏教版必修2的全部内容。
2.2化学反应中的热量课后习题基础达标一、单项选择题1.下列物质加入水中,能发生化学反应且放出热量的是( )。
A.生石灰 B.固体NaOHC.浓硫酸 D.固体NH4NO32.下列反应既属于氧化还原反应,又是吸热反应的是()。
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应3.有关下列能量转化的认识不正确...的是( ).A.植物的光合作用使太阳能转化为化学能B.人类使用照明设备是将电能转化为光能C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效D.燃料燃烧时只是将化学能转化为热能4.已知反应A+B===C+D的能量变化如图2-2-1所示,下列说法正确的是( ).图2-2-1A.该反应为放热反应 B.该反应为吸热反应C.反应物的总能量高于生成物的总能量D.该反应只有在加热条件下才能进行5.对放热反应A+B===C+D,以下说法一定正确的是(E A、EB、E C、E D分别表示物质A、B、C、D所具有的能量)()。
A.E A>E B B.EA〉E B+ECC.EA+EB〉EC+E DD.EA+EB〈E C+E D6.下列反应中,生成物的总能量高于反应物的总能量的是( )。
第二单元化学反应中的热量
《拯救大兵瑞恩》里面有一个美军用燃烧弹烧死坑道中敌兵的镜头,这就是燃烧弹在现代坑道战、堑壕战中的作用之一。
由于汽油密度较小,发热热量高,所以广泛用做燃料弹原料。
加入能与汽油结合成胶状物的黏合剂,就制成了凝固汽油弹。
为了攻击水中目标,有的还在汽油弹里添加活泼的碱金属和碱土金属,为了对付装甲坦克,还用铝粉和氧化铁制成了燃烧弹,燃烧弹为什么具有如此威力呢?化学能与热能之间存在着什么关系呢?就让我们在这一节中一起探讨吧!
1.了解化学能与热能的相互转化。
了解吸热反应、放热反应等概念。
2.知道化学键的断裂和形成是化学反应中能量变化的主要原因,能说出常见的能量转化形式。
3.了解热化学方程式的含义,学会热化学方程式的书写和简单计算。
4.了解能源是人类生存和社会发展的重要基础。
认识提高燃料的燃烧效率、开发高能清洁燃料的重要性。
5.了解化学在解决能源危机中的重要作用。
一、化学反应中的能量变化
1.化学反应的实质
化学反应的实质是原子(或原子团)的重新组合,即反应物中化学键的断裂和生成物中化学键的形成。
2.化学反应中能量变化的原因(微观角度)
(1)物质中的原子(或原子团)之间是通过化学键相结合的。
(2)当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
(3)化学键的断裂与形成是化学反应中能量变化的主要原因。
3.化学反应中能量变化的决定因素(宏观角度)
(1)反应物的总能量大于生成物的总能量,则化学反应释放能量,如图甲所示;
(2)反应物的总能量小于生成物的总能量,则化学反应吸收能量,如图乙所示。
二、反应热
1.定义:在化学反应过程中放出或吸收的热量,通常叫做反应热。
2.表示方法:用ΔH表示,它既有数值的大小,又有正负。
其中放热反应,规定ΔH 为“-”或ΔH<0; 吸热反应,规定ΔH为“+”或ΔH>0。
单位一般采用kJ·mol-1。
三、吸热反应和放热反应
1.定义
吸热反应:吸收热量的化学反应。
放热反应:放出热量的化学反应。
2.实验探究 (1)
⎩⎪⎨⎪⎧ 现象⎩⎨⎧ 有气泡产生。
温度变化⎩⎪⎨⎪⎧ 用手轻触试管底部感到发热。
用温度计测量,水银柱上升。
离子反应:2Al +6H +===2Al 3++3H 2↑。
结论:Al 与酸反应为放热反应。
(2)⎩⎪⎪⎨⎪⎪⎧ 现象⎩⎪⎨⎪⎧ 闻到刺激性气味,烧杯壁发 凉;玻璃片与烧杯黏结在 一起,混合物呈糊状。
反应:Ba OH 2·8H 2O +2NH 4Cl
===BaCl 2+2NH 3↑+10H 2O 。
结论:Ba OH 2·8H 2O 与NH 4Cl 的反应为吸热反应。
(3)⎩⎪⎨⎪⎧
现象:混合后溶液温度比 NaOH 溶液或盐酸溶液 的温度高。
离子反应:H ++OH -===H 2O 。
结论:酸碱中和反应为放热 反应。
四、热化学方程式
1.含义
可以表示化学反应中放出或吸收热量的化学方程式。
2.意义
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
如热化学方程式 CaCO 3(s)===CaO(s)+CO 2(g) ΔH =+178.5 kJ·mol -1表示1 mol CaCO 3吸收178.5 kJ 热量,完全分解生成1_mol_CaO 固体和1_mol_CO 2气体。
3.书写“三步骤”。