2020高考化学一轮复习5.2化学能与热能(2)反应热的比较与计算(过题型)学案(含解析)
- 格式:docx
- 大小:172.96 KB
- 文档页数:8

高三化学一轮复习化学能与热能在高三化学的一轮复习中,“化学能与热能”这一板块是非常重要的基础知识。
它不仅是高考的常考内容,也是理解化学反应本质和应用的关键。
首先,我们来明确一下什么是化学能。
化学能是物质发生化学反应时所释放或吸收的能量。
而热能呢,简单来说就是与温度相关的能量形式。
当化学能发生转化时,常常会以热能的形式表现出来。
化学反应的过程中,能量的变化是必然存在的。
有的反应会释放出能量,比如燃烧反应,燃料燃烧时会放出大量的热,这就是化学能转化为热能的典型例子。
而有的反应则需要吸收能量才能进行,像碳酸钙受热分解为氧化钙和二氧化碳的反应,就需要从外界吸收热量。
我们来深入探讨一下化学反应中能量变化的原因。
从微观角度看,化学反应的本质是旧化学键的断裂和新化学键的形成。
断裂旧化学键需要吸收能量,而形成新化学键则会释放能量。
如果吸收的能量大于释放的能量,反应就表现为吸热;反之,如果释放的能量大于吸收的能量,反应就表现为放热。
在判断一个化学反应是吸热还是放热时,我们可以通过反应热来衡量。
反应热是指化学反应在一定温度下进行时,所释放或吸收的热量。
如果反应热为正值,表示反应吸热;如果反应热为负值,表示反应放热。
那么,如何准确地计算反应热呢?这就需要用到盖斯定律。
盖斯定律指出,化学反应的反应热只与反应的始态和终态有关,而与反应的途径无关。
这意味着,无论一个反应是一步完成还是分几步完成,其反应热都是相同的。
在实际应用中,化学能与热能的相互转化有着广泛的用途。
例如,在工业生产中,利用化学反应释放的热能来进行加热、发电等;在日常生活中,我们使用的暖宝宝,就是利用铁粉氧化这一放热反应来提供热量。
对于高三的同学们来说,掌握好化学能与热能这部分知识,不仅有助于应对考试中的相关题目,更能为后续学习更深入的化学知识打下坚实的基础。
在复习过程中,要注重理解概念,多做一些练习题来加深对知识的理解和应用。
比如,通过做一些关于反应热计算的题目,来提高自己的计算能力和解题技巧。

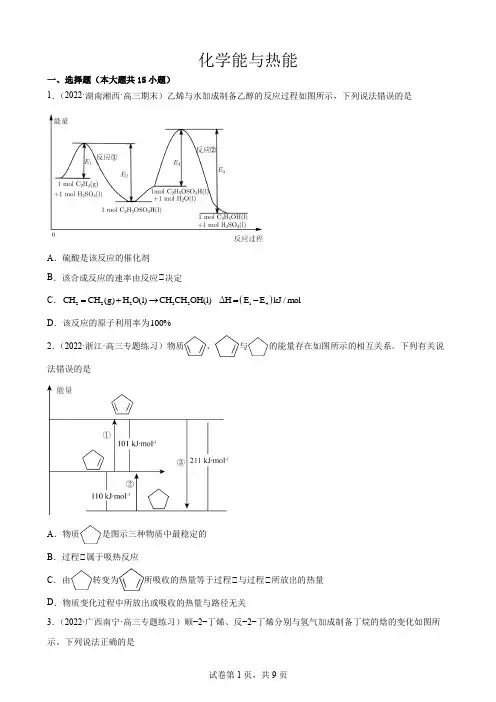
化学能与热能一、选择题(本大题共15小题)1.(2022·湖南湘西·高三期末)乙烯与水加成制备乙醇的反应过程如图所示,下列说法错误的是A .硫酸是该反应的催化剂B .该合成反应的速率由反应②决定C .()2223214CH CH (g)H O(l)CH CH OH(l)ΔH E E kJ /mol =+→=-D .该反应的原子利用率为100% 2.(2022·浙江·高三专题练习)物质、与的能量存在如图所示的相互关系。
下列有关说法错误的是A .物质是图示三种物质中最稳定的B .过程②属于吸热反应C .由转变为所吸收的热量等于过程②与过程②所放出的热量D .物质变化过程中所放出或吸收的热量与路径无关3.(2022·广西南宁·高三专题练习)顺−2−丁烯、反−2−丁烯分别与氢气加成制备丁烷的焓的变化如图所示。
下列说法正确的是A .上述反应均为吸热反应B .顺−2−丁烯比反−2−丁烯稳定C .1mol 顺−2−丁烯转化为1mol 反−2−丁烯放热4.2kJD .发生加成反应时,顺−2−丁烯断键吸收的能量高于反−2−丁烯断键吸收的能量 4.(2022·浙江·高三期末)金属钠和氯气反应的能量关系如图所示,下列说法正确的是A .∆H 3<0,∆H 5>0B .在相同条件下,2K(g)→2K +(g)的3H '∆<∆H 3C .∆H 1<∆H 4+∆H 5+∆H 6+∆H 7D .∆H 7<0,且该过程形成了分子间作用力5.(2022·广东·潮州市潮安区宝山中学高三期末)已知断裂1molH 2(g)中的H—H 键需要吸收436kJ 的能量,断裂1molO 2(g)中的共价键需要吸收498kJ 的能量,生成H 2O(g)中的1molH—O 键能放出462.8kJ 的能量。
下列说法正确的是A .断裂1molH 2O 中的化学键需要释放925.6kJ 的能量B .2H 2(g)+O 2(g)=2H 2O(g),该反应放出能量481.2kJC .2H 2O(l)=2H 2(g)+O 2(g),该反应放出能量471.6kJD .H 2(g)+12O 2(g)=H 2O(l),1mol 2O 参与反应放出能量240.6kJ6.(2022·湖南·长沙市南雅中学高三期末)下列关于反应热的叙述正确的是A.当ΔH<0时,表示该反应为吸热反应B.1molH2与0.5molO2反应生成1mol水时放出的热量即是H2的燃烧热C.热化学方程式中的化学计量数只能是整数,不能是分数D.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO37.(2022·河南·高三阶段练习)已知下列热化学方程式:H2O(g)=H2O(l) ②H=Q1kJ·mol-1;C2H5OH(g)=C2H5OH(l) ②H=Q2kJ·mol-1;C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ②H=Q3kJ·mol-1。

化学能与化学反应热的计算在学习化学的过程中,我们经常会接触到化学能和化学反应热的计算。
化学能是指物质在化学反应中释放或吸收的能量,它是化学反应过程中的重要参量。
而化学反应热则是指化学反应过程中放出或吸收的能量。
本文将围绕这两个主题展开讨论。
首先,化学能是用于描述化学反应能量变化的量。
在计算化学能时,我们常用的方法之一是利用热力学公式计算。
根据热力学第一定律,能量守恒原理,我们可以得出化学反应过程中的能量变化等于反应前后系统的能量差。
其中,能量的单位为焦耳(J)或千焦耳(kJ)。
在计算化学能时,我们经常会用到化学方程式。
化学方程式中的化学式表示的是物质的摩尔比,而摩尔质量则是描述摩尔物质质量的参数。
我们可以通过给定物质的摩尔质量和化学式的摩尔比,通过计算得出化学反应的化学能。
除了热力学公式外,还有其他一些方法可以计算化学反应的化学能。
例如,利用燃烧热或者溶解热等数据来计算反应的能量变化。
这些数据是通过实验测定得出的,可以用于计算物质的燃烧或溶解能力。
其次,化学反应热是化学反应中放出或吸收的能量。
在实际操作中,我们经常需要计算化学反应的热效应,以便了解化学反应过程中的能量变化。
常见的计算化学反应热的方法有热量平衡法和焓变法。
热量平衡法是通过测定反应物和生成物的温度变化,以及反应物和生成物的热容来计算化学反应的热效应。
根据热学定律,系统的热量变化等于反应物和生成物的热量之和。
通过测定温度变化或者直接测定反应物和生成物的热量,可以得出化学反应的热效应。
焓变法是通过测定反应物和生成物的焓变来计算化学反应的热效应。
焓是指系统的热力学参数,可以用于表示系统的能量变化。
通过测定反应物和生成物的焓变,我们可以据此计算化学反应的热效应。
总结起来,化学能和化学反应热的计算是描述化学反应能量变化的重要方法。
通过热力学公式、燃烧热和焓变等方法,我们可以计算出化学反应过程中的化学能和化学反应热。
这些计算可以帮助我们了解和研究化学反应的能量变化,进一步推动化学领域的发展和应用。

高三化学一轮复习化学能与热能在高三化学的一轮复习中,“化学能与热能”这一板块是至关重要的。
它不仅是高考中的高频考点,也是理解化学反应本质和应用的关键。
首先,我们来明确一下什么是化学能。
化学能是物质发生化学反应时所释放或吸收的能量。
化学反应的本质就是旧化学键的断裂和新化学键的形成,而在这个过程中必然伴随着能量的变化。
当反应物的总能量高于生成物的总能量时,化学反应会放出能量,表现为放热反应。
比如常见的燃烧反应,像碳在氧气中燃烧生成二氧化碳,就是一个典型的放热反应。
在这个反应中,碳和氧气之间的化学键断裂,形成二氧化碳分子中的化学键,释放出大量的热能。
相反,当反应物的总能量低于生成物的总能量时,化学反应需要吸收能量,这就是吸热反应。
比如碳酸钙在高温下分解为氧化钙和二氧化碳,这个反应就需要从外界吸收热量,才能使反应进行下去。
那么,如何判断一个反应是吸热还是放热呢?这就需要我们了解一些常见的反应类型和规律。
一般来说,燃烧、中和、金属与酸的反应等大多是放热反应;而大多数分解反应、以碳、氢气、一氧化碳为还原剂的氧化还原反应等通常是吸热反应。
但这并不是绝对的,还需要具体分析反应的热化学方程式。
热化学方程式是表示化学反应与热效应关系的化学方程式。
它不仅要表明反应物和生成物,还要注明反应的焓变(ΔH)。
焓变是一个非常重要的概念,它表示化学反应中能量的变化。
当ΔH 为负值时,反应为放热;当ΔH 为正值时,反应为吸热。
在书写热化学方程式时,需要注意以下几点:要标明物质的状态,因为同一物质在不同状态下的能量是不同的;ΔH 的单位是 kJ/mol,要注意与普通化学方程式中物质的量的对应关系;并且ΔH 的数值要与方程式的计量系数成正比。
接下来,我们再说说能源。
能源与化学能和热能的关系十分密切。
随着社会的发展,能源问题越来越受到关注。
传统的化石能源,如煤、石油、天然气等,在燃烧过程中会释放出大量的化学能,但同时也带来了环境污染等问题。

盖斯定律的应用——反应热的比较、计算及热化学方程式的书写反应热是中学化学的重要内容,在近几年的高考中都有所涉及,特别是运用盖斯定律进行有关反应焓变的比较、计算以及热化学方程式的书写更是考查的重点和热点,该题型能够很好地考查学生综合分析问题的能力,命题角度灵活,但形式比较稳定,大都是与其他化学反应原理相互融合,往往都是以一定的工业生产为背景,在几个已知热化学方程式的基础上运用盖斯定律进行反应焓变的比较、计算以及热化学方程式的书写,在复习备考中应充分理解盖斯定律的本质,掌握解题的技能进行突破。
1.盖斯定律(1)内容对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都一样。
即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(2)意义间接计算某些反应的反应热。
2.ΔH的比较要点(1)比较ΔH的大小时需考虑正负号,对放热反应,放热越多,ΔH越小;对吸热反应,吸热越多,ΔH越大。
(2)反应物和生成物的状态物质的气、液、固三态的变化与反应热的关系(3)参加反应物质的量:当反应物和生成物的状态相同时,参加反应物质的量越多,放热反应的ΔH越小,吸热反应的ΔH越大。
(4)反应的程度:参加反应物质的量和状态相同时,反应的程度越大,热量变化越大。
3.利用盖斯定律进行反应热计算的方法(1)运用盖斯定律的技巧——“三调一加”一调:根据目标热化学方程式,调整已知热化学方程式中反应物和生成物的左右位置,改写已知的热化学方程式。
二调:根据改写的热化学方程式调整相应ΔH的符号。
三调:调整中间物质的化学计量数。
一加:将调整好的热化学方程式及其ΔH相加。
(2)运用盖斯定律的三个注意事项①热化学方程式乘以某一个数时,反应热的数值必须也乘上该数。
②热化学方程式相加减时,物质之间相加减,反应热也必须相加减。
③将一个热化学方程式颠倒时,ΔH的“+”“-”随之改变,但数值不变。
(3)运用盖斯定律的三个模板AΔH1ΔH2B1.(2018·全国卷Ⅰ,28(2)①)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。




专题检测卷(五)第2讲化学能与热能(45分钟100分)一、选择题(本题包括7小题,每小题6分,共42分)1.(2013·东北三省联考)某反应由两步反应A B C构成,它的反应能量曲线如右图(E1、E2、E3、E4表示活化能)。
下列有关叙述正确的是()A.两步反应均为吸热反应B.三种化合物中C最稳定C.加入催化剂会改变反应的焓变D.整个反应的ΔH=E1-E22.1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,则()A.1 mol H2和0.5 mol O2断键吸收的能量大于1 mol H2O(g)断键吸收的能量B.氢气的燃烧热为241.8 kJ·mol-1C.1 mol H2O(l)的能量大于1 mol H2O(g)的能量D.2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量3.(2012·江苏高考)某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
下列有关叙述正确的是()A.该反应为放热反应B.催化剂能改变该反应的焓变C.催化剂能降低该反应的活化能D.逆反应的活化能大于正反应的活化能4.(2013·南平期末)用Cl2生产某些含氯有机物时会产生副产物HCl。
利用反应4HCl(g)+O 2(g)400℃2Cl2(g)+2H2O(g),可实现氯的循环利用。
已知4 mol HCl被氧化可放出115.6 kJ的热量。
下列说法正确的是()A.该反应的热化学方程式是4HCl(g)+O 2(g)400℃2Cl2(g)+2H2OΔH=-115.6 kJ·mol-1B.将36.5 g HCl(g)和8 g O2(g)充入一密闭容器中发生反应,反应放热28.9 kJC.加入催化剂,该化学反应的反应热改变D.在温度、体积一定的条件下,通入4 mol HCl和1 mol O2反应后放出的热量为Q1kJ,若通入8 mol HCl和2 mol O2反应后放出的热量为Q2kJ,则231.2>Q2>2Q15.根据碘与氢气反应的热化学方程式:(ⅰ)I 2(g)+H2(g)2HI(g) ΔH=-9.48 kJ·mol-1(ⅱ)I 2(s)+H2(g)2HI(g) ΔH=+26.48 kJ·mol-1下列判断正确的是()A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJB.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJC.反应(ⅰ)的产物比反应(ⅱ)的产物稳定D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低6. (2013·三明联考)盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步完成,整个过程的热效应是相同的。
第2课时化学能与热能(2)——反应热的比较与计算(过题型)题型一反应热(ΔH)的计算利用键能计算ΔH或根据盖斯定律计算、比较ΔH是近几年全国卷命题的必考点,特别是将热化学方程式和盖斯定律的计算融合在一起的试题,很好的考查了考生对所学知识的灵活应用和运算能力。
正确解答反应热计算的关键是合理设计反应途径,正确加减热化学方程式。
考法一利用键能计算ΔH[典例1](2018·天津高考)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)催化剂2CO(g)+2H2(g)已知上述反应中相关的化学键键能数据如下:C则该反应的ΔH=__________________。
[解析] ΔH=[4×E(C—H)+2×E(CO)]-[2×E(C O)+2×E(H—H)]=(4×413+2×745)kJ·mol-1-(2×1 075+2×436)kJ·mol-1=+120 kJ·mol-1。
[答案] +120 kJ·mol-1[备考方略] 利用键能计算ΔH的方法(1)计算公式ΔH=反应物的总键能-生成物的总键能。
(2)计算关键利用键能计算反应热的关键,就是要算清物质中化学键的数目,清楚中学阶段常见单质、化合物中所含共价键的种类和数目。
考法二利用盖斯定律计算ΔH并书写热化学方程式[典例2] (2018·高考组合题)请回答下列问题:(1)[全国卷Ⅰ,28(2)]已知:2N 2O 5(g)===2N 2O 4(g)+O 2(g) ΔH 1=-4.4 kJ·mol -12NO 2(g)===N 2O 4(g) ΔH 2=-55.3 kJ·mol -1则反应N 2O 5(g)===2NO 2(g)+12O 2(g)的ΔH =______kJ·mol -1。
(2)[全国卷Ⅱ,27(1)]CH 4CO 2催化重整反应为 CH 4(g)+CO 2(g)===2CO(g)+2H 2(g)。
已知:C(s)+2H 2(g)===CH 4(g)ΔH =-75 kJ·mol -1C(s)+O 2(g)===CO 2(g) ΔH =-394 kJ·mol -1C(s)+12O 2(g)===CO(g) ΔH =-111 kJ·mol -1该催化重整反应的ΔH =________kJ·mol -1。
(3)[全国卷Ⅲ,28(2)]SiHCl 3在催化剂作用下发生反应: 2SiHCl 3(g)===SiH 2Cl 2(g)+SiCl 4(g) ΔH 1=+48 kJ·mol -13SiH 2Cl 2(g)===SiH 4(g)+2SiHCl 3(g) ΔH 2=-30 kJ·mol -1则反应4SiHCl 3(g)===SiH 4(g)+3SiCl 4(g)的ΔH 为________kJ·mol -1。
(4)[北京高考,27(1)]近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。
过程如下:反应Ⅰ:2H 2SO 4(l)===2SO 2(g)+2H 2O(g)+O 2(g) ΔH 1=+551 kJ·mol -1反应Ⅲ:S(s)+O 2(g)===SO 2(g) ΔH 3=-297 kJ·mol -1反应Ⅱ的热化学方程式:___________________________________________________ ________________________________________________________________________。
[解析] (1)把已知两反应按顺序编号为a 、b ,根据盖斯定律,a 式×12-b 式可得:N 2O 5(g)===2NO 2(g)+12O 2(g)ΔH =+53.1 kJ·mol -1。
(2)将题给已知三个反应依次编号为①、②、③, 根据盖斯定律,由③×2-①-②可得:CH 4(g)+CO 2(g)===2CO(g)+2H 2(g) ΔH =+247 kJ·mol -1。
(3)将题给两个热化学方程式依次编号为①、②,根据盖斯定律,由①×3+②可得:4SiHCl 3(g)===SiH 4(g)+3SiCl 4(g),则有ΔH =3ΔH 1+ΔH 2=3×48 kJ·mol -1+(-30kJ·mol -1)=+114 kJ·mol -1。
(4)由题图可知,反应Ⅱ的化学方程式为3SO 2+2H 2O =====催化剂2H 2SO 4+S ↓。
根据盖斯定律,反应Ⅱ=-(反应Ⅰ+反应Ⅲ)可得:3SO 2(g)+2H 2O(g)===2H 2SO 4(l)+S(s) ΔH 2=-254 kJ·mol -1。
[答案] (1)+53.1 (2)+247 (3)+114 (4)3SO 2(g)+2H 2O(g)===2H 2SO 4(l)+S(s) ΔH 2=-254 kJ·mol -1[备考方略] 盖斯定律应用三步流程[综合训练]1.(2017·浙江4月选考)已知断裂1 mol H 2(g)中的H —H 键需要吸收436.4 kJ 的能量,断裂1 mol O 2(g)中的共价键需要吸收498 kJ 的能量,生成H 2O(g)中的1 mol H —O 键能放出462.8 kJ 的能量。
下列说法正确的是( )A .断裂1 mol H 2O 中的化学键需要吸收925.6 kJ 的能量B .2H 2(g)+O 2(g)===2H 2O(g)ΔH =-480.4 kJ·mol -1C .2H 2O(l)===2H 2(g)+O 2(g)ΔH =471.6 kJ·mol -1D .H 2(g)+12O 2(g)===H 2O(l)ΔH =-240.2 kJ·mol -1解析:选B 生成1 mol H —O 键放出热量为462.8 kJ ,条件是气态水,A 项没有注明水的状态,错误;B 项生成2 mol H 2O(g)放出的热量为(462.8×4-436.4×2-498)kJ·mol-1=480.4 kJ·mol -1,正确;C 项,H 2O 为液态时,由题目信息无法计算出ΔH 的具体数值,错误;D 项,H 2O 的状态应为气态,错误。
2.回答下列问题:(1)用水吸收NO x 的相关热化学方程式如下:2NO 2(g)+H 2O(l)===HNO 3(aq)+HNO 2(aq) ΔH =-116.1 kJ·mol -13HNO 2(aq)===HNO 3(aq)+2NO(g)+H 2O(l) ΔH =+75.9 kJ·mol -1反应3NO 2(g)+H 2O(l)===2HNO 3(aq)+NO(g)的ΔH =________ kJ·mol -1。
(2)已知:①Al 2O 3(s)+3C(s)===2Al(s)+3CO(g) ΔH 1=+1 344.1 kJ·mol -1②2AlCl 3(g)===2Al(s)+3Cl 2(g) ΔH 2=+1 169.2 kJ·mol -1由Al 2O 3、C 和Cl 2反应生成AlCl 3的热化学方程式为________________________。
(3)烟气(主要污染物SO 2、NO x )经O 3预处理后用CaSO 3水悬浮液吸收,可减少烟气中SO 2、NO x 的含量。
O 3氧化烟气中SO 2、NO x 的主要反应的热化学方程式为①NO(g)+O 3(g)===NO 2(g)+O 2(g) ΔH 1=-200.9 kJ·mol -1②NO(g)+12O 2(g)===NO 2(g)ΔH 2=-58.2 kJ·mol -1则反应3NO(g)+O 3(g)===3NO 2(g)的ΔH =______kJ·mol -1。
解析:(1)将题给三个热化学方程式依次编号为①、②和③,根据盖斯定律可知,③=(①×3+②)/2,则ΔH =(-116.1 kJ·mol -1×3+75.9 kJ·mol -1)/2=-136.2 kJ·mol -1。
(2)把热化学方程式②颠倒过来,反应热的数值不变,符号相反可得③2Al(s)+3Cl 2(g)===2AlCl 3(g) ΔH 3=-ΔH 2=-1 169.2 kJ·mol -1。
根据盖斯定律,由①+③可得Al 2O 3(s)+3C(s)+3Cl 2(g)===2AlCl 3(g)+3CO(g) ΔH =ΔH 1+ΔH 3=+174.9 kJ·mol-1,即为Al 2O 3、C 和Cl 2反应生成AlCl 3的热化学方程式。
(3)将热化学方程式②乘以2可得③2NO(g)+O 2(g)===2NO 2(g) ΔH 3=2×ΔH 2=2×(-58.2 kJ·mol-1)=-116.4 kJ·mol-1。
根据盖斯定律,由①+③可得3NO(g)+O 3(g)===3NO 2(g) ΔH =ΔH 1+ΔH 3=-317.3 kJ·mol -1。
答案:(1)-136.2(2)Al 2O 3(s)+3C(s)+3Cl 2(g)===2AlCl 3(g)+3CO(g) ΔH =+174.9 kJ·mol -1(3)-317.33.二氧化碳回收利用是环保科学研究的热点课题。
已知CO 2经催化加氢可合成低碳烯烃:2CO 2(g)+6H 22CH 2(g)+4H 2O(g) ΔH(1)几种物质的能量(kJ·mol-1)如表所示(在25 ℃、101 kPa条件下,规定单质的能量为0,测得其他物质生成时的反应热为其具有的能量):则该反应的ΔH=________kJ·mol-1。
(2)几种化学键的键能(kJ·mol-1)如表所示:a=________。
解析:(1)ΔH=E(生成物能量总和)-E(反应物能量总和)=(52-242×4-0+394×2) kJ·mol-1=-128 kJ·mol-1。
(2)ΔH=E(反应物键能总和)-E(生成物键能总和)=(803×4+436×6-615-4a-463×8)kJ·mol-1=-128 kJ·mol-1,解得a=409.25。