高中化学必修一铝的性质
- 格式:ppt
- 大小:1.72 MB
- 文档页数:27


高中化学铝的知识点_高中化学必修一铝知识点总结范文铝知识点(一)、铝1.铝与NaOH溶液的反应:因它是唯一能与碱反应的金属。
2.铝箔的燃烧:现象是铝箔熔化,失去光泽,但不滴落。
原因是铝表面的氧化膜保护了铝,氧化铝的熔点(2050℃)远远高于铝(660℃)的熔点。
3.铝、铁钝化:常温下,与浓硫酸、浓硝酸发生钝化,发生化学反应(不是不反应),因生成了致密的氧化膜。
但在加热条件下,则能继续反应、溶解。
4.铝热反应:实验现象:剧烈反应,发出耀眼的光芒,放出大量的热,有大量的熔化物落下来。
引燃剂:镁条、氯酸钾;铝热剂:铝粉和金属氧化物组成的混合物。
5.离子共存:加入铝能产生氢气的溶液,说明此溶液含有大量的H+或OH-,酸溶液中不能含有NO3-、AlO2-,溶液中一旦有了NO3-,溶液就成了HNO3,它与铝将不再产生氢气;碱溶液中不能含有Al3+、NH4+,但可含有AlO2-。
(二)、氧化铝1.熔点高:作耐火坩埚,耐火管和耐高温的实验验仪器等。
2.两性氧化物:因它是化学中唯一的两性氧化物,特别与碱的反应,更应引起重视。
3.工业制备铝:2Al2O3(熔融)=4Al+3O2↑(三)、氢氧化铝1.制备原理:命题角度为是离子方程式的书写;强调用氨水,而不能用强碱。
2.两性氢氧化物:因它是化学中唯一的两性氢氧化物,特别与碱反应,更应引起重视。
3.治疗胃酸过多:因其碱性不强,不会对胃壁产生强剌激作用,但可与胃酸(盐酸)反应,不能用强碱如NaOH。
4.明矾净水原理:因溶液中的铝离子发生水解,生成Al(OH)3胶体,它可以和悬浮水中的泥沙形成不溶物沉降下来,故明矾可用作净水剂。
1、铝和氢氧化钠溶液2Al+2NaOH+2H2o=2NaAlO2+3H2↑2、铝热反应4Al+3MnO2=3Mn+2Al2O3(高温)3、氧化铝和盐酸Al2O3+6HCl=2AlCl3+3H2O4、氧化铝和氢氧化钠溶液Al2O3+2NaOH=2NaAlO2+H2O5、氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O6、氢氧化铝和盐酸Al(OH)3+3HCl=AlCl3+3H2O7、氢氧化铝和氢氧化钠溶液Al(OH)3+NaOH=NaAlO2+2H2O8、三氯化铝和过量氨水AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl9、三氯化铝和过量氢氧化AlCl3+4NaOH=NaAlO2+3NaCl+2H2o研究发现,铝元素能损害人的脑细胞。

高中化学必修一铝知识点高中化学必修一铝知识点Ⅰ、铝①物理性质:银白色,较软的固体,导电、导热,延展性②化学性质:Al—3e-==Al3+a、与非金属:4Al+3O2==2Al2O3,2Al+3S==Al2S3,2Al+3Cl2==2AlCl3b、与酸:2Al+6HCl==2AlCl3+3H2↑,2Al+3H2SO4==Al2(SO4)3+3H2↑常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸c、与强碱:2Al+2NaOH+2H2O==2NaAlO2(偏铝酸钠)+3H2↑ (2Al+2OH-+2H2O==2AlO2-+3H2↑)大多数金属不与碱反应,但铝却可以d、铝热反应:2Al+Fe2O3===2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物Ⅱ、铝的化合物①Al2O3(典型的两性氧化物)a、与酸:Al2O3+6H+==2Al3++3H2O b、与碱:Al2O3+2OH-==2AlO2-+H2O②Al(OH)3(典型的两性氢氧化物):白色不溶于水的胶状物质,具有吸附作用a、实验室制备:AlCl3+3NH3•H2O==Al(OH)3↓+3NH4Cl,Al3++3NH3•H2O==Al(OH)3↓+3NH4+b、与酸、碱反应:与酸Al(OH)3+3H+==Al3++3H2O 与碱Al(OH)3+OH-==AlO2-+2H2O③KAl(SO4)2(硫酸铝钾)KAl(SO4)2•12H2O,十二水和硫酸铝钾,俗名:明矾KAl(SO4)2==K++Al3++2SO42-,Al3+会水解:Al3++3H2O Al(OH)3+3H+因为Al(OH)3具有很强的吸附型,所以明矾可以做净水剂铝及其化合物的重要知识点 1.铝与盐酸:2AL+6HCL=2ALCL3+3H2 气体2.铝与硫酸:2AL+3H2SO4=AL2(SO4)3+3H2气体3.铝与氢氧化钠:2Al+2NaOH+H2O=2NaAlO2+3H2气体4.氢氧化铝加热分2Al(OH)3=(加热)Al2O3+H2O5.硫酸铝与氨水:Al2(SO4)3+6NH3.H2O=2Al(OH)3沉淀+3(NH4)2SO46.氧化铝与盐酸:Al2O3+6HCl=2AlCl3+3H2O7.氧化铝与氢氧化钠:Al2O3+2NaOH=2NaAlO2+H2O8.氯化铝与氢氧化钠:AlCl3+3NaOH=Al(OH)3沉淀+3NaCl9.氢氧化铝与氢氧化钠:Al(OH)3+NaOH=NaAlO2+2H2O10.氯化铝与氢氧化钠:AlCl3+4NaOH=NaAlO2+2H2O11.偏铝酸钠与盐酸(适量):NaAlO2+HCl+H2O=Al(OH)3沉淀+NaCl12.氢氧化铝与盐酸:Al(OH)3+3HCl=AlCl3+3H2O13.偏铝酸钠与盐酸(过量):NaAlO2+4HCl=AlCl3+2H2O14.铝和硝酸Al+6HNO3=Al(NO3)3+3NO2+3H2OAl+4HNO3=Al(NO3)3+NO+2H2O铝的重要化合物1、氧化铝(Al2O3) (1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合.常作耐火材料.刚玉的主要成分是Al2O3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石.(2)化学性质:①电解熔融的氧化铝制备单质铝但由于氧化铝的熔点很高,故在氧化铝中添加冰晶石(Na3AlF6)降低其熔点.电解2Al2O3 Al(OH)3 (胶体) +3H+△。

铝的重要化合物【学习目标】1、掌握铝的重要化合物[Al2O3、Al(OH)3、Al3+、AlO-2、KAl(SO4)2·12H2O]的主要性质及其应用2、掌握“铝三角”及其转化,熟悉铝的化合物的互滴实验【主干知识梳理】一、氧化铝(Al2O3)1、物理性质:白色固体,难溶于水,熔点很高,是优良耐火材料2、化学性质:Al2O3是典性的两性氧化物,既能与酸,又能与碱反应(1)能与酸反应:Al2O3+6HCl===2AlCl3+3H2O Al2O3+6H+===2Al3++3H2O(2)能与碱反应:Al2O3+2NaOH===2NaAlO2+H2O Al2O3+2OH—===2AlO2—+H2O两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,称为两性氧化物3、Al2O3的制备(1)实验室制法:2Al(OH)3Al2O3+3H2O(2)工业制法:铝土矿→Al2O34、主要用途:制造耐火、耐高温器材、工业冶炼铝、可以制作各种宝石【即学即练1】1、下列叙述中不正确的是()A.氧化铝固体不溶于水,不导电,它是非电解质B.氧化铝熔点很高,是一种较好的耐火材料C.氧化铝是一种白色的固体,是冶炼铝的原料D.铝表面形成的氧化铝薄膜可防止铝被腐蚀2、下列关于氧化铝的叙述正确的是()A.氧化铝与酸、碱都能反应生成铝盐和水B.氧化铝既是碱性氧化物又是酸性氧化物C.氧化铝既不是碱性氧化物也不是酸性氧化物D.氧化铝溶于水可得到氢氧化铝3、下列说法正确的是()A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物B.因为Al2O3是金属氧化物,所以它是碱性氧化物C.Al2O3能跟所有的酸、碱溶液反应D.Al2O3能跟强的酸、碱溶液反应二、氢氧化铝[Al(OH)3]1、物理性质:白色胶状不溶于水的固体,有较强的吸附性2、化学性质:Al(OH)3是典型的两性氢氧化物,既能与酸,又能与碱反应(1)能与酸反应:Al(OH)3+3HCl===AlCl3+3H2O Al(OH)3+3H+ ===Al3++3H2O(2)能与碱反应:Al(OH)3+NaOH===NaAlO2+2H2O Al(OH)3+OH—===AlO2—+2H2O两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,称为两性氢氧化物Al(OH)3的电离方式与酸和碱反应过程Al(OH)3电离强度相当微弱,只有加入强酸(或强碱)时,大量H+(或OH-)才能破坏Al(OH)3的电离平衡,使平衡向右(或左)移动,生成铝盐(或偏铝酸盐),所以Al(OH)3既具有碱性,又具有酸性,当加入弱酸或弱碱时,因H+或OH-浓度太小,不能使上述平衡移动,因此Al(OH)3只溶于强酸或强碱,而不溶于弱酸(H2CO3等)、弱碱(NH3·H2O)微点拨强酸或强碱也是相对而言的,Al(OH)3不溶于H2CO3、NH3·H2O,但溶于CH3COOH(3)热稳定性差:2Al(OH)3Al2O3+3H2O3、用途(1)Al(OH)3有较强的吸附性,能凝聚水中悬浮物,又能吸附色素,可以用作净水剂(2)Al(OH)3碱性不强,不至于对胃壁产生强烈的刺激作用或腐蚀作用,却可以与酸反应,起到中和胃酸的作用,可以用作胃酸中和剂4、有关Al(OH)3的少量、过量问题(1)NaOH和AlCl322 2【即学即练2】1、下列关于Al(OH)3的性质叙述错误的是()A.受热易分解生成Al2O3和H2O B.是难溶于水的白色胶状物质C.能凝聚水中的悬浮物,也能吸附色素D.既能溶于NaOH溶液、氨水,又能溶于盐酸2、以硫酸铝溶液为原料之一,在实验室里制取少量氢氧化铝,并且容易分离,最好向溶液中加入的是() A.氢氧化钠溶液B.氢氧化钡溶液C.稀盐酸D.氨水3、氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的哪个性质()A.酸性B.碱性C.两性D.氧化性三、明矾——十二水合硫酸铝钾(1)化学式:KAl(SO4)2·12H2O (十二水合硫酸铝钾)(2)电离方程式:KAl(SO4)2==K++Al3++2SO42-(3)属类:复盐(由两种不同的金属离子和一种酸根离子组成的化合物)(4)物理性质:无色晶体,可溶于水(5)用途:作净水剂,原因是其在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来(6)化学性质:兼有Al3+和SO42-性质①向明矾中滴入Ba(OH)2溶液,当Al3+恰好完全沉淀时(沉淀的物质的量最大),化学方程式为:______________________________________________________________________________②向明矾中滴入Ba(OH)2溶液,当SO42-完全沉淀时(沉淀的质量最大),化学方程式为:_________________________________________________________________________________【即学即练3】1、关于明矾的下列说法错误的是()A.明矾的化学式为KAl(SO4)2 B.明矾是纯净物C.明矾中存在K+和Al3+两种阳离子D.明矾是一种复盐2、明矾是一种净水剂,明矾净水的原理是()A.Al3+有较强的吸附性B.Al3+与悬浮物生成沉淀C.Al3+与水反应生成的氢氧化铝胶体,具有吸附性D.明矾难溶于水四、互滴实验(试剂的滴加顺序不同而产生的现象不同)1、NaOH和AlCl3(1)向AlCl3溶液中逐滴加入NaOH溶液(开始时NaOH不足)先:AlCl3+3NaOH===Al(OH)3↓+3NaCl产生白色沉淀后:Al(OH)3+NaOH===NaAlO2+2H2O沉淀溶解现象:先产生白色沉淀后沉淀消失(2)向NaOH溶液中逐滴加入AlCl3溶液(开始时NaOH过量)先:AlCl3+4NaOH===NaAlO2+3NaCl+2H2O无白色沉淀产生后:3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+3NaCl产生白色沉淀现象:开始无现象后出现白色沉淀2、NaAlO2和盐酸(1)向NaAlO2溶液中逐滴加入盐酸先:NaAlO2+HCl+H2O===Al(OH)3↓+NaCl产生白色沉淀后:Al(OH)3+3HCl===AlCl3+3H2O沉淀溶解现象:先产生白色沉淀后沉淀消失(2)向盐酸中逐滴加入NaAlO2溶液先:NaAlO2+4HCl===NaCl+AlCl3+2H2O无白色沉淀产生后:3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+3NaCl产生白色沉淀现象:开始无现象后出现白色沉淀3、Na2CO3溶液与盐酸(1)向Na2CO3溶液中逐滴加入盐酸(开始时酸不足)先:Na2CO3+HCl===NaHCO3+NaCl无气体产生后:NaHCO3+HCl===NaCl+H2O+CO2↑有气体产生现象:刚开始无气泡产生,盐酸滴加到一定量后,有气泡产生(2)向盐酸中逐滴加入Na2CO3溶液(开始时酸过量)2HCl+Na2CO3===2NaCl+CO2↑+H2O现象:立即产生大量的气泡【即学即练4】1、(多选)下列各组物质的无色溶液,不用其他试剂即可鉴别的是()A.NaOH、AlCl3B.NaHCO3、H2SO4C.NaAlO2、NaHSO4D.Na2CO3、HCl E.Na2CO3、NaHCO3、Ca(OH)22、(多选)下列各组溶液中,只用试管和胶头滴管,不用其他任何试剂就可以鉴别的是() A.KOH和Al2(SO4)3B.稀盐酸和Na2CO3C.CaCl2和Na2CO3D.Ba(OH)2和NaHSO43、下列各组物质,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是() A.H2SO4滴入NaAlO2溶液中B.Ba(OH)2溶液滴入Al2(SO4)3溶液中C.Al2(SO4)3溶液滴入NaOH溶液中D.氨水滴入Al2(SO4)3溶液中4、下列各项操作中符合“先出现沉淀后沉淀完全溶解”现象的有几组()①向饱和碳酸钠溶液中通入CO2至过量②向Fe(OH)3胶体中逐滴滴加稀H2SO4至过量③向BaCl2溶液中通入CO2至过量④向澄清石灰水中逐渐通入CO2至过量⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量⑥向NaAlO2溶液中逐滴滴加盐酸至过量⑦向NaAlO2溶液中逐渐通入CO2至过量⑧向NaOH溶液中逐滴滴加AlCl3至过量A.2 B.3 C.4 D.5五、“铝三角”的转化关系及其应用1、Al3+、Al(OH)3、AlO-2之间的转化关系Al3+→Al(OH)3①Al3++3NH3·H2O===Al(OH)3↓+3NH+4②Al3++3AlO-2+6H2O===4Al(OH)3↓③Al3++3OH-===Al(OH)3↓Al(OH)3→Al3+Al(OH)3+3H+===Al3++3H2O Al3+→AlO-2Al3++4OH-===AlO-2+2H2O AlO-2→Al3+AlO-2+4H+===Al3++2H2OAlO-2→Al(OH)3①AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3(CO2过量)②AlO-2+H++H2O===Al(OH)3↓Al(OH)3→AlO-2Al(OH)3+OH-===AlO-2+2H2O2、“铝三角”转化的应用(1)选择制备Al(OH)3的最佳途径①向铝盐中加入足量氨水,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH+4②向偏铝酸盐中通入足量CO2,离子方程式为:AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3③NaAlO2与AlCl3的溶液混合,离子方程式为:3AlO-2+Al3++6H2O===4Al(OH)3↓(2)分析离子反应顺序①向含有H+、NH4+、Al3+的混合溶液中逐滴加入NaOH,反应的顺序是:______________________②向含有OH-、CO32-、AlO2-的混合溶液逐滴加入盐酸,反应的顺序是:______________________【即学即练5】1、向HCl、MgCl2、AlCl3、NH4Cl溶液中(假设各1 mol),逐滴加入NaOH溶液,沉淀的物质的量随NaOH溶液体积变化的图像如图。

主题:铝
一、学习目标:
1. 了解铝的基本性质;
2. 理解铝的常见用途;
3. 掌握铝的制取方法。
二、学习重点和难点:
1. 铝的化学性质;
2. 铝的制取方法。
三、教学过程:
1. 铝的基本性质
铝是一种轻质、耐腐蚀的金属,为银白色。
具有良好的导电性和导热性。
化学性质稳定,在常温下不会与空气发生反应。
2. 铝的常见用途
铝是广泛应用于工业生产和生活中的重要金属之一。
主要用途有:
- 制造航空器、火箭、汽车等轻质工业材料;
- 制造铝箔、铝合金门窗等日常用品;
- 用于电力和电力传输线路的绝缘体材料等。
3. 铝的制取方法
铝的主要制取方法是电解法。
具体过程如下:
- 将经过氧化、质纯化的氧化铝粉末加入氯化铝和氧化铝混合物中通电;
- 在高温下,氯化铝被还原为铝金属,沉积在阴极上。
四、实践活动:
1. 观察实验:观察铝在化学反应中的变化;
2. 实验操作:自行设计一种制取铝的实验方案,并进行实验验证。
1. 阅读教材相关内容,完成相关习题;
2. 思考铝的应用领域,撰写一篇小短文。
六、教学反馈:
根据学生的学习情况和实验结果,及时总结教学内容,为进一步学习打下基础。
以上为铝的化学教案,希望能对学生学习化学知识有所帮助。
![人教版高中化学必修1[知识点整理及重点题型梳理]_铝及其化合物_提高](https://uimg.taocdn.com/0318cb5cddccda38376baf7d.webp)
人教版高中化学必修一知识点梳理重点题型(常考知识点)巩固练习铝及其化合物【学习目标】1、铝的性质;2、铝的重要化合物及其相互转化。
【要点梳理】 要点一、铝12.化学性质 Al-3e -=Al 3+(1)与非金属反应: a 、铝与氧气的反应。
【铝及其化合物】实验探究:加热有氧化膜和无氧化膜的铝箔b 、与其它非金属反应: 2Al+3S Al 2S 3 2Al+3Cl 2 2AlCl 3(2)与酸反应:(3)与碱反应2Al+2H 2O+2NaOH =2NaAlO 2+3H 2↑ 2Al+2H 2O+2OH -=2AlO 2-+3H 2↑ 要点诠释:①铝是一种较活泼的金属,它并不直接与碱反应,铝与氢氧化钠溶液的反应,实际分两步进行:首先要铝与水反应:2Al+6H2O=2Al(OH)3↓+3H2↑……①由于生成的Al(OH)3覆盖在Al的表面,故看不到H2的生成;其次是生成的Al(OH)3是两性氢氧化物,它溶于NaOH:Al(OH)3+NaOH=NaAlO2+2H2O……②所以铝与NaOH溶液反应可以看到有气体产生。
将两反应式按①+②×2合并,即得总反应式:2Al+2H2O+2NaOH=2NaAlO2+3H2↑。
所以在上述反应中Al是还原剂,H2O是氧化剂。
其电子转移情况可表示如下:②Al与酸、碱反应产生同量的H2,消耗Al的物质的量之比为1∶1,消耗盐酸和NaOH的物质的量之比为3∶1。
③酸、碱、盐可直接侵蚀铝的保护膜(氧化铝也能与酸或碱反应)以及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。
④铝热反应:Al+M x O y Al2O3+xM铝热反应的应用:冶炼高熔点金属,如Fe、V、Cr、Mn等或焊接钢轨。
3.用途:铝主要用来制轻合金。
要点二、铝的化合物1.氧化铝(Al2O3)(1)物理性质:白色难熔固体、不溶于水。
(2)化学性质:Al2O3是典型的两性氧化物,既能与酸反应又能与强碱溶液反应。
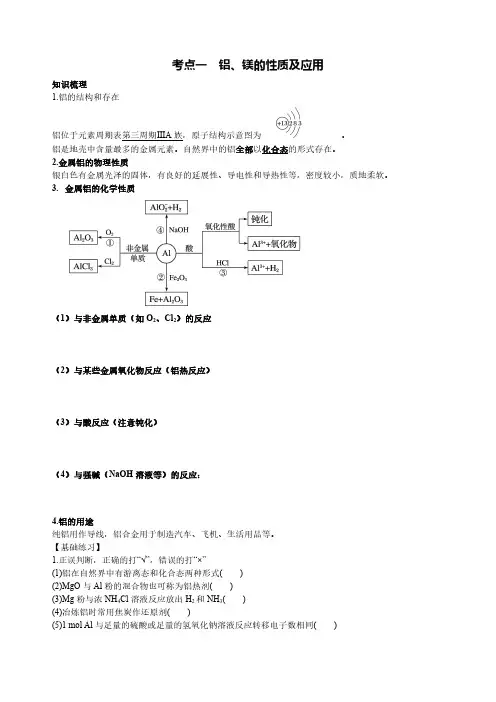
考点一铝、镁的性质及应用知识梳理1.铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质(1)与非金属单质(如O2、Cl2)的反应(2)与某些金属氧化物反应(铝热反应)(3)与酸反应(注意钝化)(4)与强碱(NaOH溶液等)的反应:4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
【基础练习】1.正误判断,正确的打“√”,错误的打“×”(1)铝在自然界中有游离态和化合态两种形式()(2)MgO与Al粉的混合物也可称为铝热剂()(3)Mg粉与浓NH4Cl溶液反应放出H2和NH3()(4)冶炼铝时常用焦炭作还原剂()(5)1mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同()(6)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()题组一对比掌握铝、镁的性质1.镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。
工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是A.①和②B.②和③C.③和④D.④和⑤2.下列关于铝单质的叙述中正确的是A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆题组二铝与酸或碱反应的计算3.(2016·河北衡水中学高三模拟)将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是A.3mol/L HClB.4mol/L HNO3C.8mol/L NaOHD.18mol/LH2SO44.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。

点燃 铝及其化合物 知识点一. 铝单质的性质1.物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2.化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 铝热剂是Al 和 Fe 2O 3(4)与沸水微弱反应:2Al+6H 2O Δ 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H2↑2Al+3H 2SO 4 ====== Al 2(SO 4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:②Al(OH)3+NaOH ======== NaAlO 2+2H 2O知识点二. 铝的重要化合物1. 氧化铝(Al 2O 3)化合价降低,被还原,得6e —①2Al+6H 2O ====== 2Al(OH)3 + 3H 2↑化合价升高,被氧化,失6e —2Al+6H 2O+2NaOH = 2NaAlO 2+3H 2↑+4H 2O失2×3 e —得6×e —(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
常作耐火材料。
刚玉的主要成分是Al 2O 3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。

引言概述:铝是一种常见的金属元素,它在自然界中广泛存在,并且具有许多重要的性质和用途。
本文将详细介绍高中化学必修一第三章第一节《铝》的相关内容。
铝的起源、性质、制备方法、化学反应以及应用领域将被逐一探讨。
正文内容:一、铝的起源1.铝的发现历史2.铝的存在形式二、铝的性质1.物理性质a.密度、熔点和沸点b.导电性和导热性2.化学性质a.反应性b.与非金属的反应三、铝的制备方法1.金属铝的制备方法a.氧化铝的还原法2.铝合金的制备方法a.合金化学反应法b.熔化法四、铝的化学反应1.与酸的反应a.铝与盐酸的反应b.铝与硫酸的反应2.与碱的反应a.铝与氢氧化钠的反应b.铝与氨水的反应3.氧化还原反应a.铝与氧的反应b.铝与二氧化碳的反应五、铝的应用领域1.工业领域a.铝制品制造b.铝合金的应用2.生活用品领域b.小家电制品总结:铝是一种常见的金属元素,它具有较低的密度、优良的导电性和导热性,并且与许多化学物质都能发生反应。
铝的制备方法包括还原法和电解法,而铝的化学反应与酸、碱和氧化还原反应都密切相关。
铝的应用领域广泛,包括工业领域和生活用品领域。
通过深入研究铝的性质和用途,我们可以更好地了解和应用这一重要的金属元素。
引言概述:本文将详细介绍高中化学必修一第三章第一节的内容,即《铝》。
铝是一种常见的金属元素,具有广泛的应用领域。
本文将从铝的性质、制备方法、化学反应以及应用等方面进行详细阐述。
正文内容:一、铝的性质1.物理性质铝是一种银白色的金属,具有良好的导电性和导热性。
铝的密度较低,为2.7g/cm³,属于轻金属之一。
铝的熔点相对较低,约为660℃,易于加工和成型。
2.化学性质铝在常温下相对稳定,与空气中的氧气反应一层致密的氧化铝膜,起到防腐蚀的作用。
铝可以与许多非金属元素反应,如卤素、硫、氮等。
铝与盐酸和硫酸等强酸反应放出氢气。
3.合金性质铝具有良好的合金性能,可以与多种金属元素形成合金,如铜、锌等。

点燃 铝及其化合物 ❖ 教学目标掌握铝单质及其化合物的相关性质及相关反应❖ 知识梳理知识点一. 铝单质的性质1.物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2.化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 铝热剂是Al 和 Fe 2O 3(4)与沸水微弱反应:2Al+6H 2O Δ 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H2↑2Al+3H 2SO 4 ====== Al 2(SO 4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:②Al(OH)3+NaOH ======== NaAlO 2+2H 2O知识点二. 铝的重要化合物化合价降低,被还原,得6e —①2Al+6H 2O ====== 2Al(OH)3 + 3H 2↑化合价升高,被氧化,失6e —2Al+6H 2O+2NaOH = 2NaAlO 2+3H 2↑+4H 2O失2×3 e —得6×e —1. 氧化铝(Al 2O 3)(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
常作耐火材料。

高中化学必修一铝的教案知识目标:1. 了解铝的性质、制取和用途。
2. 掌握铝的化合式、性质及应用。
3. 熟悉铝的氧化、还原反应。
能力目标:1. 能够通过实验加深对铝和其化合物的认识。
2. 能够根据所学知识解决相关问题。
情感目标:1. 培养学生对化学实验的兴趣和爱好。
2. 培养学生的观察与思考能力。
教学重点:1. 铝的性质、制取和用途。
2. 铝的化合式、性质及应用。
教学难点:1. 铝的氧化、还原反应。
教具准备:1. 黑板、粉笔、教材、实验器材。
教学过程:第一步:导入(5分钟)以铝的应用为切入点,引导学生思考铝在生活中的重要性,并进行铝制品的展示,激发学生对铝的兴趣。
第二步:铝的性质、制取和用途(10分钟)介绍铝的物理性质、化学性质以及制取方法和广泛用途,让学生对铝的重要性有更深入的了解。
第三步:铝的化合物(15分钟)介绍铝的一些常见化合物,如氧化铝、硫酸铝等的性质和应用,让学生掌握铝的化学性质及应用。
第四步:实验操作(20分钟)进行铝的氧化实验和还原实验,通过实验让学生亲自操作、观察,加深对铝的认识。
第五步:讨论总结(10分钟)让学生回顾本节课的学习内容,总结铝及其化合物的性质、应用及相关反应。
提出问题,引导学生思考。
第六步:作业布置(5分钟)布置相关练习题,巩固学生的学习成果,激发学生的学习兴趣。
教学反思:通过本节课的教学,学生能够全面了解铝及其化合物的性质、应用和相关反应。
通过实验操作,能够加深学生对铝的认识,培养学生的实验技能和观察思考能力。
通过讨论总结,能够提高学生的学习效果,激发学生的自主学习能力。
考点10 铝金属及其化合物的性质实验【考点定位】本考点考查铝金属及其化合物的性质实验,涉及铝及其氧化物、氢氧化物的两性实验,铝热反应的原理与操作要点,以及氢氧化铝的制备和性质探究等,明确含铝及其化合物的混合物分离提纯方法。
【精确解读】 一、铝的燃烧实验探究 实验原理:4Al+3O22Al 2O 3实验步骤:将铝片剪成长5~8 cm 、宽0.2~0.3 cm 的铝条,绕成螺旋状,一端绕紧一根火柴.实验时,用坩埚钳夹紧铝条的另一端,点燃铝条上的火柴,待火柴快要燃烧完时,将铝条伸入盛有氧气的集气瓶(瓶底盛有少量水)中,观察到的现象是发出耀眼的白光,有少量白烟。
二、铝热反应实验探究 1.实验原理:铝热法是一种利用铝的还原性获得高熔点金属单质的方法. 可简单认为是铝与某些金属氧化物(如Fe 2O 3、Fe 3O 4、Cr 2O 3、V 2O 5等)在高热条件下发生的反应.铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应其中镁条为引燃剂,氯酸钾为助燃剂.镁条在空气中可以燃烧,氧气是氧化剂.但插入混合物中的部分镁条燃烧时,氯酸钾则是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发金属氧化物和铝粉的反应。
2.实验步骤:①把少量氧化铁和少量铝粉充分混合;②少许的铝热剂与少量完全粉碎的氯酸钾充分混合.将它撒在铝热剂上面;③在铝热剂上插上一根镁条,以使镁带燃烧时产生足够的热量点燃铝热剂.点燃镁条后,戴好墨镜,以防闪光伤眼;④在铝热剂下放一些废铁,可以被铝热剂燃烧时产生大量的热量熔化,变成炙热、亮黄色的铁水,非常壮观.注意安全.⑤实验现象:镁条剧烈燃烧,放出大量热能,使氧化铁粉末和铝粉在高温下发生剧烈的氧化还原反应.最终生成液态的铁和氧化铝。
三、氢氧化铝的制备和性质探究点燃试管中产生白色絮状沉淀 Al 2(SO 4)3+6NH 3•H 2O═2Al(OH)3↓+3(NH 4)2SO 4试管中白色沉淀溶解 Al(OH)3+3HCl═AlCl 3+3H 2O试管中白色沉淀溶解Al(OH)3+NaOH═NaAlO 2+2H 2O【精细剖析】1.铝与酸、碱反应生成H 2的量的关系铝与酸、碱反应的化学方程式分别为2Al +6HCl===2AlCl 3+3H 2↑、2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑。
高中化学必修一知识点(第三章)学习高中化学要学会总结,最好一个章节一次总结,最后再来个大总结,那么化学必修一第三章知识点有哪些呢?今天小编在这给大家整理了高中化学必修一知识点(第三章),接下来随着小编一起来看看吧!高中化学必修一知识点(第三章)第三章金属及其化合物第一节金属的化学性质1.金属的物理通性有哪些?(1)金属在常温下的状态除汞是液体外,其他在常温下是固体。
(2)金属的颜色、光泽绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。
(3)良好的导电、导热性。
(4)延展性延性:拉成细丝的性质。
展性:压成薄片的性质。
2.化学通性有哪些?(1)化合态金属元素只有正化合价(2)金属单质易失电子,表现还原性(3)易与氧气反应,得到氧化物(4)活动性排在氢前的金属元素与酸反应得到盐和氢气(5)与盐反应,置换出活动性弱的金属单质3.金属钠的性质有哪些?(1)物理性质有哪些?钠银白色、质软、熔点低、密度比水的小但比煤油的大。
(2)化学性质有哪些?①很活泼,常温下:4Na + O2=2Na2O(新切开的钠放在空气中容易变暗)②加热条件下:2Na+O2Na2O2(先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
③钠与水的反应与H2O反应2Na+2H2O=2NaOH+H2↑离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
高一化学必修一知识点:铝三角高一化学必修一知识点:铝三角铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。
高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。
点击图片可在新窗口打开铝三角主要体现了铝及其化合物的两性一、单质铝(Al)铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。
铝极易失去最外层3个电子形成铝离子:Al-3e-=Al3+。
1.铝与非金属反应铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4Al+3O2点击图片可在新窗口打开2Al2O3;2Al+3S点击图片可在新窗口打开Al2S3;2Al+3Cl2点击图片可在新窗口打开2AlCl3;2.铝与酸反应这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
注意钝化也属于化学变化。
2Al+6HCl=2AlCl3+3H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;3.铝与强碱反应大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可)2Al+2NaOH+2H2O==2NaAlO2+3H2↑;对应离子方程式:2Al+2OH-+2H2O==2AlO2-+3H2↑;该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2Al+6H2O=2Al(OH)3+3H2↑;然后,氢氧化铝与氢氧化钠反应,2Al(OH)3+2NaOH=2NaAlO2+4H2O。
在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。
在解答电子转移和电线桥双线桥法的题目中要注意。
4.铝热反应铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。
2Al+Fe2O3点击图片可在新窗口打开2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。