蛋白质的分离纯化和表征
- 格式:ppt
- 大小:5.90 MB
- 文档页数:75



第7章蛋白质的分离纯化和表征第七章蛋白质的分离、纯化和表征第一节蛋白质的酸碱性质每个解离基团的pK 值与游离氨基酸的不完全相同。
等电点应通过等电点聚焦和其他方法来确定。
第二节蛋白质分子的大小和形状首先,根据化学成分确定最低相对分子质量假设只有一种微量组分,在测量其百分含量后,可以用比例公式计算出最低相对分子质量。
如果测量两种痕量组分的百分比含量,并且通过比例公式计算的最低相对分子质量不同,则可以计算两种最低相对分子质量的近似值的最小公倍数。
实施例:纯酶含有1.65%亮氨酸(MR 131)和2.48%异亮氨酸(MR 131), 以找到最低的相对分子质量。
解决方案:根据Leu 的百分比,最低Mr x1: x1 = (100'131)/1.65 = 7939.4。
最低X2先生:X2 = (100 ' 131)/2.48 = 528是3艮据lie的百分比含量计算的。
由于X1 和X2 数之间的巨大差异,建议该酶包含一个以上的Leu 和l i e 。
为了估计Leu 和lie 的数量,首先计算:X1/X2=7939.4/5282.3 〜1.5 .该酶含有的任何氨基酸的数量应为整数,表明该酶至少含有2个Leu 和3个Ile ,其最小相对分子质量为7939.4 ‘2=15878.8或5282.3 3=15846.9二、渗透压法测定相对分子质量三、沉降分析法测定相对分子质量基本原则:(a)离心力(Fc)当粒子(生物大分子或细胞器)在高速旋转下受到离心力时,离心力“ FC由以下公式定义:f = m a = m w 2ra-粒子旋转加速度,m-沉降粒子的有效质量,w粒子旋转角速度,r- 粒子旋转半径(cm)。
②相对离心力(RCF) 由于各种离心机转子的半径或离心管到转轴中心的距离不同,离心力也不同。
因此,文献中常用相对离心力”或数X g来表示离心力。
只要RCF 值不变,样品在不同的离心机上可以获得相同的结果。


第七章蛋白质的分离、纯化和表征7.1 本章主要内容1)蛋白质的酸碱性质2)蛋白质分子的大小和形状3)蛋白质的胶体性质与蛋白质的沉淀4)蛋白质分离纯化方法7.2 教学目的和要求:通过本章学习,使学生掌握蛋白质的物理化学性质,在此基础上对现实生活中的现象给出合理的解释,同时为后续知识的学习打下基础。
7.3 重点难点1.蛋白质分离纯化方法2.蛋白质物理化学性质及应用7.4 教学方法与手段讲授与交流互动相结合,采用多媒体教学。
7.5 授课内容一、蛋白质的酸碱性质蛋白质也是一类两性电解质,能和酸、碱发生作用。
在蛋白质分子中,可解离基团主要是侧链基团,及少数N端-NH2和C端-COOH。
天然球状蛋白质的可解离基团大部分可被滴定,而某些天然蛋白质中有一部分可解离基因由于埋藏在分子内部或参与氢键形成而不能解离。
1.等电点和等离子点(中性盐Ca2+、Mg2+、cl、HPO42++)等电点:以兼性离子形式存在的蛋白质的pH 值。
在等电点条件下,蛋白质的电导性、溶解度最小,粘度最大。
蛋白质的等电点和它所含的酸性氨基酸残基和碱性氨基酸残基的比例有关。
等离子点:没有其它盐类干扰时,蛋白质质子供体解离出的质子数与质子受体结合的质子数相等时的pH值称等离子点,是每种蛋白质的特征常数。
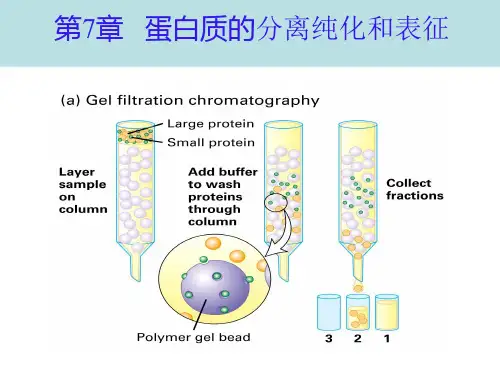
2.蛋白质的电泳分离3.离子交换层析分离蛋白质二、蛋白质的大小与形状测分子量的方法:1.化学组成法2.凝胶过滤法3.SDS-PAGE法4.沉降分析法5.渗透压法三、胶体性质与蛋白质的沉淀蛋白质分子直径在1-100nm之间,在水溶液中具有胶体溶液的通性(布朗运动,丁达耳现象,不能通过半透膜)透析:将含小分子杂质的蛋白质放入透析袋中,置水溶液中,小分子杂质不断从袋中出来,大分子蛋白质仍留在袋中。
蛋白质在水中溶解度依赖于多肽链氨基酸残基侧链基团的相对极性,离子化基因数量越多,溶解度越大。
1.稳定蛋白质胶体溶液的主要因素(1)蛋白质表面极性基团形成的水化膜将蛋白质颗粒彼此隔开,不会互相碰撞凝聚而沉淀。


