蛋白质的分离纯化和表征
- 格式:doc
- 大小:10.38 MB
- 文档页数:28







第7章蛋白质的分离纯化和表征第七章蛋白质的分离、纯化和表征第一节蛋白质的酸碱性质每个解离基团的pK 值与游离氨基酸的不完全相同。
等电点应通过等电点聚焦和其他方法来确定。
第二节蛋白质分子的大小和形状首先,根据化学成分确定最低相对分子质量假设只有一种微量组分,在测量其百分含量后,可以用比例公式计算出最低相对分子质量。
如果测量两种痕量组分的百分比含量,并且通过比例公式计算的最低相对分子质量不同,则可以计算两种最低相对分子质量的近似值的最小公倍数。
实施例:纯酶含有1.65%亮氨酸(MR 131)和2.48%异亮氨酸(MR 131), 以找到最低的相对分子质量。
解决方案:根据Leu 的百分比,最低Mr x1: x1 = (100'131)/1.65 = 7939.4。
最低X2先生:X2 = (100 ' 131)/2.48 = 528是3艮据lie的百分比含量计算的。
由于X1 和X2 数之间的巨大差异,建议该酶包含一个以上的Leu 和l i e 。
为了估计Leu 和lie 的数量,首先计算:X1/X2=7939.4/5282.3 〜1.5 .该酶含有的任何氨基酸的数量应为整数,表明该酶至少含有2个Leu 和3个Ile ,其最小相对分子质量为7939.4 ‘2=15878.8或5282.3 3=15846.9二、渗透压法测定相对分子质量三、沉降分析法测定相对分子质量基本原则:(a)离心力(Fc)当粒子(生物大分子或细胞器)在高速旋转下受到离心力时,离心力“ FC由以下公式定义:f = m a = m w 2ra-粒子旋转加速度,m-沉降粒子的有效质量,w粒子旋转角速度,r- 粒子旋转半径(cm)。
②相对离心力(RCF) 由于各种离心机转子的半径或离心管到转轴中心的距离不同,离心力也不同。
因此,文献中常用相对离心力”或数X g来表示离心力。
只要RCF 值不变,样品在不同的离心机上可以获得相同的结果。


蛋白质的分离纯化和表征第一节蛋白质的酸碱性质各个解离基团的pK 值与游离氨基酸的不完全相同。
等电点要用等电聚焦等方法测定。
第二节蛋白质分子的大小与形状一、根据化学组成测定最低相对分子质量假定某种微量成分只有一个,测出其百分含量后,可用比例式算出最低相对分子质量。
若测出两种微量成分的百分含量,分别用比例式算出的最低相对分子质量不相同时,可计算两个最低相对分子质量近似的最小公倍数。
例题:一种纯酶含亮氨酸(Mr 131)1.65%,含异亮氨酸(Mr131)2.48%,求最低相对分子质量。
解:按照Leu 的百分含量计算,最低Mr X1:X1=(100´ 131)/1.65=7939.4。
按照Ile 的百分含量计算最低Mr X2:X2=(100´ 131)/2.48=5282.3。
由于X1 和X2 数字差异较大,提示这种酶含Leu 和Ile 不止1 个,为了估算Leu 和Ile 的个数,首先计算:X1/X2=7939.4/5282.3≈1.5。
这种酶含任何氨基酸的个数均应是整数,说明该酶至少含有2 个Leu,3 个Ile,其最低相对分子质量为:7939.4 ´2 =15878.8或5282.3×3=15846.9。
二、渗透压法测定相对分子质量三、沉降分析法测定相对分子质量基本原理:(一)离心力(centrifugal force,Fc)当一个粒子(生物大分子或细胞器)在高速旋转下受到离心力作用时,此离心力“Fc”由下式定义:F=m·a=m·ω2 ra—粒子旋转的加速度,m—沉降粒子的有效质量,ω—粒子旋转的角速度,r—粒子的旋转半径(cm)。
(二)相对离心力(relative centrifugal force,RCF)由于各种离心机转子的半径或者离心管至旋转轴中心的距离不同,离心力而受变化,因此在文献中常用“相对离心力”或“数字×g”表示离心力,只要RCF 值不变,一个样品可以在不同的离心机上获得相同的结果。
RCF 就是实际离心场转化为重力加速度的倍数。
X 为离心转子的半径距离,以cm 为单位;g 为地球重力加速度(980cm/sec2);n 为转子每分钟的转数(revolutions per minute,简写成r/min,或rpm)。
(三)沉降系数(sedimentation coefficient,s)根据1924 年Svedberg 对沉降系数下的定义,颗粒在单位离心力场中粒子移动的速度。
X1:离心前粒子离旋转轴的距离;X2:离心后粒子离旋转轴的距离。
S:时常在10-13秒左右,故把沉降系数10-13秒称为一个Svedberg 单位,简写S,量纲为秒。
例如,动物原生质核糖体的沉降系数等于80S,它的含义就是:80×10-13s。
细胞及细胞的各组分的沉降系数有很大的差异,所以可以利用生物样品沉降系数的差异采用离心技术将他们彼此分开。
(四)沉降速度(sedimentation velocity)对于球形颗粒:Fc=1/6Πd3(ρp−ρm)ω2X;Ff=3Πηdv当Fc=Ff时,1/6Πd3(ρp−ρm)ω2X=3Πηdv。
v=(1/18η)[d2(ρp−ρm)ω2X](五)沉降系数与物质相对分子质量由沉降系数根据Svedberg 公式可以计算出物质的相对分子质量:Mr=RTS20,W/[D20,W(1-γρ)]Mr:相对分子质量;D20,W:以20℃的水为介质时颗粒的扩散系数;R:气体常数;T:绝对温度;S20,W:以20℃的水为介质时颗粒的沉降系数;γ:偏比容,等于溶质粒子密度的倒数;ρ:溶剂密度。
(六)沉降时间(sedimentation time,Ts)在实际工作中,常常遇到要求在已有的离心机上把某一种溶质从溶液中全部沉降分离出来的问题,这就必须首先知道用多大转速与多长时间可达到目的。
如果转速已知,则需解决沉降时间来确定分离某粒子所需的时间。
根据沉降系数(S)式可得X2:离心转轴至离心管底内壁的距离;X1:离心转轴至样品溶液面之间的距离,那么(t2-t1)用Ts表示:(七)K 系数(k factor)K 系数是用来描述在一个转子中,将粒子沉降下来的效率。
也就是使溶液澄清的一个指数,所以也叫“cleaning factor”。
原则上,K 系数愈小将粒子沉降得速度愈快。
由其公式可知,K 系数与离心转速及粒子沉降的路径有关。
所以K 系数是一个变数。
通常,离心机的转子说明书中提供的K 系数,都是根据最大路径及在最大转速下所计算出来的数值。
利用此公式预估的离心时间,对水平式转子最适合;对固定角式转子而言,实际时间将比预估的时间来得快些。
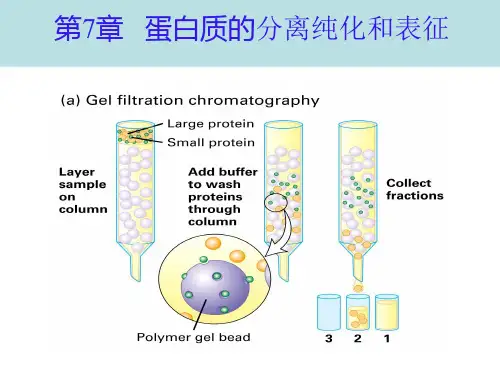
四、凝胶过滤法测定相对分子质量当含有各种组分的样品流经凝胶层析柱时,大分子物质由于分子直径大,不易进入凝胶颗粒的微孔,沿凝胶颗粒的间隙以较快的速度流过凝胶柱。
而小分子物质能够进入凝胶颗粒的微孔中,向下移动的速度较慢,从而使样品中各组分按相对分子质量从大到小的顺序先后流出层析柱,而达到分离的目的。
若以组分的洗脱体积(Ve)对组分相对分子质量的对数(lgMr)作图,可得一曲线,其中主要部分成直线关系。
以此为标准曲线,可以通过测定某一未知组分的洗脱体积,而从标准曲线中查得其相对分子质量。
在实际应用中多以相对洗脱体积Kav (Kav=Ve/Vt) 对lgMr 作曲线,称为选择曲线,曲线的斜率说明凝胶的特性。
每一类型的化合物,如球蛋白类、右旋糖酐类、酶与清蛋白类等都有各自特定的选择曲线。
测定时,未知相对分子质量的组分应位于直线部分为宜。
若不在直线部分,可选用另一种凝胶重新试验。
五、SDS 聚丙烯酰胺凝胶电泳法测定相对分子质量SDS 即十二烷基硫酸钠是阴离子去污剂,在水溶液中,以单体和分子团的混合形式存在,单体和分子团的浓度与SDS 总浓度、离子强度及温度有关,为了使单体和蛋白质结合生成蛋白质-SDS 复合物,需要采取低离子强度,使单体浓度有所升高。
在单体浓度为0.5m mol/L以上时,蛋白质和SDS 就能结合成复合物;当SDS 单体浓度大于1m mol/L 时,与大多数蛋白质平均结合比为1.4g SDS/g 蛋白质;在低于0.5mmol/L 浓度时,其结合比一般为0.4gSDS/g 蛋白质。
由于SDS 带有大量负电荷,当其与蛋白质结合时,所带的负电荷大大超过了天然蛋白质原有的负电荷,因而消除或掩盖了不同种类蛋白质间原有电荷的差异,使蛋白质均带有相同密度的负电荷,因而可利用Mr 差异将各种蛋白质分开。
在蛋白质溶解液中,加入SDS和疏基乙醇,巯基乙醇可使蛋白质分子中的二硫键还原,使多肽分成单个亚单位。
SDS 可使蛋白质的氢键、疏水键打开,还引起蛋白质构象的改变。
此复合物的流体力学和光学性质均表明,它们在水溶液中的形状近似雪茄形的长椭圆棒。
不同蛋白质-SDS 复合物的短轴相同,约1.8nm,而长轴则与蛋白质的Mr 成正比。
目前,用SDS-PAGE 研究过的蛋白质已有数百种,均证实此法测定蛋白质Mr 的可靠性。
现在,市场有标准蛋白试剂出售。
测定未知蛋白质Mr 时,可选用相应的一组标准蛋白及适宜的凝胶浓度,同时进行SDS-PAGE,则可根据已知Mr 蛋白质的电泳迁移率和Mr 的对数作出标准曲线,再根据未知蛋白质的电泳迁移率求得Mr。
本方法有仪器设备简单,操作方便,样品用量少,耗时少(仅需一天),分辨率高,重复效果好等优点,因而得到非常广泛的应用与发展。
它不仅用于蛋白质Mr 测定,还可用于蛋白混合组分的分离和亚组分的分析,当蛋白质经SDS-PAGE 分离后,设法将各种蛋白质从凝胶上洗脱下来,除去SDS,还可进行氨基酸顺序、酶解图谱及抗原性质等方面的研究。
第三节蛋白质的胶体性质与蛋白质的沉淀一、蛋白质的胶体性质大小在1-100nm 范围内;同种电荷互相排斥;质点外围有水化层。
二、蛋白质的沉淀盐析法;有机溶剂沉淀法;重金属盐沉淀法;生物碱试剂和某些酸类沉淀法;加热变性沉淀法。
第四节蛋白质分离纯化的一般原则一、前处理要选择合适的材料;合适的破碎方法;合适的提取液。
二、粗分级分离要方法简便,处理量大。
常用盐析、等电点沉淀和有机溶剂分级分离等方法,有时可用超过滤或凝胶过滤等方法。
三、细分级分离主要使用各种层析、电泳,方法要精心选择,巧妙配合。
后期可用结晶法。
第五节蛋白质的分离纯化方法(一)一、根据分子大小不同的纯化方法(一)透析和超滤1.透析透析是把待纯化的蛋白质溶液装在半透膜的透析袋里,放入透析液(蒸馏水或缓冲液)中进行的,透析液可以更换,直至透析袋内无机盐等小分子物质降到最小值为止。
原理:利用蛋白质分子不能通过半透膜的性质,使蛋白质和其他小分子物质如无机盐、单糖等分开。
2.超滤利用压力或离心力,强行使水和其他小分子溶质通过半透膜,而蛋白质被截留在膜上,以达到浓缩和脱盐的目的。
超滤是一种膜分离技术,它的特点是使用不对称多孔膜根据分子的大小来分离溶液中的大分子物质与小分子物质。
超滤尤其适用于大分子溶液的浓缩、不同种类分子的纯化以及溶剂交换等。
超滤法是一种温和、非变性的物理方法,比其它分离方法有效率更高、更灵活的优点。
原理:在外力作用下,超滤膜对大分子物质的截留主要是筛分作用,决定截留效果的主要是膜的表面活性层上孔的大小与形状。
除了筛分作用外,膜表面、微孔内的吸附和粒子在膜孔中的滞留也使大分子被截留。
现在已有各种市售的超滤膜装置可供选用,有加压、抽滤和离心等多种形式。
滤膜也有多种规格,他们截留相对分子质量不同的蛋白质。
使用中最需注意的问题是滤膜表面容易被吸附的蛋白质堵塞,使超滤速度减慢,能被截留物质的Mr 变小。
超滤的主要应用:浓缩:使用超滤来增加所需大分子溶质的浓度,即大分子被超滤膜截留而小分子和溶剂可自由通过,从而达到浓缩的目的。
梯度分离:按分子大小梯度分离样品中的溶质分子时,超滤是一种经济有效的方法,适用于分离分子量相差10 倍以上的分子组分。
在超滤过程中,虽然截留的大分子被浓缩,但滤过的溶质分子仍保持初始的浓度。
脱盐/纯化:脱盐即从大分子溶液中去除盐、非水性溶剂和小分子物质的过程。
通过溶剂交换,可最有效地去除溶液中的小分子物质,并逐渐分离纯化出大分子物质。
具体方法为:在溶液进行超滤的同时,不断向溶液中补充溶剂,补充溶剂的速度与溶液滤过速度相同,使体系始终保持恒定,这种方法又称透析超滤法。
(二)密度梯度离心(三)凝胶过滤当含有各种组分的样品流经凝胶层析柱时,大分子物质由于分子直径大,不易进入凝胶颗粒的微孔,沿凝胶颗粒的间隙以较快的速度流过凝胶柱。
而小分子物质能够进入凝胶颗粒的微孔中,向下移动的速度较慢,从而使样品中各组分按相对分子质量从大到小的顺序先后流出层析柱,而达到分离的目的。