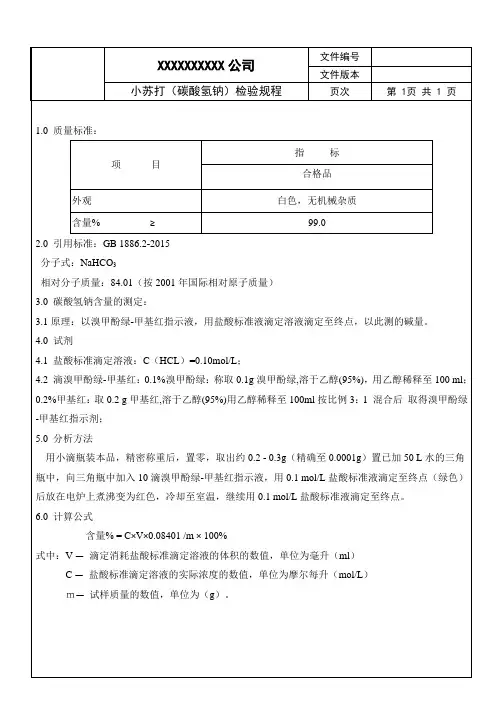
小苏打中碳酸氢钠含量的测定
- 格式:ppt
- 大小:157.50 KB
- 文档页数:15

设计实验二 小苏打中NaHCO 3含量的测定【实验原理】1、酸碱滴定分析法中,盐酸常用来配置标准酸溶液,由于浓盐酸也放出HCl 气体,所以不能直接法配置,只能先配置成近似浓度的溶液,再用适当的一级标准物质标定之。
无水碳酸钠常用于标定强酸如HCl 溶液,标定过程中甲基橙作指示剂,甲基橙加在Na 2CO 3 溶液中中显黄色。
标定至终点时溶液由黄色变为橙红,当盐酸滴定一级标准物质Na 2CO 3至终点时,可根据盐酸消耗量和一级标准物质的质量计算出HCl 的浓度:Na 2CO 3+2HCl=2NaCl+CO 2↑+H 2OC (HCl )=23232m (N a C O )10005(a )(l)M N C O V H C ⨯ (mol/L)2、小苏打样品中NaHCO 3的测定:用HCl 滴定NaHCO 3,滴定过程中,用甲基橙作指示剂,甲基橙在PH>4.4显黄色.PH<3.1显红色.3.1~4.4显橙色。
滴定NaHCO 3甲基橙加在NaHCO 3溶液中显黄色.滴定至终点时溶液由黄色变为橙红。
NaHCO 3+HCl=NaCl+ CO 2↑+H 2O.滴定达到终点后,根据下式算出C(NaHCO 3),再计算出小苏打样品中NaHCO 3的含量: C(NaHCO 3)=C (H C l)V (H C l) 1000V(NaHCO3)⨯ (mol/L)【仪器与试剂】仪器:分析天平、称量瓶、容量瓶(100ml ×2)、移液管(20ml ×2)、玻璃棒、烧杯(250ml ×2)、胶头滴管、洗耳球、滴定台、锥形瓶(250ml ×2)、酸式滴定管(25ml ×2) 试剂:分析纯Na 2CO 3、小苏打样品、0.1mol/L HCl 溶液、甲基橙、蒸馏水.【实验步骤】一、0.1mol/L HCl 标准溶液的标定:(1)在分析天平上准确称取105℃干燥至恒重的分析纯 碳酸钠[Mr(NaHCO 3):106.00]0.4~0.6g(精确至±0.0001g)溶解并定容到100ml 。


含量的测定3NaHCO 小苏打中【实验目的】1.掌握滴定分析法的用途和意义 。
2.掌握酸碱滴定的基本原理及实验基本操作。
3.学习双指示剂法测定混合碱液组成及含量的原理和方法,并巩固滴定的基本操作。
4.通过实验提高实验设计、创新能力,培养独立分析问题的能力。
5.熟悉各仪器的使用。
【实验原理】1.酸碱滴定分析是以质子转移反应为定量基础的滴定分析法。
一般用于能直接或间接与酸碱发生定量反应的物质的含量测定。
2.能用于直接配制标准溶液的物质称为一级标准物质。
而在酸碱滴定分析中,常用HCI 和NaOH 溶液作为标准溶液,但浓盐酸易挥发,NaOH 易吸收空气中的水和二氧化碳,都不能直接配成标准溶液。
只能先配制成近似浓度,然后用以及标准物质或另一种已知准确浓度的标准溶液来确定其准确浓度。
3.可用无水碳酸钠来标定盐酸浓度,反应式如下:Na 2CO 3+2HCl=2NaCl+CO 2↑+H 2O.化学计量点,溶液呈弱酸性,此时溶液pH=3.9,滴定突跃范围为pH=5.0-3.5,可用甲基橙作指示剂,滴定终点时溶液颜色由黄色变为橙红色。
根据关系式n(HCl)=2n(Na 2CO 3) 则有1000)()()(5)(23232⨯=HCl V CO Na M CO Na m HCl c (mol/L )4.碳酸氢钠(NaHCO 3)含量的测定,根据反应式如下: H + + HCO 3¯ = H 2O + CO 2↑用甲基橙作指示剂,滴定终点时,溶液由黄色变为橙红色。
)/(1000)()()()(33L mol NaHCO V HCl V HCl c NaHCO c ⨯=求得小苏打中NaHCO 3含量:w (Na 2CO 3)= { [c(HCl)×V(HCl)×M(NaHCO3)]/m 总(样品)}×100﹪ 5.甲基橙在pH>4.4时显黄色,pH<3.1时显红色,pH 范围在3.1~4.4显橙色.【仪器与试剂】仪器:电子天平、酸碱两用滴定管(25mL)、容量瓶(100mL×2)、移液管(20ml ×2)、锥形瓶(250m L×3)、烧杯(100mL×2)、量筒(10mL)、滴定台、玻棒、洗耳球、滴管。



<
知能梳理
一、硫酸铜结晶水含量的测定
①计算
能引起误差的操作
【例1】根据测定硫酸铜晶体结晶水含量的实验
C
NaOH溶液的作用是__________ _______,若直接向试样溶液中鼓人空气会导致实验填“偏高”、“偏低”或“无影响”)
)该方案需直接测定的物理量是
】选用滴定法进行测定:
样品,配成100mL溶液,取出20mL,用c mol/L的标准HCl溶液滴定,消耗体积为
则该试样中碳酸氢钠质量分数的计算式为:
】选用气体体积法进行测定:可用右图中的装置进行实验。
)为了减小实验误差,量气管中加入的液体X为
X
10
在浓
按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_______________。
E处干燥管盛放
国化工专家侯德榜的
____________________:,将样品研细.除去空气中的,假设实验操作均正确,可能的
____________________________________③ 饱和 NaHSO 3
三种离子在水溶液中形成氢氧化物沉
2)溶液A中的所含溶质为___________________________。
3)物质X应选用_________(填字母)
A、氢氧化钠、双氧水C、铁粉D、高锰酸钾
,可能的原因是
本节课我们学习了:。

实验四 小苏打中NaHCO 3含量的测定【实验目的】1 熟悉标定、滴定操作及各仪器的使用。
2 巩固滴定管,移液管,分析天平的规范操作。
3 掌握滴定中提高化学反应速率的方法。
【实验原理】Na 2CO 3+2HCl=2NaCl+CO 2↑+H 2O.用于标定HCl 浓度.C(HCl)=NaHCO 3+HCl=NaCl+ CO 2↑+H 2O.用于滴定NaHCO 3浓度 C(NaHCO 3)=C(HCl)V(HCl)1000V(NaHCO3)⨯ (mol/L)ω(NaHCO 3)=c(NaHCO3)V()M(NaHCO3)100%m()⨯总样品甲基橙在PH>4.4显黄色.PH<3.1显红色.3.1~4.4显橙色.标定HCl 时甲基橙加在Na 2CO 3 溶液中中显黄色.标定至终点时溶液变为橙红. 滴定NaHCO 3甲基橙加在NaHCO 3溶液中显黄色.滴定至终点时溶液变为橙红【实验仪器】电子天平、容量瓶(100mlx2)、移液管(20mlx2)、玻棒、烧杯(100mlx2)、滴管、滴定台、锥形瓶(150mlx6)、酸式滴定管(25mlx2)【实验试剂】分析纯Na 2CO 3、小苏打样品、0.1mol/L HCl 溶液、甲基橙、蒸馏水.【实验步骤】一、对酸式滴定管、容量瓶等仪器进行检漏,并用0.1mol/L HCl 溶液润洗酸式滴定管、用蒸馏水润洗其他仪器;二、标定HCl : 1、 用分析天平准确称取105℃干燥至恒重的分析纯碳酸钠[Mr(NaCO 3):106.00]0.4~0.6g(精确至±0.0001g)溶解并定容到100ml 。
2、 取20ml 洁净的移液管,用少量的NaCO 3溶液润洗2~3次,然后分别移取20.00ml 碳酸钠溶液于3个150ml 锥形瓶中,再分别加入甲基橙指示剂两滴,摇匀。
将酸式滴定管用少量代装的0.1ml/LHCl 溶液润洗2~3次,然后装满代标定的HCl 溶液,排除尖端气泡,调整并记下滴定管的初读数。

碳酸钠中碳酸氢钠测定碳酸氢钠(NaHCO3)是一种常见的化学物质,广泛应用于食品加工、制药、清洁剂等领域。
在化学实验中,我们经常需要测定样品中碳酸氢钠的含量,以确保实验的准确性和结果的可靠性。
下面将介绍一种常用的方法——碳酸氢钠滴定法。
碳酸氢钠滴定法是一种定量分析的方法,通过滴定溶液中的酸与样品中的碳酸氢钠反应,从而确定样品中碳酸氢钠的含量。
这种方法的原理是碳酸氢钠与酸反应产生二氧化碳气体,通过测定溶液中二氧化碳的量,间接确定样品中碳酸氢钠的含量。
我们需要准备一定浓度的酸溶液,常用的酸有盐酸(HCl)和硫酸(H2SO4)。
然后,将待测样品溶解于适量的水中,使其完全溶解。
接下来,将溶液转移至滴定瓶中,并加入适量的指示剂,常用的指示剂有酚酞和甲基橙。
指示剂的作用是在反应过程中改变溶液的颜色,以指示滴定的终点。
开始滴定前,我们需要将滴定瓶放在白色背景下,以便观察颜色的变化。
然后,通过滴加酸溶液的方式,将酸溶液滴加到样品溶液中。
初始时,溶液的颜色会发生变化,但随着酸的滴加,颜色会逐渐恢复原状。
当溶液的颜色完全恢复原状,即出现了终点,此时滴定结束。
为了准确测定样品中碳酸氢钠的含量,我们需要记录滴定前后酸溶液的体积差值。
根据滴定前后酸溶液的体积差值,可以计算出样品中碳酸氢钠的含量。
计算方法如下:假设酸溶液的浓度为C (mol/L),滴定前酸溶液的体积为V1(mL),滴定后酸溶液的体积为V2(mL),样品中碳酸氢钠的摩尔浓度为n(mol/L),则有以下关系式:C × V1 = n × V2。
需要注意的是,在进行滴定实验时,应严格控制滴定的速度和酸溶液的浓度,以确保实验的准确性。
同时,在滴定过程中,应避免气泡的产生,以免影响滴定终点的判断。
另外,为了提高实验的准确性,可以进行多次滴定,取平均值作为最终结果。
碳酸氢钠滴定法是一种常用且可靠的测定方法,其原理简单易懂,操作方便。
通过该方法,我们可以准确测定样品中碳酸氢钠的含量,为后续实验和生产提供可靠的数据支持。

碳酸氢钠含量测定方法嘿,咱今儿就来唠唠碳酸氢钠含量测定方法这档子事儿!你说这碳酸氢钠啊,那可是在好多地方都有它的身影呢。
要测定它的含量,有一种常见的方法就是酸碱滴定法。
这就好比一场精彩的“化学反应大战”!咱先准备好各种家伙什儿,比如标准的酸溶液、指示剂啥的。
然后呢,把含有碳酸氢钠的样品放进去,就像将军指挥士兵一样,让它们在那里发生反应。
你想想看啊,这酸和碳酸氢钠碰到一块儿,那反应可热闹了,就跟过年放鞭炮似的。
通过观察指示剂颜色的变化,咱就能知道反应进行到啥程度啦。
这多有意思啊!就像你在黑暗中突然看到了一盏明灯,一下子就找到方向了。
还有一种方法是重量法呢。
这就好像是给碳酸氢钠来个“称体重”的大行动。
咱把样品经过一系列处理后,最后称出剩下的东西的重量,通过计算就能得出碳酸氢钠的含量啦。
这是不是很神奇?就好比你要知道一袋子糖果里有多少颗某种口味的糖,你把其他的挑出来,称一下剩下的,不就心里有数了嘛!那有人可能会问啦,这方法准不准呀?嘿,那当然得准啦!不然咱费这劲干啥呢?这就跟你走路一样,得一步一个脚印,走得稳稳当当的,才能到达目的地呀。
要是随随便便搞一下,那不是瞎耽误工夫嘛!在实际操作中可得细心点儿哦,就跟绣花似的,不能马马虎虎。
要是一个不小心弄错了啥,那得出的结果不就不靠谱啦?那可不行!咱得对自己的实验负责,对得出的结果负责呀。
而且呀,不同的样品可能需要稍微调整一下方法呢。
这就跟每个人的口味不一样,做菜的时候得根据实际情况加点盐或者醋啥的。
咱可不能生搬硬套,得灵活点儿,根据具体情况来操作。
总之呢,测定碳酸氢钠含量的方法有好几种,各有各的特点和用处。
咱得根据实际情况选择合适的方法,认真仔细地去做,这样才能得到准确可靠的结果呀。
你说是不是这个理儿?所以呀,可别小瞧了这小小的碳酸氢钠含量测定,这里面的学问大着呢!咱可得好好研究研究,让它为咱的生活和工作服务呀!。

2%的碳酸氢钠使用说明
【原创实用版】
目录
1.碳酸氢钠的简介和用途
2.2% 碳酸氢钠的特性
3.使用 2% 碳酸氢钠的注意事项
4.2% 碳酸氢钠在实际应用中的例子
正文
【碳酸氢钠的简介和用途】
碳酸氢钠,也被称为小苏打,是一种常见的化学物质。
它广泛应用于食品工业,例如烘焙和制作糕点,同时也可以用于清洁和去污。
【2% 碳酸氢钠的特性】
2% 碳酸氢钠,指的是碳酸氢钠溶液中碳酸氢钠的含量为 2%。
它是一种弱碱性物质,可以中和酸性物质,具有良好的去污和清洁效果。
【使用 2% 碳酸氢钠的注意事项】
在使用 2% 碳酸氢钠时,有一些需要注意的事项。
首先,应该避免直接接触皮肤和眼睛,如果不慎接触,应立即用大量清水冲洗。
其次,使用时应佩戴手套,以防止对皮肤的刺激。
最后,使用后的工具和器皿应彻底清洗,避免残留。
【2% 碳酸氢钠在实际应用中的例子】
2% 碳酸氢钠在实际生活中的应用非常广泛。
例如,它可以用于清洁厨房的油污,可以去除衣物的污渍,还可以用于清洁牙齿。
此外,它还可以用于调节土壤的酸碱度,提高植物的生长效果。
第1页共1页。
小苏打中NaHCO3含量的测定【实验目的】1.掌握酸碱滴定分析的基本原理及实验操作步骤;2.?掌握正确的滴定操作、滴定终点的判断方法;3.学会HCl标准溶液及碱性物质NaHCO3的含量测定。
【实验原理】由于盐酸易挥发,不能用直接发配制标准溶液,先配制近似浓度的溶液,再用一级标准物质Na2CO3进行标定。
当盐酸滴定一级标准物质Na2CO3到达反应终点时,用消耗的HCl的量及Na2CO3的质量可计算出HCl的标准浓度。
?⁄(HCl)=n (Na2CO3)Na2CO3+2HCl=2NaCl+H2O+CO2↑? 12n(mol/L)C(HCl)=2m(Na2CO3)∗1000M(Na2CO3)∗V(HCl)小苏打样品中NaHCO3的含量的测定:由标定得到的HCl溶液浓度,小苏打样品的质量及反应终点时消耗的HCl的体积求得小苏打样品中NaHCO3的含量:?NaHCO3+HCl=NaCl+H2O+CO2↑?(mol/L)C(NaHCO3)=C(HCl)v(HCl)∗1000v(NaHCO3)W(NaHCO3)=C(HCl)∗V(HCl)∗Mr(NaHCO3)/1000⁄C(小苏打)∗20.00100.00甲基橙在PH>4.4时呈黄色,PH<3.1时呈红色,PH在3.1-4.4之间呈橙色.标定HCl时甲基橙加在NaHCO3中呈黄色,标定至终点时变为橙红,滴定NaHCO3时甲基橙加在NaHCO3溶液中呈黄色,滴定至终点时呈橙红。
【试剂与仪器】?仪器:电子分析天平、酸碱两用式滴定管(25ml)、、烧杯(100ml*2)、锥形瓶(150ml*6)、容量瓶(100ml*2)、移液管(20ml*2)、洗耳球、洗瓶、玻璃棒、胶头滴管。
?试剂:0.1mol/L的HCl溶液,蒸馏水,甲基橙指示剂,一级标准物质Na2CO3,待分析的小苏打样品。
?【实验步骤】一.对酸碱两用式滴定管、容量瓶等仪器进行检漏,并用0.1mol/LHCl溶液润洗滴定管,用蒸馏水润洗其他仪器。
小苏打中N a H C O含量的测定集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)小苏打中NaHCO3含量的测定【实验目的】1.掌握酸碱滴定分析的基本原理及实验操作步骤;2.掌握正确的滴定操作、滴定终点的判断方法;3.学会HCl 标准溶液及碱性物质NaHCO3的含量测定。
【实验原理】由于盐酸易挥发,不能用直接发配制标准溶液,先配制近似浓度的溶液,再用一级标准物质Na 2CO 3进行标定。
当盐酸滴定一级标准物质Na 2CO 3到达反应终点时,用消耗的HCl 的量及Na 2CO 3的质量可计算出HCl的标准浓度。
Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ 12n ⁄(HCl)=n (Na 2CO 3)C(HCl)=2m (Na2CO3)∗1000M (Na2CO3)∗V (HCl ) (mol/L)小苏打样品中NaHCO3的含量的测定:由标定得到的HCl 溶液浓度,小苏打样品的质量及反应终点时消耗的HCl 的体积求得小苏打样品中NaHCO3的含量:NaHCO 3+HCl=NaCl+H 2O+CO 2↑C(NaHCO 3)=C (CCC )C (CCC )∗CCCC C(NaHCO3) (mol/L ) W(NaHCO 3)=C (CCC )∗C (CCC )∗CC (NaHCO3)/CCCC C (小苏打)∗CC .CC CCC .CC ⁄甲基橙在PH>4.4时呈黄色,PH<3.1时呈红色,PH在3.1-4.4之间呈橙色.标定HCl时甲基橙加在NaHCO3中呈黄色,标定至终点时变为橙红,滴定NaHCO3时甲基橙加在NaHCO3溶液中呈黄色,滴定至终点时呈橙红。
【试剂与仪器】仪器:电子分析天平、酸碱两用式滴定管(25ml)、、烧杯(100ml*2)、锥形瓶(150ml*6)、容量瓶(100ml*2)、移液管(20ml*2)、洗耳球、洗瓶、玻璃棒、胶头滴管。
实验二 小苏打中CO N aH 3含量的测定 【实验原理】1.HCl 标准溶液的标定:当盐酸滴定一级标准物质Na2CO3,到达反应终点时,用消耗 HCl 的量及一级标准物质Na2CO3的质量可计算出HCl 的标准浓度。
Na2CO3+2HCl=2NaCl+H2O+CO2↑1/2n(HCl)=n(Na2CO3) C(HCl)= 23232m(Na CO )10005(a )(l)M N CO V HC ⨯ (mol/l ) 2.小苏打样品中NaHCO3的含量的测定:由标定得到的HCl 溶液浓度,小苏打样品的质量及反应终点时消耗的HCl 的体积求得小苏打样品中NaHCO3的含量:NaHCO3+HCl=NaCl+H2O+CO2↑3.甲基橙在PH>4.4显黄色.PH<3.1显红色.3.1~4.4显橙色.标定HCl 时甲基橙加在Na2CO3 溶液中中显黄色.标定至终点时溶液变为橙红. 滴定NaHCO3甲基橙加在NaHCO3溶液中显黄色.滴定至终点时溶液变为橙红【试剂与仪器】仪器:电子天平、酸式滴定管(25ml )、烧杯(100ml ,250ml )、锥形瓶(250ml*6)、容量瓶(100ml*2)、移液管(20ml*2)、洗耳球、洗瓶、玻璃棒、胶头滴管。
试剂:,0.1mol/L 的HCl 溶液,蒸馏水,甲基橙指示剂,一级标准物质Na2CO3,待分析的小苏打样品。
【实验步骤】①用电子天平精确称量无水Na2CO3粉末0.48~0.55g (精确至±0.0001g ),置于100ml 烧杯中,加20~30ml 蒸馏水溶解,然后将溶液移至100ml 容量瓶中,按容量瓶的标准操作方法,加蒸馏水到刻度处,摇匀。
②取20ml 洁净的移液管,用少量配好的Na2CO3 溶液润洗2-3次后,吸取Na2CO3 溶液20.00ml 放入250ml 锥形瓶中,加两滴甲基橙,这时溶液呈黄色。
③用待标定HCl 溶液滴定Na2CO3 :1)用待标定HCl 溶液润洗滴定管3次,装满HCl 溶液至“0”刻度以上,查有无气泡并排除,后放出多余液体,调整凹液面至0.00刻度或其以下的整数位,记下初始读数(准确至0.01毫升)2)将装有Na2CO3 溶液的锥形瓶移至滴定管下,缓慢滴下HCl 溶液,同时轻轻摇动锥形瓶,直到溶液变为浅黄色(临近终点),要再放慢滴定速度,直到溶液颜色刚刚变成橙色或微红,记录此时的读数,并重复滴定操作2次,(测定结果的相对偏差应该小于0.2%)。
食盐中碳酸钠碳酸氢钠含量测定实验报告碳酸氢钠和碳酸钠溶解度在相同温度下,碳酸钠比碳酸氢钠溶解度大。
碳酸氢钠是可溶的碳酸盐,其酸式盐比正盐的低,主要是因为碳酸氢根水合后与周围的碳酸氢根形成双聚或多聚离子,形成了分子内的氢键,导致溶解度下降。
碳酸氢钠俗称“小苏打”、“苏打粉”、“重曹”,白色细小晶体,是一种工业用化学品,可能存在毒性。
固体50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解。
碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性。