碳酸钠和碳酸氢钠的性质 实验报告
- 格式:docx
- 大小:19.66 KB
- 文档页数:1




第1篇一、实验目的1. 探究纯碱(碳酸钠)的化学性质。
2. 了解纯碱在酸碱反应、沉淀反应和气体生成反应中的表现。
3. 熟悉实验操作技能,提高实验观察和分析能力。
二、实验原理纯碱(碳酸钠,Na2CO3)是一种可溶性碱,具有以下性质:1. 与酸反应生成盐、水和二氧化碳气体。
2. 与某些金属离子反应生成沉淀。
3. 与强酸反应时,溶液的pH值会发生变化。
三、实验用品1. 纯碱(Na2CO3)固体2. 稀盐酸(HCl)3. 硫酸铜溶液(CuSO4)4. 氢氧化钠溶液(NaOH)5. 氯化钡溶液(BaCl2)6. 无色酚酞试液7. 试管、烧杯、滴管、玻璃棒、滤纸等四、实验步骤1. 取少量纯碱固体放入试管中,加入少量水溶解,观察溶解情况。
2. 向溶解后的纯碱溶液中滴加几滴酚酞试液,观察溶液颜色变化。
3. 分别向溶解后的纯碱溶液中加入稀盐酸、硫酸铜溶液、氢氧化钠溶液、氯化钡溶液,观察反应现象。
4. 记录实验现象,分析反应原理。
五、实验现象与结论1. 纯碱固体易溶于水,溶解后溶液呈碱性,酚酞试液变红。
2. 向溶解后的纯碱溶液中加入稀盐酸,产生气泡,说明纯碱与酸反应生成二氧化碳气体。
反应方程式:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑3. 向溶解后的纯碱溶液中加入硫酸铜溶液,无明显现象。
4. 向溶解后的纯碱溶液中加入氢氧化钠溶液,无明显现象。
5. 向溶解后的纯碱溶液中加入氯化钡溶液,产生白色沉淀,说明纯碱与钡离子反应生成碳酸钡沉淀。
反应方程式:Na2CO3 + BaCl2 → 2NaCl + BaCO3↓六、实验讨论与分析1. 实验结果表明,纯碱与酸反应时会产生二氧化碳气体,这是纯碱的典型性质之一。
2. 纯碱与硫酸铜溶液、氢氧化钠溶液、氯化钡溶液反应时,没有明显的现象,说明纯碱与这些物质在常温下不发生反应。
3. 实验过程中,观察到酚酞试液在纯碱溶液中变红,说明纯碱溶液呈碱性。
七、实验总结通过本次实验,我们了解了纯碱的化学性质,包括与酸反应、沉淀反应和气体生成反应。

碳酸钠和碳酸氢钠的性质实验报告实验报告:碳酸钠和碳酸氢钠的性质一、实验目的:1.了解碳酸钠和碳酸氢钠的化学性质;2.学习通过实验方法鉴别碳酸钠和碳酸氢钠。
二、实验原理:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为碱性物质,广泛应用于化学实验和工业生产中。
碳酸钠是白色结晶粉末,易溶于水,在潮湿空气中吸湿;碳酸氢钠也为白色结晶粉末,溶于水,但不易溶于醇类。
本实验通过一系列的实验操作和分析,来鉴别这两种碱性物质。
三、实验步骤:1.鉴别外观:将碳酸钠和碳酸氢钠分别放在两个干燥的试管中,观察外观。
发现两种物质外观相似,都为白色结晶粉末。
2.鉴别溶解性:取两个试管分别加入少量蒸馏水,并用玻璃棒搅拌溶解。
发现碳酸钠完全溶解,而碳酸氢钠溶解度较差,部分悬浮在水中。
3.鉴别酸碱性:将两个试管中分别加入几滴酚酞指示剂。
观察到碳酸钠试管中液体变为橙红色,而碳酸氢钠试管中液体仍为无色。
4.鉴别热分解性:将碳酸钠和碳酸氢钠分别放在干燥的坩埚中,放入烧杯中,使用酒精灯进行加热。
观察到碳酸钠在加热过程中失去结晶水,呈现白色粉末,同时有气泡的产生;碳酸氢钠在加热过程中,产生有臭酸(二氧化碳)气体,同时有气泡的产生。
5.鉴别与酸反应性:将两种试剂单独放入两个试管中,分别加入稀盐酸。
观察到碳酸钠试管中有大量气泡产生,呈现剧烈的反应,而碳酸氢钠试管中气泡较少。
反应后,将两个试管中产生的气体分别用湿润的蓝色红石蕊试纸接触,观察到碳酸钠试管中红石蕊试纸变蓝,而碳酸氢钠试管中无明显变化。
四、实验结果和结论:通过一系列的实验操作和观察,我们得到以下结论:1.碳酸钠和碳酸氢钠在外观上相似,都为白色结晶粉末;2.碳酸钠在水中完全溶解,而碳酸氢钠溶解度较差;3.碳酸钠为碱性物质,碳酸氢钠为中性物质;4.碳酸钠和碳酸氢钠在加热过程中有不同的反应:碳酸钠失水变为白色粉末,碳酸氢钠分解产生臭酸气体;5.碳酸钠与稀盐酸有剧烈的反应,产生大量气泡,而碳酸氢钠反应较为缓慢。

碳酸钠与碳酸氢钠的性质实验实验原理:碳酸钠、碳酸氢钠分别与强酸或强碱的反应;碳酸钠、碳酸氢钠溶液的弱碱性;碳酸氢钠的不稳定性。
实验(1):碳酸钠、碳酸氢钠分别与盐酸反应实验操作:各取少量碳酸钠、碳酸氢钠固体于两试管中,分别滴入盐酸,观察实验现象。
各取饱和碳酸钠溶液、碳酸氢钠溶液5mL放入两根试管中,分别向其中逐滴慢慢地加入0.05mol/L的稀盐酸溶液,观察反应现象。
实验现象及结论:碳酸钠、碳酸氢钠固体加入盐酸均产生无色气体,碳酸氢钠遇到盐酸放出气体比碳酸钠剧烈得多。
饱和碳酸钠溶液、碳酸氢钠溶液逐滴滴入盐酸,碳酸氢钠溶液就有气体生成,饱和碳酸钠溶液先无现象后生成气体。
说明碳酸钠、碳酸氢钠都能与盐酸等酸反应产生CO2气体。
碳酸氢钠与盐酸反应放出CO2比碳酸钠与盐酸反应放出快,是因为加入盐酸后,HCO3-直接与H+结合生成不稳定的H2CO3分解生成CO2。
而碳酸钠溶液中存在大量CO32-,加入盐酸后,CO32-先与H+结合生成HCO3-,再与H+结合才能生成H2CO3,所以放出CO2速度慢。
Na2CO3+2HCl==2NaCl+CO2↑+H2O;NaHCO3+HCl==NaCl+CO2↑+H2O;Na2CO3+HCl==NaHCO3+NaCl;NaHCO3+HCl==NaCl+CO2↑+H2O实验(2):碳酸钠、碳酸氢钠溶液分别与澄清石灰水反应实验操作:在两支试管中分别加入2-3mL澄清石灰水,分别向其中加入少量的碳酸钠溶液、碳酸氢钠溶液,观察实验现象。
实验现象及结论:两支试管中均有白色沉淀生成。
说明碳酸钠、碳酸氢钠都能与氢氧化钙等碱反应。
Na2CO3+Ca(OH)2==2NaOH+CaCO3↓;NaHCO3+Ca(OH)2==NaOH+CaCO3↓+H2O实验(3):碳酸钠、碳酸氢钠溶液分别测pH实验操作:分别测量0.1mol/L的碳酸钠溶液、碳酸氢钠溶液的pH,比较其大小。
实验现象及结论:碳酸钠溶液、碳酸氢钠溶液的pH均大于7,且碳酸钠溶液的pH大于碳酸氢钠溶液的pH。
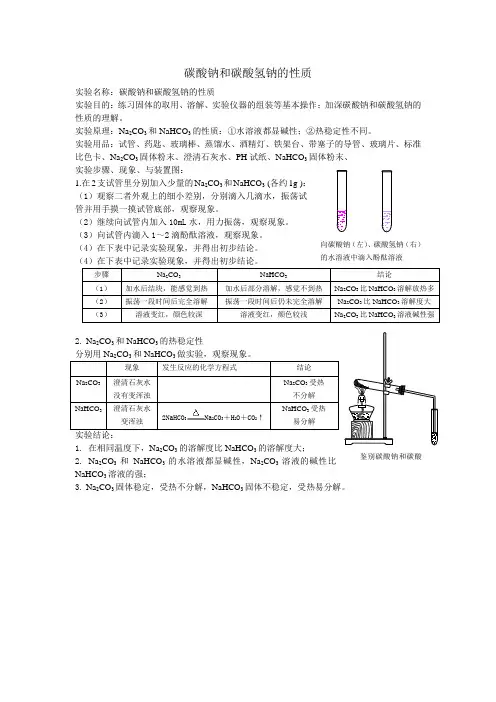
碳酸钠和碳酸氢钠的性质实验名称:碳酸钠和碳酸氢钠的性质实验目的:练习固体的取用、溶解、实验仪器的组装等基本操作;加深碳酸钠和碳酸氢钠的 性质的理解。
实验原理:Na 2CO 3和NaHCO 3的性质:①水溶液都显碱性;②热稳定性不同。
实验用品:试管、药匙、玻璃棒、蒸馏水、酒精灯、铁架台、带塞子的导管、玻璃片、标准比色卡、Na 2CO 3固体粉末、澄清石灰水、PH 试纸、NaHCO 3固体粉末、 实验步骤、现象、与装置图:1.在2支试管里分别加入少量的Na 2CO 3和NaHCO 3 (各约1g ): (1)观察二者外观上的细小差别,分别滴入几滴水,振荡试管并用手摸一摸试管底部,观察现象。
(2)继续向试管内加入10mL 水,用力振荡,观察现象。
(3)向试管内滴入1~2滴酚酞溶液,观察现象。
(4)在下表中记录实验现象,并得出初步结论。
(4)在下表中记录实验现象,并得出初步结论。
步骤 Na 2CO 3NaHCO 3结论(1) 加水后结块,能感觉到热 加水后部分溶解,感觉不到热 Na 2CO 3比NaHCO 3溶解放热多 (2) 振荡一段时间后完全溶解 振荡一段时间后仍未完全溶解Na 2CO 3比NaHCO 3溶解度大 (3)溶液变红,颜色较深溶液变红,颜色较浅Na 2CO 3比NaHCO 3溶液碱性强2. Na 2CO 3和NaHCO 3的热稳定性现象 发生反应的化学方程式结论 Na 2CO 3澄清石灰水没有变浑浊Na 2CO 3受热 不分解 NaHCO 3 澄清石灰水变浑浊2NaHCO 3Na 2CO 3+H 2O +CO 2↑NaHCO 3受热 易分解实验结论:1. 在相同温度下,Na 2CO 3的溶解度比NaHCO 3的溶解度大;2. Na 2CO 3和NaHCO 3的水溶液都显碱性,Na 2CO 3溶液的碱性比NaHCO 3溶液的强;3. Na 2CO 3固体稳定,受热不分解,NaHCO 3固体不稳定,受热易分解。

碳酸钠碳酸氢钠的性质碳酸钠和碳酸氢钠是常见的碳酸盐化合物,具有多种性质和用途。
下面将分别介绍它们的性质。
一、碳酸钠碳酸钠(Na2CO3),也称为纯碱,是一种白色晶体粉末,易溶于水,具有碱性。
它的性质如下:1.物理性质(1)外观:白色晶体粉末。
(2)相对分子质量:105.98。
(3)熔点:851℃。
(4)沸点:3336℃。
(5)密度:2.54g/cm³。
(6)易溶于水。
2.化学性质(1)碱性:碳酸钠溶解于水后呈碱性。
Na2CO3+H2O→2Na+ +CO32-+H2O(2)酸碱反应:碳酸钠可以与酸反应生成盐和水,并放出二氧化碳气体。
Na2CO3+2HCl→2NaCl+CO2+H2O(3)还原性:碳酸钠可以与还原剂如锌、铁、铝反应,放出二氧化碳气体。
(4)腐蚀性:碳酸钠具有腐蚀性,能腐蚀铁、铜等金属。
(5)加热分解:碳酸钠加热到高温时,会分解生成氧化钠和二氧化碳。
Na2CO3→Na2O+CO23.用途(1)制造玻璃:碳酸钠是制造玻璃的重要原料,可以使玻璃变得透明。
(2)制造洗涤剂:碳酸钠具有去污、除垢、杀菌等作用,被广泛用作洗涤剂原料。
(3)制造化肥:碳酸钠可以与硝酸反应生成硝酸钠,是制造化肥的原料之一。
(4)水处理:碳酸钠可以调节水中的硬度和pH值,被广泛用于水处理领域。
二、碳酸氢钠碳酸氢钠(NaHCO3),也称为小苏打,是一种白色粉末,可以溶于水,呈碱性。
它的性质如下:1.物理性质(1)外观:白色粉末。
(2)相对分子质量:84.01。
(3)熔点:50℃。
(4)沸点:3336℃。
(5)密度:2.16g/cm³。
2.化学性质(1)碱性:碳酸氢钠可以溶于水,呈碱性。
Na HCO3+H2O→Na+ +HCO3-+H2O(2)酸碱反应:碳酸氢钠可以与酸反应生成盐和水,并放出二氧化碳气体。
NaHCO3+HCl→NaCl+H2O+CO2↑(3)高温分解:碳酸氢钠受热会分解生成二氧化碳、水和氢氧化钠。


碳酸钠和碳酸氢钠的性质_实验报告实验目的:1.了解碳酸钠和碳酸氢钠的性质;2.观察不同条件下的实验现象;3.比较碳酸钠和碳酸氢钠的性质区别。
实验原理:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都是常见的无机化合物,它们在水溶液中有着不同的性质。
碳酸钠是一种强碱,能与酸反应产生盐和水,而碳酸氢钠是一种弱碱,只能在强酸存在时才能起到缓冲作用。
实验通过溶液的法则、气体的性质等来观察碳酸钠和碳酸氢钠的性质。
实验步骤:1.将30g的碳酸钠和碳酸氢钠分别放入两个不同的试管中;2.向两个试管中加入等体积的蒸馏水,摇匀使其溶解;3.分别取一部分溶液进行观察:观察碳酸钠和碳酸氢钠溶液的颜色、味道、透明度以及气体的释放情况;4.在另外两个试管中加入盐酸溶液,观察并记录反应现象;5.在最后两个试管中加入醋酸溶液,观察并记录反应现象。
实验结果:1.碳酸钠溶液呈无色透明,无味,有气泡产生;2.碳酸氢钠溶液呈无色透明,有若干气泡产生,有轻微的碱味;3.酸与碳酸钠反应:(1)盐酸与碳酸钠反应,产生气泡并放热,观察到溶液变混浊,产生白色沉淀;(2)醋酸与碳酸钠反应,产生气泡,无明显的溶液变化;4.酸与碳酸氢钠反应:(1)盐酸与碳酸氢钠反应,产生气泡,有少量白色沉淀产生;(2)醋酸与碳酸氢钠反应,产生气泡,无明显的溶液变化。
讨论与分析:通过实验,可以发现碳酸氢钠和碳酸钠溶液的性质有一定的差异。
碳酸氢钠溶液在溶解过程中会产生气体,这是由于它在水中的扩散能力较强,释放出二氧化碳气体。
而碳酸钠溶液也会产生气泡,但没有明显的碳酸氢钠溶液那样明显。
这是由于碳酸钠分解成碳酸根离子和钠离子,碳酸根离子与水发生轻微的水解反应产生氢氧根离子。
因此,溶液中的氢氧根离子会影响碳酸钠溶液的酸碱性,使得其呈现出缓冲作用的特性。
同时,实验中我们还发现,酸与碳酸钠反应会产生气泡,并有白色沉淀析出。
这是由于盐酸和醋酸都具有酸性,与碳酸钠反应生成二氧化碳气体和相应的盐。
碳酸钠和碳酸氢钠的溶解度曲线全文共四篇示例,供读者参考第一篇示例:碳酸钠和碳酸氢钠是常见的碱性盐类化合物,在实验室和工业生产中有着广泛的应用。
它们的溶解度与温度之间存在一定的关系,通过实验可以获得溶解度曲线,了解它们在不同温度下的溶解度变化规律。
本文将介绍碳酸钠和碳酸氢钠的基本性质、溶解度曲线的制作方法以及实验结果分析。
一、碳酸钠和碳酸氢钠的基本性质碳酸钠(Na2CO3)是一种无机化合物,常见的形式为无水和十水合物。
它在空气中易吸收水分产生碱性溶液,是一种重要的化工原料,广泛用于玻璃、纺织、造纸等行业。
碳酸氢钠(NaHCO3)又称小苏打,是一种含有碳酸根离子和氢碱根离子的化合物,常用作食品添加剂、中和剂等。
碳酸钠和碳酸氢钠在水中溶解时,会发生离子的溶解反应,生成碳酸根离子和氢碱根离子。
其溶解度受温度的影响较大,随着温度的升高,溶解度通常会增大。
为了研究它们在不同温度下的溶解度变化规律,我们可以进行实验制作溶解度曲线。
二、溶解度曲线的制作方法制作碳酸钠和碳酸氢钠的溶解度曲线需要以下实验仪器和药品:碳酸钠、碳酸氢钠、蒸馏水、热水浴、恒温槽、PH计等。
具体步骤如下:1. 分别称取适量的碳酸钠和碳酸氢钠样品,将其分别置于烧杯中。
2. 向每个烧杯中加入一定量的蒸馏水,搅拌均匀使固体完全溶解。
3. 将制备好的溶液置于恒温槽中,并分别设定不同的温度,如20℃、30℃、40℃、50℃等。
4. 使用PH计测量每个温度下溶液的PH值,记录下实验数据。
5. 根据PH值的变化,计算出每个温度下碳酸钠和碳酸氢钠的溶解度。
6. 绘制溶解度曲线图,表示碳酸钠和碳酸氢钠在不同温度下的溶解度变化规律。
三、实验结果分析碳酸钠和碳酸氢钠的溶解度曲线是一个重要的研究课题,通过实验证明了温度对其溶解度的影响规律。
通过继续深入研究,可以更好地理解碳酸盐的溶解行为,为相关领域的科研工作提供有益的参考和指导。
希望本文对您对碳酸钠和碳酸氢钠的溶解度曲线有所帮助。
《碳酸钠和碳酸氢钠的性质》教学设计一、教材分析《几种重要的金属化合物》是新教材中有关金属及其化合物性质的重要的学习内容之一。
金属在自然界基本以化合态形式存在,因此第一节介绍金属单质的性质后,第二节重点讲述了钠、铝、铁的化合物性质。
在这一节内容里,新教材安排了精彩的图片和丰富的实验探究。
旨在强调学生的主体学习能力,倡导学生主动参与,乐于探究,培养学生探究、分析和解决问题的能力、以及交流与合作的能力,对提高学生全面的科学素养具有十分重要的作用。
《碳酸钠与碳酸氢钠的性质》本节内容在呈现方式上有以下特点:图画较多,有利于引起学生的学习兴趣,对所学知识留下深刻的印象;活动较多,有利于培养学生的各种能力。
在介绍碳酸钠和碳酸氢钠时,采用科学探究的形式,突岀实验引探功能;利用对比的方法,让学生填写表格,可使学生在比较中学习。
教学重点是碳酸钠和碳酸氢钠的性质,难点是如何引导学生正确观察实验现象,并分析这些现象的本质,对碳酸钠和碳酸氢钠的性质作岀正确的判断。
、教案【PPT l 总结对比NQCQ和NaHCa的对比1. Na 2CQ2.NaHCQ在水中溶解性Na 2CQ> NaHCQ与盐酸反应1. CQ 32-+2H+=H2Q+CQ↑2. HCQ 3-+H=H2Q+CQ↑热稳定性NaHCQ 3 > Na2CQ2NaHC3=NaCG+H2Q+Cζ↑用途1.制玻璃、肥皂、造纸、纺织等2. 焙制糕点的发酵粉,治疗胃酸过多鉴别方法加热、酚酞、溶解、与盐酸反应作业:1.如何鉴别Na+离子的存在?2.完成Na→ NQQ→NQCQ→ NaHCQ勺化学反应方程式。
学生上台书写方程式:NaCQ+2HCI=NaHCGHeI=讨论总结后,个别回答学生分组讨论使知识系统化、条理化[板书设计]第二节几种重要的金属化合物碳酸钠和碳酸氢钠的实验探究探究实验1 :溶解性、碱性。
探究实验2:热稳定性。
探究实验3 :与稀盐酸的反应。
总结:Na t CO与NaHCO专化及鉴别。
碳酸钠和碳酸氢钠的性质
实验名称:碳酸钠和碳酸氢钠的性质
实验目的:练习固体的取用、溶解、实验仪器的组装等基本操作;加深碳酸钠和碳酸氢钠的 性质的理解。
实验原理:Na 2CO 3和NaHCO 3的性质:①水溶液都显碱性;②热稳定性不同。
实验用品:试管、药匙、玻璃棒、蒸馏水、酒精灯、铁架台、带塞子的导管、玻璃片、标准比色卡、Na 2CO 3固体粉末、澄清石灰水、PH 试纸、NaHCO 3固体粉末、 实验步骤、现象、与装置图:
1.在2支试管里分别加入少量的Na 2CO 3和NaHCO 3 (各约1g ): (1)观察二者外观上的细小差别,分别滴入几滴水,振荡试管并用手摸一摸试管底部,观察现象。
(2)继续向试管内加入10mL 水,用力振荡,观察现象。
(3)向试管内滴入1~2滴酚酞溶液,观察现象。
(4)在下表中记录实验现象,并得出初步结论。
(4)在下表中记录实验现象,并得出初步结论。
步骤 Na 2CO 3
NaHCO 3
结论
(1) 加水后结块,能感觉到热 加水后部分溶解,感觉不到热 Na 2CO 3比NaHCO 3溶解放热多 (2) 振荡一段时间后完全溶解 振荡一段时间后仍未完全溶解
Na 2CO 3比NaHCO 3溶解度大 (3)
溶液变红,颜色较深
溶液变红,颜色较浅
Na 2CO 3比NaHCO 3溶液碱性强
2. Na 2CO 3和NaHCO 3的热稳定性
现象 发生反应的化学方程式
结论 Na 2CO 3
澄清石灰水没有变浑浊
Na 2CO 3受热 不分解 NaHCO 3 澄清石灰水
变浑浊
2NaHCO 3
Na 2CO 3+H 2O +CO 2↑
NaHCO 3受热 易分解
实验结论:
1. 在相同温度下,Na 2CO 3的溶解度比NaHCO 3的溶解度大;
2. Na 2CO 3和NaHCO 3的水溶液都显碱性,Na 2CO 3溶液的碱性比NaHCO 3溶液的强;
3. Na 2CO 3固体稳定,受热不分解,NaHCO 3固体不稳定,受热易分解。
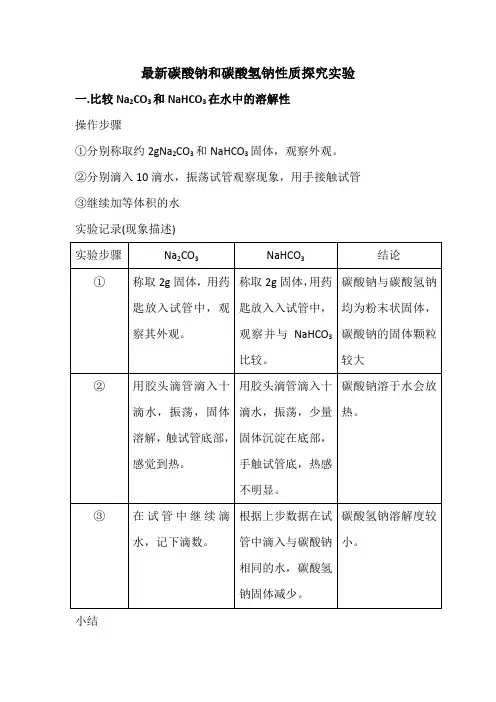
向碳酸钠(左)、碳酸氢钠(右)
的水溶液中滴入酚酞溶液
鉴别碳酸钠和碳酸。