高中化学复习知识点:碳酸钠与碳酸氢钠鉴别的实验
- 格式:docx
- 大小:315.38 KB
- 文档页数:11

基于“深度学习”视域下——碳酸钠和碳酸氢钠鉴别方法的再探究一、使用教材高中化学人教版必修一第二章第一节《钠及其化合物》教学中,Na2CO3与 NaHCO3鉴别方法中 NaHCO3只考虑固态时分解,不考虑在水溶液中分解;同时认为 CaCl2溶液与 NaHCO3溶液不反应,CaCl2溶液可以作为Na2CO3与 NaHCO3的鉴别试剂。
但客观事实和已有认知则存在一定的冲突。
二、实验器材与试剂微型实验:灭菌水药瓶两支(5ml),阿奇霉素药瓶两支、细铜丝、粗铜丝、塑料 L 型管两个、乳胶头四个、塑料滴管两个、酒精灯、碳酸钠、碳酸氢钠、澄清石灰水数字实验:电脑、数据采集器、二氧化碳传感器、温度传感器、三颈烧瓶、注射器、铁架台、1mol/LNaHCO3溶液、0.5mol/LCaCl2溶液学生实验及演示实验:学生:试管、烧杯、胶头滴管、火柴、酒精灯、试管夹、三脚架、石棉网、酚酞、0.01mol/LNaHCO3、0.01mol/LCaCl2、0.1mol/LNaHCO3教师:1mol/LNaHCO3、1mol/LNa2CO3、1mol/LCaCl2、0.5mol/LCaCl2溶液三、实验设计创新点设计思路:通过已有认知和客观事实产生的认知冲突,设计本节实验探究课,通过实验探究,完成对知识的进阶,学生对教材内容的认识得到了提升,对碳酸钠和碳酸氢钠鉴别方法的认识由浅表学习过渡到深度学习。
实验创新点:对用热分解法鉴别 Na2CO3与 NaHCO3实验改进实验设计:一个装置中同时进行两个实验且互不干扰实验改进要点:1.保证两者同时均匀受热2.保证两边空间相对独立3.操作简单微型实验装置:灭菌水药瓶两支(5ml),阿奇霉素药瓶两支、细铜丝、粗铜丝、塑料 L 型管两个、乳胶头四个、塑料滴管两个、酒精灯微型实验装置优点:1.原料源于生活、易于获得;2.对比性强、可操作性强;3.快速高效四、实验原理教学中,NaHCO3只考虑固态时分解,没有涉及在水溶液中是否分解的知识;而且认为 CaCl2溶液不与 NaHCO3溶液反应,因此 CaCl2溶液可以作为 Na2CO3与NaHCO3的鉴别试剂学生通过实验得知:NaHCO3在水溶液中加热也可以分解;CaCl2溶液与 NaHCO3溶液可以反应;CaCl2与 Na2CO3、NaHCO3溶液反应现象与其浓度和用量有关五、实验教学目标1、探究 NaHCO3在水溶液中受热是否分解的过程,对实验方案交流、点评、完善,诊断并发展了学生的实验探究水平和运用控制变量法设计实验的思维2、通过探究 CaCl2溶液是否可以作为鉴别 Na2CO3与 NaHCO3的试剂,诊断并发展学生由定性走向定量的科学思维3、基于已有的实验结论,结合学生已有的化学认知水平,引导学生勇于质疑,发现问题,并借助手持仪器进行验证,诊断并发展学生对两者鉴别方法的认知进阶六、实验教学内容任务一:对用热分解法鉴别 Na2CO3与 NaHCO3实验改进任务二:探究 NaHCO3在水溶液中受热是否分解任务三:探究 NaHCO3溶液和 CaCl2溶液反应原理任务四:讨论 Na2CO3与 NaHCO3溶液和 CaCl2溶液反应现象七、实验教学过程环节一:课前微课自主探究课前任务一:设计鉴别 Na2CO3与 NaHCO3的实验方案课前任务二:动手验证实验方案的可行性通过课前微课,既能巩固旧知,又可提高课堂效率,为接下来的深度探究做好铺垫。

2024新高考化学一轮复习讲义—碳酸钠和碳酸氢钠、碱金属[复习目标]1.掌握Na 2CO 3、NaHCO 3的基本性质及相互转化。
2.掌握Na 2CO 3、NaHCO 3的鉴别及除杂。
3.了解碱金属的通性与特性及焰色试验。
考点一碳酸钠和碳酸氢钠1.Na 2CO 3和NaHCO 3的比较(方程式用离子方程式表示)名称碳酸钠碳酸氢钠俗名纯碱或苏打小苏打主要性质色、态白色粉末细小的白色晶体水溶性易溶于水(20℃,S =21.5g)可溶于水(20℃,S =9.6g)热稳定性稳定,但结晶碳酸钠(Na 2CO 3·10H 2O)易风化受热易分解与H +反应CO 2-3+2H +===CO 2↑+H 2O(较快)HCO -3+H +===CO 2↑+H 2O(更快)与Ca(OH)2溶液反应Ca 2++CO 2-3===CaCO 3↓Ca(OH)2少量:Ca 2++2OH -+2HCO -3===CaCO 3↓+2H 2O +CO 2-3;Ca(OH)2过量:Ca 2++OH -+HCO -3===CaCO 3↓+H 2O与盐反应Al 2(SO 4)32Al 3++3CO 2-3+3H 2O===2Al(OH)3↓+Al 3++3HCO -3===Al(OH)3↓+3CO 2↑3CO 2↑与水作用水解,碱性较强水解,碱性较弱主要用途用于制玻璃、制肥皂、合成洗涤剂、造纸、纺织、石油、冶金等工业中灭火器、治疗胃酸过多、发酵粉的主要成分之一2.Na 2CO 3和NaHCO 3的相互转化Na 2CO 3①CO 2+H 2O ;②少量盐酸①固体加热;②液体NaOHNaHCO 3应用举例选择适当的试剂或方法除去杂质,并完成转化的化学方程式,“[]”内为杂质。
(1)Na 2CO 3(s)[NaHCO 3]_____________________________________________________,________________________________________________________________________。

鉴别碳酸钠和碳酸氢钠溶液方程式一、背景介绍1. 碳酸钠和碳酸氢钠是常见的化学物质,它们在实验室和工业生产中被广泛应用。
2. 碳酸钠和碳酸氢钠在溶液中的化学性质有所不同,因此需要通过一定的实验方法进行鉴别。
二、实验目的1. 了解碳酸钠和碳酸氢钠在溶液中的化学性质。
2. 掌握鉴别碳酸钠和碳酸氢钠溶液的实验方法。
3. 掌握相关实验方程式。
三、实验方法1. 实验材料:碳酸钠溶液、碳酸氢钠溶液、盐酸溶液、甲基红指示剂、试管、试管架等。
2. 实验步骤:1)分别取两个试管,加入少量碳酸钠溶液和碳酸氢钠溶液。
2)分别加入少量盐酸溶液,观察是否产生气体。
3)将甲基红指示剂滴入溶液中,观察颜色变化。
四、实验结果1. 碳酸钠溶液加入盐酸溶液后产生气体,溶液中的颜色也发生变化。
2. 碳酸氢钠溶液加入盐酸溶液后同样产生气体,但溶液中的颜色变化略有不同。
五、实验方程式1. 碳酸钠与盐酸反应产生的气体:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑2. 碳酸氢钠与盐酸反应产生的气体:NaHCO3 + HCl → NaCl + H2O + CO2↑六、实验分析1. 通过实验可以得知,碳酸钠和碳酸氢钠与盐酸反应时均产生气体,但是碳酸钠反应的气体量较大,而且溶液中的颜色变化较明显。
2. 通过观察溶液中产生气体的量和颜色变化,可以初步判断出溶液中是否含有碳酸钠或碳酸氢钠。
七、实验结论1. 通过实验方程式的分析,可以初步鉴别出溶液中是否含有碳酸钠或碳酸氢钠。
2. 实验结果表明,通过观察气体产生量和溶液颜色的变化可以鉴别碳酸钠和碳酸氢钠溶液。
八、实验意义1. 了解溶液中化学物质的鉴别方法,有利于实验室和工业生产中的化学分析和控制。
2. 掌握鉴别碳酸钠和碳酸氢钠溶液的实验方法及方程式,对于化学实验教学和科研工作具有一定的指导意义。
总结:通过本实验,我们了解了碳酸钠和碳酸氢钠在溶液中的化学性质,并掌握了鉴别它们的实验方法及方程式。

【高中化学】高中化学常识:碳酸钠和碳酸氢钠的鉴别高中化学常识碳酸钠和碳酸氢钠的鉴别方法如下(1)定性试验方法:①.取少量固体盛于固体制氧装置中,加热,将导管伸入装有澄清石灰水的试管中,石灰水变浑浊,说明固体是碳酸氢钠,否则是碳酸钠。
②. 溶解少量固体并加入氯化钙溶液以产生沉淀。
这是碳酸钠溶液,否则是碳酸氢钠溶液。
(2)定量检验法:①. 分别向等量的白色粉末中加入相同体积和浓度的稀盐酸,生成的气体为碳酸氢钠快,碳酸钠慢。
②.分别向等量的白色粉末中加等体积适量的水,固体溶解量的多的碳酸钠,少的是碳酸氢钠。
7.了解Fe3+的氧化性以及Fe3+和Fe2之间的相互转化+(1)物理性质:亚铁盐溶液呈浅绿色,铁盐溶液呈黄色。
(2)化学性质:①亚铁盐的氧化反应(体现还原性)、氯化亚铁溶液与氯反应生成氯化铁:2fecl2+Cl2=2fecl3;2fe2++cl2=2fe+3++2cl-说明:氯化铁溶液中氯化亚铁杂质的除去方法,溶液由浅绿色变成黄色,杂质转化的同时不引入新杂质。
、在盐酸酸化的条件下,通过加氧将氯化亚铁溶液转化为氯化铁溶液4fecl2+4hcl+o2=4fecl3+2h2o;4fe2++4h++o2=4fe3++2h2o注:三氯化铁溶液中三氯化铁杂质的去除方法。
溶液由浅绿色变为黄色。
当杂质被转化时,不会引入新的杂质。
、氯化亚铁溶液在盐酸酸化的条件下加入双氧水转化为氯化铁溶液2fecl2+2hcl+h2o2=2fecl3+2h2o;2fe2++2h++h2o2=2fe3++2h2o注:三氯化铁溶液中三氯化铁杂质的去除方法。
溶液由浅绿色变为黄色。
当杂质被转化时,不会引入新的杂质。
、硝酸亚铁溶液在稀硝酸的氧化下成为硝酸铁溶液3Fe(NO3)2+4hno3(稀释)=3Fe(NO3)3+no↑ + 2H2O;3fe2++4h++no=3fe3++no↑+2h2o说明:溶液由浅绿色变成黄色,fe2+和no在大量h+存在时不能大量共存。
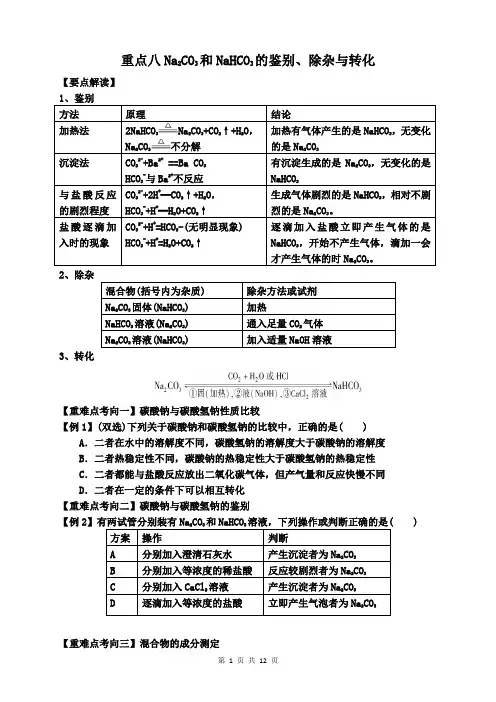
重点八Na2CO3和NaHCO3的鉴别、除杂与转化【要点解读】1、鉴别方法原理结论加热法2NaHCO3Na2CO3+CO2↑+H2O,Na2CO3不分解加热有气体产生的是NaHCO3,无变化的是Na2CO3沉淀法CO32-+Ba2+ ==Ba CO3HCO3-与Ba2+不反应有沉淀生成的是Na2CO3,无变化的是NaHCO3与盐酸反应的剧烈程度CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑生成气体剧烈的是NaHCO3,相对不剧烈的是Na2CO3。
盐酸逐滴加入时的现象CO32-+H+=HCO3-(无明显现象)HCO3-+H+=H2O+CO2↑逐滴加入盐酸立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的时Na2CO3。
2、除杂混合物(括号内为杂质) 除杂方法或试剂Na2CO3固体(NaHCO3) 加热NaHCO3溶液(Na2CO3) 通入足量CO2气体Na2CO3溶液(NaHCO3) 加入适量NaOH溶液3、转化【重难点考向一】碳酸钠与碳酸氢钠性质比较【例1】(双选)下列关于碳酸钠和碳酸氢钠的比较中,正确的是( ) A.二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度B.二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性C.二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同D.二者在一定的条件下可以相互转化【重难点考向二】碳酸钠与碳酸氢钠的鉴别【例2) 方案操作判断A 分别加入澄清石灰水产生沉淀者为Na2CO3B 分别加入等浓度的稀盐酸反应较剧烈者为Na2CO3C 分别加入CaCl2溶液产生沉淀者为Na2CO3D 逐滴加入等浓度的盐酸立即产生气泡者为Na2CO3【重难点考向三】混合物的成分测定【例3】下列测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的实验方案,合理的是①取a g混合物与过量氢氧化钠溶液充分反应,加热、蒸干、灼烧,得b g固体②取a g混合物充分加热,减重bg③取a g混合物与过量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g④取a g混合物与过量BaCl2溶液充分反应,过滤、洗涤、干燥,得b g固体( ) A.①②③ B.②③④ C.②④ D.③④【重难点考向四】性质实验探究【例4】现有Na2CO3和NaHCO3两种白色固体物质:Ⅰ.欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:请回答:①如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是__________(填字母序号);a.稀H2SO4b.NaOH溶液 c.Ca(OH)2溶液②如乙图所示,试管④中装入的固体应该是__________(填化学式);③通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性__________(填“强”或“弱”);Ⅱ.欲鉴别两种固体物质可选用的试剂是_________;Ⅲ.等物质的量浓度的两种物质的溶液与同浓度的盐酸反应,反应速率快的是__________(填化学式)。

细说碳酸氢钠与碳酸钠的鉴别《实验教学与仪器》(长沙)2007年6期34页上,有“用CaCl2溶液区分NaHCO3和Na2CO3溶液”为题的一篇文章。
我的基本观点认为,用CaCl2溶液作为NaHCO3和Na2CO3的区分试剂的方法欠妥。
1.Na2CO3和NaHCO3的一般鉴别方法(1)如果两种试样都是固体——用加热法量多(如有数克或更多)能受热分解,放出的气体能使澄清石灰水变混浊的是NaHCO3,不能受热分解的是Na2CO3.量少,甚至是微量(如米粒、绿豆、芝麻量大小)按图l所示装置,微微加热样品4s~5s,稍稍用力挤压乳胶头,让滴管尖端悬上一滴饱和石灰水,几秒钟之后,又让石灰水滴回吸到滴管内,可形成一段白色浑浊的液柱的是NaHCO3,没有这种现象发生的是Na2CO3.(2)如果两种试样都是溶液试样浓度较大:两个试管各取1mL~2m1.样液,分别加入l~2滴酚酞试液,溶液显粉红色的是NaHCO3,色泽呈深红色的是Na2CO3。
试样浓度较小:两个试管各取1mL~2mL样液,各加入1~2滴酚酞试液,溶液都呈不易分辨的浅红色。
当把两种溶液都加热煮沸,色泽由浅(红)变深(红)的是NaHCO3,没有色泽变化的是Na2CO3. 2NaHCO3=Na2CO3 + H2O+CO2↑2.细说NaHCO3与Na2CO3的鉴别大家知道,比较NaHCO3和Na2CO3的性质,有两个最显著的差别:一是NaHCO3有对热的不稳定性,受热极易分解(在空气中会缓慢分解,65℃以上迅速分解),而Na2CO3则有极高的热稳定性;二是NaHCO3水解仅显极弱的碱性(0.1mol/L NaHCO3溶液的pH=8.31),刚好在酚酞的变色范围(酚酞的变色范围是pH=8.1~10.0),仅显极浅的粉红色,而Na2CO3水解则显较强的碱性(0.1mol/LNa2CO3,溶液的pH=11.63),遇酚酞显鲜艳的红色。
显然,NaHCO3与Na2CO3这种性质上的差别,就成为这两种物质鉴别(区分)的最为可靠的理论支持和方法依据。

高中化学常识:碳酸钠和碳酸氢钠的鉴别在高中化学的学习中,掌握一定的花谢常识是有好处的,相信大家听到碳酸钠和碳酸氢钠都不会陌生,那你们知道碳酸钠和碳酸氢钠应该如何鉴别吗?下面小编整理了高中化学常识:碳酸钠和碳酸氢钠的鉴别方法,希望对同学们的化学学习有帮助。
高中化学常识碳酸钠和碳酸氢钠的鉴别方法如下(1)定性检验法:①.取少量固体盛于固体制氧装置中,加热,将导管伸入装有澄清石灰水的试管中,石灰水变浑浊,说明固体是碳酸氢钠,否则是碳酸钠。
②.取少量固体溶解,加入氯化钙溶液,产生沉淀是碳酸钠溶液,否则是碳酸氢钠溶液。
(2)定量检验法:①.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,生成气体快的是碳酸氢钠,慢的是碳酸钠。
②.分别向等量的白色粉末中加等体积适量的水,固体溶解量的多的碳酸钠,少的是碳酸氢钠。
7.了解Fe3+的氧化性,认识Fe3+和Fe2+之间的相互转化(1)物理性质:亚铁盐溶液呈浅绿色,铁盐溶液呈黄色。
(2)化学性质:①亚铁盐的氧化反应(体现还原性)ⅰ、氯化亚铁溶液与氯气反应生成氯化铁:2FeCl2+Cl2=2FeCl3;2Fe2++Cl2=2Fe+3++2Cl-说明:氯化铁溶液中氯化亚铁杂质的除去方法,溶液由浅绿色变成黄色,杂质转化的同时不引入新杂质。
ⅱ、氯化亚铁溶液在盐酸酸化的条件下通入氧气转化为氯化铁溶液4FeCl2+4HCl+O2=4FeCl3+2H2O;4Fe2++4H++O2=4Fe3++2H2O 说明:氯化铁溶液中氯化亚铁杂质的除去方法,溶液由浅绿色变成黄色,杂质转化的同时不引入新杂质。
ⅲ、氯化亚铁溶液在盐酸酸化的条件下加入双氧水转化为氯化铁溶液2FeCl2+2HCl+H2O2=2FeCl3+2H2O;2Fe2++2H++H2O2=2Fe3++2H2O说明:。

重点八Na2CO3和NaHCO3的鉴别、除杂与转化【要点解读】1、鉴别方法原理结论加热法2NaHCO3Na2CO3+CO2↑+H2O,Na2CO3不分解加热有气体产生的是NaHCO3,无变化的是Na2CO3沉淀法CO32-+Ba2+ ==Ba CO3HCO3-与Ba2+不反应有沉淀生成的是Na2CO3,无变化的是NaHCO3与盐酸反应的剧烈程度CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑生成气体剧烈的是NaHCO3,相对不剧烈的是Na2CO3。
盐酸逐滴加入时的现象CO32-+H+=HCO3-(无明显现象)HCO3-+H+=H2O+CO2↑逐滴加入盐酸立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的时Na2CO3。
2、除杂混合物(括号内为杂质) 除杂方法或试剂Na2CO3固体(NaHCO3) 加热NaHCO3溶液(Na2CO3) 通入足量CO2气体Na2CO3溶液(NaHCO3) 加入适量NaOH溶液3、转化【重难点考向一】碳酸钠与碳酸氢钠性质比较【例1】(双选)下列关于碳酸钠和碳酸氢钠的比较中,正确的是( ) A.二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度B.二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性C.二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同D.二者在一定的条件下可以相互转化【重难点考向二】碳酸钠与碳酸氢钠的鉴别【例2) 方案操作判断A 分别加入澄清石灰水产生沉淀者为Na2CO3B 分别加入等浓度的稀盐酸反应较剧烈者为Na2CO3C 分别加入CaCl2溶液产生沉淀者为Na2CO3D 逐滴加入等浓度的盐酸立即产生气泡者为Na2CO3【重难点考向三】混合物的成分测定【例3】下列测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的实验方案,合理的是①取a g混合物与过量氢氧化钠溶液充分反应,加热、蒸干、灼烧,得b g固体②取a g混合物充分加热,减重bg③取a g混合物与过量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g④取a g混合物与过量BaCl2溶液充分反应,过滤、洗涤、干燥,得b g固体( ) A.①②③ B.②③④ C.②④ D.③④【重难点考向四】性质实验探究【例4】现有Na2CO3和NaHCO3两种白色固体物质:Ⅰ.欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:请回答:①如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是__________(填字母序号);a.稀H2SO4b.NaOH溶液 c.Ca(OH)2溶液②如乙图所示,试管④中装入的固体应该是__________(填化学式);③通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性__________(填“强”或“弱”);Ⅱ.欲鉴别两种固体物质可选用的试剂是_________;Ⅲ.等物质的量浓度的两种物质的溶液与同浓度的盐酸反应,反应速率快的是__________(填化学式)。



鉴别碳酸钠和碳酸氢钠的实验探究在《碳酸钠和碳酸氢钠的应用》的教学中发现,可以设计以下实验方案鉴别Na2CO3和NaHCO3:方案①: 取等质量的两种固体,加水, 明显放热的是Na2CO3;方案②: 取等质量的两种固体,加水, 溶解度大的是Na2CO3;方案③:配成等物质的量浓度的两种溶液,测试其溶液的pH,pH 大的是Na2CO3;方案④:配成等物质的量浓度的两种溶液,滴加酚酞,红色明显深的是Na2CO3;方案⑤: 取固体放入试管中加热,有气体产生的是NaHCO3;方案⑥: 取固体分别加入盐酸,反应剧烈的是NaHCO3;方案⑦:取固体分别配成饱和溶液,滴加盐酸,刚开始无明显现象、继续滴加后产生气泡的是Na2CO3;方案⑧: 取固体分别配成溶液,滴加氯化钙溶液,有白色沉淀生成的是Na2CO3;方案⑨: 取固体分别配成溶液,滴加氯化钡溶液,有白色沉淀生成的是Na2CO3;方案⑩: 取固体分别配成饱和溶液,通入CO2,有白色固体析出的是Na2CO3;依据学生现有的知识,这些方案看上去均可以区别。
但笔者课后根据学生设计的实验,准确进行了一些实验,现将结果汇报如下:(室温:20℃ :水温20.5℃)【实验一】取1.0gNa2CO3固体,加5mL 水,立即振荡,Na2CO3全部溶解,水温升至27℃;取2.0g Na2CO3固体,加5mL 水,Na2CO3全部溶解,水温升至3 3 ℃;取1.0g NaHCO3固体,加5mL 水,立即振荡,静置,剩余固体覆盖试管底部,水温降至18℃;取2.0gNaHCO3固体,加5mL 水,立即振荡,静置,剩余大量固体,水温降至1 8 ℃;建议实验:分别取2.0gNa2CO3固体,加5mL 水,立即振荡,静置,固体全部溶解的是Na2CO3;剩余大量固体的是NaHCO3;固体溶解时能感到明显升温的是Na2CO3,无明显现象的是NaHCO3;【实验二】取Na2CO3、NaHCO3固体配成饱和溶液,分别测试两者溶液的pH,碳酸钠饱和溶液的pH 约为12,碳酸氢钠饱和溶液的pH 约为8。
na2co3与nahco3都是中学化学常见化合物,不管是中考还是高考,都经常出现他们的身影。
在高中化学中,关于它们的知识是学习有关金属及其化合物性质的重要内容之一,是学习常见无机物及其性质的继续。
在苏教版高中化学教材化学1中,这一部分知识被安排在钠的性质及用途之后,不仅使学生感受到化学物质世界的丰富多彩,同时更为学生学习正盐和酸式盐的有关知识提供了基础及重要范例。
一、na2co3与nahco3的常见鉴别方法及其缺点关于na2co3与nahco3的鉴别,主要是根据二者化学性质上的差异来进行,常见的方法有:1.用可溶性钙盐溶液(如cacl2溶液)来鉴别,原理:cacl2 + na2co3 = 2nacl + caco3↓(ca2++co32-=caco3↓)2.用可溶性钡盐溶液(如bacl2溶液)来鉴别,原理:bacl2+na2co3=2nacl+baco3↓(ba2++co32- =baco3↓)方法1与方法2可以说在反应原理上是类似的,都是根据复分解反应能得到沉淀来进行鉴别。
但这两个方法“可能存在”的缺点是:在nahco3溶液中有hco3-h++co32-和hco3-+h2oh2co3+oh-两个电离平衡的存在,碳酸是二元弱酸,存在二级电离,二级电离常数ka1=4.30×10-7、ka2= 5.61×10-11。
在nahco3溶液中:c(h+)=(ka1ka2)1/2=(4.30×10-7×5.61×10-11)1/2= 4.91×10-9mol/l根据hco3-的电离平衡:hco3- h++co32-,得:c(co32-)=ka2×c(hco3-)/c(h+) =1.14×10-2?c(hco3-) -----(1)根据难溶物的溶度积与溶度积规则,可以算出往nahco3溶液中滴入cacl2或bacl2溶液会不会出现浑浊现象。