大肠杆菌生长曲线实验报告
- 格式:docx
- 大小:26.48 KB
- 文档页数:9

大肠杆菌生长曲线测定一、目的要求了解大肠杆菌生长曲线的基本特征,从而认识微生物在一定条件下生长、繁殖的规律。
二、基本原理一定量的微生物,接种在适合的新鲜液体培养基中,在适宜的温度下培养,以菌数的对数作纵坐标,生长时间作横坐标,做出的曲线叫生长曲线。
一般可分为延迟期、对数期、稳定期和衰亡期四个时期。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数法、平板菌落计数法、称重法、比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用光电比色计测定菌悬液的光密度来推知菌液的浓度,并将所测得的光密度值(OD值)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
现已有直接用试管就可以测定OD值的光电比色计(图Ⅶ-10),只要接种一支试管,定期用它测定,便可做出该菌的生长曲线。
三、器材培养18—20小时的大肠杆菌培养液,盛有5ml肉膏蛋白胨液体培养基的大试管12支;72型或72.1型分光光度计,自控水浴振荡器或摇床,无菌吸管等。
四、操作步骤1.编号取11支盛有肉膏蛋白胨液体培养基的大试管,用记号笔标明培养时间,即0、1.5、3、4、6、8、10、12、14、16、20小时。
2.接种用1ml无菌吸管,每次准确地吸取0.2ml大肠杆菌培养液,分别接种到已编号的11支肉膏蛋白胨液体培养基大试管中,接种后振荡,使菌体混匀。
3.培养中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。
以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推动化工行业的发展。
将接种后的11支试管置于自控水浴振荡器或摇床上,37℃振荡培养。
分别在0、1.5、3、4、6、8、10、12、14、16、20小时将编号为对应时间的试管取出,立即放冰箱中贮存,最后一同比浊测定光密度值。


大肠杆菌生长曲线实验报告抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。
但某些细菌对抗生素表现出抗性,原因是其基因发生了改变,产生能抵抗抗生素的性状。
在自然情况下,细菌的基因突变率很低,而且突变是不定向的,因此在自然条件下,想要获得有抗性的细菌是很困难的。
当给与适当的物理条件时,其突变率会大大增加。
如当用α射线、β射线、γ射线、Χ射线、中子和其他粒子、紫外线、微波等物理因素辐射时,能够促进遗传物质突变。
DNA对紫外线(UV)有强烈的吸收作用,尤其是碱基中的嘧啶,它比嘌呤更为敏感。
紫外线引起DNA 结构变化的形式有DNA链断裂、碱基破坏、胸腺嘧啶二聚体等。
因此,紫外线通常作为诱变剂,用于微生物菌种选育。
一般细胞分裂越旺盛,诱变剂量越大,突变率高,诱变最有效的波长253~265 nm。
选择合适的诱变剂量对于获得较高突变率十分关键,过高或过低的辐射剂量会导致菌株死亡或诱变不充分而降低诱变效果。
在紫外线诱变下,菌株发生不定向的突变,想要得到需要的特向变异必须对诱变后的菌株做筛选。
本实验想要得到的是能够抵抗抗生素的菌株,因此可以用抗生素培养基作为筛选培养基对菌种进行筛选。
若菌株没有发生定向突变,则该菌株不能在抗性培养基上正常生长,只有发生了定向突变才可能在筛选培养基上正常生长。
紫外线对于菌株有诱变作用外,对菌株还有较强的致死作用,因为紫外线改变了菌株的基因结构导致菌株无法正常生长繁殖。
因此,通过本实验的操作,在合适的照射剂量的设置下,比较不同不同照射剂量下的致死效果和突变率,并初步分析两者的相关性。
在分析死亡曲线和诱变率曲线的基础上,能了解诱变育种的机理和方法,为做进一步的诱变实验做准备。
2.材料和方法2.1实验材料、仪器和试剂菌种:大肠杆菌仪器:超净台、离心机、高压灭菌锅、培养箱、磁力搅拌器、培养皿、涂布器、移液管、移液器试剂:牛肉膏蛋白胨培养基相关试剂、硫酸卡那霉素水溶液(50mg/ml)、生理盐水2.2实验方法2.2.1制备培养基普通培养基——牛肉膏蛋白胨培养基(400ml):牛肉膏5g蛋白胨10g Nacl 5g琼脂20g蒸馏水1000ml Ph7.0 按配方配制好培养基后置于灭菌锅中115℃15min,倒平板,4皿*15ml*5组+2皿*15ml=22皿*15ml=330ml筛选培养基(200ml):含抗生素50mg/L。

大肠杆菌细胞生长曲线的测定实验报告思
考题
在大肠杆菌细胞生长曲线的测定实验报告中,以下是一些可能的思考题:
1. 实验结果显示大肠杆菌细胞在培养基中的生长呈现出典型的生长曲线,包括潜伏期、指数期、平台期和死亡期。
这种生长曲线的形成是由什么因素引起的?
2. 在实验中,为了测定大肠杆菌细胞的生长曲线,我们选择了什么样的培养基和培养条件?这些选择是否对实验结果产生了影响?
3. 在实验过程中,我们通过测量光密度或细胞数量来确定大肠杆菌细胞的生长情况。
这种测量方法可能存在的缺陷是什么?有没有更准确的测量方法可以应用于该实验?
4. 实验中,我们还讨论了大肠杆菌细胞生长的影响因素,如温度、pH值和营养成分等。
在未来的研究中,我们可以采取哪些控制变量的方法来深入探究这些影响因素对大肠杆菌细胞生长的具体影响?
5. 大肠杆菌细胞生长曲线的测定在哪些领域有广泛的应用?如何利用实验结果来研究和解决实际问题,比如食品安全、环境污染等?
这些思考题可以帮助你对实验结果进行进一步的思考和讨论,深化对大肠杆菌细胞生长曲线的理解并应用于更广泛的领域。
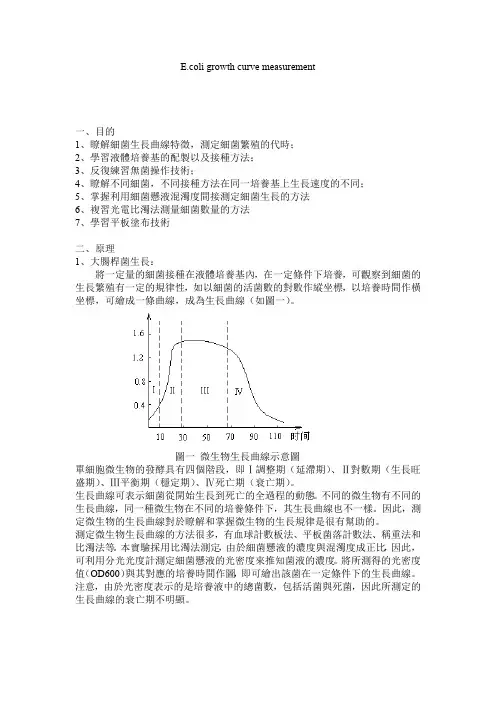
E.coli growth curve measurement一、目的1、瞭解細菌生長曲線特徵,測定細菌繁殖的代時;2、學習液體培養基的配製以及接種方法;3、反復練習無菌操作技術;4、瞭解不同細菌,不同接種方法在同一培養基上生長速度的不同;5、掌握利用細菌懸液混濁度間接測定細菌生長的方法6、複習光電比濁法測量細菌數量的方法7、學習平板塗布技術二、原理1、大腸桿菌生長:將一定量的細菌接種在液體培養基內,在一定條件下培養,可觀察到細菌的生長繁殖有一定的規律性,如以細菌的活菌數的對數作縱坐標,以培養時間作橫坐標,可繪成一條曲線,成為生長曲線(如圖一)。
圖一微生物生長曲線示意圖單細胞微生物的發酵具有四個階段,即Ⅰ調整期(延滯期)、Ⅱ對數期(生長旺盛期)、Ⅲ平衡期(穩定期)、Ⅳ死亡期(衰亡期)。
生長曲線可表示細菌從開始生長到死亡的全過程的動態。
不同的微生物有不同的生長曲線,同一種微生物在不同的培養條件下,其生長曲線也不一樣。
因此,測定微生物的生長曲線對於瞭解和掌握微生物的生長規律是很有幫助的。
測定微生物生長曲線的方法很多,有血球計數板法、平板菌落計數法、稱重法和比濁法等。
本實驗採用比濁法測定,由於細菌懸液的濃度與混濁度成正比,因此,可利用分光光度計測定細菌懸液的光密度來推知菌液的濃度。
將所測得的光密度值(OD600)與其對應的培養時間作圖,即可繪出該菌在一定條件下的生長曲線。
注意,由於光密度表示的是培養液中的總菌數,包括活菌與死菌,因此所測定的生長曲線的衰亡期不明顯。
2、平板塗布技術:塗布法接種是一種常用的接種方法,不僅可以用於計算活菌數,還可以利用其在平板表面生長形成菌苔的特點用於檢測化學因素對微生物的抑殺效應。
原理:將一定濃度,一定量的待分離菌懸液加到已凝固的培養基平板上,再用塗布棒快速地將其均勻塗布,使長出單菌落或菌苔而達到分離或計數的目的。
其目的:用於目的微生物的分離;用於藥物的抑菌試驗;觀察菌苔的形狀和特點。




大肠杆菌生长曲线的测定一、基本原理生长曲线是微生物在液体培养基中所表现出来的生长、繁殖的规律,不同的微生物表现为不同的生长曲线,而即使是同一种微生物在不同培养条件下,其生长曲线也不同。
因此测定微生物的生长曲线对于了解,掌握微生物的生长规律是有帮助的。
由于细菌悬液的浓度与混浊度成正比,因此可利用光电比色计测定菌悬液的光密度来推知菌液的浓度。
本实验是以活菌计数法与光电比浊法相对应来测定大肠杆菌在不同培养条件下的生长曲线,从而观察分析大肠杆菌在这些培养条件下的生长情况。
二、器材培养了20小时的大肠杆菌悬液;肉汤蛋白胨培养基(液体、固体);浓缩的肉汤蛋白胨液体培养基(浓缩5倍);无菌酸溶液(甲酸:乙酸:乳酸=3:1:1)。
1毫升及5毫升无菌吸管;无菌试管;无菌生理盐水;无菌平皿;血球计数器;显微镜;光电比色计;无菌离心管;离心机等。
三、操作步骤1.将经20小时培养的大肠杆菌培养物,倒入无菌离心管内离心(3000r.p.m×10),以无菌生理盐水洗涤三次后,制成约9亿毫升的菌悬液(用显微镜直接计数法),作为种子。
上述过程都必须注意严格无菌操作。
2.取盛有200毫升培养基经灭菌的三角瓶三瓶,分别标明A、B、C,按5%接种量,将上述种子接入,置37℃振荡培养。
在B瓶培养了4小时后取出,加入10毫升无菌酸溶液,然后继续振荡培养。
在C瓶培养了6小时后取出,加入10毫升无菌浓缩肉汤蛋白胨液,再继续振荡培养。
3.间隔一定时间,即0、2、4、6、8、10、12、14、16、18、20小时后,从A、B、C三角瓶中各取5毫升菌液放于无菌试管中,置冰浴。
并作适当稀释,使菌悬液的光密度控制在0.0-0.4范围内,再置光电比色计中进行比浊测定(400-440毫微米波长),用未接种的肉汤蛋白胨液为空白对照。
记下光密度值。
另外,A管在比浊测定以前,以无菌操作吸取0.1毫升菌液于肉汤蛋白胨琼脂平板上,用玻璃刮棒涂抹均匀后,置37℃培养30小时后计数。

实验日期:2017.11.1 实验班级:生物技术指导教师:张建丽姓名:高熹学号:1120152430测定细菌生长曲线一.实验目的1.通过对大肠杆菌生长曲线的测定,了解细菌生长的特点,综合训练微生物实验的基本实验技能。
2.巩固培养基的配制、灭菌、仪器的包扎、倒平板。
3.掌握用比浊法测定细菌的生长曲线。
二.实验原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,一定时间测定培养液中的菌量,以菌量的数量作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、生长期、稳定期和衰亡期。
将每一种一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期、对数生长期、稳定期和衰亡期四个阶段。
延迟期:又叫调整期。
细菌接种至培养基后,对新环境有一个短暂适应过程(不适应者可因转种而死亡)。
此期曲线平坦稳定,因为细菌繁殖极少延迟期长短因素种、接种菌量、菌龄以及营养物质等不同而异,一般为1~4小时。
此期中细菌体积增大,代谢活跃,为细菌的分裂增殖合成、储备充足的酶、能量及中间代谢产物。
对数生长期:又称指数期。
此期生长曲线上活菌数直线上升。
细菌以稳定的几何级数极快增长,可持续几小时至几天不等(视培养条件及细菌代时而异)。
此期细菌形态、染色、生物活性都很典型,对外界环境因素的作用敏感,因此研究细菌性状以此期细菌最好。
抗生素作用,对该时期的细菌效果最佳。
稳定期:该期的生长菌群总数处于平坦阶段,但细菌群体活力变化较大细菌浓度达到最大即环境最大容纳量。
由于培养基中营养物质消耗、毒性产物(有机酸、过氧化物等)积累PH下降等不利因素的影响,细菌繁殖速度渐趋下降,相对细菌死亡数开始逐渐增加,此期细菌增殖数与死亡数渐趋平衡。
细菌形态、染色、生物活性可出现改变,并产生相应的代谢产物如外毒素、内毒素、抗生素、以及芽孢等。
第九次课大肠杆菌生长曲线的测定(2学时)一、基本原理大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次.将一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期、对数期、稳定期和衰亡期四个阶段。
以培养时间为横坐标,以细菌数日的对数或生长速率为纵坐标作图所绘制的曲线称为该细菌的生长曲线。
不同的细菌在相同的培养条件下其生长曲线不同,同样的细菌在不同的培养条件下所绘制的生长曲线也不相同。
测定细菌的生长曲线,了解其生长繁殖规律,这对人们根据不同的需要,有效地利用和控制细菌的生长具有重要意义。
本实验用分光光度计进行光电比浊测定不同培养时间细菌悬浮液的OD值,绘制生长曲线.也可以直接用试管或带有测定管的三角瓶测定“klett units”值的光度计。
只要接种1支试管或1个带测定管的三角瓶,在不同的培养时间(横坐标)取样测定,以测得的klett units为纵坐标,便可很方便地绘制出细菌的生长曲线。
如果需要,可根据公式1klett units=OD/0.002换算出所测菌悬液的OD值。
二、实验器材1.菌种大肠杆菌。
2.培养基LB液体培养基70m1,分装2支大试管(5ml/支),剩余60ml装入250ml的三角瓶.3.仪器或其他用具722型分光光度计,水浴振荡摇床,无菌试管,无菌吸管等。
三、实验步骤1.标记取11支无菌大试管,用记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16和20h。
2.接种分别用5m1无菌吸管吸取2.5m1大肠杆菌过夜培养液(培养10—12h)转人盛有50m1 LB液的三角瓶内,混合均匀后分别取5m1混合液放人上述标记的11支无菌大试管中。
3.培养将已接种的试管置摇床37℃振荡培养(振荡频率250r/min),分别培养0、1.5、3、4、6、8、10、12、14、16和20h,将标有相应时间的试管取出,立即放冰箱中贮存,最后一同比浊测定其光密度值。
大肠杆菌生长曲线测定一、实验简介大多数细菌的繁殖速度很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次,将一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期、对数生长期、稳定期和衰亡期四个阶段。
以培养时间为横坐标,以细菌数目的对数或生长速率为纵坐标作图所绘制曲线称为该细菌的生长曲线。
不同的细菌在相同的培养条件下其生长曲线不同,同样的细菌在不同的培养条件下培养所绘制的生长曲线也不相同。
测定细菌的生长曲线,了解其生长繁殖规律,这对人们根据不同的需要,有效地利用和控制细菌的生长具有重要意义。
本实验用分光光度计进行光电比浊测定。
当光线通过微生物菌悬液时,由于菌体的散射及吸收作用使光线的透过率降低,在一定的范围内,微生物细胞浓度与透光度成反比,与光密度成(OD值)正比。
因此可利用分光光度计测定菌悬液的光密度来推知菌液浓度,并将所测的OD值与其对应的培养时间作图,即可绘制出该菌在一定条件的生长曲线。
二、实验试剂与材料1、菌种:大肠杆菌2、培养基:LB培养基(蛋白胨10g、酵母膏5g、氯化钠10g、PH 7.0~7.2)70ml,分装2支大试管(5ml/支),剩余60ml装入250ml三角烧瓶中进行灭菌。
3、仪器及器具:分光光度计、比色杯、水浴恒温摇床、接种环、无菌吸管、三角瓶、无菌水、无菌操作台、酒精灯。
三、实验过程和步骤1、种子液制备:在无菌操作台上用灭菌的接种环以无菌操作挑取大肠杆菌菌种放入灭过菌的无菌三角烧瓶中,并用无菌水稀释50倍。
放在无菌条件下静置一段时间作种子悬液。
注:挑取菌落时必须对大肠杆菌菌落的形态特点进行深入了解以便挑取同一菌落菌种,从而避免对后面的比浊产生影响。
2、大肠杆菌形态学观察:取菌悬液将其涂布在1cm^2的载玻片的面积上自然烘干,然后进行革兰氏染色(涂片—晾干—固定—结晶紫染色—水洗—媒染—水洗—脱色—复染—水洗—晒干—镜检),对其进行形态学观察。
用比浊法测定大肠杆菌的生长曲线(一)实验目的了解细菌生长曲线的持点及测定原理,学会用比浊法测定细菌的生长曲线。
(二)实验原理将一定数量的细菌,接种于适宜的液体培养基中,在适温下培养,定时取样测数,以菌数的对数为纵坐标,生长时间为横坐标,作出的曲线称为生长曲线。
该曲线表明细菌在一定的环境条件下群体生长与繁殖的规律。
一般分为延缓期、对数期、稳定期及衰亡期四个时期,各时期的长短同菌种本身特征、培养基成分和培养条件不同而异。
比浊法是根据细菌悬液细胞数与混浊度成正比,与透光度成反比关系,利用光电比色计测定细胞悬液的光密度(即OD值),用于表示该菌在本实验条件下的相对生长量。
实验设正常生长、加酸抑制和加富培养等三种处理,以了解细菌在不同生长条件下的生长情况。
(三)实验器材(1)活材料:大肠杆菌(E.coli)。
(2)培养基和试剂:牛肉膏蛋白胨液体培养基14支(每支10mL),浓缩5 倍的牛肉膏蛋白胨培养基1支。
无菌酸溶液(甲酸:乙酸:乳酸=3:1:1)。
(3)器材:1mL无菌吸管、摇床、冰箱、光电比色计、标签等。
(四)实验方法方法(1)1)接种:取13支装有牛肉膏蛋白胨培养液的试管,贴上标签(注明菌名、培养处理、培养时间、组号)。
按无菌操作法用吸管向每管准确加入0.2mL的大肠杆菌培养液,接种后,轻轻摇荡,使菌体混匀。
另一支不接种的培养管注明CK(对照)。
2)培养:将接种后的培养管置于摇床上,在37℃下振荡培养。
其中9支培养管分别于培养的0、1.5、3、4、6、8、10、12和14h后取出,放冰箱中贮存,待测定。
加酸处理。
取出经4h培养的另二支培养管,按无菌操作法加入lmL无菌酸溶液,摇匀后放回摇床上,继续振荡培养,于培养8h和14h后取出放冰箱中贮存,待测定。
加富营养物处理。
余下的二支培养管于培养6h后取出,按无菌操作法加入浓缩5倍的牛肉膏蛋白胨培养液1mL,摇匀后,继续进行振荡培养,于培养8h和14h后取出,放入冰箱中贮存,待测定。
四川大学化学实验报告课程名称生物工艺学实验课程号 309119060学院轻纺与食品学院专业轻工生物技术学生姓名赵凤佼学号 0843095035指导教师周荣清成绩评定实验日期 2011-06-20~2011-06-22一、实验名称:大肠杆菌生长曲线的制作二、实验目的:1.通过细菌数量的测量了解大肠杆菌的生长特征与规律,绘制生长曲线。
2.掌握光电比浊法测量细菌数量的方法。
三、实验仪器及药品:1.菌种:大肠杆菌。
2.培养基:LB培养基100ml,分装两支大试管(5ml/支),剩余90ml装入250ml三角瓶。
3.仪器和其他药品:722型分光光度计,水浴振荡摇床,无菌试管和无菌吸管等。
四、基本原理:在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次,将一定量的细菌转入新鲜培养液中,在适宜的培养条件下细胞要经历延迟期、对数期、稳定器和衰亡期4个阶段。
以培养时间为横坐标,细菌数目的对数或生长速率为纵坐标所绘制的曲线成为该细菌的生长曲线。
不同的细菌在在相同的培养条件下其生长曲线不同,同种细菌在不同的培养条件下所绘制的生长曲线也不同。
当光线微生物菌悬液时,由于菌体的散射及吸收作用使光线的透过量降低。
在一定范围内,微生物细胞浓度与透光度成反比,与光密度成正比;而光密度或透光度可以通过光电池精确测出。
因此,可利用一系列菌悬液测定的光密度及其含菌量,做出光密度—菌数的标准曲线,然后根据样品液所测得的光密度,从标准曲线中查处对应的菌数。
本实验用分光光度计进行光电比浊,测定不同时间细菌悬浮液的OD值,绘制生长曲线。
五、关键步骤及注意事项:1.测定OD值时,要求从低浓度到高浓度测定2.严格控制培养时间六、操作步骤:1.标记取11支无菌试管,用记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16、20h。
2.接种分别用5ml无菌吸管吸取2.5ml大肠杆菌过夜培养液(培养10~12h)转入盛有90mlLB培养液的三角瓶,混合均与后分别取5ml混合液放入上述标记的11支无菌试管中。