九年级化学第十一单元盐化肥 课题1生活中常见的盐
- 格式:ppt
- 大小:366.50 KB
- 文档页数:23
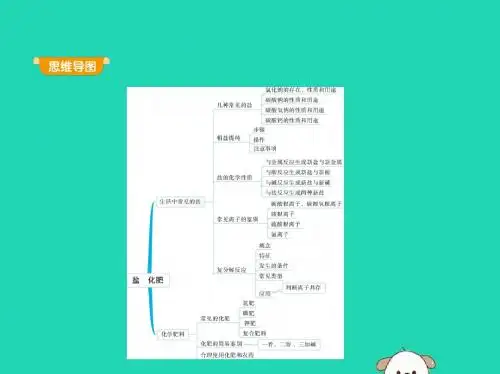

课题1 生活中常见的盐(第一课时) 一.教学目标:1.通过资料收集和实验探究,理解生活中常见的盐的种类和用途。
2.初步学会粗盐提纯和鉴定碳酸根离子的方法;3.能判断复分解反应的类型及发生条件。
二.重点和难点:重点:粗盐的提纯、对碳酸盐的特性的理解、复分解反应概念的形成。
难点:复分解反应发生条件的判断。
课时安排共3课时三.教学过程一.常见的盐1. 氯化钠化学式NaCl 俗名食盐(1)物理性质:白色固体,易溶于水,水溶液呈中性。
(2)用途:课本P68(3)氯化钠在自然界的存有:海水、盐湖、盐井、盐矿提出问题:“如何将粗盐转化为精盐?”“怎样除去粗盐中不溶性杂质和可溶性杂质?”今天的学习任务:活动与探究──粗盐的初步提纯。
(4)粗盐的提纯步骤:溶解、过滤、蒸发所需仪器:铁架台(带铁圈)、烧杯、托盘天平、漏斗、玻璃棒、蒸发皿、滤纸、酒精灯、火柴、量筒、药匙过滤操作的注意事项:“一贴二低三靠”问题拓展:通过本节课的学习,同学们基本会用过滤的方法除去粗盐中不溶性杂质,如果要除去粗盐中可能含有的氯化镁、氯化钙、碳酸钠等可溶性杂质,你将用什么方法除去?原理是什么?怎样操作?2.碳酸钙CaCO3(1)物理性质:白色晶体或粉末状固体,难溶于水。
(2)用途:重要的建筑材料:可作补钙剂。
(3)化学性质:高温分解;与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑3. 碳酸钠 Na2CO3俗名:纯碱或苏打(1)物理性质:白色粉末状固体,易溶于水,水溶液呈碱性,碳酸钠晶体在常温下放在干燥的空气中,逐渐失去结晶水成为粉末,这种现象叫做“风化”。
(2)用途:蒸馒头、洗涤衣物、广泛用于玻璃、造纸、纺织、洗涤剂等工业上。
(3)化学性质:a.与盐酸反应Na2CO3+2HCl=2NaCl+H2O+CO2↑b.与澄清石灰水反应Na2CO3+Ca(OH)2 =2NaOH+CaCO3↓。
c.与氯化钙反应。
4. 碳酸氢钠NaHCO3 俗名:小苏打化学性质:受热分解;碳酸氢钠与盐酸:NaHCO3+HCl=NaCl+H2O+CO2↑。




第十一单元盐化肥
课题1 生活中常见的盐(第一课时)
【学习目标】
加深了解“盐”概念。
了解氯化钠在自然界中的存在、用途以及在人体中的生理功能。
学会粗盐初步提纯的操作方法。
重点
知道氯化钠的用途,学会粗盐初步提纯的操作方法
难点
学会粗盐初步提纯的操作方法
【示标设疑,布置自学】
预习教材72-73页,完成下列问题
1、什么是盐?你能说出几种常见的盐及它们的化学式吗?
2、化学中的盐和日常生活中所说的“盐”有什么不同?
3、氯化钠的生理功能及在自然界中的存在
4、氯化钠的用途有哪些?
5、提纯粗盐的操作及涉及到的仪器有哪些?
【检查学情,问题归类】
一、盐
1、什么是盐
组成中含有_________________和_________________的化合物。
2、生活中常见的盐
氯化钠化学式___________,易溶于水,其溶液呈中性
亚硝酸钠化学式:NaNO2,易溶于水,其溶液显碱性。
碳酸钠俗名_________、__________,化学式__________,易溶于水,其溶液显碱性碳酸氢钠俗名__________,化学式___________,易溶于水,溶液显碱性
高锰酸钾化学式______________,易溶于水形成__________色的溶液
石灰石的、大理石的主要成分__________ 化学式__________,难溶于水的白色固体
3、化学中的盐和日常生活中所说的“盐”有什么不同?
日常生活中所说的盐,通常中指食盐(主要成分:氯化钠);而化学中的盐不仅仅是食盐,而的组成中含有金属离子和酸根离子的化合物的一类物质的总称。
二、食盐。




