课题1 生活中常见的盐
- 格式:doc
- 大小:52.00 KB
- 文档页数:4


从前有一个国王,他很喜欢吃糖。
于是他就问他的厨师说:“这个世界上什么东西最好吃?”厨师说:“这个世界上最好吃的是盐。
”国王很生气,于是把厨师关了起来。
同时命令全国人民只能吃糖,不准吃盐。
过了一段时间后,他发现他的国民个个都愁眉苦脸的,而且有很多人出现了不同的症状,于是他不得不取消了这项命令。
盐是什么??生活中的盐:化学中的盐:通常指食盐(主要成分是NaCl)一类组成里含有金属离子和酸根离子的化合物,如NaCl、CuSO4、CaCO3等。
生活中的盐:化学中的盐:通常指食盐(主要成分是NaCl)一类组成里含有金属离子和酸根离子的化合物,如NaCl、CuSO4、CaCO3等。
火眼金睛:哪些是盐?HCl、Ca(OH)2、NaCl、NaHCO3、Na2CO3、NaOH、CaCO3、H2SO4火眼金睛:哪些是盐?HCl、Ca(OH)2、NaCl、NaHCO3、Na2CO3、NaOH、CaCO3、H2SO4火眼金睛:哪些是盐?HCl、Ca(OH)2、NaCl、NaHCO3、Na2CO3、NaOH、CaCO3、H2SO4氯化钠碳酸钠碳酸氢钠碳酸钙化学式俗称颜色状态水溶性用途NaCl Na2CO3NaHCO3CaCO3食盐苏打、纯碱小苏打石灰石白色固体白色固体白色固体白色固体可溶不溶可溶可溶【活动与探究】调味料等生产玻璃等发酵粉等补钙剂等盐酸腐蚀含碳酸钙的建材【活动与探究】现象氯化钠+盐酸碳酸钠+盐酸碳酸氢钠+盐酸碳酸钙+盐酸【活动与探究】现象氯化钠+盐酸无现象碳酸钠+盐酸碳酸氢钠+盐酸碳酸钙+盐酸现象氯化钠+盐酸无现象碳酸钠+盐酸碳酸氢钠+盐酸碳酸钙+盐酸【活动与探究】反应迅速,产生大量气泡,澄清石灰水变浑浊。
CaCO3+2HCl=CaCl2+H2CO3H2O+CO2↑NaHCO3+HCl=NaCl+H2CO3H2O+CO2↑Na2CO3+2HCl=2NaCl+H2CO3H2O+CO2↑请设计一个实验证明鸡蛋壳的成分。

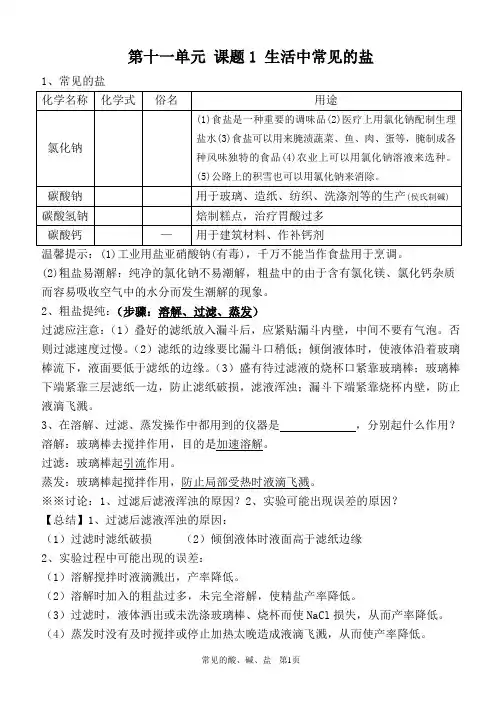
第十一单元课题1 生活中常见的盐1、常见的盐温馨提示:(1)工业用盐亚硝酸钠(有毒),千万不能当作食盐用于烹调。
(2)粗盐易潮解:纯净的氯化钠不易潮解,粗盐中的由于含有氯化镁、氯化钙杂质而容易吸收空气中的水分而发生潮解的现象。
2、粗盐提纯:(步骤:溶解、过滤、蒸发)过滤应注意:(1)叠好的滤纸放入漏斗后,应紧贴漏斗内壁,中间不要有气泡。
否则过滤速度过慢。
(2)滤纸的边缘要比漏斗口稍低;倾倒液体时,使液体沿着玻璃棒流下,液面要低于滤纸的边缘。
(3)盛有待过滤液的烧杯口紧靠玻璃棒;玻璃棒下端紧靠三层滤纸一边,防止滤纸破损,滤液浑浊;漏斗下端紧靠烧杯内壁,防止液滴飞溅。
3、在溶解、过滤、蒸发操作中都用到的仪器是,分别起什么作用?溶解:玻璃棒去搅拌作用,目的是加速溶解。
过滤:玻璃棒起引流作用。
蒸发:玻璃棒起搅拌作用,防止局部受热时液滴飞溅。
※※讨论:1、过滤后滤液浑浊的原因?2、实验可能出现误差的原因?【总结】1、过滤后滤液浑浊的原因:(1)过滤时滤纸破损(2)倾倒液体时液面高于滤纸边缘2、实验过程中可能出现的误差:(1)溶解搅拌时液滴溅出,产率降低。
(2)溶解时加入的粗盐过多,未完全溶解,使精盐产率降低。
(3)过滤时,液体洒出或未洗涤玻璃棒、烧杯而使NaCl损失,从而产率降低。
(4)蒸发时没有及时搅拌或停止加热太晚造成液滴飞溅,从而使产率降低。
4、盐的化学性质:【务必掌握】(1)盐+金属→新盐+新金属(置换反应) 如:Fe + CuSO4——Cu + AgNO3——(2)盐+酸→新盐+新酸(复分解反应)如:HCl + BaCO3——H 2SO4+ BaCl2——Na2CO3+ H2SO4——HCl + AgNO3——H 2SO4+ MgCO3——(3)盐+碱→新盐+新碱(复分解反应) (前提:反应物均可溶)如:K2CO3+ Ca(OH)2——MgSO4 + Ba(OH)2——FeCl3+ NaOH ——Cu(NO3)2+ KOH ——Al2(SO4)3+ NaOH ——(NH4)2SO4+ Ca(OH)2——(4)盐+盐→另两种盐(复分解反应) (前提:反应物均可溶)如:Na2CO3+ Ca(NO3)2——BaCl2 + AgNO3——Ba(NO3)2+ K2SO4——K 2CO3+ Fe(NO3)2——MgSO4 + Na2CO3——判断下列反应能否发生,能反应的完成化学方程式:① Zn + FeSO4——② Cu + AgCl ——③ NaCl + CuSO4——④ Na2CO3+ Ca(OH)2——⑤ BaCl2 + Na2CO3——⑥ CuCl2 + H2SO4——⑦ CaCO3 + BaCl2——⑧ BaSO4+ HCl ——⑨ Na2CO3+ Cu(OH)2——⑩Na2CO3+ BaCl2——5、复分解反应(1)定义:由________________互相交换成分,生成_________________的反应。

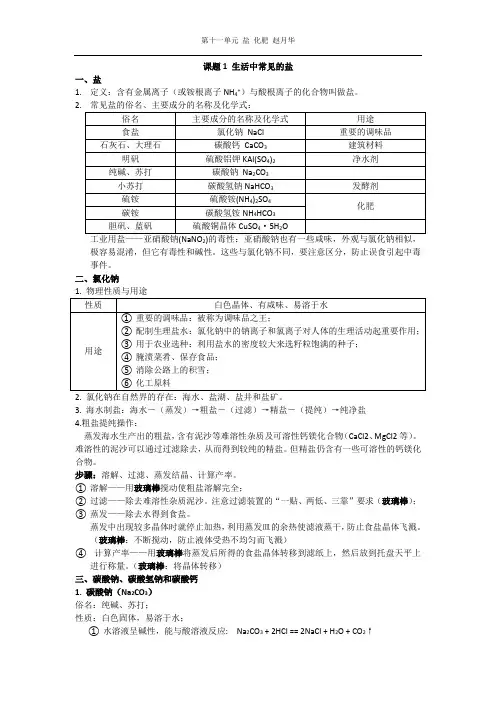
课题1 生活中常见的盐一、盐1.定义:含有金属离子(或铵根离子NH4+)与酸根离子的化合物叫做盐。
2.2极容易混淆,但它有毒性和碱性。
这些与氯化钠不同,要注意区分,防止误食引起中毒事件。
二、氯化钠3. 海水制盐:海水―(蒸发)→粗盐―(过滤)→精盐―(提纯)→纯净盐4.粗盐提纯操作:蒸发海水生产出的粗盐,含有泥沙等难溶性杂质及可溶性钙镁化合物(CaCl2、MgCl2等)。
难溶性的泥沙可以通过过滤除去,从而得到较纯的精盐。
但精盐仍含有一些可溶性的钙镁化合物。
步骤:溶解、过滤、蒸发结晶、计算产率。
①溶解——用玻璃棒搅动使粗盐溶解完全;②过滤——除去难溶性杂质泥沙。
注意过滤装置的“一贴、两低、三靠”要求(玻璃棒);③蒸发——除去水得到食盐。
蒸发中出现较多晶体时就停止加热,利用蒸发皿的余热使滤液蒸干,防止食盐晶体飞溅。
(玻璃棒:不断搅动,防止液体受热不均匀而飞溅)④计算产率——用玻璃棒将蒸发后所得的食盐晶体转移到滤纸上,然后放到托盘天平上进行称量。
(玻璃棒:将晶体转移)三、碳酸钠、碳酸氢钠和碳酸钙1. 碳酸钠(Na2CO3)俗名:纯碱、苏打;性质:白色固体,易溶于水;①水溶液呈碱性,能与酸溶液反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑②能与碱溶液(石灰水)反应:Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH③能与某些盐溶液反应:Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl用途:用于造纸、玻璃、纺织和生产洗涤剂。
2. 碳酸氢钠(NaHCO3)俗名:小苏打性质:白色固体,易溶于水;①水溶液呈碱性,能与酸溶液反应: NaHCO3 + HCl == NaCl + H2O + CO2↑用途:焙制糕点时用于作发酵粉;在医疗上用于治疗胃酸过多。
3.碳酸钙(CaCO3)俗名:大理石、石灰石的主要成分性质:白色固体,难溶于水;能与酸溶液反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑用途:作建筑材料和装饰材料;可用于作补钙剂。



课题1 生活中常见的盐一、氯化钠(NaCl)1、俗名:食盐2、存在:海水、盐湖、盐井、盐矿3、制取:晾晒——海水煮——盐井、盐湖水开采——盐矿4、用途(1)调味、腌渍食品(2)生理盐水(3)化工原料5、粗盐提纯(1)称量(2)溶解(3)过滤(4)蒸发二、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)(一)碳酸钠(Na2CO3)1、俗名:纯碱,苏打2、性质:白色粉末,易溶于水,水溶液显碱性3、用途:生产玻璃,造纸,纺织,洗涤剂等。
(二)碳酸氢钠(NaHCO3)1、俗名:小苏打2、性质:白色粉末,易溶于水,水溶液显碱性3、用途:食品添加剂、制药品等。
(三)碳酸钙(CaCO3)——大理石、石灰石的主要成分1、性质:白色固体,难溶于水。
2、用途:(1)建筑材料(2)补钙剂3、CO32-的鉴别(1)取样品滴加稀盐酸,(2)将产生的气体通入澄清石灰水,(3)澄清石灰水变浑浊,则含有CO32-例:Na2CO3 +2HCl= 2NaCl + H2O + CO2↑CaCO3 + 2HCl = CaCl2 + H2O + CO2↑CO2 + Ca(OH)2 = CaCO3↓+ H2O三、盐溶液相似的化学性质1、盐+金属→另一种金属+另一种盐条件:在金属活动顺序中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来。
Fe + CuSO4 = FeSO4 + Cu硫酸铜硫酸亚铁Cu + Hg(NO3)2 = Cu(NO3)2 + Hg 硝酸汞硝酸铜2、盐+酸→另一种盐+另一种酸HCl + AgNO3 = AgCl ↓+ HNO3硝酸银氯化银2HCl + BaCO3 = BaCl2 + H2O + CO2↑碳酸钡氯化钡H2SO4 + BaCl2 = BaSO4↓+ 2HCl3、盐+碱→另一种盐+另一种碱2NaOH + CuSO4 = Cu(OH)2 ↓+ Na2SO4硫酸铜氢氧化铜硫酸钠Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓3NaOH + FeCl3 = Fe(OH)3 ↓+ 3NaCl氯化铁氢氧化铁4、盐+盐→另外两种盐AgNO3 + NaCl = AgCl↓+ NaNO3硝酸银氯化银硝酸钠BaCl2 + Na2SO4 = BaSO4 ↓+ 2NaCl氯化钡硫酸钠硫酸钡四、复分解反应1、复分解反应——由两种化合物互相交换成分,生成两种新的化合物的反应。
课题1 生活中常见的盐班级姓名一、学习目标,明确清晰1. 了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙的组成、性质及主要用途。
2. 了解复分解反应,能根据复分解反应发生的条件判断一些常见酸、碱、盐之间的反应能否发生。
3. 掌握碳酸根离子的检验方法。
二、自学质疑,知识构建1. 带着以下问题自学书本68-71页,完成下列表格:氯化钠碳酸钠碳酸氢钠碳酸钙化学式俗称颜色状态水溶性用途2.如何鉴定含有CO32-(或HCO3-)的盐?3.复分解反应的定义是什么?需要哪些条件才能发生?三、课堂探究,精彩纷呈1. 【活动与探究】与盐酸的反应现象化学方程式氯化钠+盐酸碳酸钠+盐酸碳酸氢钠+盐酸碳酸钙+盐酸2. 【活动与探究】碳酸钠溶液与澄清石灰水的反应现象化学方程式碳酸钠溶液+澄清石灰水四、迁移运用,能力提升1.下列说法正确的是()A. 盐都能食用,故称食盐B. 盐就是食盐,易溶于水C. 盐都有咸味,都是白色晶体D. 盐是一类物质的总称2.氯化钠是重要的调味品,炒菜时如果不放食盐,菜将食之无味。
氯化钠有许多的用途,下列说法中不是它的用途的是()A. 医疗上用它来配制生理盐水B. 农业上用氯化钠来选种C. 生活中用食盐来腌制蔬菜、肉D. 常用晾晒海水的办法得到含较多杂质的粗盐3. 判断复分解反应能否发生,不必考虑的是()A. 是否有沉淀生成B. 是否有气体生成C. 是否有水生成D. 金属活动性顺序4. 厨房里的两只调料瓶中都放有白色固体,只知道它们分别是精盐(NaCl)和碱面(Na2CO3)中的一种,请利用家中现有的条件将它们区分开来,简要叙述实验步骤、现象和结论。
第十一单元盐化肥
课题1 生活中常见的盐教学设计
学习目标:
1、了解生活中几种常见盐(食盐、碳酸钠、碳酸氢钠、碳酸钙)的性质及用途。
2、知道粗盐提纯的步骤及各步骤操作时的注意事项。
3、初步总结酸、碱、盐之间发生反应的条件,得出复分解反应的条件。
学习重点:1、碳酸盐的检验方法
2、复分解反应的条件
学习难点:复分解反应的条件
【课前预习】
1、盐是一类组成里含有和的化合物。
2、写出常见的碳酸钠、碳酸氢钠的化学式及俗称。
3、从海水中获得的盐属于,通过、、等方法可变成我们食用的精盐。
4、写出下列物质中主要成分的化学式:
食用碱,发酵粉,石灰石及大理石。
5、举例说出你学过的基本反应类型:
;
;。
【课内探究】
【课后延伸】
1、鉴别化合物中含有碳酸根的最简单方法是:
A、加入盐酸后产生的气体通入澄清的石灰水出现浑浊
B、加盐酸后产生的气体使燃着的木条熄灭
C、加热时产生的气体使燃着的木条熄灭
D、加热时产生的气体通入石灰水出现浑浊
2、列各组物质能在同一溶液中大量共存的是:
A、NaCl,HCl,MgSO4,Cu(NO3)2
B、AgNO3,NaCl,Mg(NO3)2,NaOH
C、Ca(OH)2,NaNO3,Na2CO3,NH4Cl
D、HCl,K2SO4,NaOH,NaNO3
3、别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是
A、NaNO3,Ba(OH)2,HNO3
B、H2SO4,NaNO3,Na2SO4
C、H2SO4,NaNO3,FeSO4
D、CaCl2,Na2SO4,BaCl2
4、判断复分解反应能否发生,不必考虑的是
A、是否有气体生成
B、是否有沉淀生成
C、是否有水生成
D、金属的活动性
5、甲已丙丁四瓶溶液分别是K2CO3, Ba(NO3)2,H2SO4, K2SO4中的一种,其中甲分别能与已丙丁发生反应,则甲是
A、K2CO3
B、H2SO4
C、Ba(NO3)2
D、K2SO4
6、怎样验证水垢、珍珠、蛋壳的主要成分是碳酸钙?
7、种物质两两相混是否能发生反应?若能反应,写出方程式。
H2SO4 Ba(OH)2 NaOH K2CO3 CaCl2 HCl。