体外诊断试剂表格模板
- 格式:doc
- 大小:484.00 KB
- 文档页数:38
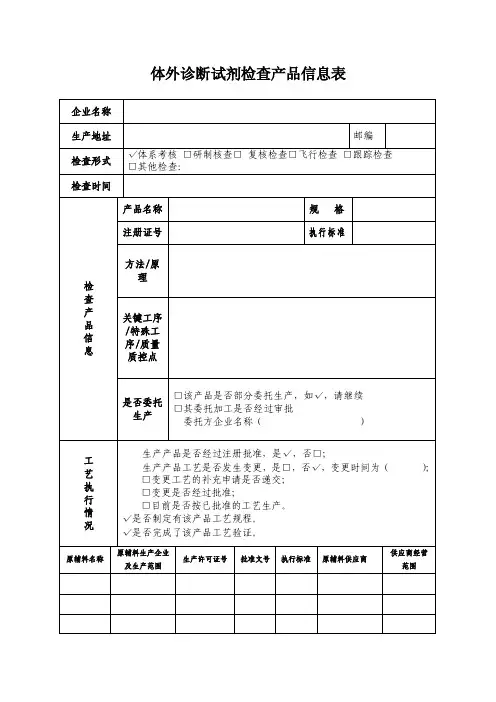
体外诊断试剂检查产品信息表
填报说明:
1、体外诊断试剂的生产从物料的购进到成品出厂的每个工序均应有效控制。
掌握产品所需原料的供应、使用情况,旨在引导企业逐步加强对原辅料使用的控制以及对物料供应商的审计管理。
2、本表格为被检查体外诊断试剂生产企业设计,由具有一定资质人员填写并加盖公章,以保证表格内容真实性。
3、生产企业应在检查工作结束前完成本表格填写。
填写产品范围为检查组在现场检查中所涉及到的产品,包括抽查批记录以及现场正在生产的产品。
每个产品填写一份表格。
4、在体系考核检查、研制核查、整改后复核检查、跟踪检查、飞行检查或其他检查时填写该表格。
检查形式是指检查的具体内容,请在相应类别后√。
5、如遇使用的原辅料无生产许可证、批准文号和质量标准等,请在相关项下填“无”;如生产原辅料为国外生产企业,填写原辅料供应商及供应商经营范围。
6、该表格电子版存入现场检查检查工作系统中一并带回国家药品认证中心。

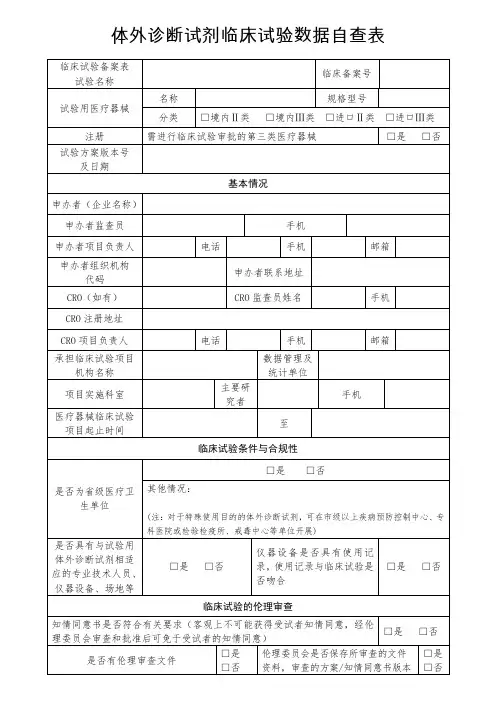
体外诊断试剂临床试验数据自查表试验名称:试验编号:试验阶段:试验日期:一、试验目的:(明确试验目的,包括研究的问题、假设、目标等)二、试验设计:(详细描述试验设计,包括对照组设置、样本大小、分组方式等)三、试验方法:1.试验对象:(描述试验对象的选取标准,包括年龄、性别、病史等)2.试验操作:(描述执行试验时的具体操作步骤,如采样、实验操作、数据记录等)3.试验指标:(详细说明试验所测定的指标,包括主要指标和次要指标)4.试验测量与评估:(描述试验对象的测量方法和评估标准,包括测量设备、评估方法等)5.数据记录与存储:(描述试验数据的记录方式和存储方法,包括纸质记录、电子化记录等)四、试验结果与数据分析:1.参与者基本信息:(描述试验对象的基本信息,如年龄、性别、身体指标等)2.数据质量控制:(描述试验数据的质量控制措施,如数据清洗、排查错误数据等)3.数据统计与分析:(详细描述试验数据的统计方法和分析方法,包括描述性统计、方差分析等)4.结果呈现:(将试验结果以表格、图表等形式展示,并进行文字解读)五、试验结论:(根据试验结果进行结论总结,有无测定指标达到预定目标等)六、试验限制与不确定因素:(描述试验过程中的限制条件和不确定因素,可能对试验结果产生影响)七、道德考虑与安全性保证:(说明试验过程中的道德考虑,包括试验对象知情同意等)总结:(对整个试验进行总结,包括试验设计的合理性、数据的可靠性、结论的准确性等)附件:(列明所有附件,如数据表格、图表等)以上就是体外诊断试剂临床试验数据自查表的要求。
在填写表格时,需要详细描述试验的目的、设计、方法、结果等方面的信息,并进行合理的数据分析和结论总结。
同时,需要对试验过程中的道德考虑和安全性保证进行说明,并附上相关的附件。

境内体外诊断试剂注册申请表申请单位信息:
单位名称:
单位地址:
申请人及代表人信息:
申请人姓名:
申请人职位:
代表人姓名:
代表人职位:
一、注册产品信息:
1.产品名称:
2.通用名称:
3.适用范围:
4.产品规格及包装:
5.产品类型:
6.生产企业名称及地址:
7.产品原产地:
二、产品技术信息:
1.原理和方法:
2.主要技术指标:
4.成分和材料:
5.样品和质控的准备:
6.使用方法和操作步骤:
7.结果的解读和判断标准:
8.结果的精确性和稳定性:
三、临床试验数据:
1.临床试验用途:
2.试验对象:
3.试验方法和步骤:
4.试验结果和数据:
5.结果的准确性和可靠性:
6.不良事件和副作用记录:
四、检验验证数据:
1.检验验证用途:
2.验证对象:
3.验证方法和步骤:
4.验证结果和数据:
5.结果的准确性和可靠性:
6.不良事件和副作用记录:
五、质量控制数据:
1.原材料及购进渠道:
2.生产工艺和设备:
3.生产过程控制:
4.成品检验和统计规格:
5.不良品处理和追溯体系:
6.质量手册和规程:
7.质量体系评估结果:
六、其他补充材料:
请提供其他与注册申请相关的补充材料,如产品销售许可证、生产许可证等。
本注册申请所提供的资料真实可靠,未隐瞒任何与注册申请相关的信息。
本申请单位愿意承担因注册申请信息不真实、不全面而产生的法律责任和经济损失。
申请单位签章:。

试验试剂运送交接记录表临床试验名称:试剂运输工具:试剂冷藏方式:试剂存储温度要求:物品名称生产厂家规格/使用截止日期批号/数量储存位置备注申办方:有限公司发货人签名:日期:研究单位:接收人签名:日期:附件:冷链运输相关文件耗材交接记录表日期:年月研究中心:********医院项目名称申办者:******科技有限公司冰箱/柜型号:日期温度记录员签名备注9:0015:0012345678910111213141516171819202122232425262728293031日期:2018年月研究中心:******医院项目名称申办者:*******科技有限公司冰箱/柜型号:日期温度记录员签名备注上午下午12345678910111213141516171819202122232425262728293031样本筛选记录表项目名称申办方研究单位序号样本条码号有无患者信息(有:√;无:×)样本类型(不加抗凝剂采血管收集的全血:√)目测样本足够(是:√;否:×)样本是否新鲜无凝块无气泡(是:√;否×)是否根据医院检测的项目参考范围筛选(是:√;否×);根据其他:请备注是否入选(是:√;否×)1入选样本数量样本保存位置筛选时间筛选人备注说明1临床试验样本使用记录表项目名称:研究中心:申办方:序号样本编盲号使用后处理备注12345678910111213使用人(签字):使用日期:第1页共1页试剂发放保存记录表项目名称:临床试验研究机构/科室:主要研究者:试剂名称:批号:保存地点:日期出/入库+数量剩余数量发放人领用人备注:完整试剂开封使用后,如有剩余试剂未使用,当天试验完成后继续入库保存试剂使用记录表项目名称:研究机构/科室:主要研究者:试剂名称:使用日期批号型号规格使用数量使用人(签字)备注仪器使用记录表试验名称:研究中心:仪器名称/型号:仪器编号:序号使用日期开关机时间段仪器运行状态使用者123456789101112131415试验试剂及相关物资的回收记录表临床试验原始数据记录表日期项目名称试验试剂名称样本编盲号临床试验数据记录表日期项目名称临床试验单位临床试验操作者(签名)复核者(签名)试验仪器信息试验试剂名称试验试剂批号样本编盲号。
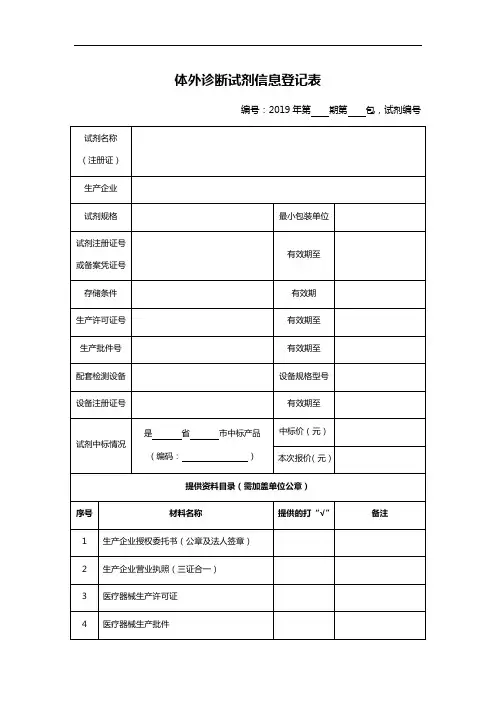

医疗器械体外诊断试剂临床试验申请表
一、临床试验项目名称:____体外诊断试剂的效果研究____
二、申请单位:____XXX医院____
三、主要研究人员情况:
姓名:______张_______
职称:________主任医师________
学历:________________
主要经历:_____________
(2)其他研究人员:
姓名:________李、王_______
职称:_____副主任医师、住院医师_____
学历:_________________
主要经历:_________________
四、试验项目概述:
本试验旨在研究实验物质的体外诊断试剂效果,以期研发出质量优良、具有市场竞争力的诊断产品。
五、试验的目的和假设:
1、研究实验物质的体外诊断试剂效果,考察实验物质体外诊断的准
确性、可靠性以及早期发现的效力;
2、通过与其他诊断技术的比较,评估实验物质体外诊断在诊断过程中的临床价值;
3、建立实验物质体外诊断的诊断标准。
六、研究方案
1.研究对象:
本研究选取XXX医院病房和急诊科住院患者共200例,拟实行观察性研究。
2.研究方式:
(1)向所有患者采集血样,选取实验物质体外诊断实验技术,计算检测结果。
(2)同时采集患者的临床资料,采集的内容包括病人的初步诊断、病史、实验室检查和影像学检查结果等。
(3)经患者及监护人知情同意后复查患者。


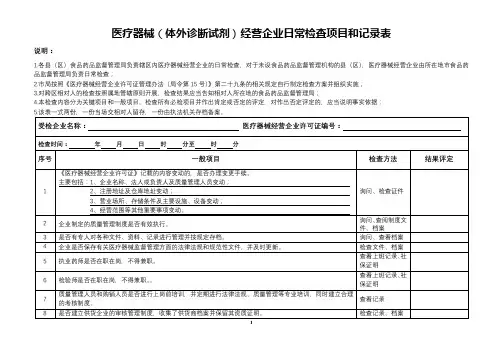
医疗器械(体外诊断试剂)经营企业日常检查项目和记录表
说明:
1.各县(区)食品药品监督管理局负责辖区内医疗器械经营企业的日常检查,对于未设食品药品监督管理机构的县(区),医疗器械经营企业由所在地市食品药品监督管理局负责日常检查;
2.市局按照《医疗器械经营企业许可证管理办法(局令第15号)》第二十九条的相关规定自行制定检查方案并组织实施;
3.对跨区相对人的检查按照属地管辖原则开展,检查结果应当告知相对人所在地的食品药品监督管理局;
4.本检查内容分为关键项目和一般项目。
检查所有必检项目并作出肯定或否定的评定,对作出否定评定的,应当说明事实依据;。