2017_2018学年高中化学专题4硫氮和可持续发展4.2.1氮氧化物的产生及转化课时作业苏教版必修1
- 格式:docx
- 大小:373.40 KB
- 文档页数:5
【2019最新】高中化学专题四硫、氮和可持续发展第二单元生产生活中的含氮化合物(第1课时)氮氧化物的产生及转化教案苏教版必修1
[教学过程]
投影练习
1.下列环境问题与二氧化氮的排放有关的是( )
A.酸雨
B. 光化学烟雾
C.臭氧空洞
D.温室效应
2.下列气体中,易溶于水的无色气体是( )
A.N2
B.NO
C.NO2
D.NH3
3. 下列气体都有毒,其使人中毒的原理与CO相似的是( )
A.Cl2
B.SO2
C.NO
D.NO2
4.当前城市空气质量恶劣的主要原因是汽车尾气的超标排放,你是否能应用氮元素的单质和化合物之间的关系,设计除去汽车尾气中的一氧化碳和氮氧化物(NO NO2)等的理论构想?其中包括:确定无害化过程及产物,选择无害化试剂及反应条件等
(1)将有害物质转化为什么物质即可完成无害化过程?
(2)应根据什么化学原理完成无害化过程?
(3)在完成无害化过程,选择试剂的原则是什么?
(4)对无害化过程反应条件的确定原则是什么?
(5)如果无害化过程反应是在充分利用汽车尾气中自有的成分并在催化剂的条件下发生化学反应而实现的,那么写出有关化学反应的方程式
板书设计:
氮氧化物的产生及转化
<一>氮氧化物的产生及转化
1.产生: N2+O2放电2NO
2.转化: 2NO+O2==2NO2
3NO2+H2O=2HNO3+NO
O2+4NO2+2H2O=4HNO3
<三>氮氧化物对人类的影响
1. 有利的:
2. 有害的:
3. 防治措施:。

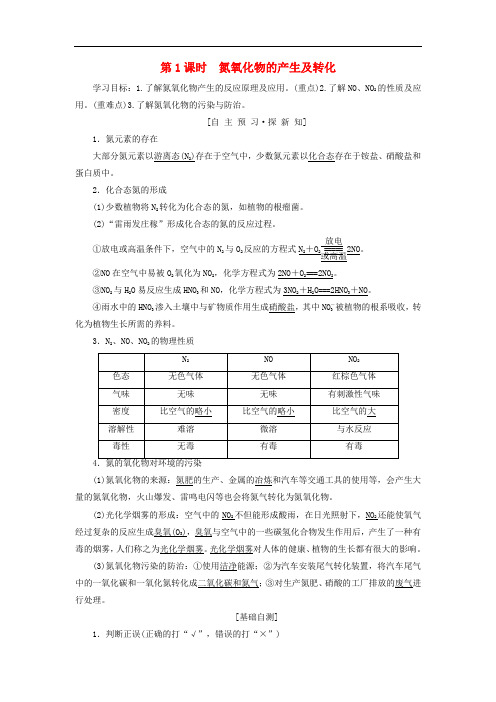
第1课时 氮氧化物的产生及转化学习目标:1.了解氮氧化物产生的反应原理及应用。
(重点)2.了解NO 、NO 2的性质及应用。
(重难点)3.了解氮氧化物的污染与防治。
[自 主 预 习·探 新 知]1.氮元素的存在大部分氮元素以游离态(N 2)存在于空气中,少数氮元素以化合态存在于铵盐、硝酸盐和蛋白质中。
2.化合态氮的形成(1)少数植物将N 2转化为化合态的氮,如植物的根瘤菌。
(2)“雷雨发庄稼”形成化合态的氮的反应过程。
①放电或高温条件下,空气中的N 2与O 2反应的方程式N 2+O 2===== 放电或高温2NO 。
②NO 在空气中易被O 2氧化为NO 2,化学方程式为2NO +O 2===2NO 2。
③NO 2与H 2O 易反应生成HNO 3和NO ,化学方程式为3NO 2+H 2O===2HNO 3+NO 。
④雨水中的HNO 3渗入土壤中与矿物质作用生成硝酸盐,其中NO -3被植物的根系吸收,转化为植物生长所需的养料。
3.N 2、NO 、NO 2的物理性质(1)氮氧化物的来源:氮肥的生产、金属的冶炼和汽车等交通工具的使用等,会产生大量的氮氧化物,火山爆发、雷鸣电闪等也会将氮气转化为氮氧化物。
(2)光化学烟雾的形成:空气中的NO 2不但能形成酸雨,在日光照射下,NO 2还能使氧气经过复杂的反应生成臭氧(O 3),臭氧与空气中的一些碳氢化合物发生作用后,产生了一种有毒的烟雾,人们称之为光化学烟雾。
光化学烟雾对人体的健康、植物的生长都有很大的影响。
(3)氮氧化物污染的防治:①使用洁净能源;②为汽车安装尾气转化装置,将汽车尾气中的一氧化碳和一氧化氮转化成二氧化碳和氮气;③对生产氮肥、硝酸的工厂排放的废气进行处理。
[基础自测]1.判断正误(正确的打“√”,错误的打“×”)(1)空气中N 2的体积分数约为78%。
( )(2)N 2在高温条件下与O 2发生反应生成NO 。
( )(3)自然界中只存在游离态的氮元素,不存在化合态的氮元素。

第二单元生产生活中的含氮化合物第1课时氮氧化物的产生及转化1.实验室收集NO、NO2两种气体( )A.均可用排水法B.均可用向上排空气法C.NO用向上排空气法,NO2用排水法D.NO用排水法,NO2用向上排空气法答案:D2.发射宇宙飞船的运载火箭的推进剂引燃后,产生的大量高温气体从尾部喷出,该气体的主要成分是CO2、H2O、N2、NO等,在发射现场可看到火箭尾部产生大量红棕色气体,其原因是( )A.高温下N2遇空气生成NO2B.NO遇空气生成NO2C.CO2与NO反应生成CO和NO2D.NO与H2O反应生成H2和NO2解析:NO遇空气生成NO2,NO2是红棕色气体。
答案:B3.下列除去杂质的方法正确的是( )A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤解析:除去N2中的少量O2:通过灼热的铜网,A项错误;除去CO2中的少量HCl:通入饱和NaHCO3溶液,B 项错误;除去KCl溶液中的少量MgCl2:加入适量KOH溶液,D项错误。
答案:C4.最新研究表明:NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。
病毒学研究同时证实,NO对SARS病毒有直接抑制作用。
下列关于NO的叙述正确的是( )A.NO是一种红棕色的气体B.含等质量的氧元素的NO和CO的物质的量相等C.常温常压下,NO不能与空气中的O2直接化合D.NO易溶于水,不能用排水法收集答案:B5.下列氧化物中,不属于酸性氧化物的是( )A.CO2B.NO2C.SiO2D.SO2解析:NO2不属于酸性氧化物。
答案:B6.诺贝尔化学奖曾授予德国化学家Gerhard Ertl,以表彰他在固体表面化学研究过程中的重大发现。
使CO、NO x等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。


第1课时 氮氧化物的产生及转化1.起固氮作用的化学反应是(双选)( )A .N 2与H 2在一定条件下反应生成NH 3B .硝酸工厂用NH 3氧化制NOC .雷雨时空气中的N 2转化为NOD .由NH 3制碳酸氢铵和硫酸铵解析:选AC 。
固氮作用是指将N 2转化成含氮的化合物,而用NH 3作原料,不属于固氮的范围。
2.不属于大气污染物的是( )A .N 2B .NOC .NO 2D .SO 2解析:选A 。
NO 、NO 2和SO 2都是大气污染物。
3.下列关于NO 的说法错误的是( )A .NO 是具有刺激性气味的红棕色气体B .NO 是汽车尾气的有害成分之一C .NO 在人体的血管系统内具有传送信号的功能D .NO 能够与人体血红蛋白结合,造成人体缺氧中毒解析:选A 。
NO 无色无味。
4.将5 mL NO 和15 mL NO 2的混合气体,通入倒置于水槽中的充满水的试管中,最后在试管中能收集的气体体积是( )A .20 mLB .15 mLC .10 mLD .5 mL解析:选C 。
V (剩余)=V (NO)原+13V (NO 2)=10 mL 。
5.如图所示,室温下向盛有3.0 mL NO 的试管中缓缓通入1.5 mL O 2(所有气体体积均在标准状况下测定)。
试回答下列问题:(1)写出观察到的现象:①________________________________________________________________________; ②________________________________________________________________________; ③________________________________________________________________________。
(2)最终试管中剩余的气体是____________,体积为______________。
专题4 硫、氮和可持续发展 4.2.1 氮氧化物的产生及转化 [对点训练]
知识点1 N2、NO、NO2的主要性质
1.下列叙述中正确的是( )
A.N2既可以和O2反应,又可以和H2反应,因此N2的化学性质很活泼
B.在NO2和H2O的反应中,NO2是还原剂,H2O是氧化剂
C.雷雨时,发生氮的固定变化可增加土壤中硝酸盐类氮肥的含量
D.NO可用向上排空气法收集
【解析】在通常情况下,N2的化学性质不活泼;在3NO2+H2O===2HNO3+NO反应中,NO2既是还原剂又是氧化剂;NO用排水法收集。
【答案】 C
2.下列关于实验室收集NO和NO2气体的方法中,正确的是( )
A.都是排水法
B.都用向上排空气法
C.NO用向上排空气法,NO2用排水法
D.NO用排水法,NO2用向上排空气法
【解析】NO易与O2反应,所以NO不能用排空气法收集,只能用排水法;NO2可与H2O 反应,所以不能用排水法收集,只能用向上排空气法。
【答案】 D
3.据估计,高空大气中的O2吸收紫外线可生成臭氧,臭氧可分解:O3O2+O。
臭氧与大气污染物之一的NO发生反应:NO+O3NO2+O2,NO2+O===NO+O2,纵观这些反应可以看出NO是作( )
A.氧化剂 B.还原剂
C.催化剂 D.干燥剂
【解析】分析题给两个反应,发现NO在反应前后不变,所以NO是催化剂。
【答案】 C
4.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。
下列关于NO说法错误的是( )
A.NO是具有刺激性的红棕色气体
B.NO是汽车尾气的有害成分之一
C.NO在人体的血管系统内具有传送信号的功能
D.NO能够与人体血红蛋白结合,造成人体缺氧中毒
【解析】NO在生物体内许多组织中存在,它有扩张血管、提高免疫、增强记忆的功能,而成为当前生命科学的研究热点,被称为“明星分子”。
NO为无色气体,NO2才是红棕色气体。
【答案】 A
5.在NO2被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的质量比为( )
A.3:1 B.1:3
C.1:2 D.2:1
【解析】3NO2+H2O===2HNO3+NO,3 mol NO2中,有2 mol氮的价态升高,1 mol氮的价态降低,所以发生还原反应的NO2与发生氧化反应的NO2的物质的质量比为1:2。
【答案】 C
6.发射宇宙飞船的运载火箭的推进剂引燃后,产生大量的高温气体从尾部喷出,该气体的主要成分是CO2、H2O、N2、NO等,在发射现场可看到火箭尾部产生大量红色气体,其原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO与H2O反应生成H2和NO2
【答案】 (1)①N 2+3H 22NH N 2=====点燃Mg 3N
试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,
面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体
.下列关于自然界中氮循环(如图所示)的说法不正确的是( )
.氮元素均被氧化
.工业合成氨属于人工固氮
.含氮无机物和含氮有机物可相互转化
.碳、氢、氧三种元素也参与了氮循环
人工固氮中氮气转化为氨气,是N2转化为NH3的过程,N
必须在催化剂表面才能反应
.汽车尾气的主要污染成分包括CO2和NO
CO和NO
是该过程的中间产物;NO和O的反应不需要催化剂;汽车尾气的主要污
________________________________________________________________________
的试管倒扣于水槽中,然后向试管中通入一定量的
气体的体积比为________
为标准状况,则所得的溶液的物质的量浓度应为________
,生成的溶质。