
第三章水溶液中的离子平衡
第一节弱电解质的电离
第二节水的电离和溶液的酸碱性
第三节盐类的水解平衡
第四节难溶电解质的溶解平衡
第二章化学反应速率和化学平衡 第四节化学反应进行的方向【思维导图】 【微试题】 1.(2010·杭州第一次质量检测)下列说法中正确的是() A.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应 C.熵增加且放热的反应一定是自发反应 D.非自发反应在任何条件下都不能发生
【答案】C 2.对于反应:4Fe(O H)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)ΔH=-kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对该反应的方向起决定作用的是( ) A.焓变B.温度C.压强D.熵变 【答案】A
3.高温下,某反应达平衡,平衡常数K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)],恒容时,温度升高,H2浓度减小,下列说法正确的是(? ?)? A.该反应的焓变为正值? B.恒温恒容下,增大压强,H2浓度一定减小 C.升高温度,逆反应速率减小? D.该反应的化学方程式为CO+H2O CO2+H2 【答案】A
4.(2012·海南高考·15) 已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下: 温度/ ℃700 800 830 1000 1200 平衡常数 回答下列问题: (1)该反应的平衡常数表达式K= ,△H 0(填“<”“>”“=”); (2)830℃时,向一个5 L的密闭容器中充入0.20m ol的A和的B,如反应初始6s内A的平均反应速率υ(A)= mol·L-1·s-1。,则6s时c(A)= mol·L-1,C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为; (3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变 b.气体的密度不随时间改变 c.c(A)不随时间改变d.单位时间里生成C和D的物质的量相等 (4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为。
七年级下册语文单元评价思维导图及评价量规第四单元人教版作者姓名学科语文年级七年级 主题单元名称文化艺术(七下第四单元) 单元评价方案的思维导图
“寻觅家乡艺术美”研究性学习评价量规 评价指标 (权重) 好一般需要改进自评生评师评 (评价指标1) 积极参与小组调查活动 (10分)小组各成员分 工非常具体,任 务非常明确,调 查表设计合理, 抓住重点,能在 规定时间内完 成调查任务。 小组各成员分 工较具体,学生 任务较明确,调 查表重点不突 出,在规定时间 内基本完成调 查任务。 小组各成员分 工含糊,调查表 填写内容混乱, 不能在规定时 间内完成调查 任务。 (评价指标2) 搜集家乡艺术资料详实、丰富 (10分)搜集家乡艺术 内容丰富,并能 介绍和展示,接 受师生的询问。 搜集家乡艺术 资料较多,但不 很熟悉艺术的 具体内容。 搜集资料少,且 和他人雷同。 (评价指标3) 能积极主动展示、交流学习成 果 (20分)展示材料准备 充分,介绍有中 心,有条理,语 言清晰,自然大 方,表情手势和 内容配合好。 展示材料准备 比较充分,介绍 有中心,有条 理,语言清晰, 不够自然大方。 展示材料准备 比较充分,介绍 语言不够清晰 和条理。 (评价指标4) 作文中能用多种修辞手法描述家乡艺术美 (40分)作文情感真挚, 内容充实,选材 典型,层次清 楚,构思新颖, 细节刻画细腻 生动,修辞手法 运用巧妙,详略 得当。 作文情感比较 真挚,选材较典 型,层次比较清 楚,注重细节刻 画,修辞手法较 灵活。 作文内容空洞, 情感不够真挚, 表达方式、修辞 手法比较单一。 (评价指标5) 张贴展示自己的作品 (20分)能在“家乡文化 艺术苑”展板上 张贴小组的优 秀图片、优秀作 文、活动总结, 数量多。获得优 胜团队。 能在“家乡文化 艺术苑”展板上 张贴小组的优 秀图片、优秀作 文、活动总结, 数量较少。 不能在“家乡文 化艺术苑”展板 上张贴小组的 优秀图片、优秀 作文、活动总 结,或者张贴数 量最少。
(人教版)化学选修四思维导图:2-3化学平衡(含答案) https://www.doczj.com/doc/fe12996027.html,work Information Technology Company.2020YEAR
第二章化学反应速率和化学平衡 第三节化学平衡 【思维导图】 【微试题】 2
1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0 反应达到平衡后,为提高CO的转化率,下列措施中正确的是( ) A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂 【答案】 B 2.向绝热恒容密闭容器中通入SO 2和NO 2 ,在一定条件下使反应SO 2 (g)+NO 2 (g)SO 3 (g)+NO(g)达到平衡,正反应速率随时间变化的示意图如 下所示。由图可得出的正确结论是() A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点 3
C.反应物的总能量低于生成物的总能量 D.△t 1=△t 2 时,SO 2 的转化率:a~b段小于b~c段 【答案】 D 3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[: A.平衡前,随着反应的进行,容器内压强始终不变 B.平衡时,其他条件不变,分离出硫,正反应速率加快 C.平衡时,其他条件不变,升高温度可提高SO2的转化率 D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 【答案】D 4
高中知识思维导图 高中化学知识模块 概念与理论化学物质 化学实验 化学计算化化化化化化化化化 化化化化化化化 化化化化化 化化化化化 化化化化 化化化化 化化化化化化化 化化化化化 化化化化化化化化 化化化化化化化 化化化化化化 化化化化化化化化 化化化化化化化 化化化化化化化化化 化化化化化 化化化化化化化化 化化化化化化化化 化化化化化 化化化化化化化化化 一、基本概念与基本理论?物质的分类 物质的分类 混合物 纯净物 单质 化合物 金属单质 非金属单质 稀有气体 同素异形体 无机化合物 有机化合物 ←分子种类不同→ ←分子中原子种类不同,左为同种原子,右为不同中原子→
1、 化学变化类型 化学变化 类型 无机反应 有机反应 化学变化的基本类型(形式) 按有无电子转移划分(本质) 其他 化合反应 分解反应 置换反应 复分解反应 氧化还原反 应 非氧化还原反应 从参加反应的微粒划分 从是否可逆划分 从热效应划分 分子反应 原子反应 可逆反应 不可逆反应 放热反应 吸热反应 一、基本概念与基本理论?化学变化
一、基本概念与基本理论?物质结构
一、基本概念与基本理论?元素周期律核 外电子排布的周期性 元 素 性 质 的 布 周 期 性 元 素 周 期 律 元 素 周 期 表 横:周期 n=1 n=2 n=3 n=4 n=5 n=6 n=7 元素种类: 2 8 8 18 18 32 26 短周期 长周期 不完全周期 主族:ⅠA~ⅦA 副族:ⅢB~ⅦB、 ⅠB~ⅡB Ⅷ族 0族 纵:族 决定归纳编制表的结构 元素性质 原子结构 实质 周期表位置
文件编号: E3-08-4E-E4-C7
高中化 学基础 知识网 络图
第 1 页 共 11 页
A4 打印 / 可编辑
文件编号: E3-08-4E-E4-C7
高中化学基础知识网络图
第一部分:物质的组成、分类、性质和变化
物质:元素
游离态 单 质
分子
分子晶体
※表示原子或元素的化学用语:元素符号、
化合物 化合态
原子
原子晶体 离子符号、电子式、原子结构示意图;
离子
离子晶体
相对原子质量、相对分子质量
构成物质的微粒
纯净物
分类 混合物
单质:金属 、非金属 、稀有气体
氢化物:非金属氢化物、金属氢化物
化合 物
无机 物
氧化物:酸性氧化物、碱性氧化物、两性
氧化物、不成盐氧化物、过氧化物 酸:无氧酸 、含氧酸 、强酸 、弱酸
有机 物
碱:强碱 、弱碱 盐:正盐 、酸式盐 、碱式盐 、复盐 、络盐
※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等
物质
性质
物理性质:色、态、熔点、密度、溶解性等 化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性
物理变化
变化
基本反应类型:化合、分解、置换、复分解
电子转移:氧化还原、非氧化还原
物理变化
离子参加:离子反应、非离子反应 反应程度:可逆、不可逆
热效应:放热、吸热
※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式
计量 分散系
物质的量 (mol)
阿伏加德罗常数:N =N/n
A
摩尔质量:M=m/n
气体摩尔体积:V =22.4 n(标准状况)
溶液的浓度:C=n/V
浊液:悬浊液、乳浊液 胶体:分散质微粒直径 10-9~10-7m
溶液:溶解平衡、溶解度
第 2 页 共 11 页
2020-2-26 9:09:5 【老师】俸? KH 高中化経套思“.版).pdf (18.11MB ) 髙中化学全套思谁导图(高清版),pdf} 来目群文件 打开打开文骸 转发三1 【老师】俸 自己没有思维导图的可以借鉴。
1 /43 高中化学 第一章 从实验学化学 第一节化学实验基础知识 取用固体 取用液体 防火与灭火 常见危险与安全措施 了解实验安全常识及意外事故处理方法 学法指导 操作的先后顺序 操作的注意事项 操作的目的 适用范围 化学与人类健康 不溶性固体与液体的分萬 实验安全 化学与环境保护 分离溶于溶液中的固体溶质 适用范围 1 .蒸发过程不断搅拌 I 注意事项 蒸发 是否易潮解. 物质的提纯是将混合物中的少 量杂质除去而得到纯净物质 将物质的分 萬与提纯混淆 吸取少量液体用滴管 (专用,垂直悬滴,不倒置) 实验基 本操作 物质分离提 纯必须遵循 注意防火、防爆炸、防倒吸 不増、不减、易分离、易复原 2.当大量固体析岀时,停止加热,余热蒸干 知识 梳理 化学实解 通过动手实验,熟练掌握常用化学 仪器的使用方法和操作注意事项 较多液体用倾倒法 (瓶塞倒 放,标签向手心, 抓住物质的特性寻找突破口 物质检验和实验综合题 块状固体用锻子 粉末状用药匙 中及故 取用药 品的仪器 的意的 热覗 分离 仪器 热源,温度可达400 - 500 r 酒劈/龜精不超过2/3,不少于1/4,用外 / 5,不对 火,不吹灯,先灭后添酒精 喷灯温度可达I 000 X ) 水浴 漏斗 loop 以下 普通漏斗 长颈漏斗 分液 漏斗 主要 用途 萃取,分液, 反应加液体 用器 常仪 冷凝管 洗气瓶 于燥管 注意 事项 用前先检査是否漏液, 分液时上层液体从上口 倒岀,下层液体从下层 放出,放液时应打开分 液漏斗上玻璃塞或将塞 上的凹槽对准上口小孔。 使漏斗内外大气压相等 反应器1 是否易被氧化 是否易燃、易爆 是否易与空 W 中某些成分作用 是 否易挥发、,1 尹华 是否具有毒性、 腐蚀度 便于取用 防止变质 防独、防爆等 细口瓶、产口瓶、 通瓶 塑料瓶、赢r 笑是器等 剂质 试性 则 原 仪器 据 依 学 剂保 化试的存 密封:水封、 油封、蜡封 方式/开放式存放 阴凉、避光处 ( 干燥器中存放 利用沸点不同,除去难挥发和不挥发的杂质适用范围 1.蒸憎烧瓶加热要垫石棉网,温度 、 计的水银球与支管口下缘位于同一水平线 注意事项 2.冷水是下口进,上口出 3.要加碎瓷片,防暴沸 在互不相溶的溶剂里溶解度差别较大的溶质适用范围 1 .溶液总量不超过漏斗容积的3/4 2.把分液漏斗放在铁架台上静置、分层 注意事项 蒸饌 分液 3.打开塞子,先从下口放出下层 液体,再从上口倒出上层液体 其他基本 操作 计量仪器 玻璃仪器的洗涤 药品的取用 药品的保存 装置气密性检验 溶液的配勉 气体的收集和体积的测量 量筒 试管、柑垠、 f 隔网可加热或液浴 烧杯、烧瓶、 蒸憎烧瓶、锥形瓶 乂_不能加热 集气瓶、试剂瓶、滴瓶、 启普发生器 主要用途 粗略量取液体,精度0.1 mL 刻度由下而上增大,无0刻度线, 读数平视。取用原则:次数越少 越好,量筒越小越好,不反应, 不溶解,不受热,不配制 飞芝S 事项 主要用途 精确至0.1 mL,可估读到0.01 mL 滴定管 托盘天平 酸式滴定管盛酸性、氧化性溶液,碱式滴定 管盛碱性、非氧化性溶液,二者不能互代; 注意使用前要洗净并检查是否漏液,先润洗再装 事M ——亠宀 溶液;0刻度在上方,但不在管最上端,最大 刻度不在管最下端 容量瓶 精确配制溶液 标有温度、容积,用前检漏, 注意 不反应、不加热、不换塞、 事项不贮存、不溶解 温度计量程 使用注意事项《备銀球不要羸器壁 使用注 意事项 称前调零点,称时“左物右码” 品不能直接放在托盘上,易潮解、 \腐 蚀性药品放在玻璃器皿中秘量—
第四章细菌和真菌 第一节细菌和真菌的分布 1、菌落:一个细菌或真菌繁殖后形成的肉眼可见的集合体称为菌落。馒头上长出的一个个 菌斑就是霉菌的菌落。 大小形态颜色 小表面或粗糙干燥或光滑粘稠白色或黄色 # 细菌 真菌大绒毛状、絮状、蜘蛛网状红、褐、绿、黑、黄等 、 3、培养细菌和真菌的方法:配制培养基→高温灭菌、冷却→接种→恒温培养。 高温灭菌的目的是:杀死培养皿和培养基内原有的杂菌。 接种前冷却的目的是:以免高温杀死要接种的菌。 4、细菌真菌生存的基本条件是:适宜的温度、一定的水分、充足的有机物。有的细菌并 不需要氧,这样的菌叫做厌氧型细菌(如乳酸菌、破伤风杆菌)。有的细菌则需要有第二节细菌 1、发现细菌的是列文虎克。“微生物学之父”是巴斯德,他通过“鹅颈瓶实验”证实了“细 菌不是自然发生的,而是由原来空气中已经存在的细菌产生的”。他还发现了乳酸菌、酵母菌,发明了巴氏消毒法和防止手术感染的方法。 2 (1)大小:个体十分小,必须用高倍显微镜或者电子显微镜观察。 · (2)根据形态分为:球菌、杆菌、螺旋菌。细菌都是单细胞的。一个细菌就是一个细胞。(3细菌的基本结构:有细胞壁、细胞膜、细胞质、DNA。特殊结构:鞭毛(运动)和荚膜(保护)。 (4细菌与动植物细胞的主要区别是:细菌虽有DNA集中的区域,却没有成形的细胞核。 这样的生物是原核生物。 (5)细菌的营养方式:细菌体内没有叶绿体,只能利用现成的有机物,大多数是异养。(6)细菌的生殖:细菌的生殖方式为分裂生殖。 (7)细菌分布广泛的原因:①分裂生殖②利用芽孢度过不良时期③个体微小易扩散。(8)有些细菌在生长发育后期形成芽孢,芽孢是细菌的休眠体,对不良环境有较强的抵抗能力。细菌没有叶绿体,大多只能利用现成的有机物生活,是生态系统中的分解者。 3、常见真菌:多细胞真菌:大型真菌(蘑菇)、霉菌(青霉);单细胞真菌:酵母菌。 : 4、真菌共同特点有:①每个细胞都有细胞壁、细胞膜、细胞质和真正的细胞核,因此是真 核生物。②与植物细胞相比没有叶绿体,因而真菌的营养方式为异养。③真菌的生殖方式为孢子生殖。多细胞真菌由菌丝构成。 5、青霉孢子是青绿色,着生在直立菌丝上,呈扫帚状。
第二章化学反应速率和化学平衡 第三节化学平衡 【思维导图】 【微试题】 1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0 反应达到平衡后,为提高CO的转化率,下列措施中正确的是( ) A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂 【答案】B 2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是() A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点 C.反应物的总能量低于生成物的总能量 D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 【答案】D 3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[: A.平衡前,随着反应的进行,容器内压强始终不变 B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率 D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 【答案】D 4.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应: 2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1?H < 0 (I) 2NO(g)+Cl2(g)2ClNO(g) K2?H < 0 (II) (1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。 (2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入 NO和 Cl2,10min时反应(II)达到平衡。测得10min内(ClNO)=×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2а1(填“>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是。 【答案】(1) 2 1 2 K K (2)×10-2;75%;>;不变;升高温度 【解析】(1)方程式(I)×2 (II)即可得到:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),所以平衡常数K= 2 1 2 K K ; (2)ClNO的浓度变化△c(ClNO)=×10-2mol?L,所以ClNO的物质的量变化△n(ClNO)=,所以Cl2的物质的量变化率△n(Cl2)=,则平衡后n(Cl2)=;转化的n(NO)=,则NO的转化率а1==75%;其他条件保持不变,反应(II)在恒压条件下进行,则反应(II)的压强大于反应(I)的压强,则平衡有利于向正方向移动,所以平衡时NO的转化率а2>а1;因为温度不变,所以化学平衡常数不变;因为反应(II)的?H < 0,为放热反应,所以要减小化学平衡常数,就要使平衡向逆方向移动,可以采取加热的方法;
第一章化学反应与能量 第一节化学反应与能量变化 【思维导图】 【微试题】 1.(12全国卷I)已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( ) A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l) △H = 2b KJ/mol C.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = -2b KJ/mol D.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = b KJ/mol 【答案】C 2.(2019年全国理综试题)已知(1)H2(g)+1/2O2(g) = H2O(g) △H1= a kJ·mol-1 (2)2H2(g)+O2(g) = 2H2O(g) △H2= b kJ· mol-1 (3)H2(g)+ 1/2O2(g) = H2O(l) △H3= c kJ· mol-1 (4)2H2(g)+O2(g) = 2H2O(l) △H4= d kJ· mol-1 下列关系式中正确的是( ) A.a<b<c<0 B.b>d>0 C.2a=b<0 D.2c= d>0 【答案】C
3.(2018·大纲全国理综,9)反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是() 【答案】D
4.实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据: 实验次数起始温度t1/℃终止温度t2/℃ 盐酸NaOH溶液 1 20. 2 20. 3 23.7 2 20. 3 20.5 23.8 3 21.5 21.6 24.9 试完成下列问题:
人教版化学选修四思维导图化学反应进行的方 向含答案 集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]
第二章化学反应速率和化学平衡 第四节化学反应进行的方向 【思维导图】 【微试题】 1.(2010·杭州第一次质量检测)下列说法中正确的是( ) A.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应 C.熵增加且放热的反应一定是自发反应 D.非自发反应在任何条件下都不能发生 【答案】C 2.对于反应:4Fe(O H) 2(s)+2H 2 O(l)+O 2 (g)===4Fe(OH) 3 (s) ΔH=-444.3kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对该反应的 方向起决定作用的是() A.焓变B.温度C.压强D.熵变 【答案】A 3.高温下,某反应达平衡,平衡常数K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)],恒容时,温度升高,H2浓度减小,下列说法正确的是(??)? A.该反应的焓变为正值? B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小? D.该反应的化学方程式为CO+H2O CO2+H2 【答案】A 4.(2012·海南高考·15)已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下: 温度/℃70080083010001200 平衡常数 1.7 1.1 1.00.60.4 回答下列问题: (1)该反应的平衡常数表达式K=,△H0(填“<”“>”“=”); (2)830℃时,向一个5 L的密闭容器中充入0.20m ol的A和0.80mol的B,如反应初始6s内A的平均反应速率υ(A)=0.003mol·L-1·s-1。,则6s时c(A)=mol·L-1,C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为; (3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变b.气体的密度不随时间改变 c.c(A)不随时间改变d.单位时间里生成C和D的物质的量相等 (4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为。 【答案】(1) (C)(D) (A)(B) ? ? c c c c<(2)0.0220.0980%80% (3)c(4)2.5
第四章电化学基础 第四节金属的电化学腐蚀与防护【思维导图】 【微试题】 1.关于下列各装置图的叙述中,不正确的是()
①②③④ A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ C.装置③中钢闸门应与外接电源的负极相连 D.装置④中的铁钉几乎没被腐蚀 【答案】B 2.下列说法正确的是() A. 金属腐蚀就是金属原子失去电子被还原的过程 B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e- = 4OH-
C.镀锌铁皮的镀层损坏后,铁更容易腐蚀 D.氯碱工业中,阳极发生的反应为:2Cl--2e-=C12↑ 【答案】D 3.(2012·海南高考·10)下列叙述错误的是( ) A.生铁中含有碳,抗腐蚀能力比纯铁弱B.用锡焊接的铁质器件,焊接处易生锈C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液D.铁管上镶嵌锌块,铁管不易被腐蚀【答案】C
4.(2014山东卷理综30.(16分))离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。(1)钢制品应接电源的极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为。若改用AlCl3水溶液作电解液,则阴极产物为。 (2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为mol。 (3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有。 a.KCl b. KClO3 c. MnO2 d. Mg 取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是(用离子方程式说明)。 【答案】(1)负 4Al2Cl7—+3e-=Al+7AlCl4— H2 (2)3
第三单元复习 一、字词部分 妥帖贴补惊慌说谎一贯习惯贪婪贫穷机械戒心推敲礼貌 多音字:济济南接济蒙蒙骗蒙蒙亮 二、《成语故事》 1 《成语故事》分别讲了_《自相矛盾》__、_《滥竽充数》_、_《画龙点睛》_。 “自相矛盾”比喻一个人的言语或行为前后抵触,告诉我们说话做事要前后一致。 举例:.“今年过节不收礼……收礼只收脑白金” “滥竽充数”比喻没有真才实学的混在行家里面充数,或比喻拿不好的东西混在好的里面充数。告诉我们要有真才实学才能立身处世。 举例: “画龙点睛”比喻作文或说话时在关键地方加上精辟语句,使内容更加生动传神。 2、来自寓言故事的成语:守株待兔狐假虎威拔苗助长杯弓蛇影 来自历史故事的成语:望梅止渴背水一战四面楚歌纸上谈兵 来自神话故事的成语:大闹天宫火眼金睛精卫填海开天辟地 3、总是……她大大咧咧的,做事总是不能让人放心。 不要……而要……我们不要过分地依赖父母,而要学会独立。 三、《推敲》 1、《推敲》贾岛的《题李凝幽居》中诗句“鸟宿池边树,僧敲月下门”的“敲”原先是“推”,因此,后人把在写诗和作文时斟酌文字叫做“推敲”。 2、你认为用“推”,还是用“敲”好?请说明理由:(1)月夜访友,即使友人家门没有闩,也不能莽撞推门,敲门表明你是一个懂得礼貌的人。(2)用“敲”更能衬托出月夜的宁静,读起来也响亮些。 3、本课讲的是唐朝著名诗人贾岛(“苦吟诗人”)与韩愈一起斟酌诗句中用词的故事,表现了贾岛认真严肃的创作态度和锲而不舍的钻研精神。 4、课后习题4推敲练习 (1)“访问”与“拜访”。“访问”是有目的地去探望人并跟他谈话。“拜访”也是访问,但对被访者包含了敬意,是礼节性的访问。文中用“拜访”,说明贾岛对朋友充满敬意,并非一般性的“访问”。(2)“即时”与“即兴”。“即时”是立即的意思。“即兴”是对眼前情景有所感触,临时发生兴致而创作。文中用“即兴”是说贾岛的《题李凝幽居》一诗是即景生情,有感而发的。 (3)“安静”与“宁静”。“安静”指没有声音,没有吵闹和喧哗。“宁静”指(环境、心境)很安静,表示静的程度很深。文中用“宁静”准确地描写出月夜特定环境的特点。 四、《嫦娥奔月》
七年级上册数学四单元思维导图 第一章丰富的图形世界? ? ? ?棱柱:n棱柱有__个顶点,__条棱,__个面? ? ?柱体? ? ? ?圆柱? ?生活中的立体图形?几何体? ? ?锥体?棱锥:n棱锥有__个顶点,__条棱,__个面? ? ? ? ? ?圆锥:? ? ? ?构成:点动成__,线动成__,面动成__ ? ? ? ? ? ? ? ?平面展开图? ? ? ? ?正方体展开与折叠? ? 丰? ?对立面? ? 富? ? 的? ? ? ? 图? ? 形? ?正方体______________________________ ? ? 世? ? 界? ?圆柱_______________________________ ? ? ?截一个几何体? ? ?圆锥_________________________________ ? ? ? ? ? ? ?圆_________________________________ ? ? ? ? ?主视图? ? ? ? ? ? ?左视图?从三个方向看? ? ? ? ?俯视图? ? ? ? ? ?
? ? ? ? ? 第二章有理数? ? ? ? ? __________ ? ?按定义分? ? ? __________ ? ? ? ?分类? ? _________ ? ?按性质符号分? _________ ? ? ? ? _________ ? ? ? ? ? ? __________________ ?数轴:三要素:? ? _______________________ ?几何意义:? ? ? ? ? ?代数意义:____________________,叫做互为相反数。 ? ?相反数——? ? ? ?字母表示:a的相反数是____,a+b 的相反数是____ ? ? ?性质:若a,b互为相反数,则_____________. ? ? ? ? ? ?几何意义:___________________________ ? ? ? ? ? ? ____ ,a ? 0 ? ? ?绝对值—— ?代数意义:a= ? ? ? ____,a ? 0 ? ? ? ? ? ? ? ?性质:非负性a ____ 0 理数?相关概念? ? ? ? ? ? ?倒数——乘积是1的两个数互为倒数. ? ? 正数的倒数是___,负数的倒数是___,0的倒数是_____. ? ? ? ? ? ? ? ?乘方——_____________________叫做乘方,乘方的结果叫做____ ? ? 相同的因数叫做_____,_________________叫做指数? ? ? ? ? ? 把一个数表示成_______的形式(其中1 ? a ? 10,? ?科学记数法—— n是正整数),这种记数方法叫做科学记数法? ? ? ? ?有理数的加法法则? ? ? 有理数的减法法则? ? ? 运算法则?有理数的乘法法则? ?有理数的除法法则? ? ? ? ? ?乘方的运算符号法则? ? ? ? ? ? ? ? ?
(人教版)化学选修四思维导图:4-1原电池 (含答案) https://www.doczj.com/doc/fe12996027.html,work Information Technology Company.2020YEAR
第四章电化学基础 第一节原电池 【思维导图】 【微试题】 1.(2012全国大纲卷)①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是() 2
A.①③②④ B.①③④② C.③④②① D.③①②④ 【答案】 B A.检测时,电解质溶液中的H+向负极移动 B.若有0.4mol电子转移,则在标准状况下消耗 4.48L氧气 C.电池反应的化学方程式为:CH3CH2OH+O2 = CH3COOH+ H2O D.正极上发生的反应为:O2+ 4e–+2H2O=4OH– 【答案】C 3
3.(2011全国新课标)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是() A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 C.电池充电过程中,阴极附近溶液的pH降低 D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O 【答案】C 4
4. (2015山东理综卷29、(15分))利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。 5
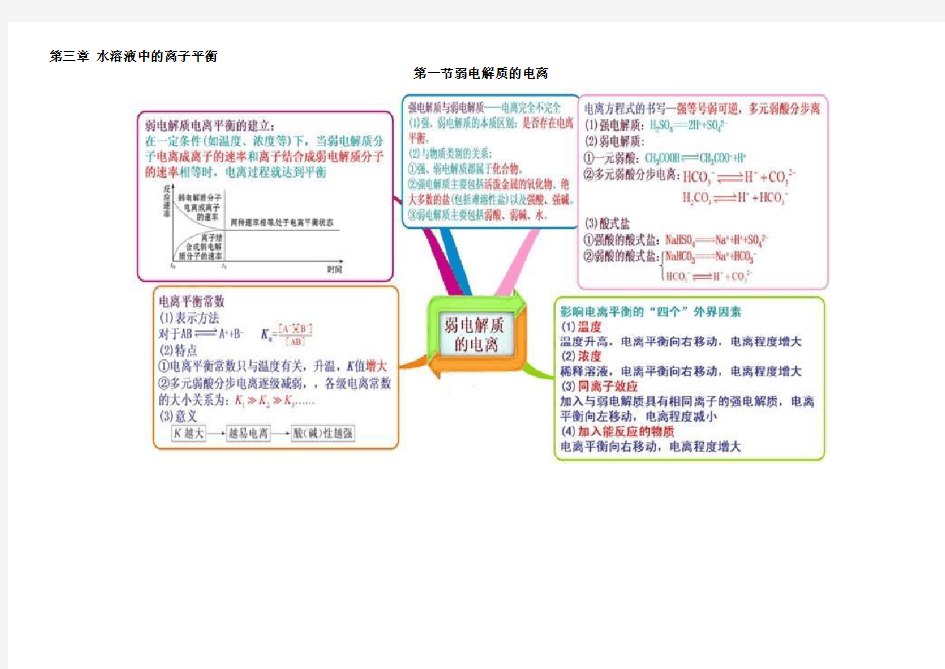
第三章水溶液中的离子平衡 第一节弱电解质的电离【思维导图】 【微试题】 1.(2011·福建高考)常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液的pH=(a+1)的措施是( ) A.将溶液稀释到原体积的10倍 B.加入适量的醋酸钠固体 C.加入等体积0.2 mol·L-1盐酸 D.提高溶液的温度 【答案】B
2.(2012·淮北模拟)醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验研究”的探究活动。他设计了如下方案,其中错误的是( ) A.先配制一定量的0.10 mol·L-1的CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 B.先配制一定量的0.01 mol·L-1和0.10 mol·L-1的CH3COOH溶液,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 C.先测0.10 mol·L-1 CH3COOH溶液的pH,然后将其加热至100℃,再测pH,如果pH变小,则可证明醋酸是弱电解质 D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 【答案】C
3.有①CH3COOH、②HCl、③H2SO4三种溶液,下列说法不正确的是( ) A.pH相同时,其物质的量浓度由大到小的顺序是①>②>③ B.物质的量浓度相同时,其pH由大到小的顺序是①>②>③ C.中和等量的烧碱溶液,需等物质的量浓度的①②③三种酸溶液的体积比为2∶2∶1 D.体积和物质的量浓度均相同的①②③三溶液,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为2∶1∶2 【答案】D
初二数学第四章知识点初二数学第四章思维导图 一、四边形的相关概念 1、四边形 在同一平面内,由不在同一直线上的四条线段首尾顺次相接组成的图形叫做四边形。 2、四边形具有不稳定性 3、四边形的内角和定理及外角和定理 四边形的内角和定理:四边形的内角和等于360。 四边形的外角和定理:四边形的外角和等于360。 推论:多边形的内角和定理:n边形的内角和等于180 多边形的外角和定理:任意多边形的外角和等于360。 6、设多边形的边数为n,则多边形的对角线共有条。从n边形的一个顶点出发能引(n-3)条对角线,将n边形分成(n-2)个三角形。 二、平行四边形 1、平行四边形的定义 两组对边分别平行的四边形叫做平行四边形。 2、平行四边形的性质 (1)平行四边形的对边平行且相等。 (2)平行四边形相邻的角互补,对角相等 (3)平行四边形的对角线互相平分。 (4)平行四边形是中心对称图形,对称中心是对角线的交点。 常用点:(1)若一直线过平行四边形两对角线的交点,则这条直线被一组对边截下的线段的中点是对角线的交点,并且这条直线二等分此平行四边形的面积。 (2)推论:夹在两条平行线间的平行线段相等。 3、平行四边形的判定 (1)定义:两组对边分别平行的四边形是平行四边形 (2)定理1:两组对角分别相等的四边形是平行四边形 (3)定理2:两组对边分别相等的四边形是平行四边形 (4)定理3:对角线互相平分的四边形是平行四边形 (5)定理4:一组对边平行且相等的四边形是平行四边形 4、两条平行线的距离 两条平行线中,一条直线上的任意一点到另一条直线的距离,叫做这两条平行线的距离。 平行线间的距离处处相等。 5、平行四边形的面积 S平行四边形=底边长高=ah 三、矩形 1、矩形的定义 有一个角是直角的平行四边形叫做矩形。 2、矩形的性质 (1)矩形的对边平行且相等
高中知识思维导图 1、无机化合物的分类 物质的分类 混合物 纯净物 单质 化合物 金属单质 非金属单质 稀有气体 同素异形体 无机化合物 有机化合物 ←分子种类不同→ ←分子中原子种类不同,左为同种原子,右为不同中原子→ 一、基本概念与基本理论?物质的分
2、有机化合物的分类 1、 化学变化类型 一、基本概念与基本理论?化学变化 有机化合物 烃 烃的衍生物 合成高分子 化合物 蛋白质 糖 无机化合物 氢化物 氧化物 酸 碱 盐 气态氢化物 固态氢化物 不成盐氧化物 成盐氧化物 强酸 弱酸 强碱 弱碱 正盐 酸式盐 碱式盐 复盐 金属氧化物 非金属氧化物 两性氧化物 过氧化物 复杂氧化物 氧化性酸 非氧化性酸 可溶性强碱 微可溶性强碱 可溶性弱碱 不可溶性弱碱
一、基本概念与基本理论?电解质溶 一、基本概念与基本理论?化学平衡 核外电子排布 的周期性 元素性质的布周期性 元素周期律 元素周期表 横:周期 n=1 n=2 n=3 n=4 n=5 n=6 n=7 元素种类: 2 8 8 18 18 32 26 短周期 长周期 不完全周期 主族:ⅠA~ⅦA 副族:ⅢB~ⅦB 、 ⅠB~ⅡB Ⅷ族 0族 纵:族 决定 归纳 编制 表的结构 元素性质 原子结构 实质 周期表位置 一、基本概念与基本理论?元素周期 一、基本概念与基本理论?物质结构
一、基本概念与基本理论?电解池 原电池 原理 应用 电源 蓄电池 干电池 高能电池 一、基本概念与基本理论?原电池 化合物 电解质 强电解质(完全电离)AB →A ++B - 弱电解质(部分电离) 离子反应 化学能与电能的转换:化学能垐垐垎噲 垐垐原电池电解池 电能 水的电离平衡 H 2O 垐垎噲 垐H ++OH - 电离度定义 电离平衡的移动 水的离子积 Kw=1×10-14(25℃) 溶液的酸碱性—pH=(-lg[H +]) 盐类的水解 实质 类型 规律(显性判断) 影响因素 发生条件 表示方式 常见类型 离子方程式 非氧化还原 氧化反应 复分解反应 水解反应 络合反应 置换反应 溶液中氧化还原反应 电离平衡 AB 垐垎噲垐A ++B -
第三章水溶液中的离子平衡 第四节难溶电解质的溶解平衡 【思维导图】 【微试题】 1.已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp (CaF2)=1.46×10-10。现向1 L 0.2 mol/LHF溶液中加入1 L 0.2 mol/LCaCl2溶液,则下列说法中,正确的是() A.25℃时,0.1 mol/LHF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化 C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀 【答案】D 2.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是() 提示:BaSO4(g)Ba2+(aq)+S2-4(aq)的平衡常数K sp=c (Ba2+)·c(SO2-4),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成D.a点对应的K sp大于c点对应的K sp 【答案】C 3.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积K sp(25℃)如下: 下列叙述错误的是( ) A.沉淀转化的实质就是沉淀溶解平衡的移动 B.溶解度小的沉淀可以转化为溶解度更小的沉淀 C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 【答案】C
4. (2012·海南高考)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下: I:向废液中投入过量铁屑,充分反应后分离出固体和滤液: II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。 己知:Ksp[Fe(OH)3]= 4.0×10-38 回答下列问题: (1)FeCl3蚀刻铜箔反应的离子方程式为; (2)过程I 加入铁屑的主要作用是,分离得到固体的主要成分是,从固体中分离出铜需采用的方法是; (3)过程II中发生反应的化学方程式为; (4)过程II中调节溶液的pH为5,金属离子浓度为。(列式计算) 【答案】(1)2Fe3+ + Cu == 2Fe2+ + Cu2+; (2)回收铜Cu和Fe 加入过量的盐酸后过滤 (3)FeCl2+Ca(OH)2==CaCl2+Fe(OH)2↓4Fe(OH)2+O2+2H2O===4Fe(OH)3
第二章化学反应速率和化学平衡 第一节化学反应速率 【思维导图】 【微试题】 1.(20182·上海,双选)为探究锌与稀硫酸的反应速率(以v(H2)表示)。向反应混合物中加入某些物质,下列判断正确的是() A.加入NH4HSO4固体,v(H2)不变 B.加入少量水,v(H2)减小 C.加入CH3COONa固体,v(H2)减小 D.滴加少量CuSO4溶液,v(H2)减小 【答案】BC
2.(2018海南,双选)对于可逆反应H2(g)+I2(g)2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是() A. H2(g)的消耗速率与HI(g)的生成速率之比为2:1 B. 反应进行的净速率是正、逆反应速率之差 C. 正、逆反应速率的比值是恒定的 D. 达到平衡时,正、逆反应速率相等 【答案】BD
[: 3.(2018·福建卷)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )[: A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小 C.R的起始浓度越小,降解速率越大 D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 【答案】D 4.臭氧是一种强氧化剂,常用于消毒、灭菌等。 (1)O3与KI溶液反应生成的两种单质是___________和_________。(填分子式) (2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如题表所示。已知:O3的起始浓度为0.0216 mol/L。 ①pH增大能加速O3分解,表明对O3分解起催化作用的是___________.