高中教材图解(思维导图+微试题)人教版化学选修4 4-2化学电源
- 格式:doc
- 大小:1.24 MB
- 文档页数:5


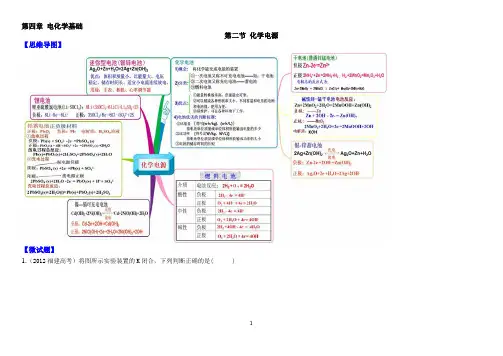

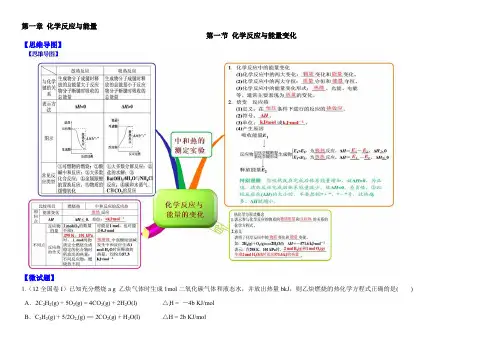
第一章化学反应与能量第一节化学反应与能量变化【思维导图】【微试题】1.(12全国卷I)已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( ) A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H = -4b KJ/molB.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l) △H = 2b KJ/molC.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = -2b KJ/molD.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = b KJ/mol【答案】C2.(2014年全国理综试题)已知(1)H2(g)+1/2O2(g) = H2O(g) △H1= a kJ·mol-1(2)2H2(g)+O2(g) = 2H2O(g) △H2= b kJ·mol-1(3)H2(g)+ 1/2O2(g) = H2O(l) △H3= c kJ·mol-1(4)2H2(g)+O2(g) = 2H2O(l) △H4= d kJ·mol-1下列关系式中正确的是( )A.a<b<c<0 B.b>d>0 C.2a=b<0 D.2c= d>0 【答案】C3. (2012·大纲全国理综,9)反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是()【答案】D4.实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:实验次数起始温度t1/℃终止温度t2/℃盐酸NaOH溶液1 20.2 20.3 23.72 20.3 20.5 23.83 21.5 21.6 24.9试完成下列问题:(1)实验时用环形玻璃棒搅拌溶液的方法是_____________________________________,不能用铜丝搅拌棒代替环形玻璃棒的理由是__________________________________。

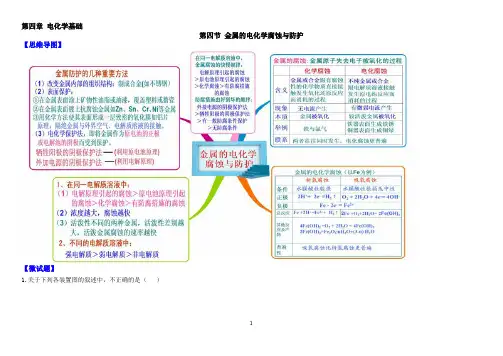
第四章电化学基础第四节金属的电化学腐蚀与防护【思维导图】【微试题】1.关于下列各装置图的叙述中,不正确的是()12① ② ③ ④ A .用装置①精炼铜,则a 极为粗铜,电解质溶液为CuSO 4溶液 B .装置②的总反应是:Cu+2Fe 3+=Cu 2++2Fe 2+C .装置③中钢闸门应与外接电源的负极相连D .装置④中的铁钉几乎没被腐蚀【答案】B2.下列说法正确的是( )A. 金属腐蚀就是金属原子失去电子被还原的过程B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e- = 4OH-C.镀锌铁皮的镀层损坏后,铁更容易腐蚀D.氯碱工业中,阳极发生的反应为:2Cl--2e-=C12↑D【答案】3.(2012·海南高考·10)下列叙述错误的是( )A.生铁中含有碳,抗腐蚀能力比纯铁弱B.用锡焊接的铁质器件,焊接处易生锈C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液D.铁管上镶嵌锌块,铁管不易被腐蚀【答案】C34.(2014山东卷理综30.(16分))离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为。
若改用AlCl3水溶液作电解液,则阴极产物为。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有。
a.KCl b. KClO3 c. MnO2 d. Mg取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是(用离子方程式说明)。
4【答案】(1)负 4Al2Cl7—+3e-=Al+7AlCl4— H2 (2)3(3) b、d 不能 Fe2O3+6H+=2Fe3++3H2O 2Fe3++ Fe=3Fe2+(或只写Fe+ 2Fe3+ =3Fe2+)【解析】(1)在钢制品上电镀铝时,即钢制品为镀件,电镀时作为阴极(与电源的负极相连);在电镀时,阴极生成Al单质,所以电极反应为4Al2Cl7—+3e-=Al+7AlCl4—;电镀时若用AlCl3作为电解液,则由水电离出的H+也能在阴极放点生成H2;(2)用NaOH溶液溶解钢制品表面的铝镀层时,发生反应的方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,该反应的还原产物是H2。



第四章电化学基础
第二节化学电源【思维导图】
【微试题】
1.(2012福建高考)将图所示实验装置的K闭合,下列判断正确的是( )
1
2
A.Cu 电极上发生还原反应
B.电子沿Zn →a →b →Cu 路径流动
C.片刻后甲池中c(SO 42-
)增大 D.片刻后可观察到滤纸b 点变红色
【答案】
A
2.碱性电池具有容量大、放电电流大的特点,故得到广泛应用。
锌锰碱性电池以KOH 溶液为电解液,电池总反应式为Zn(s)+2MnO 2(s)+H 2O(l)===Zn(OH)2(s)+Mn 2O 3(s),下列说法错误的是( )
A .电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
C
【答案】
3
4 A .在阴极式,发生的电极反应为:2H 2O +2e -=2OH -
+H 2↑ B .在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H +浓度增大,使平衡2CrO 42-+2H +Cr 2O 72-
+H 2O 向右移动
C .该制备过程总反应的化学方程式为:4K 2CrO 4+4H 2O 2K 2Cr 2O 7+4KOH +2H 2↑+O 2↑
D .测定阳极液中K 和Cr 的含量,若K 与Cr 的物质的量之比为d ,则此时铬酸钾的转化率为1-(d/2)
【答案】
D
4.(2014·海南卷)锂锰电池的体积小、性能优良,是常用的一次电池。
该电池反应原理如图所示,其中电解质LiClO 4,溶于混合有机溶剂中,
Li +通过电解质迁移入MnO 2晶格中,生成LiMnO 2。
回答下列问题:
5 (1)外电路的电流方向是由________极流向________极。
(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO 2可与KOH 和KClO 3在高温下反应,生成K 2MnO 4,反应的化学方程式为____________________________________。
K 2MnO 4在酸性溶液中歧化,生成KMnO 2和MnO 2的物质的量之比为________。
【答案】(1)b a
(2)MnO 2+e -+Li +===LiMnO 2
(3)否 电极Li 是活泼金属,能与水反应
(4)3MnO 2+KClO 3+6KOH=====高温
3K 2MnO 4+KCl +3H 2O 2∶1
【解析】 (1)该电池工作时Li 失去电子作负极、MnO 2得到电子作正极,故外电路的电流方向是由b 极流向a 极。
(2)电池正极上MnO 2得到电子,其中+4价的Mn 元素变为+3价,由此可以写出电池的正极反应式为MnO 2+e -+Li +===LiMnO 2。
(3)由于Li 易与水反应,故不能用水代替电池中的混合有机溶剂。
(4) 因锰元素价态升高,故KClO 3被还原为KCl ,故可将方程式先写成:MnO 2+KOH +KClO 3―→K 2MnO 4+KCl ,依得失电子守恒得:3MnO 2+KOH +KClO 4―→3K 2MnO 4+KCl ,再根据质量守恒知KOH 前应该配6,右侧还有“3H 2O”。
K 2MnO 4(Mn 为+6价)在酸性溶液中歧化,生成KMnO 4(锰为+7价)和MnO 2(锰为+4价)。
由氧化还原反应中得失电子守恒可知生成的KMnO 4和MnO 2的物质的量之比为2∶1。