高中教材图解(思维导图+微试题)人教版化学选修4 3-3盐类的水解
- 格式:doc
- 大小:1.23 MB
- 文档页数:4
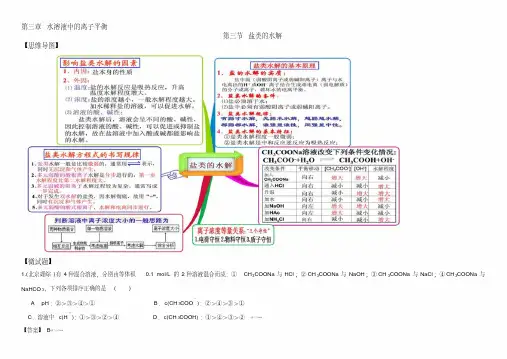
第三章水溶液中的离子平衡第三节盐类的水解【思维导图】【微试题】1.(北京理综)有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是()A.pH:②>③>④>①B.c(CH3COO-):②>④>③>①C.溶液中c(H+):①>③>②>④D.c(CH3COOH):①>④>③>②[来源学科网Z.X.X.K]【答案】B[来源:学.科.网Z.X.X.K]2.(全国卷理综)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 m ol/L的NaA和NaB混合溶液中,下列排序正确的是( )[来源:学,科,网] A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)[来源:学科网]C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)【答案】A3.(2015山东卷)室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。
下列说法正确的是()[来源:学科网]A、a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)B、a、b两点所示溶液中水的电离程度相同C、pH=7时,c(Na+)= c(A—)+ c(HA)D、b点所示溶液中c(A—)> c(HA)【答案】 D4.(2014山东卷节选29.(3))实验室可用NaOH溶液吸收NO2,反应为2NO2+2Na OH=NaNO3+NaNO2+H2O。
含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L ̄1的CH3COONa溶液,则两溶液中c(NO3 ̄)、c(NO2-)和c(CH3COO ̄)由大到小的顺序为。







思维导图高中化学
一目了然,快乐学习
全套高中化学思维导图(清晰打印版)
•
•
•
•
•
•
变化
•第二节燃烧热能源•第三节化学反应热的计算•第二章化学反应速率和
化学平衡
•第一节化学反应速率•第二节影响化学反应速率
的因素
•第三节化学平衡•第四节化学反应进行的方
向
•第三章水溶液中的离子
平衡
•第一节弱电解质的电离•第二节水的电离和溶液的
酸碱性
•第三节盐类的水解•第四节难溶电解质的溶解
平衡
•第四章电化学基础
•第一节原电池
•第二节化学电源
•第三节电解池
•第四节金属的电化学腐蚀
与防护• 2 有机化合物的结构特点• 3 有机化合物的命名• 4 研究有机化合物的一般
步骤和方法
•第二章烃和卤代烃
• 1 脂肪烃
• 2 芳香烃
• 3 卤代烃
•第三章烃的含氧衍生物
• 1 醇酚
• 2 醛
• 3 羧酸酯
• 4 有机合成
•第四章生命中的基础有
机化学物质
• 1 油脂
• 2 糖类
• 3 蛋白质和核酸•第五章进入合成有机高
分子化合物的时代
• 1 合成高分子化合物的基
本方法
• 2 应用广泛的高分子材料• 3 功能高分子材料。


第三章水溶液中的离子平衡
第三节盐类的水解
【思维导图】
【微试题】
1.(北京理综)有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是()
A.pH:②>③>④>①B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④D.c(CH3COOH):①>④>③>②
【答案】B
2.(全国卷理综)已知乙酸 (HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是( ) A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
【答案】A
3.(2015山东卷)室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。
下列说法正确的是()
A、a点所示溶液中c(Na+)>c(A—)> c(H+)>c(HA)
B、a、b两点所示溶液中水的电离程度相同
C、pH=7时,c(Na+)= c(A—)+ c(HA)
D、b点所示溶液中c(A—)> c(HA)
【答案】D
4.(2014山东卷节选29.(3))实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。
含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为。
(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
【答案】c (NO3‾) > c(NO2-) > c(CH3COO‾);b、c
【解析】根据盐类水解规律,越弱越水解,所以CH3COO‾的水解程度大于NO2-,故离子浓度大小是c(NO3‾)>c(NO2-)>c(CH3COO‾);因为CH3COO‾的水解程度大于NO2-,所以溶液A的PH小于溶液B的PH。
a.向溶液A中加适量水(使A的PH减小),b.向溶液A中加适量NaOH(使A的PH增大),c.向溶液B中加适量水(使B的PH减小),d.向溶液B中加适量NaOH (使B的PH增大),只有bc满足题意。