8038-药用聚氯乙烯(PVC)硬片检验标准操作规程
- 格式:doc
- 大小:57.00 KB
- 文档页数:4


目的:规范聚乙烯硬片检验的操作。
适用范围:聚乙烯硬片检验。
责任:化验室主任及化验人员。
内容:
1. 抽样方法
1.1 每批至少从一卷中取样检验,取样应以距离硬片外端100cm处剪取。
1.2 将以上剪下两PVC硬片作外观质量、厚度和宽度的检查。
2. 检测工具
精度0.02mm的游标卡尺、直尺(分度值0.5mm)。
3. 检验方法
3.1 外观质量:将剪下的硬片在60cm距离正视观察,样品应无色、透明平整、薄厚均匀。
不能有穿孔、气泡及异物等现象。
3.2 厚度和宽度测定:
3.2.1 用精度0.02mm的游标卡尺测定硬片的厚度应为0.25mm-0.28mm。
3.2.2 用直尺直接测量硬片的宽度应为要求规格(mm)±0.25mm。
4. 供试液的制备
用开孔面积为20cm2消毒过的金属模板压在试样的内层面上,将无菌棉签用无菌生理盐水稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置100cm2,每支棉签擦抹完毕后立即剪断(或烧断),投入
盛有100ml无菌生理盐水的三角瓶(或大试管)中,全部擦抹棉签投入瓶(试管)中后,将瓶(或试管)迅速摇晃1分钟,即得供试液。
照微生物限度检查法检查。
4.1 微生物限度检查(个/100cm2)。
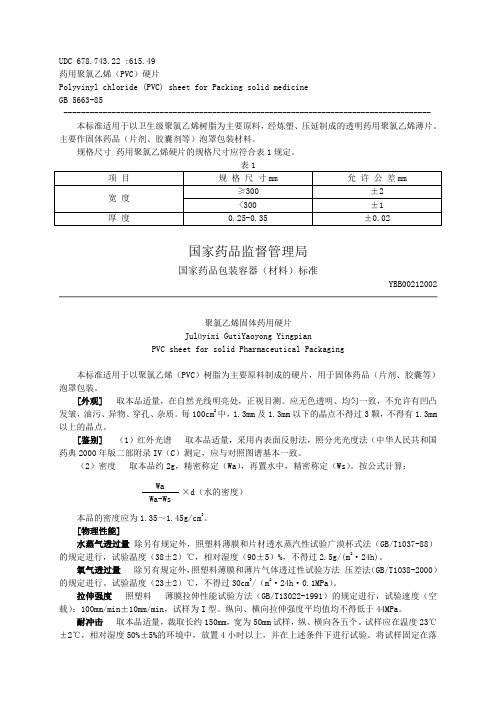
UDC 678.743.22 :615.49药用聚氯乙烯(PVC)硬片Polyvinyl chloride (PVC) sheet for Packing solid medicineGB 5663-85------------------------------------------------------------------------------------ 本标准适用于以卫生级聚氯乙烯树脂为主要原料,经炼塑、压延制成的透明药用聚氯乙烯薄片。
主要作固体药品(片剂、胶囊剂等)泡罩包装材料。
规格尺寸药用聚氯乙烯硬片的规格尺寸应符合表1规定。
表1国家药品监督管理局国家药品包装容器(材料)标准YBB00212002聚氯乙烯固体药用硬片Julüyixi GutiYaoyong YingpianPVC sheet for solid Pharmaceutical Packaging本标准适用于以聚氯乙烯(PVC)树脂为主要原料制成的硬片,用于固体药品(片剂、胶囊等)泡罩包装。
[外观]取本品适量,在自然光线明亮处,正视目测。
应无色透明、均匀一致,不允许有凹凸发皱,油污、异物、穿孔、杂质。
每100cm2中,1.3mm及1.3mm以下的晶点不得过3颗,不得有1.3mm 以上的晶点。
[鉴别](1)红外光谱取本品适量,采用内表面反射法,照分光光度法(中华人民共和国药典2000年版二部附录IV(C)测定,应与对照图谱基本一致。
(2)密度取本品约2g,精密称定(Wa),再置水中,精密称定(Ws)。
按公式计算:×d(水的密度)本品的密度应为1.35~1.45g/cm3。
[物理性能]水蒸气透过量除另有规定外,照塑料薄膜和片材透水蒸汽性试验广漠杯式法(GB/T1037-88)的规定进行,试验温度(38±2)℃,相对湿度(90±5)%,不得过2.5g/(m2·24h)。

PVC检验
第五章样品测试与品质评定5.1 样品测试项目
聚氯乙烯(PVC)交割质量指标
检测项目等级指标一等品
平均聚合度或粘数1135-981 杂质粒子数/个≤30
挥发物(包括水)质量分数/% ≤0.40 表观密度/(g/ml)≥0.45
筛余物
质量分数/% 250μm筛孔 2.0 63μm筛孔≥90
“鱼眼”数/(个/400cm2)≤40
100g树脂增塑剂吸收量/g ≥17
白度(160℃,10min)/% ≥75
残留氯乙烯单体含量/(μg/g)≤10
5.2 样品测试标准
上表测试项目中,分别参照如下检测标准进行测试:
检测项目参照标准
平均聚合度或粘数GB/T 3401-2007
杂质粒子数GB/T 9348-2008 挥发物(包括水)质量分数GB/T 2914-2008
表观密度GB/T 20022-2005 筛余物250μm筛孔GB/T 2916-2007
质量分数63μm筛孔
“鱼眼”数GB/T 4611-2008 100g树脂增塑剂吸收量GB/T 3400-2002 白度(160℃,10min)GB/T 15595-2008 残留氯乙烯单体含量GB/T 4615-2008。


聚氯乙烯标准
聚氯乙烯(PVC)是一种常见的塑料材料,被广泛应用于建筑、
医疗、包装、电子、交通等领域。
为了确保产品质量和安全性,制
定了一系列的聚氯乙烯标准,以规范生产、加工和使用过程中的各
项要求。
首先,聚氯乙烯标准涵盖了原料的选择和质量要求。
在生产聚
氯乙烯制品时,需要使用符合标准要求的原料,以确保最终产品的
质量和性能。
这些标准通常包括了原料的物理性能、化学成分、加
工工艺要求等内容,以指导生产企业在原料采购和使用过程中的各
项操作。
其次,聚氯乙烯标准还涉及了产品的加工工艺和质量控制要求。
在聚氯乙烯制品的生产过程中,需要严格按照标准规定的工艺流程
进行操作,确保产品的尺寸精度、表面光洁度、机械性能等指标符
合要求。
同时,标准还规定了产品的质量检测方法和要求,以确保
产品的质量稳定性和可靠性。
另外,聚氯乙烯标准还包括了产品的使用和维护要求。
在聚氯
乙烯制品的使用过程中,需要严格按照标准规定的条件和方法进行
安装、使用和维护,以确保产品能够发挥预期的性能和功能。
这些标准通常包括了产品的使用环境要求、安全使用方法、维护周期和方法等内容,以指导用户在实际使用过程中的各项操作。
总的来说,聚氯乙烯标准是保障聚氯乙烯制品质量和安全的重要依据,它涵盖了原料选择、加工工艺、质量控制、产品使用和维护等方面的要求,对生产企业和用户都具有重要意义。
只有严格遵守这些标准要求,才能够生产和使用高质量、安全可靠的聚氯乙烯制品,推动行业的健康发展。
1.目的:建立一个聚氯乙烯固体药用硬片检验的标准操作程序,使检验操作过程规范化。
2.范围:本标准适用于进厂聚氯乙烯固体药用硬片的检验。
3.职责:本文件由QC负责起草,质量部经理审核,质量管理负责人批准,QC负责本操作规程的实施。
4.内容:4.1引用标准聚氯乙烯固体药用硬片质量标准(编码:TS-QS-2008-00)。
4.2【规格尺寸及偏差】取聚氯乙烯固体药用硬片用精度为0.01mm的千分尺测定两边、中间等各部位的厚度,用精度为0.5mm的直尺测定其宽度,共测6处,其结果应符合要求。
若有一项不合格,则该卷为不合格。
4.3【外观质量】4.3.1外观检验:氯乙烯固体药用硬片按每卷取2m进行检验。
4.3.2取聚氯乙烯固体药用硬片检验,应符合下列要求。
4.4.1密度法:取本品2g,照密度测定法(YBB00132-2015)测定,应为1.25~1.45g/cm2。
4.5【物理性能】4.5.1水蒸气透过两取本品适量,照水蒸气透过量测定法(YBB00092003-2015)测定,不得过2.5g/(m2·24h)。
4.5.2氧气透过量取本品适量,照气体透过量测定法(YBB00082003-2015)测定,不得过30cm3/(m2·24h·0.1MPa)。
4.5.3拉伸强度取本品适量,照拉伸性能测定法(YBB00112003-2015)测定,试验速度(空载)100mm/min±10mm/min,试样为I型。
纵向、横向拉伸强度平均值不得低于44MPa。
4.5.4耐冲击取本品适量,裁取150mm*150mm试片,纵横各5片。
试样在温度23℃±2℃,相对湿度50%±5%的环境中,放置4小时以上,并在上述条件下进行试验。
将试样固定在落球冲击试验机上,跨距为100mm。
按下表选取钢球和落球高度,使钢球自由落下于跨距中央部位,纵横向均不得有2片以上破损。
取本品适量,照加热伸缩率测定法(YBB00292004-2015)测定,伸缩率应在±6%以内。
硬聚氯乙烯(pvc-u)混配料标准硬聚氯乙烯(PVC-U)是一种常用的塑料材料,广泛应用于建筑、水利、电器等领域。
为了提高PVC-U的性能和降低生产成本,常常需要进行混配料。
下面将介绍硬聚氯乙烯混配料的标准和相关知识。
首先,我们需要了解硬聚氯乙烯的基本性质和特点。
硬聚氯乙烯具有优良的耐候性、电气绝缘性能和化学稳定性,但其力学性能较差,刚性不够。
因此,需要通过混配料的方式来改善PVC-U的性能。
混配料主要有填充剂、增塑剂和稳定剂三种。
填充剂可以增加PVC-U的硬度、强度和耐热性。
常用的填充剂有碳酸钙、硅酸钙和滑石粉等。
增塑剂可以增加PVC-U的柔韧性和可加工性,常用的增塑剂有酯类、酚酸盐类和环氧酯类等。
稳定剂可以提高PVC-U的抗氧化性和热稳定性,常用的稳定剂有有机锡和金属盐等。
硬聚氯乙烯混配料的标准主要包括以下几个方面:1.混配料比例标准:混配料的比例应根据具体应用需求来确定。
一般来说,填充剂的添加量可控制在10-40%,增塑剂的添加量可控制在20-60%,稳定剂的添加量可控制在0.3-1.0%。
2.技术指标要求:混配料后的PVC-U材料应满足相关的技术指标要求。
例如,硬度、拉伸强度、断裂伸长率、热变形温度等指标应符合国家或行业标准。
3.混配料工艺参数:混配料的工艺参数包括料温、混合时间、混合速度等。
这些参数需要根据具体的混配料设备和材料特性来确定,以保证混配料的均匀性和稳定性。
4.产品检验标准:混配料后的PVC-U产品需要进行质量检验,以确保其符合相关的标准和要求。
产品的检验项目包括外观质量、物理性能、机械性能、电气性能等。
在实际混配料过程中,还需要注意以下几个方面:1.选择合适的混配料设备:不同的混配料设备对材料的混合效果有所区别,应选择合适的设备来实现理想的混配料效果。
2.控制好混合过程:混配料的过程需要控制好混合时间、混合速度和温度等参数。
注意材料的溶解和分散情况,避免产生聚集和球化现象。
德信诚培训网聚氯乙烯电缆进货检验和确认检验规程1本规程适用于以聚氯乙烯树脂为主要原料,加入增塑剂、稳定剂等助剂,经混合、塑化,制粒而制得的电线电缆用软聚氯乙烯塑料。
2编制依据GB/T8815-20083产品分类3.1产品名称、型号见表1表14技术要求4.1聚氯乙烯塑料机械物理性能和电性能应符合表2的规定表24.2聚氯乙烯塑料老化后的机械物理性能应符合表3的规定表35检验表46判定依据6.1每批塑料进厂应有质保书。
6.2塑料进厂用目力检测每包料生产日期应在保质期内,包装应完好,对不符要求的则进行退货。
7定期确认检验7.1定期确认检验项目和方法7.1.1检验项目:外观、拉伸强度、断裂拉伸应变、空气烘箱热老化试验后(100℃,168h)〔拉伸强度、拉伸强度最大变化率、断裂拉伸应变、断裂拉伸应变最大变化率〕、热老化质量损失(100℃,168h)、热变形(120℃,1h)、冲击脆化性能(-15℃)--破裂数/试样数、200℃热稳定时间、20℃时体积电阻率、介电强度、70℃时体积电阻率(J-70检验项目)。
7.1.2检验方法:依据标准GB/T8815-2008中包括的聚氯乙烯电缆料(J-70)检验项目条文号(5.1/5.2/6.3/6.12/6.4/6.5/6.6/6.7/6.8)。
7.2定期确认检验具体要求德信诚培训网7.2.1主要原材料在进货检验的基础上,还需进行定期确认检验,以满足本公司认证产品的技术要求。
7.2.2本公司不具备聚氯乙烯电缆料(J-70)定期确认检验能力,定期确认检验由供应商每年抽样或本公司抽样委托国家权威检测机构进行试验。
定期确认检验由质检部负责。
7.2.3定期确认检验频次:频次不低于1次/12月。
7.2.4定期确认检验的评定和不合格品的处置7.2.4.1定期确认检验的全部项目合格,供应商可继续向本公司供货。
7.2.4.2定期确认检验中发现不合格项目应及时向上一级部门报告,开出整改项目,要求其整改,停止供货。
固體藥用聚烯烴塑膠瓶檢驗標準操作規程目的:規範塑膠藥瓶檢驗的操作。
適用範圍:塑膠藥瓶的檢驗。
責任:檢驗室檢驗人員按本規程操作,檢驗室主任監督本規程的執行。
程序:1.抽樣方法1.1抽樣時首先查明該批産品有無生産廠家的檢驗合格證。
1.2按照《包裝材料取樣辦法》的要求,從不同方位抽取不少於100個作外觀質量檢查。
1.3從以上包裝中抽取50個作機械性能測試。
1.4根據來貨量的多少,至少抽取8套以上的樣品瓶作微生物限度檢查。
2.所用儀器及試劑:2.1放大鏡(10倍)2.2細菌測定所需的儀器、用具及試劑。
2.3黴菌測定所用的儀器、用具及試劑。
2.4大腸桿菌測定用的儀器、用具及試劑。
3.檢驗方法3.1外觀的檢驗:取以上抽出的樣品,在充足的光線下目測,或輔以10倍放大鏡檢查樣品的外觀,應符合以下要求。
3.1.1應具有均勻一致的乳白色澤,不得有明顯的色差,瓶的表面應光潔、平整,不允許有變形和明顯的皺痕,不允許有砂眼、油污、氣泡。
瓶口應平整光滑,不應有飛邊和缺陷。
3.1.2不合格允許≤2.0%。
3.2機械性能測試:3.2.1瓶、蓋和瓶口吻合嚴密,保險圈與瓶體咬合準確到位,且保險圈應隨瓶蓋的旋開而斷裂分離。
3.2.2瓶蓋不合格率允許≤2.0%。
3.3微生物限度檢查3.3.1供試液的製備每套瓶子加入藥瓶容量1/3的無菌生理鹽水,將瓶蓋旋緊,振搖1分鐘後,取瓶內溶液作爲供試液。
3.3.2試驗方法按《微生物限度檢驗標準操作規程》(SOP-QC-107-00)項下規定的方法操作。
3.3.3統計以上測得的結果,應符合藥用聚乙烯瓶質量標準中微生物限度的要求。
4.以上外觀檢查及機械性能測試總合格率不少於98.0%。
目的:使检验人员正确进行聚氯乙烯(PVC)固体药用硬片的检验工作,确保检验数据的真实性、检验结果的准确性。
范围:适用于聚氯乙烯(PVC)固体药用硬片的检验操作。
责任:质检中心检验人员按本规程操作,质检主任监督本规程的执行。
内容:
1 外观
取试样2米,在自然光线明亮处,正视目测,色泽应均匀一致,无凹凸发皱、油污、异物、穿孔、杂质。
每100 cm2中,用游标卡尺测定1.3 mm及1.3 mm以下的晶点,不得过3颗,不得有1.3 mm 以上的晶点。
2 规格尺寸
用直尺测定宽度230 mm ,偏差±1 mm。
用螺旋测微器测定厚度0.25 mm,偏差±0.02 mm。
3 加热伸缩率试验
3.1设备
加热试验用老化试验箱或烘箱,其控温精度±1℃。
长度测定用精度0.02mm的游标卡尺。
3.2试样
从硬片上切取正方形片二片(如图1所示),每片宽度为120mm。
找准中心划出纵向AB,横向CD间距为100mm互相垂直90℃平分的二条线。
图 1
3.3 操作
将试片平放在玻璃板上,置于100±1℃的试验箱中,持续10分钟,取出冷却至室温,然后准确测定每片AB、CD线段长度。
3.4 计算
求得两片AB、CD的平均值,并按(1)算出纵向和横向的伸缩率。
L2-L1
S(%)=
×100 (1)
L1
式中:S-伸缩率
L1-加热前的标点间的距离,mm;
L2-加热后的标点间的距离,mm。
4 溶出物试验
4.1试验试液的制备
仪器与试剂高压蒸汽灭菌器
除另有规定外,取样品适量,分别裁取内表面积为300 cm2(分割成长3cm,宽0.3cm 的小片),用适量水清洗,一份置500ml具塞锥形瓶中,加水200ml,密闭,置高压蒸汽灭菌器内,121℃±2℃加热30分钟取出,放冷至室温;另二份分别置具塞锥形瓶中,
加65%乙醇200ml置(70℃±2℃)恒温水浴保温2小时后;正己烷200ml置(58℃±2℃)恒温水浴保温2小时后。
取出,放冷至室温,即得供试品溶液;并同时以同批水、65%乙醇、正己烷制备空白对照液。
备用,进行下列试验。
4.2澄清度
仪器与试剂澄清度检测仪、浊度标准液
操作过程取水供试品液10ml,置50 ml纳氏比色管中,照《澄清度检查法操作规程》测定。
标准规定应澄清。
如显色,与2号浊度标准液比较,不得更浓。
4.3易氧化物
仪器与试剂数显恒温水浴锅、0.002mol/L高锰酸钾液、稀硫酸、碘化钾、滴淀粉指示液、硫代硫酸钠滴定液(0.01mol/L)
操作过程精密量取水供试品液20ml,精密加入0.002mol/L高锰酸钾液20ml与稀硫酸1ml,煮沸3分钟,迅速冷却,加0.1g碘化钾,在暗处放置5分钟,用硫代硫酸钠滴定液(0.01mol/L)滴定至浅棕色,再加入5滴淀粉指示液后滴定至无色。
另取水空白对照液同法操作,计算两者消耗滴定液之差。
标准规定两者消耗硫代硫酸钠滴定液(0.01mol/L)的体积之差不得过1.5ml。
4.4不挥发物
仪器与试剂数显恒温水浴锅、电热鼓风干燥箱
操作过程分别精密量取水、65%乙醇、正己烷供试品液与对应空白对照液各100ml置于已恒重的蒸发皿中,水浴蒸干,在105℃干燥至恒重,水不挥发物与其空白对照液。
标准规定水不挥发物与其空白对照液之差不得过30.0mg;65%乙醇不挥发物与其空白对照液之差不得过30.0mg;正己烷不挥发物与其空白对照液之差不得过30.0mg。
4.5重金属
仪器与试剂醋酸盐缓冲液(PH3.5)、硫代乙酰胺试液、标准铅溶液、稀焦糖溶液操作过程精密量取水供试液20ml,加醋酸盐缓冲液(PH3.5)2ml,按《重金属检查标准操作规程》测定。
标准规定含重金属不得过百万分之一。
5 微生物限度
仪器与试剂高压蒸汽灭菌器、霉菌培养箱、电热恒温培养箱、氯化钠注射液、培养基、
操作过程取本品用开孔面积为20 cm2的消毒过的金属板压在内层面上,将无菌棉签用氯化钠注射液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置100 cm2。
每只棉签抹完后立即剪断,投入盛有30ml氯化钠注射液的锥形瓶中。
全部擦抹棉签投入瓶中后,将瓶迅速摇晃1分钟,即得供试液,照微生物限度法《微生物限度检查法标准操作规程》测定。
标准规定细菌数不得过1000cfu/100 cm2,霉菌、酵母菌数不得过100cfu/100 cm2,大肠埃希菌不得检出。
6 检验规则
6.1 每批从1-2卷中取样检验,取样应以距离硬片外端1m处剪取。
6.2 以同一时间进厂的PVC片为一批。
规格尺寸、外观应抽样检验。
6.3 加热伸缩率:新供货单位初次进货时全检,以后根据使用情况抽检。
6.4 检验结果应按下列规定处理
6.4.1 规格尺寸、外观其中一项不合格则该卷不合格。
6.4.2 加热伸缩率不合格时,应重新在原批中加倍取样复测,仍不合格,则整批为不合格品。
6.4.3 澄清度不合格,则整批为不合格。
7 包装、标志、运输贮存
7.1 聚氯乙烯固体药用硬片应为定量包装,卷尾用胶带封口,每卷用2只聚乙烯塑料薄膜包装,内装有合格证,再装入纸箱,并用胶带封严。
7.2 每箱应有产品合格证,并写明制造厂名称、产品名称、规格、型号、卷号、批号、重量、检验员代号以及生产日期,每批产品应附有质量部门开具的产品报告单。
7.3 在贮存期内聚氯乙烯固体药用硬片应保管在干燥、通气,阴凉处。
7.4 聚氯乙烯硬片运输时,应轻装轻卸,切勿日晒雨淋,保证包装完好。
8 生产厂家选定:
应具有国家药品监督管理局颁发的药品包装用材料和容器注册证(Ⅰ类)//。