水通道蛋白综述与展望
- 格式:docx
- 大小:28.38 KB
- 文档页数:20



水通道蛋白结构水通道蛋白是一类在生物体中起着重要作用的蛋白质。
它们存在于细胞膜上,形成了细胞膜的一种通道,能够允许水分子快速通过细胞膜。
水通道蛋白的发现和研究为我们理解细胞内外液体平衡以及水分运输提供了重要的线索。
水通道蛋白最早是在1980年代被发现的,研究者发现一种叫做水通道蛋白1(Aquaporin-1,简称AQP1)的蛋白质在红细胞膜上表达,能够加速水分子通过细胞膜。
这项发现引起了科学家们的广泛关注,并在接下来的几十年里,研究人员陆续发现了多种水通道蛋白。
水通道蛋白的结构非常特殊,它们由多个亲水性的氨基酸残基组成,形成了一条通道,通道中心是一个疏水性的区域,能够排斥离子和其他溶质,只允许水分子通过。
水通道蛋白的结构使其具有高度选择性和通透性,能够快速而特异地传输水分子。
水通道蛋白的结构在进化过程中发生了一些变化,目前已经发现了多种类型的水通道蛋白。
其中,AQP1是最早被发现的一种,广泛存在于多种细胞类型中,包括红细胞、肾脏和眼睛等。
AQP1的结构由四个相同的亚单位组成,每个亚单位由六个跨膜螺旋组成,形成了一个中央水通道。
除了AQP1之外,还有其他类型的水通道蛋白,如AQP2、AQP3等。
它们在组织和细胞中的分布具有一定的特异性,发挥着不同的生理功能。
例如,AQP2主要存在于肾脏中,调节尿液的浓缩和稀释;AQP3主要存在于皮肤和肠道中,参与水分的吸收和散发。
水通道蛋白的功能不仅仅局限于水分的传输,它们还参与了一系列重要的生理过程。
例如,水通道蛋白在维持细胞内外液体平衡方面发挥着重要作用。
细胞内外液体平衡的失调会导致细胞的肿胀或收缩,影响细胞的正常功能。
水通道蛋白能够调节细胞内外水分的平衡,保持细胞内外环境的稳定。
水通道蛋白还参与了一些特殊细胞功能的实现。
例如,在肾脏中,水通道蛋白能够调节尿液的浓缩和稀释,帮助维持体内水分的平衡。
在眼睛中,水通道蛋白参与了眼内房水的生成和排泄,维持了眼压的稳定。


水通道蛋白的名词解释水通道蛋白是一类存在于生物体细胞膜上的蛋白质,其主要功能是调节细胞内外水分的平衡。
这些蛋白质以其独特的细胞膜通透性,通常被形容为“细胞的水渠”。
尽管细胞膜对水具有一定的渗透性,但水通道蛋白的出现使得水分的跨膜运输变得更加高效和方便。
水通道蛋白主要通过形成一个微小的通道,让水分子直接穿过细胞膜,从而加速细胞内外的水分交换。
水通道蛋白最早被发现于红细胞膜,其中最为著名的是被称为Aquaporin-1(AQP1)的蛋白质。
AQP1被发现能够高效地传输水分子,使其成为研究者们研究水通道蛋白的重要起点。
此后,越来越多的水通道蛋白被发现,它们在各种生物体的细胞膜上广泛存在。
水通道蛋白家族主要包括两类:小分子量蛋白(20~35kDa)和大分子量蛋白(约为50~90kDa)。
小分子量蛋白包括AQP1、AQP2和AQP4等,它们主要负责水分子的传输。
大分子量蛋白则包括AQP0、AQP5和AQP6等,除了与水分交换有关,这些蛋白质还可能参与其他细胞功能的调节。
水通道蛋白在生物体中具有广泛而重要的作用。
例如,在人体内,水通道蛋白在器官和组织中起着维持水分平衡的关键作用。
当体内水分过多或过少时,水通道蛋白能够根据需要调整细胞膜的通透性,控制水分大量吸收或排泄。
这一过程在保持人体内部环境稳定方面非常重要。
此外,水通道蛋白还在植物、昆虫、微生物等生物体中发挥着类似的功能。
在植物体内,水通道蛋白不仅参与了水分的吸收和输送,还对维持细胞渗透稳定性和调节植物生长发育起到了重要作用。
在昆虫和微生物中,水通道蛋白也发挥着类似的水分调节作用,确保它们能够在不同环境下生存和繁衍。
随着科学技术的发展,研究人员对水通道蛋白进行了深入的研究。
他们通过结构生物学、细胞生物学以及分子生物学等多种手段,揭示了水通道蛋白的分子结构和生理功能,并进一步研究了其与疾病之间的关系。
例如,某些疾病,如肾脏功能障碍、肿瘤、水肿等,与水通道蛋白的异常表达或功能失调密切相关。

动物医学进展,021,42(3)=102-105Progress in Veterinary Medicine水通道蛋白在动物疾病发生过程中的作用研究进展张玉婷,张琪,郭抗抗,许信刚*,周宏超*(西北农林科技大学动物医学院,陕西杨凌712100)摘要:水通道蛋白(AQP)是细胞上存在的一种膜孔道蛋白。
动物、植物、微生物细胞上均有水通道蛋白的表达,其主要功能是参与机体的水与电解质代谢。
近年来,针对水通道蛋白在机体所发挥的功能方面研究较多,发现水通道蛋白不仅参与机体生理方面的调控,而且在一些疾病的发生发展过程中也发挥重要的作用。
综述概括了水通道蛋白在脑、肺、肾脏、肠道等组织器官的定位;重点阐述了水通道蛋白在动物脑部疾病、肺部疾病、肾脏疾病、肠道疾病发展过程中所发生的变化。
旨在为患病动物出现水与电解质代谢紊乱症状时,对水通道蛋白发生的变化研究提供参考。
关键词:水通道蛋白;脑水肿;肺动脉高压;肾损伤;腹泻中图分类号:S852.2文献标识码:A 文章编号=^^5038^1)3-0102-0.-1水通道蛋白(aquaporin,AQP)作为一种水转运蛋白在机体各个部位广泛分布,尤其在涉及水液输送的组织细胞内分布量较多,例如在大脑、胃、肠道,肾脏及膀胱等器官均有表达,水通道蛋白在保持机体内环境稳态方面发挥重要作用,增强了机体的代谢能力[]。
研究发现,哺乳动物体内所表达的水通道蛋白已经有13种亚型,分别为AQP0、AQP1、AQP2、AQP3、AQP4、AQP5、AQP6、AQP7、AQP8、AQP9、AQP10、AQP11、AQP12。
水通道蛋白家族根据各个亚型在机体发挥的功能不同,可分为3类:①单纯的水通道蛋白,如AQP1,AQP2,AQP4, AQP5;②水甘油通道蛋白,如AQP3,AQP9、AQP10;③超级水通道蛋白,如AQP6,AQP8, AQP11、AQP12[]。
近年来,某些疾病的发生与水通道蛋白异常表达现象,得到了广泛的关注。

细胞水通道蛋白
1991年,获诺贝尔医学奖的德国科学家Dr?Erwineher发现了人的细胞膜上存在着直径2纳米,能让水和离子化营养物质一同进入细胞的通道,叫做细胞水通道。
小分子团水容易通过细胞膜这道城门,而10个以上的水分子团则很难进入细胞内部。
人渴了,要喝水。
水喝到体内后,不管是大分子团水还是小分子团水,仍然是以分子团的形式存在。
2000年美国科学家彼得?阿格雷用特殊的显微摄影成功的拍到了世界第一张细胞膜水通道蛋白的高清晰立体照片并向世人公布。
因此获得了2003年诺贝尔化学奖。
这个伟大的发现揭示了细胞膜上有水通道,这个通道只允许小分子团水通过。
细胞水通道为2纳米,单个水分子为0.2纳米,最多可以容纳10个水分子进入。
如果水分子团大于10个,则需要消耗人体自身能量才能够吸收和代谢。
这张照片揭示了人类细胞因水的交流受阻而过早衰老的原因。
这个伟大的发现揭示了细胞壁是被许多水通道贯穿的而非封闭状的壳体。
生命对水的吸收是通过细胞膜水通道—这些缝隙连接通道是由六个蛋白质亚单位包绕而成的六角形通道,呈喇叭形且十分狭窄,在蛋白的静电力作用下,水分子一个一个穿过通道进入细胞,进行水合作用,对营养物质和代谢物进行吸收和排泄。
它证实了人体细胞吸收和生理活动需要的必须是小分子团水,小分子团水才能被细胞吸收,才能起到物质代谢、能量代谢、信息代谢的载体功能。
水通道蛋白的发现及对人体的作用刘彦成(渭南师范学院环境与生命科学系陕西渭南 714000)摘要:水通道蛋白(aquaporin,AQP) 是一种对水专一的通道蛋白。
具有介导水的跨膜转运和调节体内水代谢平衡的功能。
水通道蛋白调节失控与水平衡紊乱等一系列疾病密切相关。
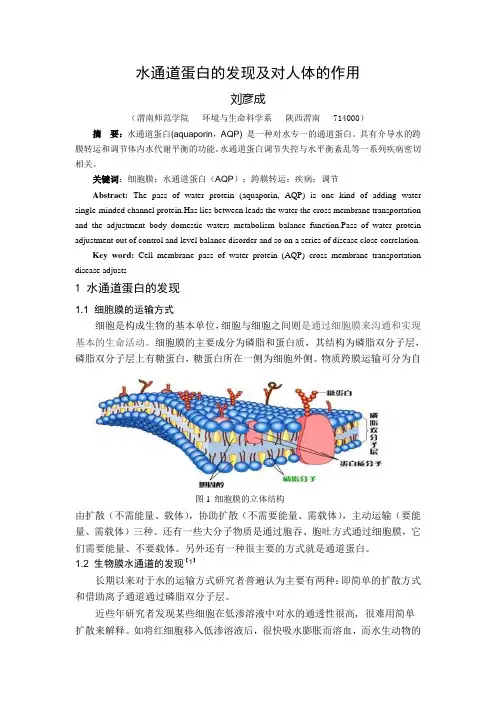
关键词:细胞膜;水通道蛋白(AQP);跨膜转运;疾病;调节Abstract:The pass of water protein (aquaporin, AQP) is one kind of adding water single-minded channel protein.Has lies between leads the water the cross membrane transportation and the adjustment body domestic waters metabolism balance function.Pass of water protein adjustment out of control and level balance disorder and so on a series of disease close correlation.Key word:Cell membrane pass of water protein (AQP) cross membrane transportation disease adjusts1 水通道蛋白的发现1.1 细胞膜的运输方式细胞是构成生物的基本单位,细胞与细胞之间则是通过细胞膜来沟通和实现基本的生命活动。
细胞膜的主要成分为磷脂和蛋白质,其结构为磷脂双分子层,磷脂双分子层上有糖蛋白,糖蛋白所在一侧为细胞外侧。
物质跨膜运输可分为自图1 细胞膜的立体结构由扩散(不需能量、载体),协助扩散(不需要能量、需载体),主动运输(要能量、需载体)三种。
还有一些大分子物质是通过胞吞、胞吐方式通过细胞膜,它们需要能量、不要载体。

水通道蛋白基因水通道蛋白基因是一类编码蛋白质的基因,其产物是一种受体蛋白,能够调节细胞膜的通透性,使细胞能够快速、高效地调节水分的进出。
本文将从水通道蛋白基因的发现、结构与功能以及在生物体中的重要作用等方面进行阐述。
一、水通道蛋白基因的发现水通道蛋白基因的发现与诺贝尔奖得主皮特·阿格雷(Peter Agre)密不可分。
1992年,阿格雷和他的团队在研究红细胞膜蛋白时,发现了一种新的蛋白质,被命名为水通道蛋白(aquaporin)。
他们通过功能性研究发现,水通道蛋白能够高效地调节细胞内外水分的平衡,从而维持细胞的正常功能。
二、水通道蛋白的结构与功能水通道蛋白是一种跨膜蛋白,其主要结构特征是存在于细胞膜中的六个跨膜螺旋。
这些跨膜螺旋形成了一个水分子可以通过的微小通道,从而实现水分子的快速跨膜运输。
水通道蛋白的通道是高度选择性的,只允许水分子通过,而离子和其他溶质则无法进入。
水通道蛋白通过调节细胞膜的通透性,起到了维持细胞内外水分平衡的重要作用。
在生理过程中,水通道蛋白能够帮助细胞快速吸收和释放水分,从而调节细胞内外水分的浓度差。
此外,水通道蛋白还参与了细胞的渗透调节、尿液浓缩等重要生理过程。
水通道蛋白基因广泛存在于各种生物体中,并在不同组织和器官中发挥着重要的生理功能。
例如,在植物中,水通道蛋白基因参与了植物对水分的吸收和运输,维持植物体内外水分的平衡,保证植物的正常生长发育。
在动物中,水通道蛋白基因则在肾脏、肺部、眼睛等组织中起到关键作用,帮助维持体内水分的稳定。
水通道蛋白基因的异常表达与一些疾病的发生发展密切相关。
例如,水通道蛋白基因突变可导致肾脏功能障碍和尿液浓缩能力下降,进而引发多种肾脏疾病。
此外,一些研究还发现,水通道蛋白基因的异常表达与肿瘤的发生和转移有关,可能成为肿瘤治疗的潜在靶点。
总结:水通道蛋白基因作为一类重要的蛋白质基因,在维持细胞内外水分平衡、调节生理过程等方面发挥着重要作用。

水通道蛋白与脑水肿水通道蛋白(aquaporin, AQP)是一种水的分子通道,在动物和植物细胞中已经发现有多种不同的水通道蛋白。
由于水通道蛋白的存在,细胞才可以快速调节自身体积和内部渗透压,水通道蛋白对于生命活动至关重要。
本文仅就水通道蛋白与脑水肿关系的研究进展进行简单介绍。
一、AQP 的发现与家族种类过去认为,水在细胞内外的转运只是通过脂质双分子层扩散来完成。
但在某些生理现象中,如红细胞、肾近曲小管上皮细胞等对水的转运速度非常快,不能用水简单扩散来解释。
Agre [1]等(1988) 在鉴定人类Rh 血型抗原时,偶然在红细胞膜上发现一种新的28KD 的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28 (CHIP) ,1991 年完成其cDNA 克隆,但当时并不知道该蛋白的功能。
在进行功能鉴定时,将体外转录合成的CHIP28 cDNA 注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5min 内破裂。
为进一步确定其功能,又将其构建于蛋白磷脂体内,通过活化能及渗透系数的测定以及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28 为AQP1 。
以后又陆续从哺乳动物组织中鉴定出9 种水通道蛋白(AQP2 ~AQP10 ) ,它们与先前克隆的晶体纤维中的主要内源性蛋白(major intrinsic protein ,MIP) 有20 %~40 %的氨基酸序列同源性,目前所发现的水通道均属MIP家族,后经证明MIP 亦有弱的水通道活性,被命名为AQP0。
这些相继发现的专一性运输水的通道蛋白被统称为AQPs。
AQP家族,存在于不同的组织器官中,如:AQP2 存在于肾髓和肾皮质收集管主细胞,它在调节水的排泄中有重要作用,约有10% 的肾小球滤过液流经集合管时是在AQ P2 的参与下被重吸收的。
AQP5 大量存在于唾液腺和泪腺中,与唾液和泪液的产生有关[2]。

水通道蛋白的研究【关键词】水通道蛋白,法医病理学【中图分类号】q503;d919.1【文献标识码】b【文章编号】1007 9297(20XX)01—0053—03一、水通道蛋白的发现水是生物机体细胞的主要成分,每时每刻有大量的水分子通过细胞膜进出细胞。
在90年代以前,对于水分子的转运机制,主要有两种理论解释,一种是水分子的简单扩散学说,认为细胞内外渗透压差是其动力源,需要较高的阿里纽斯活动能(arrhenius activation energy,以下简称ea),一般ea> 10 keal/mol,达到平衡时渗透率(coefficient of osmotic permeability,简称pf)与扩散率(coefficient of diffusional permeability,简称pd)趋于相等,不能被汞等通道蛋白阻断剂所抑制。
但水分子简单扩散理论不能解释一些生理现象,如尿的浓缩、pf/pd> 1时水的转·法医学理论与实践·运及有些细胞水转运可被通道蛋白阻断剂抑制等,所以就产生了另一种理论,认为细胞膜上存在水分子转运的特殊通道,即水通道学说。
水分子通过该通道进出细胞,水通过水通道时需要的ea较低,一般eaaqp3和aqp7对甘油和尿素等有机小分子有一定的通过性,并且它们的核苷酸序列也很相似,[14, ]可据此将aqps家族分为两个亚家族,即aqp3和aqp7为一个亚家族,其余aqps为另一个亚家族。
对aqps的调节存在长期和短时调节之分。
长期调节作用在核酸转录水平上,主要表现为aqps的mrna合成增加,蛋白表达量增强,如皮质醇类激素可以从该水平上增加aqp1的表达等。
[ ]短时调节主要表现为细胞浆内的囊泡等膜单位短时与细胞膜融合,它们膜上的aqps转移到细胞膜上,导致细胞膜单位面积上aqps的量短时增加,如当受到加压素的作用时,肾组织细胞浆中的囊泡与肾脏细胞顶端膜融合,使囊泡中的aqp2转移到胞膜中发挥作用,一旦刺激消失,又通过形成囊泡载体,aqp2返回到胞浆中,从而减少细胞膜上的aqp2,水通透性降低,所以这种短时调节机制又称为“穿梭机制”。
彼得·阿格雷(Peter Agre),科学家。
1949年生于美国,1974年在巴尔的摩约翰斯·霍普金斯大学医学院获医学博士,现为该学院生物化学教授和医学教授。
由于发现了细胞膜水通道蛋白,在2003年获得诺贝尔化学奖。
水通道蛋白发现历程19世纪20年代以前,人们认为水分子只是以自由扩散形式透过细胞膜,但是后来通过自由扩散方式水分子通过量很少且活化能很高,难以解释水分子以很快速度大量通过细胞膜,且通过菲克第一定律测量出细胞膜对水的通透性远高于人造脂质体,并且Posm(渗透水通透系数)/Pdw(扩散水通透系数)>1。
于是当时人们提出细胞膜上很可能存在调控水分子和其他小的溶质分子进出细胞的某种通道。
50年代,许多科学家(Arthur K. Solomon in Boston, Alan Finkelstein in New York, Robert Macey in Berkeley, Gheorghe Benga in Romania, Guillermo Whittembury in Venezuela, Mario Parisi in Argentina)通过大量实验证实水分子能快速,大量通过选择性通道进入红细胞,而其他分子或离子(H+)通不过,这种现象同样存在于唾液腺,肾脏和膀胱(99%的水分被肾小管重吸收利用)中。
尽管科学家做了努力,但由于这种分子通道十分简单,因此始终未能分离并鉴定。
1988年,Peter Agre和他的团队在研究分离提纯兔子Rh血型抗原蛋白(利用抗体—抗原结合特性来鉴定一定分子质量的物质并进行过滤)结果发现抗体与质量接近30kDa的蛋白结合,起初以为是32kDa的抗原水解产物,但是由银光标记的琼脂糖凝胶电泳实验(SDS-PAGE)结果显示有一条28kDa的不连续条带。
他们发现此蛋白不被考马斯亮蓝等染液染色,排除了抗原水解产物的可能。
这便引起了Peter Agre的极大兴趣。
【PETMR专题】⽔通道蛋⽩磁共振(AQPMR)分⼦成像技术进展作者:GE 医疗(中国),赵周社李宏利张泉王⽂帅⾃2012年开始⽔通道蛋⽩磁共振(Aquaporin MR, AQP MR)分⼦成像技术研究以来,⽬前已经取得很⼤的进展。
记得2013年的在国内⾸次介绍AQP MR成像技术时,⼏乎得到多数与会者的质疑和不惑。
主要是因为AQP MR成像理论对传统的⽔分⼦扩散加权成像( MR diffusionweighted imaging, MR-DWI )技术的理论基础提出了挑战。
AQP MR认为⽔分⼦通过⽔通道转运,⽽传统的MR-DWI认为⽔分⼦在细胞膜是⾃由扩散运动。
由此引发更多学者对AQP MR成像理论的兴趣、讨论和研究。
1AQP MR分⼦成像理论基础AQP MR分⼦成像的理论基础是⽔通道蛋⽩对⽔分⼦转运和IVIM模型。
在AQP和IVIM模型基础上,推出了AQP MR分⼦成像技术。
随着对不同⽔通道蛋⽩分⼦成像研究的不断深⼊,AQP MR分⼦成像技术理论也在进⼀步完善中。
AQP MR分⼦成像技术研究是采⽤转化医学理念,以分⼦影像技术作为⼯具,精准医学作为⽬标进⾏研究的⼀个范例。
⽔分⼦通过⽔通道蛋⽩模式图2AQP MR分⼦成像技术应⽤从已经公开发表的资料来看,AQP MR成像已经涉及到神经系统痴呆、帕⾦森⽒病和脑缺⾎性疾病研究;在肿瘤的研究脑胶质瘤、肺癌、肝癌、⼦宫颈癌等;在肝脏纤维临床研究也取得很⼤的进展。
最近也看到在肾脏功能研究应⽤。
只有加速积累AQP MR分⼦成像研究的基础和临床资料,才能获得对AQP MR深⼊的理解。
3AQP MR分⼦成像技术研究启发和展望从已经报道的资料可以看出,MRI的研究已经从单纯的序列研究已经进⼊到对MRI序列反映的⽣物学意义研究,MRI的研究已经进⼊真正的分⼦影像学时代。
只有将MRI的研究从传统的解剖结构、功能(BOLD)、⾎流灌注(DCE、DSC)和简单的代谢(MRS,CEST和APT),推向分⼦靶向成像,才能使得MRI技术适应精准医学的发展,才能使MRI技术产⽣新的活⼒。
水通道蛋白作用原理嘿,朋友们!今天咱来聊聊水通道蛋白的作用原理,这可真是个神奇的玩意儿啊!你看啊,水通道蛋白就像是一扇扇特别的小门,专门让水分子快速通过。
这就好比是在一个拥挤的人群中,有了专门的通道让特定的人快速通过一样。
想象一下,细胞就像一个小房子,里面需要水来维持各种活动。
如果没有水通道蛋白,水分子就得慢悠悠地挤进去,那多耽误事儿啊!但有了水通道蛋白,水分子就可以顺畅地进进出出啦。
这些水通道蛋白可挑剔了呢,它们只让水分子通过,其他的分子想混进去,门儿都没有!这就像一个严格的守卫,只放自己认识的人进去。
它们是怎么做到这么精准的呢?原来啊,水通道蛋白的结构特别巧妙。
它有一个合适的形状和大小,刚好能让水分子舒舒服服地通过。
这就好像是为水分子量身定制的通道一样。
而且哦,水通道蛋白的工作效率超高的!它们能在很短的时间内让大量的水分子通过。
这要是换成我们人类来干这活儿,那得累个半死吧!水通道蛋白在我们身体里的作用可大了去了。
比如在肾脏里,它们帮助过滤和重吸收水分,让我们的身体能保持水分平衡。
要是没有它们,我们的身体可就乱套啦!在我们的细胞里,水通道蛋白就像一群勤劳的小蜜蜂,默默地工作着,保障着细胞的正常运转。
没有它们,细胞可能就会变得干巴巴的,没法好好工作啦。
你说神奇不神奇?水通道蛋白虽然小小的,可它们的作用却是大大的呀!它们就像是我们身体里的无名英雄,一直在为我们的健康默默奉献着。
所以啊,我们可千万不能小看了这些小小的水通道蛋白。
它们虽然不显眼,但却在我们的身体里发挥着至关重要的作用。
我们得好好感谢它们呢!这就是水通道蛋白的作用原理啦,是不是很有趣呢?。
水通道蛋白名词解释
水通道蛋白(aquaporin)是一类存在于细胞膜上的跨膜蛋白,其功能是调节细胞内外水分的平衡。
水通道蛋白是由8个跨膜α螺旋结构组成,形成一个具有水分子通过能力的通道。
它们广泛存在于多种生物体的细胞膜上,包括植物、动物和微生物等。
水通道蛋白的主要功能是促进水分子在细胞膜上的快速跨膜传递。
由于水分子是极性的,无法通过细胞膜的疏水层,而水通道蛋白则提供了一个高度选择性通道,使水分子能够迅速通过细胞膜而不受阻碍。
水通道蛋白的通道结构限制了其他溶质的通过,从而确保水分子的优先通道。
除了调节水分平衡外,水通道蛋白还在细胞内外水分调节以及保护细胞免受渗透压和压力变化等环境因素的影响中发挥重要作用。
在植物中,水通道蛋白在根系中的表达调控了植物对于土壤中水分的吸收和利用。
在人体中,水通道蛋白在肾脏、眼睛和脑组织等重要器官中的表达与正常的水平维持和离子浓度平衡密切相关。
水通道蛋白的发现为我们深入了解细胞内外水分平衡的调控机制提
供了重要的线索。
通过研究水通道蛋白的结构和功能,人们可以进一步探索其在疾病发生和发展中的作用,为相关疾病的治疗和预防提供新的策略和途径。
水通道蛋白水通道 - 从原子结构到临床医学 生物膜的透水性在生理学上是一个长期存在的问题,但负责此类蛋白质的蛋白质仍然未知,直到发现水通道蛋白1(AQP1)水通道蛋白。 AQP1由渗透梯度驱动的水选择性渗透。人类AQP1的原子结构最近被定义。四聚体的每个亚基含有允许水分子单文件通过但中断氢键通过质子所需的单独水孔。已经鉴定了至少10种哺乳动物水通道蛋白,并且它们被水(水通道蛋白)或水加甘油(水甘油聚糖)选择性渗透。表达位点与临床表型密切相关,从先天性白内障到肾源性尿崩症。在植物,微生物,无脊椎动物和脊椎动物中发现超过200个水通道蛋白家族成员,并且它们对这些生物体的生理学的重要性正在被揭开。
在20世纪20年代发现脂质双层提供了当沐浴在较低或较高pH或含有毒性浓度的Ca2 +或其他溶质的细胞外液中时细胞如何维持其最佳细胞内环境的解释。 从1950年代开始发现离子通道,交换剂和共转运体为溶质的跨膜运动提供了分子解释。 然而,长期以来,假定水的输送是由于通过脂质双层的简单扩散。 来自具有高膜渗透性的多个实验系统的观察,例如两栖膀胱和哺乳动物红细胞,表明通过脂质双层的扩散不是水跨越膜的唯一途径。 虽然提出了各种解释,但直到10年前发现AQP1才能知道分子水 - 特异性转运蛋白(Preston等,1999)。 现在人们普遍同意扩散和通道介导的水分运动都存在。 通过所有生物膜以相对较低的速度发生扩散。 水通道蛋白水通道发现于上皮细胞的一部分10至100倍的水渗透能力。 值得注意的是,水通道蛋白水通道的选择性非常高,甚至质子(H3O +)被排斥。 在大多数组织中,扩散是双向的,因为水进入细胞并从细胞释放,而水通道蛋白介导的体内水流则由渗透或液压梯度引导。 扩散的化学抑制剂是未知的,扩散发生在高Ea(Arrhenius活化能)。 相比之下,大多数哺乳动物水通道蛋白受汞的抑制,Ea等同于大量溶液中水的扩散(〜5 kcal mol_1)。 水通道蛋白的发现说明了偶发性在生物学研究中的重要性,并且引起了上游流体运输过程中水如何穿过生物膜的范式的完全转变。 这个话题对正常生理学以及影响人类的多种临床疾病的病理生理学非常重要。 水通道蛋白在几乎每一种生物体中被鉴定出来,包括高等哺乳动物,其他脊椎动物,无脊椎动物,植物,真细菌,原细菌和其他微生物,表明这种新认可的蛋白质家族参与了整个自然界的不同生物过程。 一、发现AQP1 红细胞Rh血型抗原不知道参与水运(Heitman&Agre,2000),但是Rh的研究导致了水通道蛋白的偶然发现。用于纯化Rh多肽的生物化学技术产生污染的28kDa多肽(Agre等,1987)。基于洗涤剂中的28kDa蛋白质的相对不溶性,N-月桂酰肌氨酸,开发了产生大量蛋白质的简单纯化系统。红细胞和肾近端小管 - 具有最高已知水渗透性的组织中,28kDa蛋白质显示出非常丰富(Denker等,1988)。此外,28kDa蛋白质表现为四聚体整合膜蛋白 - 通常是膜通道蛋白的特征(Smith&Agre,1991)。使用28kDa多肽的N-末端序列克隆编码来自红细菌文库的269个氨基酸多肽的cDNA(Preston&Agre,1991)。遗传数据库的分析显示了多种物种的同源物,包括微生物和植物,但其分子功能是未知的。 “CHIP28”暂时用于描述这种蛋白质为“28kDa的通道样整合蛋白”。 二、AQP1的结构 AQP1的结构非常有力,因为它具有独特的渗透特性。推导的序列揭示了以前未描述的拓扑,两个串联重复每个由具有两个高度保守的环(B和E)的跨膜结构域形成,包含签名基序,天冬酰胺 - 脯氨酸 - 丙氨酸(NPA)。奇怪的是,重复序列被预测为相对于彼此以180度取向(图2,顶部)。通过在非洲爪蟾卵母细胞中表达AQP1的位点定向插入突变体来证实这种独特的对称性(Preston等人,19994a)。在环路E中,在接近NPA基序的Cys-189处证明了汞抑制的位点。用较大分子量的残基替换NPA侧翼残基的突变体没有表现出水渗透性,表明环E形成水孔的一部分(Preston等,1993)。当环B(Ala-73)中的NPA基序之前的相应位置被半胱氨酸取代时,水分渗透性也受到汞的抑制。当NPA基序侧翼的残基被更大的残基取代时,观察到该环B也表现为似乎形成水孔的一部分。这些研究一起导致了AQP1亚基各自含有部分由“沙漏”形成的内部水孔(图2,底部)的建议,其由从相反的双层折叠成双层的环B和E产生的结构膜的两侧在双层传单之间的中间接触(Jung et al。,1994b)。 1992年,瑞士巴塞尔大学Biozentrum的Andreas Engel和同事们开始了长期合作,随后与日本京都大学的Yoshinori Fujiyoshi及其同事一起解决了AQP1蛋白的结构。使用通过用N-月桂酰肌氨酸预萃取膜囊泡的纯化方法,可以将高达5mg的AQP1纯化成来自一品脱人血液的同质性(Smith&Agre,1991)。当通过透析将高浓度的蛋白质小心地重构成脂质双层体时,形成均匀的晶格(“膜晶体”),其中蛋白质保留其100%的水输送活性(Walz等人1994b)。蛋白质的四聚体组织在低分辨率下明确确定,并且其通过3D电子显微镜测定其在膜中的组织(Walz等人,1994a)。用高达60度的倾斜研磨的精细膜晶体,由我们在京都的同事开发的技术先进的电子显微镜,以3.8Å分辨率产生电子密度图。使用由重组体研究建立的约束,使用AQP1的主序列进行建模产生了AQP1结构的第一个原子模型(Murata等人,2000)。另外一种基于电子显微镜的模型以不同的主链方向以相同的螺旋排列出版(Ren et al.2001)。 与其中四个亚基围绕中心孔的离子通道不同,AQP1作为每个亚单位的四聚体存在含有自己的孔。 在双层传单之间的中间孔的孔径变窄至约3埃。 在这一点上,由跨膜结构域TM1,2,4和5形成的壁是疏水的,而NPA图案中的两个高度保守的Asn-76和Asn-192被并置,如在沙漏模型中预测的那样,提供极性 用于氢键的残基(图3)。 此外,成孔环B和E的末端部分均含有短的α-螺旋,其在膜的中心产生部分正电荷。 这种结构刚好在由残基Phe-56,His-180,Cys-189(汞抑制位点)和Arg-195所包围的2.8A的缩合物之下,Arg-195在精制的AQP1结构中是公认的(de Groot等人2001)。 Arg-195在大水通道蛋白基因家族的所有成员中几乎完全保守,并且在通道的最窄部分提供功能上重要的正电荷。 His-180在中性pH下不带电,但在较低的pH下变质子化,提供第二个正电荷。 Arg-195,His-180和来自孔螺旋的正偶极子在水渗透期间提供抵抗质子(水合氢离子)通过的强排斥电荷。 AQP1的这些结构特征很好地解释了排除较大或带电溶质的最小抗渗透能力。特别地,阻断质子传递的能力澄清了肾脏如何每天从肾小球滤液中重吸收数百升的水,同时排泄酸。重要的是,分辨率为2.2的大肠杆菌同源物GlpF的三维晶体的X射线衍射分析(Fu等人2000)允许对AQP1结构进行改进(de Groot等人,2001),其实质上与模型由2.2 A分辨率的牛AQP1的三维晶体确定(Sui et al。2001)。实时分子动力学模拟表明,在通过NPA图案的并置Asn-76和Asn-192(de Groot&Grubmuller,2001)期间,水的旋转发生。分子动力学研究也由其他研究者进行(Kong&Ma,2001; Tajkhorshid et al.2002)。结构研究和分子动力学模拟对膜水输送过程带来了非常高的原子认知水平。生物医学研究领域的调查人员现在认识到,水通道蛋白提供了水通过生物膜快速和选择性运动的机制。 三、AQP1的分布 1991年11月,丹麦奥胡斯大学的Soren Nielsen及其团队长期合作。 我们的目标是使用光学显微镜和免疫电子显微镜在细胞和亚细胞水平的肾脏和其他组织中定位AQP1(和随后的其他水通道蛋白)。 这些研究为AQP1的生理和病理作用提供了明确的证据,并且在其他部位牢固地预测了同源蛋白的存在。 自20世纪30年代荷马史密斯早期的职业生涯以来,肾脏比其他器官吸引了运输生理学家的兴趣。使用对AQP1蛋白的C末端特异性的亲和纯化抗体和N末端的第二抗体,将AQP1的位置精确地定位在近端小管的顶端刷边界和基底外侧膜(图4)和下降薄来自大鼠肾脏的Henle四肢(Nielsen等,1993c)和人(Maunsbach等,1997)。此外,蛋白质在下垂血管直肠中被鉴定(Pallone等人,1997),其定义了将大量水从管腔转移到间质,然后进入血管空间的途径。 AQP1蛋白质清楚显示仅存在于这些部位的质膜中,而不存在于细胞内部位。因此,建立了这样的范例,即通过AQP1在顶端和基底外侧血浆膜中将水输送穿过近端小管上皮和下肢细胞,其驱动力由通过特异性转运蛋白的溶质的矢量运动产生的小立场渗透梯度提供在这些膜(Nielsen&Agre,1995).. 在其他组织中也证实了AQP1蛋白,其中包括脉络丛(脑脊髓液),前房室内的非色素上皮(房水),胆管细胞(胆汁)和毛细血管内皮等重要分泌作用,包括肺支气管循环 (Nielsen等,1993b)。 重要的是发现肾脏收集管道完全缺乏AQP1,可以很好的预测多种水通道蛋白质的需要。 同样,唾液腺上皮缺乏AQP1蛋白,预测其他同源物的存在。 四、AQP1空人