水通道蛋白解读
- 格式:ppt
- 大小:200.50 KB
- 文档页数:10

浅析水通道蛋白
在我们身体的每一个细胞中,都有一种神奇的蛋白质——水通道蛋白。
它们像细胞的“水门”,帮助水分子快速进出细胞,维持着我们的生命活动。
但你知道吗?水分子通过这些“水门”时,并不需要与水通道蛋白“绑定”哦!
想象一下,如果水分子每次进出细胞都需要与水通道蛋白“握握手”,那得多慢啊!实际上,水通道蛋白的工作方式更像是高速公路上的收费站。
水分子就像车辆,而水通道蛋白就是收费站的那个快速通道。
车辆(水分子)可以快速通过,而不需要停下来和收费站工作人员(水通道蛋白)进行复杂的交互。
科学研究已经证实,水通道蛋白在多种生物体中广泛存在,并在维持细胞内外水平衡、调节体液渗透压等方面发挥重要作用。
它们就像细胞的“水泵”,确保水分子能够按照需要快速、准确地进出细胞。
所以,下次当你喝水或者出汗时,记得感谢你身体里的这些小小“水门”——水通道蛋白。
它们正默默地工作着,确保你的每一个细胞都能得到足够的水分,让你保持健康和活力!。

水通道蛋白的名词解释水通道蛋白是一类存在于生物体细胞膜上的蛋白质,其主要功能是调节细胞内外水分的平衡。
这些蛋白质以其独特的细胞膜通透性,通常被形容为“细胞的水渠”。
尽管细胞膜对水具有一定的渗透性,但水通道蛋白的出现使得水分的跨膜运输变得更加高效和方便。
水通道蛋白主要通过形成一个微小的通道,让水分子直接穿过细胞膜,从而加速细胞内外的水分交换。
水通道蛋白最早被发现于红细胞膜,其中最为著名的是被称为Aquaporin-1(AQP1)的蛋白质。
AQP1被发现能够高效地传输水分子,使其成为研究者们研究水通道蛋白的重要起点。
此后,越来越多的水通道蛋白被发现,它们在各种生物体的细胞膜上广泛存在。
水通道蛋白家族主要包括两类:小分子量蛋白(20~35kDa)和大分子量蛋白(约为50~90kDa)。
小分子量蛋白包括AQP1、AQP2和AQP4等,它们主要负责水分子的传输。
大分子量蛋白则包括AQP0、AQP5和AQP6等,除了与水分交换有关,这些蛋白质还可能参与其他细胞功能的调节。
水通道蛋白在生物体中具有广泛而重要的作用。
例如,在人体内,水通道蛋白在器官和组织中起着维持水分平衡的关键作用。
当体内水分过多或过少时,水通道蛋白能够根据需要调整细胞膜的通透性,控制水分大量吸收或排泄。
这一过程在保持人体内部环境稳定方面非常重要。
此外,水通道蛋白还在植物、昆虫、微生物等生物体中发挥着类似的功能。
在植物体内,水通道蛋白不仅参与了水分的吸收和输送,还对维持细胞渗透稳定性和调节植物生长发育起到了重要作用。
在昆虫和微生物中,水通道蛋白也发挥着类似的水分调节作用,确保它们能够在不同环境下生存和繁衍。
随着科学技术的发展,研究人员对水通道蛋白进行了深入的研究。
他们通过结构生物学、细胞生物学以及分子生物学等多种手段,揭示了水通道蛋白的分子结构和生理功能,并进一步研究了其与疾病之间的关系。
例如,某些疾病,如肾脏功能障碍、肿瘤、水肿等,与水通道蛋白的异常表达或功能失调密切相关。

水通道蛋白水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的水泵”一样。
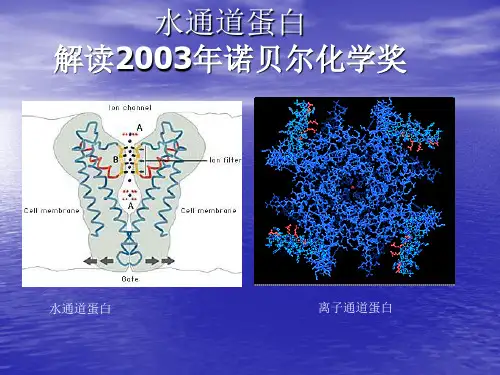
水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。
水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因水通道蛋白的发现编辑Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。
但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 mDNA 注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min 内破裂。
为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
水通道蛋白分类编辑AQP0AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.AQpo的突变可能导致晶状体水肿和白内障。
小鼠缺乏AQPO将患先天性白内障[61]。
AQP1AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一种主要蛋白。

基于水通道蛋白浅析“肾主水”现代医学内涵水通道蛋白(AQPs)是一族细胞跨膜蛋白,许多研究发现AQPs在肾脏中表达的变化对揭示各种疾病导致水代谢平衡紊乱具有重要意义,而中医理论认为“肾主水”功能在维持机体内津液代谢方面起主宰作用,但其作用机制尚需明确,故从分子水平,探讨“肾主水”与水代谢紊乱和AQPs表达之间的关系,可以进一步认识“肾主水”的现代医学内涵,从而为中医药治疗水代谢紊乱疾病提供客观理论依据及新思路。
标签:肾主水;水通道蛋白;水液代谢“肾主水”是肾藏象理论的重要内容之一,如《素问·逆调论》:“肾者水脏,主津液”,中医理论认为“肾主水”对津液代谢的所有环节均起着主持和调节作用,但其作用机制及靶点尚需明确。
AQPs是一族细胞膜上高效转运水分子的特异性孔道蛋白,其对维持机体水平衡有着重要作用,随着近年对AQP1和2在肾脏疾病中功能表达的深入研究,可从分子水平上揭示“肾主水”的现代医学内涵,为临床治疗提供新思路、新方法。
1 AQP1、AQP2的现代研究AQPs是一族细胞膜上高效转运水分子的特异性孔道蛋白。
迄今为止,在哺乳动物体内已发现13个水通道蛋白(AQP0-AQP12)。
现代医学研究发现,AQPs 广泛分布于神经、呼吸、消化、泌尿等系统的组织细胞中,而肾脏作为维持机体水代谢平衡最重要的器官,至少存在9种水通道蛋白(AQP1-AQP8和AQP11),是体内AQPs含量最高、分布亚型最多的组织[1-3],因此,研究AQPs在肾脏中表达的变化对于揭示肾脏疾病导致水代谢平衡紊乱的机理具有重要意义。
而在水通道蛋白中AQP1、AQP2对机体水平衡、体液容量、渗透压等调节都尤为重要。
AQP1主要分布于在肾脏近端小管的顶质膜和基底侧膜,以及髓襻降支细段和直小血管降支。
AQP1在肾脏近曲小管等重吸收过程和尿液浓缩中起重要作用,正常成人每日肾小球滤液约90%经AQP1转运,离体实验证明,AQP1缺失导致近曲小管和亨利袢降支细段的渗透性及重吸收能力降低,逆流倍增系统遭破坏,AQP1基因敲除小鼠可出现尿液浓缩功能严重受损,表现为多尿、多饮,在限制进水的情况下会出现较对照组更为严重的脱水现象[4]。

水通道蛋白结构水通道蛋白(aquaporin)是一种在细胞膜上广泛存在的蛋白质。
它们扮演着调节细胞内外水分平衡的重要角色。
本文将从水通道蛋白的结构、功能和应用等方面进行阐述。
一、水通道蛋白的结构水通道蛋白是一类跨膜蛋白,由六个跨膜α螺旋构成。
这些α螺旋呈现出一种特殊的编折结构,形成了一个水分子通过的通道。
通道的内部是由高度保守的氨基酸残基组成,这些残基能够与水分子形成氢键,从而促进水分子的快速通过。
二、水通道蛋白的功能水通道蛋白的主要功能是通过调节细胞膜的通透性来控制细胞内外的水分平衡。
它们可以快速而选择性地促进水分子的跨膜运输,而阻止离子和其他溶质的通过。
这种高度选择性的水通透性使得细胞能够维持稳定的细胞内环境。
三、水通道蛋白的亚型水通道蛋白有多个亚型,其中最为典型的是AQP1、AQP2和AQP3。
AQP1广泛分布于许多组织和器官中,参与维持细胞内外液体平衡;AQP2主要存在于肾小管上皮细胞中,调节尿液的浓缩和稀释;AQP3主要分布在皮肤和肾脏中,参与水分的吸收和排泄。
这些不同的亚型在不同组织和器官中发挥着特定的生理功能。
四、水通道蛋白的应用水通道蛋白在许多领域都有重要的应用价值。
例如,在生物医学研究中,水通道蛋白可以作为肿瘤标志物,用于癌症的诊断和治疗。
此外,水通道蛋白还可以用于制备高效的水处理膜,用于海水淡化和废水处理等领域。
此外,水通道蛋白还被应用于药物传递系统的设计和开发,以提高药物的透过性。
因此,水通道蛋白的研究和应用具有广阔的前景。
总结:水通道蛋白是一类重要的蛋白质,通过调节细胞膜的通透性来控制细胞内外的水分平衡。
它们的结构独特,具有高度的水选择性通透性。
水通道蛋白有多个亚型,在不同组织和器官中发挥着特定的功能。
此外,水通道蛋白还具有广泛的应用价值,可以用于肿瘤诊断和治疗、水处理和药物传递系统等领域。
随着对水通道蛋白的深入研究,我们对其机制和应用的理解将进一步加深,为生命科学和工程技术的发展提供更多的可能性。

水通道蛋白与泌尿外科疾病很早以前,生理学家就认识到水的跨膜转运除了简单扩散外,还存在某种特殊的水转运机制,并提出了水通道概念。
1991年Agre等[1]首先克隆了相对分子质量为28 000的水通道蛋白(AQP),称为AQP1(aquaporin1),并证明具有将细胞外的水转运至细胞内的功能。
随后发现了一大家族具有高选择性水通道功能的膜蛋白分子,共有6种,统称为AQP,存在于多种组织细胞的质膜中。
在涉及到水平衡紊乱的疾病中,尤其是在泌尿外科某些疾病,如多囊肾、肾癌、双侧输尿管梗阻后利尿以及结石形成的研究中有重要意义。
一、水通道的分类及在组织中的分布1.AQP1首先被定性为水通道蛋白,称之为CHIP(channel integrated protein),用免疫组化、免疫电镜及分子生物学技术发现AQP1在机体许多组织中有表达,如平滑肌和子宫组织[2],肾脏的近曲小管和髓襻降支细胞上皮的顶膜及基侧膜。
此外,在涉及水转运的其它组织中亦发现有AQP1显著表达,如角膜的内皮细胞、脉络膜网、肝胆管上皮细胞、胆囊颈内壁、汗腺上皮、支气管和肺泡上皮、唾液腺上皮、结肠、脾脏和毛细血管内皮[3]。
在淋巴管和粘膜下毛细血管的AQP1,能促进吸收的水迅速进入淋巴管和毛细血管床,维持机体的内环境稳定。
2.AQP2是血管加压素调控的水通道蛋白,位于肾集合管的顶质膜上,对尿浓缩起重要作用,在肾外尚未发现有表达,它与AQP1 cDNA有42%的同源性。
该基因突变可产生常染色体隐性遗传病即肾源性尿崩症[4],表现为血清抗利尿激素水平明显增高,而尿不被浓缩。
它与X连锁的肾源性尿崩症不同,该疾病为抗利尿激素V2受体基因突变所致。
刺激V2受体,肾集合管顶质膜AQP2表达明显增高。
锂剂可以抑制它的表达,因而可以解释锂剂的副作用,这种作用限制了它在治疗精神病中的作用。
3.AQP3是肾脏集合管和胃肠道表达的另一型水通道蛋白,主要分布在集合管的上皮细胞的基侧膜,该部位水的通透性被认为是不可调节的。

水通道蛋白水通道- 从原子结构到临床医学生物膜的透水性在生理学上是一个长期存在的问题,但负责此类蛋白质的蛋白质仍然未知,直到发现水通道蛋白1(AQP1)水通道蛋白。
AQP1由渗透梯度驱动的水选择性渗透。
人类AQP1的原子结构最近被定义。
四聚体的每个亚基含有允许水分子单文件通过但中断氢键通过质子所需的单独水孔。
已经鉴定了至少10种哺乳动物水通道蛋白,并且它们被水(水通道蛋白)或水加甘油(水甘油聚糖)选择性渗透。
表达位点与临床表型密切相关,从先天性白内障到肾源性尿崩症。
在植物,微生物,无脊椎动物和脊椎动物中发现超过200个水通道蛋白家族成员,并且它们对这些生物体的生理学的重要性正在被揭开。
在20世纪20年代发现脂质双层提供了当沐浴在较低或较高pH或含有毒性浓度的Ca2 +或其他溶质的细胞外液中时细胞如何维持其最佳细胞内环境的解释。
从1950年代开始发现离子通道,交换剂和共转运体为溶质的跨膜运动提供了分子解释。
然而,长期以来,假定水的输送是由于通过脂质双层的简单扩散。
来自具有高膜渗透性的多个实验系统的观察,例如两栖膀胱和哺乳动物红细胞,表明通过脂质双层的扩散不是水跨越膜的唯一途径。
虽然提出了各种解释,但直到10年前发现AQP1才能知道分子水- 特异性转运蛋白(Preston 等,1999)。
现在人们普遍同意扩散和通道介导的水分运动都存在。
通过所有生物膜以相对较低的速度发生扩散。
水通道蛋白水通道发现于上皮细胞的一部分10至100倍的水渗透能力。
值得注意的是,水通道蛋白水通道的选择性非常高,甚至质子(H3O +)被排斥。
在大多数组织中,扩散是双向的,因为水进入细胞并从细胞释放,而水通道蛋白介导的体内水流则由渗透或液压梯度引导。
扩散的化学抑制剂是未知的,扩散发生在高Ea(Arrhenius活化能)。
相比之下,大多数哺乳动物水通道蛋白受汞的抑制,Ea等同于大量溶液中水的扩散(〜5 kcal mol_1)。
水通道蛋白的发现说明了偶发性在生物学研究中的重要性,并且引起了上游流体运输过程中水如何穿过生物膜的范式的完全转变。

水通道蛋白概述水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的帮浦”一样。
水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。
水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因。
水通道蛋白的发现Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。
但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 eDNA注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min内破裂。
为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
水通道蛋白分类AQP0AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.hQpo的突变可能导致晶状体水肿和白内障。
小鼠缺乏AQPO将患先天性自内障[61。
AQP1AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一种主要蛋白。


水通道蛋白水通道蛋白是介导水跨膜转运的一大膜蛋白家族,分布于高等脊椎动物上皮细胞或内皮细胞。
结构上由28-KDa 亚单位组成四聚体,每个亚单位构成孔径约的水孔通道,在渗透压驱动下实现水双向跨膜转运【1】。
目前11 种亚型已经在哺乳动物中被确定,各种亚型的体内分布具有组织特异性,其中水通道蛋白-4 (Aquaporin 4,AQP4)以极化形式集中分布于中枢神经系统脑毛细血管周边的星形胶质细胞足突或室管膜细胞【2】。
血脑屏障为脑内另一调控水平衡的复合体,由无窗孔的脑毛细血管内皮细胞及细胞间紧密连接、基底膜、星形胶质细胞等组成,介于血液和中枢神经系统之间,限制血液中某些离子、大分子物质转移到脑实质,此屏障作用为维持CNS 内环境稳定、保障脑功能正常行使提供了重要保障。
BBB 分化发育过程中脑毛细血管内皮细胞间紧密连接的形成虽被认为是其成熟的标志,但BBB 生理功能的实现有赖于各组成成分间的相互作用。
近来对星形胶质细胞调控BBB 物质交换和脑内水平衡方面的作用日益受到重视,并认为与AQP4 表达有关。
本文就AQP4 与血脑屏障发育及其完整性关系的研究进展作一综述。
分化发育过程中AQP4 的表达目前由于对鸡胚视顶盖中血管及BBB 分化的研究已较完善,因此常被用于BBB 的研究模型。
Nico 及其同事【3】采用免疫细胞化学、分子生物学技术研究了鸡胚视顶盖AQP4 在BBB 分化发育过程的动态表达。
免疫电镜显示鸡胚视顶盖发育第9 d,BBB仅由不规则的内皮细胞组成,内皮细胞间紧密连接尚未形成,AQP4 未见表达。
待发育至第14 d,Western blot 技术首次在约30 kDa 链附近检测出AQP4 的免疫活性,电镜下显示短的内皮细胞间紧密连接已形成,并串联构成BBB 的微血管,星形胶质细胞间断黏附于血管壁,AQP4 不连续地表达于血管周边,血管周围仍然存在小空隙。
发育第20 d BBB 成熟,内皮细胞间紧密连接形成,BBB 微血管被星形胶质细胞紧紧包被,血管周边星形胶质细胞足突上的AQP4 呈现强阳性表达,且冷冻断裂研究显示AQP4 的正交排列阵也同步形成。
水通道蛋白结构水通道蛋白(aquaporin)是一类存在于细胞膜上的蛋白质,其主要功能是调控细胞内外水分的运输。
水通道蛋白的结构具有一定的特点,这些特点使其能够高效地传递水分子,并在维持生物体内水平衡中发挥重要作用。
水通道蛋白的结构由一系列螺旋状的α螺旋和两个高度保守的氨基酸残基NPA(天冬氨酸-丙氨酸-天冬氨酸)序列组成。
这些α螺旋通过跨膜区域连接在一起,形成了一个通道。
水分子通过这个通道进出细胞膜,实现水的快速传输。
水通道蛋白的结构具有高度的选择性和通透性。
其选择性是由通道内存在的氨基酸残基决定的。
水分子通过水通道蛋白时,其氢键与蛋白内的氨基酸残基形成相互作用,这种相互作用有助于水分子的选择性传输。
与水分子大小相似的分子,如甘油和尿素,也能通过水通道蛋白,但其通透性要低于水分子。
水通道蛋白的通道内部具有高度的亲水性。
这是因为通道内部存在大量的亲水氨基酸残基,如精氨酸和赖氨酸。
这些氨基酸残基能够与水分子形成氢键,从而增强通道内的亲水性,有利于水分子的传输。
水通道蛋白的结构还具有调节功能。
研究发现,水通道蛋白的通道内部存在着一些调节位点,这些位点能够与一些小分子物质或离子相互作用,从而影响水通道蛋白的通透性。
例如,一些药物和离子能够结合到水通道蛋白上,改变其通透性,从而调节细胞内外水分的平衡。
水通道蛋白的结构与其功能密切相关。
水分子在生物体内的传输对于维持细胞内外水分平衡至关重要。
水通道蛋白通过其独特的结构,实现了水分子的快速传输和选择性通透,从而维持了细胞内外水分的平衡。
水通道蛋白的结构研究不仅有助于深入理解生物体内水分调节的机制,还为开发新型药物和治疗水分失衡相关疾病提供了重要的理论基础。
总结起来,水通道蛋白的结构由α螺旋和NPA序列组成,具有高度的选择性和通透性。
通道内部具有亲水性和调节位点,能够实现水分子的快速传输和选择性通透,维持细胞内外水分平衡。
水通道蛋白的结构研究对于了解水分调节机制、开发新药物具有重要意义。
水通道蛋白质4
水通道蛋白4是一种小的完整膜蛋白,在大脑中强烈表达。
它在围绕脑血管系统的星形细胞尾足的近腔侧具有高度极化的表达,并且还在软膜下和室管膜下星形胶质细胞突起以及室管膜细胞的基底外侧膜上表达。
水通道蛋白4主要参与双向水通量,但也具有多种作用,例如Ca²⁺信号传导、K⁺缓冲、神经炎症和废物清除。
水通道蛋白4诱导的星形胶质细胞水运动已被证明是促进血管旁间隙清除如淀粉样蛋白β的驱动力。
来自英国利物浦大学的Adjanie Patabendige团队认为,在缺血性卒中的早期阶段使用水通道蛋白4抑制剂会导致癫痫发作,因为水通道蛋白4依赖性神经兴奋涉及脑细胞外液中的K⁺/水偶联,因此限制了水通道蛋白4调节剂在癫痫患者中的使用。
需要注意的是,水通道蛋白4的调节需要进一步的研究来更好地理解其潜在的分子机制,这将有利于开发减少细胞毒性水肿的有效治疗策略。
如果成功,可能会创造一个有利于神经保护和神经再生的环境,从而减少与缺血性卒中相关的神经损伤。
水通道蛋白名词解释
水通道蛋白(aquaporin)是一类存在于细胞膜上的跨膜蛋白,其功能是调节细胞内外水分的平衡。
水通道蛋白是由8个跨膜α螺旋结构组成,形成一个具有水分子通过能力的通道。
它们广泛存在于多种生物体的细胞膜上,包括植物、动物和微生物等。
水通道蛋白的主要功能是促进水分子在细胞膜上的快速跨膜传递。
由于水分子是极性的,无法通过细胞膜的疏水层,而水通道蛋白则提供了一个高度选择性通道,使水分子能够迅速通过细胞膜而不受阻碍。
水通道蛋白的通道结构限制了其他溶质的通过,从而确保水分子的优先通道。
除了调节水分平衡外,水通道蛋白还在细胞内外水分调节以及保护细胞免受渗透压和压力变化等环境因素的影响中发挥重要作用。
在植物中,水通道蛋白在根系中的表达调控了植物对于土壤中水分的吸收和利用。
在人体中,水通道蛋白在肾脏、眼睛和脑组织等重要器官中的表达与正常的水平维持和离子浓度平衡密切相关。
水通道蛋白的发现为我们深入了解细胞内外水分平衡的调控机制提
供了重要的线索。
通过研究水通道蛋白的结构和功能,人们可以进一步探索其在疾病发生和发展中的作用,为相关疾病的治疗和预防提供新的策略和途径。
水通道蛋白4-水通道蛋白家族是近些年来逐渐被发现的一类水特异性膜内在蛋白水通道蛋白4-水通道蛋白家族是近些年来逐渐被发现的一类水特异性膜内在蛋白,迄今已在哺乳动物的脑内已发现7种水通道蛋白,其中水通道蛋白4为主要在脑组织中表达的水通道蛋白,参与了脑缺血、脑损伤、脑水肿等病理生理过程。
学术术语来源---骨髓间充质干细胞移植联合依达拉奉抑制脑梗死后的神经元凋亡文章亮点:1 文章以脑梗死大鼠模型为实验对象,探讨骨髓间充质干细胞移植联合依达拉奉对水通道蛋白4、Bcl-2、脑源性神经营养因子在大鼠脑梗死区域表达的影响,创新性地从分子生物学角度分析依达拉奉联合骨髓间充质干细胞移植治疗对脑梗死组织的保护作用。
2 结果显示,依达拉奉可在清除自由基和抑制脂质过氧化反应后,降低大鼠脑梗死周围组织水通道蛋白4的表达,提高Bcl-2、脑源性神经营养因子的表达,可明显改善大鼠的神经学功能,减少移植细胞的凋亡。
依达拉奉联合骨髓间充质干细胞移植对脑梗死大鼠的治疗效果优于单纯治疗组。
关键词:干细胞;骨髓干细胞;骨髓间充质干细胞;依达拉奉;水通道蛋白4;bcl-2基因;脑源性神经营养因子;脑梗死主题词:干细胞;间质干细胞;水通道蛋白质4;基因,bcl-2;脑源性神经营养因子摘要背景:国内外多项研究证实骨髓间充质干细胞移植对脑梗死组织具有一定的神经保护作用。
依达拉奉是一种新型强效小分子羟自由基清除剂,可通过清除脑梗死产生的自由基,抑制神经细胞损伤,从而起到脑保护作用。
目的:观察骨髓间充质干细胞移植联合依达拉奉对大鼠脑梗死组织水通道蛋白4、Bcl-2、脑源性神经营养因子表达的影响。
方法:选取Wistar大鼠80只,建立右侧大脑中动脉闭塞模型,随机分为对照组、骨髓间充质干细胞组、依达拉奉组和联合治疗组。
建模6 h后通过尾静脉分别注入移植液,对照组注射培养液,骨髓间充质干细胞组注射骨髓间充质干细胞,依达拉奉组给予依达拉奉注射液,联合组同时注入骨髓间充质干细胞和依达拉奉注射液。