水通道蛋白的基本结构与特异性通透机理
- 格式:doc
- 大小:534.00 KB
- 文档页数:5

水通道蛋白结构水通道蛋白是一类在生物体中起着重要作用的蛋白质。
它们存在于细胞膜上,形成了细胞膜的一种通道,能够允许水分子快速通过细胞膜。
水通道蛋白的发现和研究为我们理解细胞内外液体平衡以及水分运输提供了重要的线索。
水通道蛋白最早是在1980年代被发现的,研究者发现一种叫做水通道蛋白1(Aquaporin-1,简称AQP1)的蛋白质在红细胞膜上表达,能够加速水分子通过细胞膜。
这项发现引起了科学家们的广泛关注,并在接下来的几十年里,研究人员陆续发现了多种水通道蛋白。
水通道蛋白的结构非常特殊,它们由多个亲水性的氨基酸残基组成,形成了一条通道,通道中心是一个疏水性的区域,能够排斥离子和其他溶质,只允许水分子通过。
水通道蛋白的结构使其具有高度选择性和通透性,能够快速而特异地传输水分子。
水通道蛋白的结构在进化过程中发生了一些变化,目前已经发现了多种类型的水通道蛋白。
其中,AQP1是最早被发现的一种,广泛存在于多种细胞类型中,包括红细胞、肾脏和眼睛等。
AQP1的结构由四个相同的亚单位组成,每个亚单位由六个跨膜螺旋组成,形成了一个中央水通道。
除了AQP1之外,还有其他类型的水通道蛋白,如AQP2、AQP3等。
它们在组织和细胞中的分布具有一定的特异性,发挥着不同的生理功能。
例如,AQP2主要存在于肾脏中,调节尿液的浓缩和稀释;AQP3主要存在于皮肤和肠道中,参与水分的吸收和散发。
水通道蛋白的功能不仅仅局限于水分的传输,它们还参与了一系列重要的生理过程。
例如,水通道蛋白在维持细胞内外液体平衡方面发挥着重要作用。
细胞内外液体平衡的失调会导致细胞的肿胀或收缩,影响细胞的正常功能。
水通道蛋白能够调节细胞内外水分的平衡,保持细胞内外环境的稳定。
水通道蛋白还参与了一些特殊细胞功能的实现。
例如,在肾脏中,水通道蛋白能够调节尿液的浓缩和稀释,帮助维持体内水分的平衡。
在眼睛中,水通道蛋白参与了眼内房水的生成和排泄,维持了眼压的稳定。

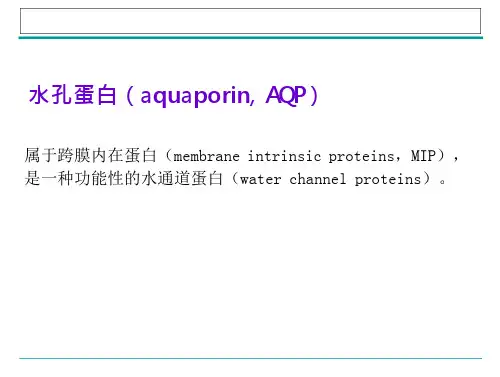
水通道蛋白水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的水泵”一样。
水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。
水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因水通道蛋白的发现编辑Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。
但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 mDNA 注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min 内破裂。
为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
水通道蛋白分类编辑AQP0AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.AQpo的突变可能导致晶状体水肿和白内障。
小鼠缺乏AQPO将患先天性白内障[61]。
AQP1AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一种主要蛋白。

水通道蛋白结构水通道蛋白(aquaporin)是一种在细胞膜上广泛存在的蛋白质。
它们扮演着调节细胞内外水分平衡的重要角色。
本文将从水通道蛋白的结构、功能和应用等方面进行阐述。
一、水通道蛋白的结构水通道蛋白是一类跨膜蛋白,由六个跨膜α螺旋构成。
这些α螺旋呈现出一种特殊的编折结构,形成了一个水分子通过的通道。
通道的内部是由高度保守的氨基酸残基组成,这些残基能够与水分子形成氢键,从而促进水分子的快速通过。
二、水通道蛋白的功能水通道蛋白的主要功能是通过调节细胞膜的通透性来控制细胞内外的水分平衡。
它们可以快速而选择性地促进水分子的跨膜运输,而阻止离子和其他溶质的通过。
这种高度选择性的水通透性使得细胞能够维持稳定的细胞内环境。
三、水通道蛋白的亚型水通道蛋白有多个亚型,其中最为典型的是AQP1、AQP2和AQP3。
AQP1广泛分布于许多组织和器官中,参与维持细胞内外液体平衡;AQP2主要存在于肾小管上皮细胞中,调节尿液的浓缩和稀释;AQP3主要分布在皮肤和肾脏中,参与水分的吸收和排泄。
这些不同的亚型在不同组织和器官中发挥着特定的生理功能。
四、水通道蛋白的应用水通道蛋白在许多领域都有重要的应用价值。
例如,在生物医学研究中,水通道蛋白可以作为肿瘤标志物,用于癌症的诊断和治疗。
此外,水通道蛋白还可以用于制备高效的水处理膜,用于海水淡化和废水处理等领域。
此外,水通道蛋白还被应用于药物传递系统的设计和开发,以提高药物的透过性。
因此,水通道蛋白的研究和应用具有广阔的前景。
总结:水通道蛋白是一类重要的蛋白质,通过调节细胞膜的通透性来控制细胞内外的水分平衡。
它们的结构独特,具有高度的水选择性通透性。
水通道蛋白有多个亚型,在不同组织和器官中发挥着特定的功能。
此外,水通道蛋白还具有广泛的应用价值,可以用于肿瘤诊断和治疗、水处理和药物传递系统等领域。
随着对水通道蛋白的深入研究,我们对其机制和应用的理解将进一步加深,为生命科学和工程技术的发展提供更多的可能性。



水通道蛋白水通道- 从原子结构到临床医学生物膜的透水性在生理学上是一个长期存在的问题,但负责此类蛋白质的蛋白质仍然未知,直到发现水通道蛋白1(AQP1)水通道蛋白。
AQP1由渗透梯度驱动的水选择性渗透。
人类AQP1的原子结构最近被定义。
四聚体的每个亚基含有允许水分子单文件通过但中断氢键通过质子所需的单独水孔。
已经鉴定了至少10种哺乳动物水通道蛋白,并且它们被水(水通道蛋白)或水加甘油(水甘油聚糖)选择性渗透。
表达位点与临床表型密切相关,从先天性白内障到肾源性尿崩症。
在植物,微生物,无脊椎动物和脊椎动物中发现超过200个水通道蛋白家族成员,并且它们对这些生物体的生理学的重要性正在被揭开。
在20世纪20年代发现脂质双层提供了当沐浴在较低或较高pH或含有毒性浓度的Ca2 +或其他溶质的细胞外液中时细胞如何维持其最佳细胞内环境的解释。
从1950年代开始发现离子通道,交换剂和共转运体为溶质的跨膜运动提供了分子解释。
然而,长期以来,假定水的输送是由于通过脂质双层的简单扩散。
来自具有高膜渗透性的多个实验系统的观察,例如两栖膀胱和哺乳动物红细胞,表明通过脂质双层的扩散不是水跨越膜的唯一途径。
虽然提出了各种解释,但直到10年前发现AQP1才能知道分子水- 特异性转运蛋白(Preston 等,1999)。
现在人们普遍同意扩散和通道介导的水分运动都存在。
通过所有生物膜以相对较低的速度发生扩散。
水通道蛋白水通道发现于上皮细胞的一部分10至100倍的水渗透能力。
值得注意的是,水通道蛋白水通道的选择性非常高,甚至质子(H3O +)被排斥。
在大多数组织中,扩散是双向的,因为水进入细胞并从细胞释放,而水通道蛋白介导的体内水流则由渗透或液压梯度引导。
扩散的化学抑制剂是未知的,扩散发生在高Ea(Arrhenius活化能)。
相比之下,大多数哺乳动物水通道蛋白受汞的抑制,Ea等同于大量溶液中水的扩散(〜5 kcal mol_1)。
水通道蛋白的发现说明了偶发性在生物学研究中的重要性,并且引起了上游流体运输过程中水如何穿过生物膜的范式的完全转变。

水通道蛋白概述水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的帮浦”一样。
水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。
水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因。
水通道蛋白的发现Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。
但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 eDNA注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min内破裂。
为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
水通道蛋白分类AQP0AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.hQpo的突变可能导致晶状体水肿和白内障。
小鼠缺乏AQPO将患先天性自内障[61。
AQP1AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一种主要蛋白。



水孔蛋白名词解释1. 引言水孔蛋白是一类在生物界广泛存在的蛋白质,它们在细胞膜上形成通道以便于水分子和其他小分子通过。
本文将对水孔蛋白进行详细解释和探讨。
2. 什么是水孔蛋白水孔蛋白是一类跨越细胞膜的蛋白质,主要功能是通过形成疏水通道调节细胞内外的水分子和其他小分子的运输。
水孔蛋白在细胞生理过程中起着重要的作用,如细胞内离子平衡维持、细胞体积调节和细胞间通信等。
3. 水孔蛋白的结构水孔蛋白通常由具有多个跨膜α螺旋结构的亚单位组成,这些亚单位可以组合成一个或多个蛋白质复合物。
水孔蛋白的通道区域一般由高度保守的氨基酸残基构成,这些残基可以形成疏水性的环境,以促使水和其他小分子的通过。
3.1 水孔蛋白的分类根据其结构和功能的差异,水孔蛋白可以分为不同的类别。
目前已经发现的水孔蛋白有甲烷水孔蛋白、非甲烷水孔蛋白以及离子水孔蛋白等。
3.2 水孔蛋白的通道大小水孔蛋白的通道大小是其功能的重要特征之一。
通道大小可以通过测量水分子在通道中的运动速率来确定。
较大的通道可以允许更多的水分子通过,而较小的通道则对大分子的通过具有选择性。
3.3 水孔蛋白的调节水孔蛋白的活性和通透性可以通过多种方式进行调节,如磷酸化、蛋白质相互作用和温度等。
这些调节机制可以根据细胞内外环境的需要来改变水孔蛋白的功能,以维持细胞内外水分的平衡。
4. 水孔蛋白在生物体中的功能水孔蛋白在生物体中起着多种重要的功能。
以下是水孔蛋白的一些主要功能:4.1 细胞内外水分平衡维持水孔蛋白通过细胞膜上的通道调节细胞内外水分子的流动,从而维持细胞内外水分的平衡。
这对于细胞的正常生理活动和稳态维持至关重要。
4.2 细胞体积调节当细胞受到外界刺激或环境变化时,水孔蛋白可以调节细胞内外水分子的流动,从而帮助细胞实现体积的调节和平衡。
4.3 细胞间通信某些类型的水孔蛋白可以作为细胞间通信的通道,促进细胞之间的信号传递和物质交换。
这种细胞间通信对于多细胞生物的组织发育和协调功能至关重要。
水通道蛋白水通道蛋白是介导水跨膜转运的一大膜蛋白家族,分布于高等脊椎动物上皮细胞或内皮细胞。
结构上由28-KDa 亚单位组成四聚体,每个亚单位构成孔径约的水孔通道,在渗透压驱动下实现水双向跨膜转运【1】。
目前11 种亚型已经在哺乳动物中被确定,各种亚型的体内分布具有组织特异性,其中水通道蛋白-4 (Aquaporin 4,AQP4)以极化形式集中分布于中枢神经系统脑毛细血管周边的星形胶质细胞足突或室管膜细胞【2】。
血脑屏障为脑内另一调控水平衡的复合体,由无窗孔的脑毛细血管内皮细胞及细胞间紧密连接、基底膜、星形胶质细胞等组成,介于血液和中枢神经系统之间,限制血液中某些离子、大分子物质转移到脑实质,此屏障作用为维持CNS 内环境稳定、保障脑功能正常行使提供了重要保障。
BBB 分化发育过程中脑毛细血管内皮细胞间紧密连接的形成虽被认为是其成熟的标志,但BBB 生理功能的实现有赖于各组成成分间的相互作用。
近来对星形胶质细胞调控BBB 物质交换和脑内水平衡方面的作用日益受到重视,并认为与AQP4 表达有关。
本文就AQP4 与血脑屏障发育及其完整性关系的研究进展作一综述。
分化发育过程中AQP4 的表达目前由于对鸡胚视顶盖中血管及BBB 分化的研究已较完善,因此常被用于BBB 的研究模型。
Nico 及其同事【3】采用免疫细胞化学、分子生物学技术研究了鸡胚视顶盖AQP4 在BBB 分化发育过程的动态表达。
免疫电镜显示鸡胚视顶盖发育第9 d,BBB仅由不规则的内皮细胞组成,内皮细胞间紧密连接尚未形成,AQP4 未见表达。
待发育至第14 d,Western blot 技术首次在约30 kDa 链附近检测出AQP4 的免疫活性,电镜下显示短的内皮细胞间紧密连接已形成,并串联构成BBB 的微血管,星形胶质细胞间断黏附于血管壁,AQP4 不连续地表达于血管周边,血管周围仍然存在小空隙。
发育第20 d BBB 成熟,内皮细胞间紧密连接形成,BBB 微血管被星形胶质细胞紧紧包被,血管周边星形胶质细胞足突上的AQP4 呈现强阳性表达,且冷冻断裂研究显示AQP4 的正交排列阵也同步形成。
水通道蛋白结构水通道蛋白(aquaporin)是一类存在于细胞膜上的蛋白质,其主要功能是调控细胞内外水分的运输。
水通道蛋白的结构具有一定的特点,这些特点使其能够高效地传递水分子,并在维持生物体内水平衡中发挥重要作用。
水通道蛋白的结构由一系列螺旋状的α螺旋和两个高度保守的氨基酸残基NPA(天冬氨酸-丙氨酸-天冬氨酸)序列组成。
这些α螺旋通过跨膜区域连接在一起,形成了一个通道。
水分子通过这个通道进出细胞膜,实现水的快速传输。
水通道蛋白的结构具有高度的选择性和通透性。
其选择性是由通道内存在的氨基酸残基决定的。
水分子通过水通道蛋白时,其氢键与蛋白内的氨基酸残基形成相互作用,这种相互作用有助于水分子的选择性传输。
与水分子大小相似的分子,如甘油和尿素,也能通过水通道蛋白,但其通透性要低于水分子。
水通道蛋白的通道内部具有高度的亲水性。
这是因为通道内部存在大量的亲水氨基酸残基,如精氨酸和赖氨酸。
这些氨基酸残基能够与水分子形成氢键,从而增强通道内的亲水性,有利于水分子的传输。
水通道蛋白的结构还具有调节功能。
研究发现,水通道蛋白的通道内部存在着一些调节位点,这些位点能够与一些小分子物质或离子相互作用,从而影响水通道蛋白的通透性。
例如,一些药物和离子能够结合到水通道蛋白上,改变其通透性,从而调节细胞内外水分的平衡。
水通道蛋白的结构与其功能密切相关。
水分子在生物体内的传输对于维持细胞内外水分平衡至关重要。
水通道蛋白通过其独特的结构,实现了水分子的快速传输和选择性通透,从而维持了细胞内外水分的平衡。
水通道蛋白的结构研究不仅有助于深入理解生物体内水分调节的机制,还为开发新型药物和治疗水分失衡相关疾病提供了重要的理论基础。
总结起来,水通道蛋白的结构由α螺旋和NPA序列组成,具有高度的选择性和通透性。
通道内部具有亲水性和调节位点,能够实现水分子的快速传输和选择性通透,维持细胞内外水分平衡。
水通道蛋白的结构研究对于了解水分调节机制、开发新药物具有重要意义。
细胞质膜的通透性与水水孔蛋白通透效应的观察1. 引言细胞是生物体的基本组成单位,通过细胞膜与外界环境进行物质交换和信息传递。
细胞质膜作为细胞内外环境的隔离屏障,其通透性对细胞的生命活动起着至关重要的作用。
细胞质膜的通透性主要由水水孔蛋白调控,本文就细胞质膜的通透性与水水孔蛋白通透效应展开观察与研究。
2. 细胞质膜的结构与功能细胞质膜是由磷脂双层构成的,其主要功能是将细胞内外环境分隔开来,维持细胞内部稳定的内环境。
细胞质膜除了充当屏障的功能外,还具有选择性渗透的特性,即只允许特定物质通过。
这种选择性渗透是由细胞膜上的水水孔蛋白调控的。
3. 水水孔蛋白的通透效应水水孔蛋白是细胞膜上的一类跨膜蛋白,其特点是具有高度的通透性,可以让水分子快速穿过膜层进行物质交换和溶质扩散。
水水孔蛋白的结构特点是由众多亚基组成的,亚基之间形成了一系列的通道。
这些通道大小适中,可以容纳水分子的通过,但对较大的溶质则具有一定的选择性。
4. 细胞质膜通透性的调控机制细胞质膜的通透性主要由水水孔蛋白进行调控。
水分子通过水水孔蛋白快速穿过细胞质膜,从而实现物质的交换。
水水孔蛋白的通透效应可以通过多种因素进行调控,包括温度、物质浓度、细胞质膜的厚度和分子大小等。
5. 细胞质膜通透性的研究方法研究细胞质膜的通透性需要一些特定的实验方法。
常用的方法包括渗透值测定、电生理学方法、光学技术和分子动力学模拟方法等。
这些方法可以从不同角度对细胞质膜的通透性进行观察和研究。
6. 实验结果与讨论通过实验方法的应用,我们可以观察到细胞质膜的通透性与水水孔蛋白通透效应之间的关系。
实验结果显示,水水孔蛋白能够显著提高细胞质膜的通透性,增强细胞对外界环境的物质吸收和排泄能力。
而在水水孔蛋白功能异常的情况下,细胞质膜的通透性会受到影响,导致细胞内部环境的不稳定。
7. 结论细胞质膜的通透性与水水孔蛋白通透效应密切相关。
水水孔蛋白能够调控细胞质膜的通透性,使细胞能够更好地与外部环境进行物质交换和信息传递。
水通道蛋白作用原理嘿,朋友们!今天咱来聊聊水通道蛋白的作用原理,这可真是个神奇的玩意儿啊!你看啊,水通道蛋白就像是一扇扇特别的小门,专门让水分子快速通过。
这就好比是在一个拥挤的人群中,有了专门的通道让特定的人快速通过一样。
想象一下,细胞就像一个小房子,里面需要水来维持各种活动。
如果没有水通道蛋白,水分子就得慢悠悠地挤进去,那多耽误事儿啊!但有了水通道蛋白,水分子就可以顺畅地进进出出啦。
这些水通道蛋白可挑剔了呢,它们只让水分子通过,其他的分子想混进去,门儿都没有!这就像一个严格的守卫,只放自己认识的人进去。
它们是怎么做到这么精准的呢?原来啊,水通道蛋白的结构特别巧妙。
它有一个合适的形状和大小,刚好能让水分子舒舒服服地通过。
这就好像是为水分子量身定制的通道一样。
而且哦,水通道蛋白的工作效率超高的!它们能在很短的时间内让大量的水分子通过。
这要是换成我们人类来干这活儿,那得累个半死吧!水通道蛋白在我们身体里的作用可大了去了。
比如在肾脏里,它们帮助过滤和重吸收水分,让我们的身体能保持水分平衡。
要是没有它们,我们的身体可就乱套啦!在我们的细胞里,水通道蛋白就像一群勤劳的小蜜蜂,默默地工作着,保障着细胞的正常运转。
没有它们,细胞可能就会变得干巴巴的,没法好好工作啦。
你说神奇不神奇?水通道蛋白虽然小小的,可它们的作用却是大大的呀!它们就像是我们身体里的无名英雄,一直在为我们的健康默默奉献着。
所以啊,我们可千万不能小看了这些小小的水通道蛋白。
它们虽然不显眼,但却在我们的身体里发挥着至关重要的作用。
我们得好好感谢它们呢!这就是水通道蛋白的作用原理啦,是不是很有趣呢?。
水通道蛋白名词解释
水通道蛋白(aquaporin)是一类存在于细胞膜上的跨膜蛋白,其功能是调节细胞内外水分的平衡。
水通道蛋白是由8个跨膜α螺旋结构组成,形成一个具有水分子通过能力的通道。
它们广泛存在于多种生物体的细胞膜上,包括植物、动物和微生物等。
水通道蛋白的主要功能是促进水分子在细胞膜上的快速跨膜传递。
由于水分子是极性的,无法通过细胞膜的疏水层,而水通道蛋白则提供了一个高度选择性通道,使水分子能够迅速通过细胞膜而不受阻碍。
水通道蛋白的通道结构限制了其他溶质的通过,从而确保水分子的优先通道。
除了调节水分平衡外,水通道蛋白还在细胞内外水分调节以及保护细胞免受渗透压和压力变化等环境因素的影响中发挥重要作用。
在植物中,水通道蛋白在根系中的表达调控了植物对于土壤中水分的吸收和利用。
在人体中,水通道蛋白在肾脏、眼睛和脑组织等重要器官中的表达与正常的水平维持和离子浓度平衡密切相关。
水通道蛋白的发现为我们深入了解细胞内外水分平衡的调控机制提
供了重要的线索。
通过研究水通道蛋白的结构和功能,人们可以进一步探索其在疾病发生和发展中的作用,为相关疾病的治疗和预防提供新的策略和途径。
水通道蛋白的基本结构与特异性通透机理王晶桑建利(北京师范大学生命科学学院北京 100875)摘要水通道蛋白是一个具有跨膜运输水分子功能的蛋白家族。
从1988 年Agre 等发现水通道蛋白起,目前在不同物种中已经发现了200 余种水通道蛋白,其中存在哺乳动物体内的有13 种。
概述了水通道蛋白的结构、组织特异性分布及特异性通透机理。
关键词水通道蛋白水分跨膜转运水分子的跨膜转运对维持不同区域的液体平衡和内环境稳态非常重要。
水分子作为一种不带电荷且半径极小的极性分子,很早被证实能通过自由扩散穿透脂质双分子层。
在发现水通道蛋白以前,人们一直认为这是水分子透过质膜的唯一方式。
但通过实验发现,红细胞和肾小管细胞中水的通透速率之快远非简单扩散强度所能提供的,因此猜测,质膜上可能存在某种通道介导水的转运。
1 水通道蛋白的发现1988年,Agre 等从人类红细胞膜上纯化分离分子量为32×106的Rh 多肽时,偶然鉴定到一种新的分子量为28×106的整合膜蛋白,并且通过免疫印迹发现这类蛋白也存在于肾脏的近端肾小管中[1],把它称为类通道整合膜蛋白(channel-like integralmembrane protein, CHIP28)。
随后,在1991 年Agre 和Preston 成功克隆得到了CHIP28 的cDNA,通过分析其编码的氨基酸序列,发现CHIP28 含有6个跨膜区域、2个N-糖基化位点、且N 端和C 端都位于膜的胞质一侧。
另外,对比CHIP28 与早期从牛晶体纤维中克隆得到的主要内源性蛋白(major intrinsicprotein,MIP)的DNA 序列,发现二者具有高度同源性。
由于很早以前就证实了MIP 家族的成员蛋白参与形成允许水和其他小分子通透的膜通道,因此,推测CHIP28 可能也具有类似功能[2]。
1992 年,Preston 等通过在非洲爪蟾的卵母细胞中表达CHIP28,首次证实它是一种水通道蛋白。
非洲爪蟾的卵母细胞对水具有极低的渗透性,当向其中显微注射体外转录的CHIP28 的RNA后,卵母细胞在低渗溶液中迅速膨胀,并于5 min内破裂。
这一现象表明注射CHIP28 的RNA 后卵母细胞膜的水通透性有了明显提高。
为了进一步确定CHIP28 的功能,将提纯的CHIP28 构建在蛋白磷脂体中,构建后的蛋白磷脂体对水的通透性增长了50 倍,但对尿素却不具备通透性[3]。
这些结果最终证实了CHIP28 为水通道蛋白,后来它被命名为水通道蛋白-1(aquaporin-1,AQP1)。
水通道蛋白的发现,开辟了一个崭新的领域。
随着更多亚型的发现,水通道蛋白相关研究成为了膜转运方向的研究热点,Agre 也因其对水通道蛋白做出的突出贡献而获得2003 年诺贝尔化学奖。
2 水通道蛋白的分子结构水通道蛋白分布广泛,目前已在哺乳动物、两栖类、植物、酵母、细菌以及各种各样的有机体中发现水通道蛋白的存在。
水通道蛋白是一类高度保守的疏水小分子膜整合蛋白,各种亚型之间蛋白序列及三维结构非常相似。
哺乳动物水通道蛋白的分子大小在26×106~34×106之间,氨基酸序列同源性为19%~52%[4]。
因水通道蛋白的三维结构相似,一般以AQP1的结构作为代表。
AQP1 是一条由269 个氨基酸残基构成的单肽链,对比AQP1 分子前后半段的氨基酸序列,发现2 段序列具有相关性,推测AQP1在进化上可能是通过基因复制而来。
单肽链在细胞膜上往返折叠形成6 个α螺旋的跨膜区域,并且肽链的N 端和C 端都位于质膜内侧;6 个跨膜区域由5 条环(A~E loop)相连。
目前,被人们广为接受的水通道蛋白三维结构是“沙漏模型(hourglassmodel)”[4],模型指出:肽链中的B 环和E 环具有高度保守的天冬酰胺- 脯氨酸- 丙氨酸(Asn -Pro - Ala,NPA)特征性序列,B 环和E 环折返进入膜双分子层,2个保守的NPA 序列在膜的磷脂双层中间位置相互结合,6 条跨膜区域在四周包围,共同构成了一个供水分子通过的亲水通道(图1)。
通过对AQP1 的三维结构进一步研究发现,B环和E 环折返入膜后分别形成短螺旋B(HB)和短螺旋E(HE),中心孔道处起稳定作用的2 条NPA基序几乎呈90°交叉,所形成的亲水通道的直径约为2.8×10-10 m,刚好能容纳单个水分子通过,外围6 条跨膜区域呈现右手螺旋包围。
构成中心孔道表面的除B 环和E 环外,还有螺旋2、5 以及螺旋1、4 的C 端部分。
有研究指出,将B 环和E 环联系在一起的作用力主要是2 条NPA 基序中脯氨酸残基间的范德华力,同时也受到离子键和氢键的稳定。
几乎所有AQP 分子的B 环和E 环上都有高度保守的NPA 特征性序列。
但也有少数例外:在AQP11 和AQP12 中仅发现E 环上具有NPA 序列,另一个在B 环上的NPA 序列分别由天冬酰胺-脯氨酸-半胱氨酸(Asn-Pro-Cys,NPC)和天冬酰胺-脯氨酸-苏氨酸(Asn-Pro-Thr,NPT)替代[6]。
在体内,AQP1 主要以同源四聚体的形式存在。
研究发现,四聚体中某个水通道蛋白单体发生突变并不会影响其他3 个蛋白单体的功能,即每一个水通道蛋白单体是一个独立的功能单位。
水分子的跨膜渗透是通过水通道蛋白单体的中心通道完成的,而无法通过中聚体的中央孔洞(4 个单体衔接处的中心缝隙)[7]。
每个单体通过跨膜的α螺旋与邻近的2 个单体相互作用。
这些相互作用很有可能受到一些氨基酸残基之间的氢键的稳固。
3 水通道蛋白的种类迄今为止,已有200 余种水通道蛋白在不同物种中被发现,其中存在于哺乳动物体内的水通道亚型有13 种,即AQP0-AQP12(见下表)。
根据它们的基因结构和通透性,这13 种水通道蛋白可划分为3 组:传统水通道蛋白(orthodox aquaporins)(包括AQP0、1、2、4、5、6、10)、甘油水通道蛋白(aquaglyceroporins)(包括AQP3、7、9)和未明确分类的AQP8、11、12。
目前对哺乳动物中较早发现的10 个水通道蛋白AQP0~AQP9 研究较为透彻,它们的功能也通过人类疾病的鉴定及对基因缺失小鼠的研究而被鉴定;而较近发现的3 个成员AQP10~AQP12 则相对研究较少,它们的胞内定位及表达异常导致的人类疾病都还未被鉴定[8]。
4 水分子特异性通透机理水通道蛋白对水分子具有高度选择性。
大部分水通道蛋白严格排斥除水分子O+)、甘油以外的所有物质通过,包括结合水分子的氢离子(水合氢离子,H3和各种离子等,但也有部分水通道蛋白对甘油等小分子中性溶质具有通透性。
AQP1膜蛋白的密度可达到大于109 个/μm2,。
这一密度远远高于普遍的离子通道的密度(除突触后膜上的乙酰胆碱受体外,大多小于1 个/μm2)。
水通道蛋白是怎样对水分子进行严格筛选的呢?首先,通道的空间大小只能容纳单个水分子,限制了比水分子大的分子通过。
以对水分子具有专一通透性的AQP1 为例,AQP1 的中心通道呈哑铃状,狭口处在脂双层中央B 环和E 环相互作用的NPA 序列位置附近。
构成中心孔道表面的氨基酸残基中,亲水和疏水的残基数量基本是对等的。
这些亲水残基在对水分子去水化过程中有重要作用。
另外,中心孔道最窄处由4 个残基构成,包括亲水的His180、Arg195、Cys189 和疏水的Phe56。
虽然这一缩口只有1 个氨基酸残基的跨度,但是它2.8×10-10 m 的直径仍然阻断了比水分子大的离子和溶质的通过。
因此,这4 个残基的变化都可以对水通道的选择性产生影响。
根据已有研究可知,His180 在只对水具有通透性的水通道蛋白中高度保守,但在一些对甘油也具通透性的水通道蛋白,如GlpF 中则被甘氨酸残基代替[11]。
另一个困扰人们已久的问题是何种机制阻断了水道蛋白对质子的跨膜运输。
早在短杆菌肽中的研究就已表明,水可以以连续不断的方式通过膜上的开放孔,这种水分子排列成一条直线、质子由一个水分子传递到另一个水分子、并伴随着氢键的断裂和重建的过程,被研究者称为“Grotthus 效应”。
既然水通道蛋白对水具有特异通透性, 那么可通过“Grotthus效应”传递的质子运输又是怎样被阻断的呢?目前被较多人接受的另一个机制是在NPA 序列处有1对偶极子对水分子起着定向作用。
在每个水通道的中心位置,NPA 序列上的Asn76 和Asn192 的氨基向孔道最窄处延伸。
此时,位于此处的水分子与其邻近的水分子之间的氢键发生断裂,其氧原子替代性地与Asn76 和Asn192 的氨基形成氢键。
这一变化重排了水的分子轨道,使最窄处水分子的2 个氢原子定向到与通道轴线垂直的方向(图2)。
因此,中心处水分子的2 个氢原子无法与周围邻近的水分子形成氢键;另外,在通道最窄处的残基附近的氨基酸残基都是疏水的,因此不会有另外的残基与水分子的2 个氢原子形成氢键。
这一模式使得位于通道上下2 部分中的水分子在取向上相反,不利于形成氢键链,从而也阻断了质子通过“Grotthus 效应”完成连续传输,同时,因为疏水氨基酸不参与形成氢键,也保证了水分子在通过孔道时只需要跨越一个相当低的能量障碍[7,12]。
a:NPA 基序上的偶极矩改变了中心水分子的定向,使通道上下水分子取向相反。
b,c:水分子与Asn192、Asn76 的氨基形成氢键,水分子的2 个氢原子重定向至与通道轴线垂直[7]据已有研究,水通道蛋白几乎严格排斥其他所有离子。
从理论上来说,水合化的离子直径为7.16×10-10 m,而去水合化的离子只有1.9×10-10 m的直径,是可以通过最窄处为2.8×10-10 m 的中心通道的。
孔道狭窄的阳离子通道就具有使离子去水合化的能力,如KcsA 钾通道中就有16 个羰基氧以4 个每环的结构垛叠排列,这一结构具有分离与离子水合的水分子的能力。
而AQP1 中孔道中的羰基氧的结构虽然足以分离体相水中的水分子,但是只能使水合离子部分去水合化,而后者则因直径仍大于狭口直径而无法通过水通道[13]。
主要参考文献1 Denker B.M., Smith B.L., Kuhajda F.P. et al . Identification,purification, and partial characterization of a novel Mr 28000 integral membrane protein from erythrocytes and renal tubules.J Biol Chem,1988,263(3):15634.2 Preston G. M., Agre P.. Isolation of the cDNA for erythrocyte integral membrane protein of 28 kilodaltons:member of an ancient channel family. Proc Natl Acad Sci USA, 1991, 88:11110—11114.3 Preston G.M.,Carroll T.P., Guggino W.B.et al . Appearance ofwater channels in Xenopus oocytes expressing red cell CHIP28 protein.Science,1992, 256(5055):385—387.摘自《生物学通报》2011年第2期。