2020年诺贝尔奖绿色荧光蛋白(精选干货)
- 格式:ppt
- 大小:1.06 MB
- 文档页数:25

绿色荧光蛋白的基因克隆和表达研究(湖北师范学院生命科学学院生物科学0802班湖北黄石435002)摘要:目的:研究绿色荧光蛋白(Greed Fluorescent Protein,GFP)基因的基因克隆及在大肠杆菌中的表达。
方法:通过分别将DH-5α (pEGFP-N3)和DH-5α(pET-28a)提取质粒、酶切并连接形成重组质粒pET-28a-GFP,将重组质粒导入E.coli DH-5α感受态细胞中进行转化,通过限制性核酸内切酶Not I与Bam H1和PCR对所建质粒进行分析鉴定后, 通过转化的方法把含绿色荧光蛋白(GFP)外源基因转入大肠杆菌体BL-21内进行表达,再用IPTG 诱导GFP基因表达,可以看到显现绿色,判断GFP基因在大肠杆菌中成功表达。
结果:结果显示构建的重组质粒pET-28a-GFP在E.coli中成功表达。
关键词:绿色荧光蛋白;质粒重组;原核表达;诱导表达中图分类号:Q53Studies On Cloning and Expression of Green FluorescentProtein geneAbstract: Objective:Studies indicated that the cloning and expression of the GFP gene in the E.coli. Methods:Extract the plasmid of the DH-5α(pEGFP-N3) and DH-5α(pET-28a). Then cutting by enzyme and connecting the two plasmids to form pET-28a-GFP recombined plasmid. The recombinant plasmid confirmed by restriction enzyme and PCR transfected into E.coli DH-5α to ensure the expression of green fluorescent protein. Guiding the recombined plasmid, which contains exogenous genes of GFP into E.coli for expression, through transformative method. The expression of GFP gene can be induced by the IPTG and then we can see green. Results: The results suggest that pET-28a-GFP recombined plasmid has successfully expressed in E.coli. Keywords: G ed Fluorescent Protein; Recombined Plasmid; Prokaryote Expression; Induced Expression绿色荧光蛋白的基因克隆和表达的研究引言随着分子生物学和基因工程技术的迅速发展和广泛应用, 人们根据自己的意愿有目的、有计划、有根据、有预见地将外源基因导入动物细胞内, 使外源基因进行表达、阐明基因表达的调控机理或者通过与染色体基因组进行稳定整合,将生物性状传递给子代动物的研究方兴未艾[1]。


2009新题:“绿色荧光蛋白”相关(含详解)2008年度诺贝尔化学奖授予美国华裔化学家钱永健等三位科学家,以表彰他们在发现和研究绿色荧光蛋白(GFP)所做出的贡献。
GFP首次在水母中被发现,它是由水母中的GFP基因表达一种能在紫外线照射下发出绿色荧光的蛋白质,即绿色荧光蛋白。
GFP可做为生物示踪分子,同时为追踪多种生物细胞变化的研究奠定了基础。
回答以下问题:(Ⅰ)1.GFP的合成是在相关基因的控制下完成的,它包括在细胞核中进行的和在中进行的两个过程组成。
2. GFP是由238个氨基酸组成。
科学家发现将第65位丝氨酸换为苏氨酸(S65T)或半胱氨酸(S65C),荧光强度将提高4倍。
荧光强度的改变,其变异的来源是。
3. GFP发出的荧光稳定,检测方便而且对细胞也不会产生明显毒害,因此在基因工程中可以作为,用以追踪多种生物细胞的迁移和变化情况。
(Ⅱ)下面是某科学家用GFP做的相关实验,根据所学知识补充实验过程,并分析回答相关问题。
课题:研究GFP标记的大鼠神经干细胞移植于损伤脊髓后的迁移情况目的:观察神经干细胞移植于损伤脊髓后的迁移方法:(1)构建含GFP基因的慢病毒载体。
(2)体外培养胎鼠脊髓神经干细胞:取孕14~16天Wistar大鼠,在条件下取胎鼠脊髓,解剖显微镜下剔除表面软膜和血管,剪碎,再用进行处理,制成神经干细胞悬浮液,200目铜网过滤,离心,加干细胞培养液,其他条件适宜,进行培养,2-3天换培养液。
(3)用浸染神经干细胞,将已浸染的神经干细胞以乙交酯一丙交酯共聚物(PLGA)为支架移植入大鼠T9半横断脊髓损伤处。
(4)移植后1个月在荧光显微镜下。
结果:荧光显微镜下,神经干细胞球及散在的神经干细胞呈强烈的绿色荧光,各个部位深浅不一。
神经干细胞的迁移移植后1个月,在脊髓损伤的头端和尾端可见发绿色荧光的神经干细胞。
结论:。
分析与讨论:(1)在构建含GFP基因的慢病毒载体过程,需要用到的工具酶有和。


荧光蛋白及其发光原理介绍Xxx(xxxx xxxx xxx xxxxx)摘要本文介绍了荧光蛋白的来源,基本结构和发光机理,并通过与电子行业中广泛应用的无机固体发光材料进行比较,提出荧光蛋白可行的应用前景。
关键词:荧光蛋白,生色团,发光原理,应用前景1 引言自然界有许多生物能够发光。
多数生物发光过程是通过小分子有机化合物荧光素和荧光素酶的化学反应释放出光能。
然而有一类荧光物质不仅能在化学能激发下发出荧光,还能被光激发---荧光蛋白。
荧光蛋白种类很多,其中最有应用价值的是在最早在多管水母中提取的绿色荧光蛋白]1[。
绿色荧光蛋白化学性质稳定,分子量约27000,为238个氨基酸残基组成的单链结构。
在溶液中可形成二聚体或四聚体桶状晶体。
其荧光发射峰在509nm , 最大激发波长为395 nm , 并在470 nm 处有一肩峰。
由绿色荧光蛋白为蓝本通过基因技术合成的突变体发射光谱在整个可见光波段,因此在生物荧光标记方面得到广泛的应用,2008年诺贝尔化学奖也授予下俢村,钱永健等在此方面做出贡献的科学家。
2 绿色荧光蛋白基本结构绿色荧光蛋白分子呈圆柱桶状。
Yang 等]2[的研究表明, GFP是由两个相当规则的内含一个α2螺旋和外面包围11个β2折叠链的β2桶状结构组成的二聚体。
图1 绿色荧光蛋白结构蛋白质前端环化形成生色团。
生色团的结构可以人工改造,从而发出不同波长的荧光。
生色团一经形成其化学性质便十分稳定,又能通过桶装蛋白质外壳给予其足够的保护,只有遇到强化学或者温度环境时才会遭到破坏,而且还具有一定的自我恢复能力。
正是这样的特殊结构使得荧光蛋白具有稳定的发光能力。
图2 生色团环化形成示意图如图所示,蛋白质二聚体端基环化氧化后能够发生质子化以及顺-反异构变化]3[,因此导致分子能级发生变化,具有发光能力。
生色团在蓝光照射下,会吸收蓝光的部分能量,然后发射出绿色的荧光。
利用这一性质,生物学家们可以用绿色荧光蛋白来标记几乎任何生物分子或细胞,然后在蓝光照射下进行显微镜观察。

gfp激发光波长和发射光波长GFP激发光波长和发射光波长:深入探究引言绿色荧光蛋白(GFP)是一种非常流行的荧光蛋白家族成员,自从1990年首次从水螅上分离出来以来,已经成为生物技术和分子生物学领域的研究热点。
GFP 是一种蛋白质,能够在特定条件下发出特定颜色的荧光,广泛应用于荧光显微镜和融合蛋白质表达等领域。
在使用GFP时,有两个重要的概念需要了解,即GFP 激发光波长和发射光波长。
本文将介绍这两个概念的定义和相关背景知识,并探讨它们对GFP应用的影响。
第一部分:GFP的背景知识GFP的背景知识我们不必过多赘述,因为它在分子生物学和生物技术领域已被广泛运用,但我们仍然需要介绍一下它的简要历史和结构。
GFP的简要历史GFP最初是在1962年从海葵(Aequorea victoria)的触手中分离出来的。
然而,由于当时在结构和化学组成方面的技术限制,GFP的分子结构和工作机制一度不为人们所知。
1990年,Martin Chalfie等人成功地将GFP引入到线虫(Caenorhabditis elegans)的基因表达研究中。
随后,Douglas Prasher和Roger Tsien分别研究GFP的发射光波长和在其他生物系统中的应用。
由于这些重要研究的贡献,GFP成为了分子生物学和生物技术领域的研究热点,并在2008年赢得了化学领域的诺贝尔奖。
GFP的结构GFP是由一个238个氨基酸残基组成的蛋白质,其分子结构的最重要特点是三个环状结构。
这三个环状结构共同构成了GFP的一个色团(chromophore),这个色团是GFP能够发出荧光的根本原因,因此这个结构是研究GFP的重要关键之一。
值得一提的是,GFP虽然是从海葵中分离出来的,但它实际上是一种正常存在于海葵内的分子。
海葵在需要发出荧光时,GFP就会在细胞中储存并释放出来,所以GFP对于海葵来说就像是一种反应器,而我们可以通过基因工程技术在其他生物体系中引入这个反应器,从而实现在生物学中的应用。



08年诺贝尔化学奖会发光的蛋白质故事北京时间2022年10月8日下午,瑞典皇家科学院宣布,日本科学家下村修(OamuShimomura)、美国科学家马丁·查尔菲(MartinChalfie)、美籍华裔科学家钱永键(RogerYTien)因“发现并发展了绿色荧光蛋白(GFP)”,共同获得本年度诺贝尔化学奖。
绿色荧光蛋白是一种自行能够发出绿色淡光的蛋白质物质,它使人们能够在正常条件下对活细胞内分子水平和机理进行观察和研究。
用它来标记需要研究的蛋白,就好像给那些蛋白装上了一盏小灯,于是,他们什么时间、什么地点在做什么,可能发生什么变化,科学家一目了然。
瑞典科学院将绿色荧光蛋白的发现和发展与显微镜的的发明相提并论,称:“绿色荧光蛋白在过去10年间成为生物化学家、医学家、生物学家和其他研究人员的引路明灯。
成为当代生物科学研究中最重要的工具之一。
”下村修的好奇心下村修1928年出生于日本京都,后来在长崎长大。
1945年的原子弹爆炸致使他一度失明。
二战后,下村修从长崎医科大学毕业,想要到名古屋大学继续深造,阴差阳错间,进入了科学家平田义正的研究室。
1955年,平田交给下村一项任务,让他找出海萤被碾碎后放在水里仍能发光的原因。
“那次阴差阳错决定了我的命运。
”下村后来回忆说。
那项研究当时许多人在做,但无一得出结论,然后下村却在第二年便从海萤体内提取了一种发光的蛋白质,下村的研究引起了美国普林斯顿大学弗兰克约翰逊的强烈兴趣,在对方的邀请下,1960年下村来到美国。
可能是因为从小和海打交道,下村对海洋生物特别感兴趣,他非常想知道水母为什么会发光,于是1961年,下村来到盛产水母的华盛顿州的“星期五港”(Fridayharbor),开始正式对维多利亚多管水母(aequoreavictoria)进行研究。
他先是从渔民手中购买,后来干脆亲自上阵甚至带动全家一块出海捕捞,回到家里就把水母那一圈会发光的“裙边”剪下来,然后用最原始的办法挤出那些散发着微弱荧光的液体。

走近绿色荧光蛋白现行高中生物教科书(人教版)中,多处描述了荧光标记技术,并有有关荧光蛋白的描述,如荧光标记的小鼠细胞和人细胞融合实验、荧光标记技术与基因定位、荧光鼠的培育等。
2008年10月8日,瑞典皇家科学院把今年的诺贝尔化学奖授予绿色荧光蛋白的发现者和推广者。
于是,笔者搜集并整理了有关资料,从绿色荧光蛋白(GFP)的来源、分子结构、发光机制、研究历程以及在生物技术中的应用等方面进行概述。
12008年诺贝化学奖及获奖者简介日本的下村修、美国的马丁·沙尔菲和美籍华人钱永健于2008年10月8日,因对绿色荧光蛋白(GFP)的研究,分享了今年的诺贝尔化学奖。
他们的研究历程,犹如一场接力跑:下村修发现了GFP,沙尔菲确定了它的应用价值;而钱永健则让它变得多样化。
下村修现年80岁,生于京都,长于长崎。
1960年获得名古屋大学理学博士学位后赴美,先后在美国普林斯顿大学、波士顿大学和伍兹霍尔海洋生物实验所工作。
1962年他发现荧光蛋白,被誉为生物发光研究第一人。
从33岁做出重要发现,到46岁完成全部关键实验,他的研究遥遥领先,却一直默默无闻。
2001年退休后,年逾七旬的下村修继续在家里的地下室潜心研究。
马丁·沙尔菲现年61岁,美国哥伦比亚大学生物学教授,他在利用绿色荧光蛋白做生物示踪分子方面做出贡献。
钱永健1952年出生于美国纽约,现为美国加州大学圣迭戈分校生物化学及化学系教授、美国国家科学院院士、国家医学院院士,2004年沃尔夫奖医学奖得主。
他发明的多色荧光蛋白标记技术,将为细胞生物学和神经生物学发展带来一场革命。
2荧光现象一些化学物质能从外界吸收并储存能量(如光能、化学能、x线或阴极射线等)而进入激发态,当其从激发态再回复到基态时,过剩的能量可以电磁辐射的形式散失(即发光),这种现象就是荧光现象。
可产生荧光的分子或原子在接受能量后即刻引起发光。
而一旦停止供能,发光(荧光)现象也随之瞬间消失。
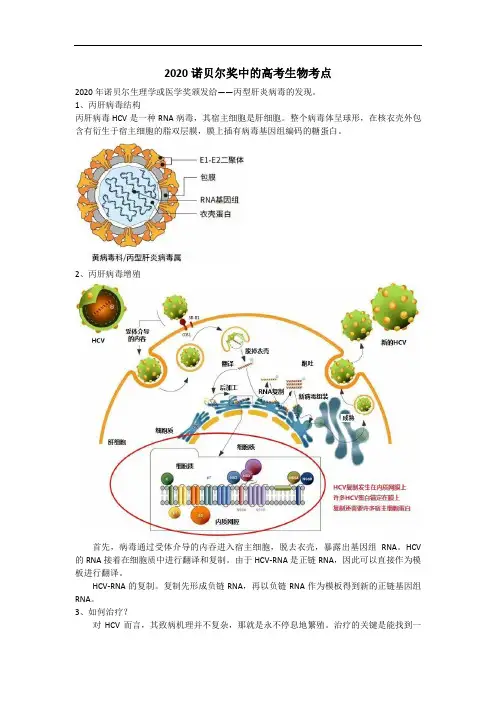
2020诺贝尔奖中的高考生物考点2020年诺贝尔生理学或医学奖颁发给——丙型肝炎病毒的发现。
1、丙肝病毒结构丙肝病毒HCV是一种RNA病毒,其宿主细胞是肝细胞。
整个病毒体呈球形,在核衣壳外包含有衍生于宿主细胞的脂双层膜,膜上插有病毒基因组编码的糖蛋白。
2、丙肝病毒增殖首先,病毒通过受体介导的内吞进入宿主细胞,脱去衣壳,暴露出基因组RNA。
HCV 的RNA接着在细胞质中进行翻译和复制。
由于HCV-RNA是正链RNA,因此可以直接作为模板进行翻译。
HCV-RNA的复制。
复制先形成负链RNA,再以负链RNA作为模板得到新的正链基因组RNA。
3、如何治疗?对HCV而言,其致病机理并不复杂,那就是永不停息地繁殖。
治疗的关键是能找到一种理想的原料类似物,该物质在HCV制造下一代RNA时“蒙骗”过RNA聚合酶并“以假乱真”地代替正常原料掺入,一旦操作成功则可导致RNA制造的失败,HCV就丧失繁殖能力,开发出的药物被称为核苷酸类似物。
典型例题:1.丙型肝炎病毒(HCV)是一种RNA病毒,其侵染肝细胞的过程如图所示。
下列叙述错误的是()A.过程①与膜的流动性有关B.过程②需要DNA聚合酶参与C.过程③所需的tRNA和氨基酸来自肝细胞D.过程②③均遵循碱基互补配对原则【答案】B2、图1是新型冠状病毒结构模式图,请回答以下问题:(1)病毒与其他生物体在结构上的主要区别是____________病毒只能营____________生活,原因是_______________________________________________________。
(2)不同种病毒感染的宿主细胞可能不同,从宿主细胞分析其原因是____________。
(3)科学研究发现,新型冠状病毒是一种以前未发现的冠状病毒的新分支,你认为冠状病毒变异的主要来源是____________。
(4)型冠状病毒突破人体的第一道防线后,机体可以通过第二道防线____________和____________清除病毒,也可通过____________(方式)特异性识别和清除病毒。
湖北师范学院分子生物学综合试验论文论文题目绿色荧光蛋白(GFP)基因的克隆和表达作者姓名樊恒达专业名称生物技术准考证号2008114020308指导教师王友如中国·黄石绿色荧光蛋白(GFP)基因的克隆和表达樊恒达(湖北师范学院生命科学学院0803班学号:2008114020308,湖北黄石)摘要目的:研究绿色荧光蛋白(green fluorescent protein,GFP)基因在大肠杆菌中的基因克隆与重组表达。
方法:从E.coli DH5ɑ中用碱法提取质粒的方法提取质粒pET-28a-GFP。
然后用质粒DNA的琼脂糖凝胶电泳对已经提取的产物进行电泳,确定从大肠杆菌中成功提取了质粒。
再用限制性内切酶BamHI和NotI对成功提取的质粒进行酶切,并用质粒DNA的琼脂糖凝胶电泳对酶切后的质粒进行电泳,用以确定已经提取的质粒中含有GFP基因。
将含有GFP基因的质粒转化到感受态细胞E.coli BL-21中,用LB培养基对转化后的E.coli进行扩大培养。
最后用IPTG诱导GFP基因表达可以看到浅绿色菌落。
结论:本实验对学生掌握最基本的分子生物学试验技术奠定了基础。
关键词:绿色荧光蛋白基因克隆重组表达转化Green Fluorescent Protein (GFP) Gene Cloning and ExpressionFan Hengda(class 3 grade 8, college of biology science ,Hubei Normal university, Huang Shi) : AbstractObjective:searching for the phenomenon of green fluorescent protein gene’s cloning and restructuring expression in the E.coli .Method:drawing plasmid pET-28a-GFP from E.coli DH5ɑ by using the method of Alkali Distillation .Then the selected production can be electrophored by using the AGE ,in order to make sure drawing successfully plasmid from E.coli. The selected plasmid is cutting by the extinction enzymes BamHI and NotI and the sliced plasmid can be electrophored by using the AGE in order to ensure the selected plasmid containing GFP gene .Converting the plasmid having gene of GFP into the feeling states E.c oli BL - 21 cells and cultivating it largely through the LB medium .Finally the IPTG can guide the expression of GFP gene and we can see light green clonies .Conclusion:This experiment sets up foundation for students to master the basical experimental technology of molecular biology .目录引言 (3)材料与方法 (3)1材料 (3)1.1材料 (3)1.2仪器 (3)1.3试剂 (3)2方法 (3)2.1重组质粒(pET-28a-GFP)的构建 (3)2.2碱法提取质粒 (4)2.3质粒DNA的琼脂糖凝胶电泳 (4)2.5.E.coliDH5α感受态细胞的制备及转化 (4)2.6 扩大培养 (4)2.7 GFP蛋白的诱导表达 (5)结果 (5)1实验现象 (5)1.1 碱法提取质粒 (5)1.2碱法提取质粒电泳 (5)1.3酶切质粒电泳 (5)1.4重组质粒的转化及阴阳性对照 (6)1.5 GFP蛋白的诱导表达结果 (6)1.6 紫外灯下看到的绿色荧光蛋白 (7) (7)讨论 (7)参考文献 (8)引言:2008年10 月 8日,瑞典皇家科学院把今年的诺贝尔化学奖授予绿色荧光蛋白(GFP)的发现者和推广者。
荧光蛋白研究进展赵嫚学院:理学院班级:应化0803班学号:2008310203907摘要:凭借在绿色荧光蛋白质(GFP)研究领域取得的重要成就,3 位科学家获得了今年的诺贝尔化学奖,他们分别是马丁·查尔菲、钱永健和下村修。
绿色荧光蛋白质可以帮助科学家了解细胞机制如何工作。
利用转基因技术,所有细胞和动物都可以产生荧光蛋白质。
康涅狄格学院化学家、《发光基因》作者马克·齐默将绿色荧光蛋白质称之为“21 世纪的显微镜”。
通过让基因携带绿色荧光蛋白质——与瘤转移或大脑功能有关的基因——科学家只需通过寻找荧光便可知道基因何时以及为什么“开启”。
本文就GFP的发现历程、生化特性、及其在分子生物学研究中的应用潜力进行简要阐述。
关键词:荧光蛋白质 GFP 诺贝尔化学奖研究前景1、荧光蛋白质简介荧光蛋白质为从发光生物中分离出的发光性蛋白质。
它不是虫荧光素、虫荧光酶那种酶蛋白质催化所引起的发光,而是通过低分子物质催化而发光的蛋白质。
水母的发光蛋白质(aequorin)是通过Ca2+而发光的。
海仙人掌类的Renilla也含有同样的发光蛋白质。
这种物质包含在细胞内颗粒中,这种颗粒称发光小体(lumisome),发光蛋白质所包含的发光物体是与海荧虫荧光素极为相近的物质,因而推测,发光蛋白质的发光与虫荧光素、虫荧光素酶反应有着密切的关系。
自1992 年绿色荧光蛋白基因从水母体内克隆以来,现在已经从很多的海洋生物物种中克隆到了新的荧光蛋白,它们能特异地“点亮”生物分子或细胞,并显示出生物分子的活动情况,从而能更有助于我们揭示这些分子或细胞的活动规律及本质。
已报道的荧光蛋白光谱分布于整个可见光区,它们被广泛应用于基因的表达调控、蛋白质空间定位与转运、蛋白折叠、信号传导、蛋白酶活性分析、生物分子相互作用等研究领域,荧光蛋白的发现与应用为现代生物学的研究提供了强有力的研究手段。
日籍科学家下村修(Osamu Shimomura)首次从水母(Aequorea victoria) 中分离出绿色荧光蛋白(green fluorescent protein,GFP),美籍教授查尔菲(Martin Chalfie)首次将GFP 的cDNA 转到新的物种中表达。