蝴蝶兰的组织培养
- 格式:doc
- 大小:38.20 KB
- 文档页数:4

毕业论文(设计)学生姓名:指导教师:专业名称: 园林技术所在系部:园林系2010年 3 月 9 日辽宁林业职业技术学院毕业论文评审书蝴蝶兰品种组织培养技术摘要:被誉为“洋兰王后"的蝴蝶兰,几年来一直都处于花卉销售的首位,一直受到花迷们的青睐。
近年来除了盆花,还大量被用作切花材料,切花中除我们常见的插花用途之外,还是制作胸花的好材料,在开会庆典场合备受瞩目,至于用来制作新娘捧花,也是目前国内流行的新风潮,深受广大消费者的好评,这就使得高品质的蝴蝶兰需求量逐年增加。
但目前由于专业性培育蝴蝶兰的整体水品不是很高,关键的生产环节技术薄弱,造成蝴蝶兰生产成本较高繁殖系数偏低,工业化生产效率不高,许多名贵品种短缺,品质较低,且市场售价较高。
因此建立和完善蝴蝶兰组培快繁技术是解决这一问题的关键环节。
本文针对植物组织培养中常见的褐变现象,详细地分析了其产生的机理及影响因素,并提出了相应的对策,为科研和生产提供了一定的理论和实践依据。
关键词:蝴蝶兰;快繁技术;养殖;褐变目录前言……………………………………………………………………………………………第一章蝴蝶兰的生态习性…………………………………………………第二章蝴蝶兰的快速繁殖技术…………………………………………………2.1茎尖培养…………………………………………………2。
2蝴蝶蝶兰的诱导培养基为VW、KC、MS、BK……………………………2。
3叶片培养…………………………………………………2.4花梗腋培养…………………………………………………2。
5根尖培养…………………………………………………2.6 原球茎的继代培养与育苗…………………………………………………第三章蝴蝶兰的栽培管理…………………………………………………3.1栽培介质…………………………………………………3.2温度……………………………3。
3浇水………………………………………………………………………3.4光照……………………………………………………………………3。

农技服务园艺作物·55·2017,34(24)蝴蝶兰的组织培养概述卢 舒,林浩群(揭阳市农业科学研究所,广东 揭阳 522000)作者简介:卢舒(1988.7-),女,广东省揭阳人,初级农艺师,主要从事农艺工作,研究方向:农作物新品种技术研究。
[摘要]本文从蝴蝶兰外植体选择、培养基、激素和添加物的选择、原球茎的增殖与生根壮苗等几方面概述了蝴蝶兰的组织培养技术的研究进展,为其组培技术研究提供参考。
[关键词]蝴蝶兰;农业;组织培养;快速繁殖蝴蝶兰(Phalaenopsis aphrodite Rchb. F.)为兰科蝴蝶兰属,由于它的花形较为优美、色彩多样且鲜丽、花期较长而享有“兰花皇后”的美誉,观赏价值和经济价值都很高,是世界上四大最具商业价值观赏热带兰的其中一个。
蝴蝶兰为单茎性气生兰,较少侧芽生成,再生能力不高,不利于一般的分株繁殖;且无胚乳的种子在自然环境中难以萌发,难以满足市场的大量需求。
农业科研工作者一直在探索蝴蝶兰优质种苗快速繁殖的方法,其中应用植物组织培养技术进行快速繁殖已经成为蝴蝶兰种苗繁殖最好的方法。
组织培养方法可以缩短繁育周期,获得大量成株,还可以保持种质优良性状。
本文从外植体选择、培养基、激素和添加物的选择、原球茎的增殖与生根壮苗等几方面概述了蝴蝶兰的组织培养的研究进展,以期为蝴蝶兰的生产发展提供有益的信息。
1外植体的选择 对外植体培养成功与否的其中一个主要影响因素就是外植体的来源,花梗芽、叶片、茎尖和根等都是蝴蝶兰组织培养中经常利用的诱导原球茎的外植体。
由于组织培养的分化能力和分化程度与品种、选取的器官有关,所以要成功地进行蝴蝶兰组织培养就要选择合适的外植体进行无菌操作。
1.1花梗芽蝴蝶兰花梗芽是最佳的组培培养外植体,具有易取材、易消毒、对母株损伤小、诱导率高等优点。
从蝴蝶兰产生花梗到花谢期间,绿色的花梗都可以取材,一般越嫩的花梗诱导出的原球茎生长状况越好。

2023-11-08•蝴蝶兰组培生产概述•蝴蝶兰组培生产的基本流程•蝴蝶兰组培生产的堤防事项•蝴蝶兰组培生产的常见问题与解决方案•蝴蝶兰组培生产的未来发展趋势与展望目录01蝴蝶兰组培生产概述蝴蝶兰是兰科蝴蝶兰属的一种植物,其花朵形状独特,色彩鲜艳,具有很高的观赏价值。
蝴蝶兰原产于热带雨林地区,喜欢温暖湿润的环境,不耐寒,需要较高的空气湿度和半阴的光照条件。
蝴蝶兰的生物学特性产的一种方法。
培养基的优化、继代培养和生根培养等环节。
产业。
通过组培生产,可以实现蝴蝶兰的全年供应,提高花卉市场的品种多样性。
此外,蝴蝶兰的组培生产还有助于保护珍稀野生资源和进行植物新品种的培育。
蝴蝶兰的组培生产在花卉产业中具有重要的地位,其繁殖速度快、周期短,可以满足市场对蝴蝶兰的大量需求。
02蝴蝶兰组培生产的基本流程确定培养基配方根据蝴蝶兰的品种和生长阶段,选择适宜的培养基配方。
常用的培养基配方有MS、1/2 MS、VW等。
制备培养基按照选定的配方,称取适量的琼脂、糖、激素等成分,加入蒸馏水,加热至琼脂溶化,然后调节pH值至适宜的范围。
培养基的制备选择健康、无病虫害的蝴蝶兰植株作为外植体,如叶片、茎段、花梗等。
选择外植体将外植体表面清洗干净,然后进行消毒处理,以杀死表面的细菌和真菌。
常用的消毒剂有升汞、酒精等。
外植体消毒外植体的选择与处理在超净工作台上进行无菌接种操作,确保无菌环境。
无菌环境将消毒好的外植体切割成适宜的大小,然后接种到培养基上。
接种时要避免交叉污染,每个瓶内只接种一种外植体。
接种操作将接种好的培养瓶放置在恒温培养箱内,保持适宜的温度、湿度和光照条件。
一般而言,适宜的温度为25℃左右,光照强度为2000-3000勒克斯。
培养条件无菌接种与培养经过一段时间的培养后,外植体上的组织会逐渐生长扩大,需要进行继代培养以维持其生长。
继代培养与增殖继代培养蝴蝶兰的增殖途径包括腋芽增殖、丛生芽增殖和根尖增殖等。
不同的增殖途径具有不同的特点和适用范围。

蝴蝶兰的组织培养研究本试验以蝴蝶兰原优良品种满天红花梗为外植体,对休眠芽萌发诱导、叶片原球茎诱导、原球茎增殖、根诱导和组培苗的移栽等方面进行初步研究,得出以下结果: 1、花梗休眠芽的诱导在夏季、秋季、春季三个季节选取含休眠芽的花梗节段进行培养,对污染率、休眠芽萌发诱导率和芽生长状况进行了比较。
试验表明秋季选取的花梗外植体灭菌效果最好,休眠芽萌发诱导率最高。
MS+BA 5.0培养基较适合休眠芽的诱导。
2、无菌苗叶片的原球茎诱导本试验以无菌苗叶片为外植体诱导原球茎产生,结果表明,BA浓度5.0mg·L<sup>-1</sup>最适合叶片原球茎诱导,添加15%(V/V)椰乳(CW)能提高原球茎的诱导率,并有利于原球茎的生长。
MS+BA 5.0+CW 15%培养基较适合诱导叶片产生原球茎,诱导率最高达到38%。
3、原球茎的增殖在MS培养基中添加一定浓度的BA和果汁能提高原球茎的增殖率。
另外,添加聚乙烯吡咯烷酮(PVP)100~200mg·L<sup>-1</sup>能有效控制培养基的酚污染、提高原球茎的增殖率。
MS+BA 5.0+CW 15%培养基较适合原球茎的增殖。
J‘西大学祝眨d卜学位论文4、根的诱导在1/2 Ms培养基中附加一定浓度NAA(0 .1一0.5mg’L一’)和多效哇MET(0 .1<sup>0</sup>.5mg’L一‘)与BA配合,能诱导小苗生根。
用多效哇诱导生根,幼苗矮壮,叶片较绿,有利提高幼苗的移栽成活率。
添加0.39一’活性炭(AC)能大大提高生根苗的平均根数和平均根长。
对根诱导较适合的培养基是:1/2 MS+B A 2.0+NAA 0.卜AC或1/ZMS+BA 2.0+MET 0.3。
5、组培苗移栽土上!苦篇乐左牙湘于丁石,卜Z戈寸汗吞目J 立伏禽己七心不破万县‘nl翻云六刁一谁才曰丢,卜Z人叹产1才曰日之习隆百冬观兀笠气1土刃尺水万万U圣a猫田联硒平葵啊权人。
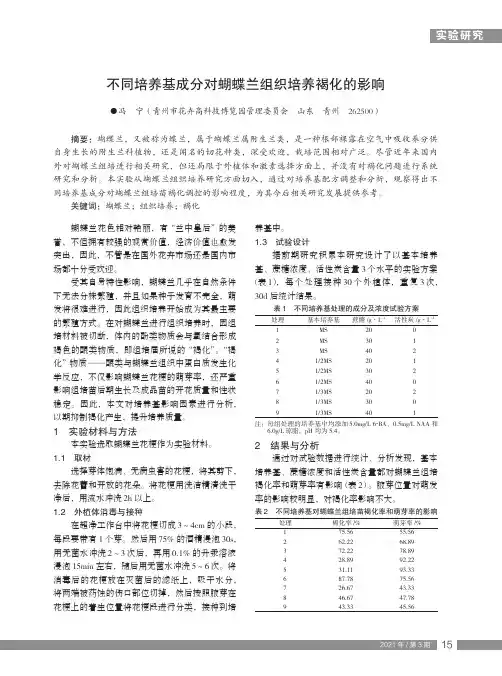
不同培养基成分对蝴蝶兰组织培养褐化的影响●冯 宁(青州市花卉高科技博览园管理委员会 山东 青州 262500)摘要:蝴蝶兰,又被称为蝶兰,属于蝴蝶兰属附生兰类,是一种根部裸露在空气中吸收养分供自身生长的附生兰科植物,还是闻名的切花种类,深受欢迎,栽培范围相对广泛。
尽管近年来国内外对蝴蝶兰组培进行相关研究,但还局限于外植体和激素选择方面上,并没有对褐化问题进行系统研究和分析。
本实验从蝴蝶兰组织培养研究方面切入,通过对培养基配方调整和分析,观察得出不同培养基成分对蝴蝶兰组培苗褐化调控的影响程度,为其今后相关研究发展提供参考。
关键词:蝴蝶兰;组织培养;褐化蝴蝶兰花色相对艳丽,有 “兰中皇后”的美誉,不但拥有较强的观赏价值,经济价值也愈发突出,因此,不管是在国外花卉市场还是国内市场都十分受欢迎。
受其自身特性影响,蝴蝶兰几乎在自然条件下无法分株繁殖,并且如果种子发育不完全,萌发将很难进行,因此组织培养开始成为其最主要的繁殖方式。
在对蝴蝶兰进行组织培养时,因组培材料被切断,体内的酚类物质会与氧结合形成褐色的醌类物质,即组培届所说的“褐化”。
“褐化”物质——醌类与蝴蝶兰组织中蛋白质发生化学反应,不仅影响蝴蝶兰花梗的萌芽率,还严重影响组培苗后期生长及成品苗的开花质量和性状稳定。
因此,本文对培养基影响因素进行分析,以期抑制褐化产生,提升培养质量。
1 实验材料与方法本实验选取蝴蝶兰花梗作为实验材料。
1.1 取材选择芽体饱满、无病虫害的花梗,将其剪下,去除花蕾和开放的花朵。
将花梗用洗洁精清洗干净后,用流水冲洗2h以上。
1.2 外植体消毒与接种在超净工作台中将花梗切成3~4cm的小段,每段要带有1个芽。
然后用75%的酒精浸泡30s,用无菌水冲洗2~3次后,再用0.1%的升汞溶液浸泡15min左右,随后用无菌水冲洗5~6次。
将消毒后的花梗放在灭菌后的滤纸上,吸干水分,将两端被药蚀的伤口部位切掉,然后按照腋芽在花梗上的着生位置将花梗段进行分类,接种到培养基中。

蝴蝶兰组织培养研究进展摘要通过不同培养基、不同激素及添加物对蝴蝶兰各培养再生途径的影响进行了概述,为蝴蝶兰的组培技术研究提供参考。
关键词蝴蝶兰;组织培养;研究进展蝴蝶兰(Phalaenopsis)属热带或亚热带的兰科植物,深受人们的喜爱,研究和开发蝴蝶兰的组织培养具有重要的意义[1]。
组织培养是蝴蝶兰快速繁殖的有效方式,目前主要有3条途径:一是利用蝴蝶兰杂交种子在无菌条件下诱导发芽,获得再生植株[2];二是从离体器官诱导产生原球茎(Protocorm like-body,以下简称PLB),通过原球茎的增殖、分化获得再生植株,即原球茎再生途径[3,4];三是通过离体器官诱导产生丛生芽,通过培养丛生芽获得再生植株,即器官再生途径[4-7]。
1无菌播种再生途径蝴蝶兰经人工授粉可获得种子,但种子个体极其微小,结构简单,没有胚乳,只有1层极薄的种皮,通常在自然状态下很难萌发,需经组织培养无菌播种才能获得植株。
在蝴蝶兰开花时选择优良植株进行自交或杂交授粉,生长4~6个月后尚未开裂的蒴果可用于试管无菌播种。
由于蒴果内种子数量达几千万之多,1个蒴果便可繁殖出成千上万的植株[8]。
通过无菌播种人工培养,能够在短期内获得大量幼小植株,是现阶段经济有效的快速繁殖方法,也是工厂化育苗的重要途径。
种子无菌播种10d后胚明显膨大,呈鹅黄色,陆续变成绿色,约1个月的时间形成原球茎)。
随后,原球体拉长,同时原球体上伴随着长出白色根毛状物,接着在顶端生长点处长出芽鞘,芽鞘不断长大,形成第1片鞘叶。
至2个月时,于第1片鞘叶对面长出第2片鞘叶,随着鞘叶的生长,2~3个月的时间在2片鞘叶之间长出真叶。
最后,转移到新的培养基上形成再生植株[8-10]。
魏翠华等[9]研究发现,添加香蕉汁对蝴蝶兰种子发芽、原球体形成以及叶片的生长具有促进作用,水解乳蛋白对种子萌发有抑制作用,比较光照和黑暗2种培养条件,种子萌发无明显差异。
章玉平等[10]研究表明,外源植物生长调节剂对种子萌发有抑制作用,天然物质如苹果汁、香蕉汁、胰蛋白胨和活性炭对种子萌发具有促进作用。


蝴蝶兰组培的研究进展研究论文蝴蝶兰组培的研究进展研究论文蝴蝶兰,兰科蝴蝶兰属植物,属热带、亚热带气生兰。
原产于菲律宾、印度尼西亚、泰国、马来西亚和我国台湾等地,其株型美观、花形奇特似蝶、枝叶繁茂,花朵硕大、花色鲜艳、花期持久,观赏价值极高,在热带兰中素有“兰花皇后”的美誉,有较高的观赏和经济价值,深受国内外花卉市场的欢迎。
但是,由于蝴蝶兰是单茎性气生兰,植株很少发育侧枝,很难采用常规分株方式进行无性繁殖。
其种子也不含胚乳或其他组织,在自然条件下萌发率极低,因此无法利用播种方式进行有性繁殖。
而采用组织培养方法进行种苗繁殖是目前蝴蝶兰大规模生产的唯一途径。
蝴蝶兰快速繁殖的途径主要是利用无菌播种和利用各种类型的外植体诱导类原球茎,进而诱导分生苗实现快繁,不用通过诱导愈伤组织而直接分化丛生芽。
蝴蝶兰组培快繁的影响因素1.无菌播种途径蝴蝶兰种子的胚发育不完全,不易发芽,用人工合成的培养基促使种子无菌萌发,可以得到较高发芽率。
种子培养过程中使用的培养基有KC、MS、花宝等,其中改良KC 培养基是蝴蝶兰种胚萌发的理想培养基。
对不同无菌播种方法包括撒播法、涂布法、稀释法进行了比较,结果表明稀释法较好,种子分布均匀,利用率高,明显减少转接次数,且原球茎发育健壮整齐【1】。
果龄采收期也影响着无菌播种效果。
也可采用无菌播种途径快繁蝴蝶兰,能够在短期内获得大量幼小植株,且技术简单、成本较低,是现阶段经济有效的快速繁殖方法,也是工厂化育苗的重要途径【2】。
但由于蝴蝶兰种子苗是一种杂交品系,因此后代变异率高,除了少数自花系列较稳定以外,难以形成品质均一的大规模栽培品种。
因此,在采用无菌播种进行蝴蝶兰种苗生产时,要对父母本进行严格的选择,以确保后代性状的尽可能一致。
2.类原球茎途径原球茎是兰科植物组织培养产生的特有现象,通过离体器官诱导原球茎快繁法获得试管苗基本一致,增殖系数较高,变异性较少,适合大规模繁殖,是兰花组培快繁的一个主要形式。


蝴蝶兰组培种苗生产技术作者:刘思余来源:《西北园艺·果树专刊》 2017年第4期刘思余蝴蝶兰为兰科蝴蝶兰属多年生附生草本植物,花形如蝶,姿态优雅,色彩鲜艳,花期长久,在热带兰中素有“兰花皇后”之美誉,观赏价值极高,深受人们的喜爱,国内外市场的需求量越来越大。
蝴蝶兰属单型茎的兰花,很少有侧芽萌发,靠自然无性繁殖,繁殖率极低,速度慢,不能满足日益增长的市场需求;有性繁殖需经人工授粉才能获得种子,又因种子细小,发育不全,不含为种子萌发提供营养的胚乳和其他组织,而且种子萌发还需要共生菌滋养,所以在自然条件下很难萌发。
因此,组织培养是快速获得大量蝴蝶兰种苗的有效途径。
本文主要介绍通过花梗作为外植体,获得蝴蝶兰无菌种苗,再进行大量繁育蝴蝶兰种苗的生产技术。
1 组织培养技术1.1 无菌苗获得蝴蝶兰花梗作为外植体,不仅易获得,而且不会损伤植株,容易诱导。
选择侧芽饱满、新鲜、无病毒的蝴蝶兰花梗,整枝取下。
在切取花梗时要注意将刀片消毒,以防微生物感染。
将取下的花梗,去掉花朵,先用自来水冲洗,再用洗涤精浸泡5~7分钟,最后用自来水反复冲洗后放在超净工作台上进行表面灭菌。
先将花梗剪成3 cm左右的带芽梗段,用75%酒精浸泡5分钟,无菌水冲洗3次,再用2%次氯酸钠消毒20~30分钟,最后用无菌水冲洗2~3次,在整个消毒过程中,要不断摇动容器,使其能够均匀全面的消毒。
将消毒后的带芽梗段接种在诱导培育基1/2 MS+6-BA 3~5 mg/L+胰蛋白胨0.5~1 g/L+椰乳150~200 ml/L+蔗糖20~25 g/L+琼脂5.5~7 g/L。
培养20天后,侧芽萌发长出2叶片后,将其切下直接继代增殖或者诱导原球茎。
1.2 原球茎诱导将无菌小苗叶片切成小段,接种在MS+6-BA 4~6 mg/L+NAA 1~2 mg/L+胰蛋白胨0.5~1 g/L+椰乳150~200 ml/L+蔗糖20~25 g/L+琼脂5.5~7 g/L的培养基上诱导原球茎。

蝴蝶兰组织培养技术研究进展摘要:蝴蝶兰的传统繁殖方式为分株繁殖,繁殖系数低,速度慢,不能满足日益增长的市场需求。
组织培养是蝴蝶兰快速繁殖的有效途径,本文综述了蝴蝶兰的原球茎诱导增殖培养,并对我国未来蝴蝶兰研究发展进行了展望。
关键词:蝴蝶兰;原球茎;组织培养蝴蝶兰是兰科蝶属植物,花形奇特,色彩艳丽,花期持久,一般2~3个月,最长可达半年,适于家庭摆设或作切花用于花篮、花束等。
但蝴蝶兰很难用传统的方式进行无性繁殖。
蝴蝶兰是单茎性气生兰,植株很少发育侧芽,且种子极难萌发,对其进行常规性的繁殖,增殖速度很慢,故多采用组织培养的方法对其进行快速繁殖。
原球茎是兰科植物组织培养产生的特有现象。
原球茎的发生途径可以由花梗节段、幼叶、根段、茎尖等部位直接产生,也可以通过诱导愈伤组织,再从愈伤组织诱导原球茎产生。
不同外植体原球茎的诱导,其特点及培养基的选择也不同。
本文就蝴蝶兰原球茎诱导增殖培养的研究现状进行综述。
1 外植体的选择外植体的来源是决定外植体能否培养成功的重要因素,不同品种、不同器官之间的分化程度和能力存在差别,因此,在进行组织培养时必须选择合适的外植体进行无菌操作才能保证蝴蝶兰组织培养的成功。
常用于蝴蝶兰组织培养的外植体有茎尖、根、叶片和花梗芽。
1.1 茎尖茎尖是最早用于兰花快速繁殖的外植体,较容易诱导培养,是成功率较高的部位。
利用蝴蝶兰的茎尖诱导出类原球茎,再由类原球茎分化成苗。
这种培养的突出问题在于蝴蝶兰为单茎性植株,剥取茎尖就损坏了母株本身,而蝴蝶兰茎极短,操作困难,易污染。
但茎尖培养的优点是比较容易获取类原球茎或愈伤组织,因为茎尖分生组织细胞的生理年龄小,易于脱分化和分化,同时,操作细致还能达到脱毒效果,获得无病毒苗。
1.2 根尖蝴蝶兰根为外植体诱导原球茎的诱导率相对较低。
以蝴蝶兰新发生的根尖段切成0.5~0.8 cm接种到培养基上,遮光处理4~5 d,14d后可形成愈伤组织。
将蝴蝶兰根平放在培养基上经过约50 d的培养后,根尖顶端可长出原球茎,其诱导率在75%左右,而根尖分生区以外的根段上却诱导不出原球茎。
蝴蝶兰组培工厂化生产流程及注意事项蝴蝶兰原产于亚热带雨林地区,是附生性兰花,其气生根发达,生长过程中吸收空气中的养分,并促进光合作用,蝴蝶兰在种植过程中,需要通过人工授粉才能结出果实,所以人工授粉工作量大,不易于大量生产。
从而利用植物组培快繁技术,进行蝴蝶兰的组培苗生产,下面让我们来看下蝴蝶兰组培快繁流程及注意事项。
一、培养基的研究和配制1.在蝴蝶兰的组织培养中,培养基的种类与成分是决定组培成功与否的关键因素之一。
蝴蝶兰不同品种、不同培养材料或不同的生长阶段对培养基的要求都不同,因此,培养基的研究和选择是一个非常关键的基础性工作,也是蝴蝶兰组培生产中的关键环节之一。
2.在培养基的配制过程中,要保证所使用的各种试剂或原材料的稳定性(如不使用过期的试剂,不使用变质的椰子汁、香蕉等原材料)。
3.在培养基的配制过程中,要保证各种称量的准确性。
二、外植体的取材与消毒处理1.外植体的取材选择除培养基成分外,决定蝴蝶兰组培成败的另一个重要因素就是外植体的来源。
虽然从理论上讲,植物细胞都具有全能性,能够再生新植株,因此任何器官、任何组织,都可以作为外植体。
但实际上,蝴蝶兰的不同器官之间的分化能力有巨大差别,因此选择合适的外植体就显得尤为重要。
①蝴蝶兰的组培外植体主要有叶片、花梗腋芽、花梗节间、茎尖、根尖等,其中花梗腋芽是蝴蝶兰组培的最佳外植体,也是目前利用最广泛的。
②在选择外植体时,应先选择生长健壮、无病虫害、不变异的母株。
③在采取外植体前,对母株进行采前预处理(在采前5-7天,用杀菌剂喷洒母株),可有效预防和降低内源性污染,提高诱导的成功率。
④外植体的最佳成熟度:叶片:叶龄3-5天花梗腋芽:第一朵花现蕾时茎尖或根尖:无菌苗或株龄40天内的植株2.外植体的消毒无菌的外植体材料是蝴蝶兰组培成功的重要前提和根本保证,而消毒是获得无菌外植体的有效方法,它通过一些表面消毒剂来杀死外植体表面的微生物,又尽可能保持外植体的生命力。
2020年第1期现代园艺蝴蝶兰组织培养关键技术探讨张雯(杨凌职业技术学院,陕西杨凌712100)蝴蝶兰大多是通过组织培养技术繁殖培育的。
组培苗能够保持母本性状,减少组培苗变异和具有植株整齐等特点。
通过对蝴蝶兰组织培养关键技术中外植体选择、培养基成分以及培养条件等进行探讨,以期提高蝴蝶兰组培苗的生产效益。
褐变;蝴蝶兰;外植体;组织培养了至关重要的作用。
在蝴蝶兰的工厂化生产中,植物激素6-BA 、NAA 浓度决定了原球茎发生的诱导速度,而椰子汁、香蕉泥和土豆泥等对蝴蝶兰组培苗一致性有显著的影响。
生根壮苗培养是提高植株成活率的一项重要内容,壮苗生根阶段为试管苗的移栽和成活奠定基础,直接影响到工厂化生产的种苗质量。
在组培苗壮苗生根阶段,通常提高培养基的生长素浓度,下调细胞分裂素浓度,从而促进植物发根。
此外,培养基中添加了椰子汁、香蕉汁、苹果汁等天然添加物,对蝴蝶兰组培苗的生根壮苗有明显的促进作用,移栽成活率也较高。
3培养条件在花梗诱导丛生芽过程中,适宜的温度十分重要。
较低温度有利于腋芽转化为花芽,而较高温度则有利于腋芽转化为营养芽。
此外,光照强度对蝴蝶兰试管苗的生长也有较大影响,但光照强度合适范围还需要进一步的探究。
蝴蝶兰幼苗对温度的要求比较高。
温度过低,蝴蝶兰根部会停止吸收水分,从而造成生理干旱,进而叶片变黄、脱落,甚至死亡。
光照过强会灼伤叶片,使叶片老化,甚至枯死。
夏季在中午前后要做好遮荫处理。
4植物组织培养褐变在蝴蝶兰组织培养过程中,材料非常容易出现褐变的情况。
尤其是切取茎尖进行脱除病毒的步骤,由于茎尖太小,更容易因褐化而导致死亡。
因此蝴蝶兰组织培养过程需要重视褐化问题。
褐变是因植物组织多酚氧化酶与其酚类底物结合,在氧的作用下,二者发生化学反应形成醌类物质。
醌类物质是褐色物质,当该类物质扩散到培养基时,会对植物材料造成毒害,进而影响植物体内酶的活性,阻碍植物正常代谢,严重时甚至导致材料死亡。
目前,常用的褐化抑制剂分为2大类:一类是吸附剂,另一类是抗氧化剂。
蝴蝶兰组培研究进展张丹桂201310010125集贤创新实验131班蝴蝶兰(Phalaenopsis spp.)为兰科多年生附生草本,花形态优美似蝶,枝叶繁茂,花期持久,观赏价值极高,在热带素有“兰花皇后”的美誉。
蝴蝶兰是目前兰科植物中栽培最广泛的种类之一,同时也是室内绿化美化的新型观赏花卉,国内外市场对其需求量越来越大。
但是,由于蝴蝶兰是单茎性气生兰,植株很少发育侧枝,很难采用常规分株方式进行无性繁殖;其种子也不含胚乳或其他组织,在自然条件下萌发率极低,因此无法利用播种方式进行有性繁殖。
而采用组织培养方法进行种苗繁殖是目前蝴蝶兰大规模生产的唯一途径。
本文概述了近年来蝴蝶兰的组织培养与快繁技术的研究进展。
外植体繁殖途径糊蝶兰组培的过程一般分为外植体的诱导、继代增殖、壮苗、生根、健化移栽5个阶段。
目前,国内外蝴蝶兰组培研究主要集中在外植体的选择、基本培养基选择、植物激素种类和配比浓度、褐变防治措施等方面。
1.外植体选择及培养方法关于糊蝶兰组培外植体选择方面的报道较多,不同外植体各有优缺点。
常见的用作组培的外植体有种子(曾宋君,彭晓明,张京丽,等.蝴蝶兰的组织培养和快速繁殖[J].武汉植物学研究,2000,18(4):344- 346. 章玉平,刘成运,胡鸿钧,等.蝴蝶兰无菌萌发技术的研究[J].武汉植物学研究,2004,22(1):82- 86.)、叶片(李成慧,蔡斌,单丽丽,等.应用正交设计法探讨蝴蝶兰叶片类原球茎的诱导[J]. 扬州大学学报(农业与生命科学版),2004,25(2):76- 78.)、花梗节间(鲁雪华,郭文杰,徐立晖,等.蝴蝶兰花梗节间段培养繁殖的初步研究[J].园艺学报,2002,29(5):491- 492. 刘福林,李淑萍.蝴蝶兰花梗的组织培养和植株再生[J].商丘师范学院学报,2001,17(6):98- 99.)、根尖(曾宋君,彭晓明,张京丽,等.蝴蝶兰的组织培养和快速繁殖[J].武汉植物学研究,2000,18(4):344- 346.)、花梗腋芽(刘林,李淑兰.温度、节位和BA 对蝴蝶兰花茎腋芽生长的影响[J].北方园艺,2003(5):50- 51.)等。
第20卷第3期生物学杂志V01.20Ho.3:22:芏!星巴旦坚坐!竺呈磐:翌坚..!,』望垒;i;一文章编号:1008—9632(2003)03一争ii一吲羹霆羹嚣萋冀雾蓁羹雾爹錾;墓囊薹;≯耋鏊|耋冀囊薹蠢嚣薹妻差:棼鞋]nl≤鞲}i蠹备;妻妻蕈薹攀墓妻冀蒋耗嗣塞誊蒌毒i玎榭H垂}塾辜叫誊j兰妻毫嚣鳟蚕羹霎喜蝎誊莲薹雾:霎j£擎垂l。
耋H囊的蠡窜g霉燕耋斥,不仅培养了学生学习植物形态解剖学的兴趣,而且全面提高了学生读片识图能力、动手能力、分析问题和解决问题能力,促进了教学质量的全面提高(表1)。
表l应用电视一丑徽成像系统前后成绩对比19昕年2Dol嬲粼勰鬻蝴粼勰裂”・3707∞21348058】993935由表l可以看出,在期末考试中结构模式图的得分率由1997年的69.2%上升到2001年的93.9%,理论部分的得分率由70.7%上升到81.9%,课程总成绩由均分的70.3分上升到80.5分,不及格率由原来的13.4%下降到3.5%。
总之,将电视一显微成像系统单独或与其它仪器组合后应用于实际教学,既可以丰富植物形态解剖学实验教学内容,同时也创造了生动、活泼的课堂气氛,明显地提高了实验教学效果。
参考文献:[1]张彪,淮虎银.崔月花,等.植物彤态解剖学实验课程改革[J],实验宣研究与探索,2002,2l(3):43~45.[2]张彪.金银根,淮虎捧.植物形态解剖学实瞳[M],东南大学出版社.2001.[3]张彪,宋晓森,淮虎银,等.植物形态解训学试验考试的改革[J].生物学杂志,2002,19(4),47—48.[4]朱值义,柬*武,何晓燕,彩色电视机连续变倍体视显微键在植物学实验教学中的应用[J],实验室研究与探索,1998,17(1);24—26.Theapplicati彻ofvjdeo-mjcrophotographsyst咖inplantanat伽呵experimentteachingZHANGBiao1喁rANGAi—QinWANGHor培一HleiDUKun(c0HegeofBjol0盯Scj∞ceB11dBiote曲nolo斟,Ya“gdloLlU正ve巧i哆,Yan酣删,225009,Qd衄)Ak由氍t:Theappucation0fvideo-诚c砌0l罐乒aphygyst咖i“plantanab∞1y唧edrn朗taIteadlil堰h蚰beerli11删ucedThroLl曲叫。
蝴蝶兰的组织培养 蝴蝶兰[phalaenopsis ]为兰科蝴蝶兰属植物,它是一种热带气生兰,俗称“洋兰”。蝴蝶兰花型似蝴蝶,形态美妙、色彩丰富、花期长,在热带兰中素有“兰花皇后”之美称,。蝴蝶兰种类丰富,分布广,东起菲律宾、新几内亚,南达澳大利亚北部,西苏门答腊,北到我国台湾、云南、四川西部均有原种(野生的蝴蝶兰) 存在,约有50 多种,其中我国有7 种,全部为附生兰。蝴蝶兰商品化大规模栽培十分成功,是近年来在国际花卉市场上最受欢迎的洋兰。从离体器官诱导产生类原球茎,通过类原球茎的增殖培养,得到大量幼苗,为实现蝴蝶兰工厂化生产奠定了基础。类原球茎是一类呈珠粒状的幼嫩器官(种子萌发时先是胚的膨大,种皮破裂,一定时间后发育成肉眼可见浅黄色的原胚呈球状,称为原球茎,由其它外植体诱导产生的称类原球茎),在兰科植物中多以这种器官发育、增殖和分化。蝴蝶兰的组培快繁有胚培养、叶片培养和腋芽培养,腋芽培养形成试管苗,再以丛生芽的方式增殖快繁,可以有效地保持母本的优良性状,变异率最低。 1 材料与方法 (1)材料 取已过盛花期带休眠芽的花梗作为外植体材料。 (2)材料消毒与接种 切下其带芽茎段,长约2 - 3cm ,用自来水清洗干净,在饱和漂白粉上清液中浸泡15 min ,浸泡时不断搅动,浸泡后的茎段用流水冲洗干净,置于超净工作台上,先用75 %的酒精消毒30 s ,无菌水清洗1 次,再用0. 1 %的升汞浸泡10 min ,经无菌水冲洗数次,将带芽茎段接种到经设计的不同激素组合的诱导培养基上,重复3 。 (3)培养基的配制 花梗腋芽诱导培养基为1/ 2MS +BA2. 5 mg/L + NAA0. 2 mg/L 。 增殖培养基为1/ 2 MS + BA3. 5 mg/L + KT1. 0 mg/L + NAA0. 5 mg/L + 椰乳10 %。 生根培养基为1/ 2MS + BA1. 5 mg/L +NAA0. 3 mg/L + 80 g/L 香蕉泥 以上培养基p H 均为5. 5 2 结果 在培养条件每天光照12 h ,光强1 600Lx ,温度25 ±2 ℃获得以下效果。 (1)诱导培养效果:蝴蝶兰花梗接种到不同激素浓度的培养基上,生长1 周后在花梗的基部有褐色物质产生,腋芽开始萌动,1 月后腋芽可以长到1. 5 cm 高,出芽率可达50%。 (2)增殖培养效果:将长出的芽选取约1. 5cm 的苗,取出后切去叶片和基部褐化部分,转接到增殖培养基中,40 d 后,增殖倍数可达到3倍以上。 (3)生根培养效果:将高约2. 0 cm 的蝴蝶兰试管苗接种到生根培养基中, 50 d 后,全部生根,平均生根3.5条,长2.5cm。 (4)壮苗培养与驯化移栽:壮苗。生根组培苗壮苗培养基1/2MS+ 蔗糖10g/L+ 琼脂粉3.5 g/L+ 活性炭1.5 g/L ,pH5.4,温度( 25±2) ℃, 光照强度2000Lx, 光照时间14h/d。培养15d 后移栽。驯化:室内开瓶炼苗3d+室外炼苗3d。 移栽基质:最适合的栽培基质为水苔,椰糠也是良好的移栽基质。 3 讨论 (1)蝴蝶兰和其他兰科植物一样,在组培快繁生产中存在着易褐化死亡的问题,因此如何克服褐变成了组培快繁生产成功与否的关键,活性炭2 g/L ,或PVP 1 g/L效果显著;适时切除培养物的褐化部分并及时更换新鲜培养基,能有效抑制外植体褐变死亡;培养基中加入10%椰子水,也能促进原球茎的生长,减少原球茎增殖过程中的褐变;蝴蝶兰的群体效应很明显,单芽容易褐化死亡,且增殖较慢,因此,刚诱导出的原球茎状体不能过早切割转移,在继代阶段接种时,应尽量避免切成单芽,增殖时切块也不宜过小,否则容易褐化死亡;添加香蕉汁对蝴蝶兰原球茎形成及幼苗生长具有明显的促进作用。 (2)另有报道:①蝴蝶兰原球茎的诱导主要受外植体、培养基和培养条件等因素的共同影响,其中,外植体最难以控制,这与外植体本身的生长发育和生理生化状态有关。因此,对外植体的筛选是组培中较关键的技术。蝴蝶兰组织培养过程中,采用同样培养基处理时,茎尖比叶片、花梗侧芽作为外植体效果较好。②)在激素浓度相同条件下, 1 /2MS、MS、White、B5 作为基本培养基均能诱导出原球茎,但MS效果最好,且诱导的原球茎数量多,密度大。③以MS作为基本培养基对蝴蝶兰原球茎进行增殖培养,附加NAA 1. 00 mg/L和6-BA 2. 00 mg/L时,增殖效果最好。④蝴蝶兰生根过程中,在1 /2MS培养基上根生长最快,生根率可达94. 42%,根长可达0. 86 cm,长势最粗壮,数量最多,说明低浓度的盐分有利于侧根发生。⑤基本培养基中添加蔗糖浓度为3%,琼脂为6. 00 g/L,活性炭为1. 00 g/L; pH值为5. 60 ~5. 80;培养温度为( 25 ±1) ℃;光照时间为13h /d;光照强度为1 500~2 000 lx。 (3)组织培养是蝴蝶兰快速繁殖的有效途径,主要通过两条途径:一是利用种子无菌发芽,二是从离体器官诱导产生原球茎,通过原球茎的增殖培养,得到大量幼苗。早在1949 年,Potor利用无菌培养技术成功地促使蝴蝶兰花梗上的休眠芽发育成完整植株,该方法经过其他研究人员改进后,曾一度成为蝴蝶兰的主要无性繁殖方式。1974 年,Intuwong等利用蝴蝶兰茎尖诱导产生了原球茎状体,再由原球茎分化成植株,为实现蝴蝶兰工厂化生产奠定了基础。蝴蝶兰的组织培养中有几个关键的时期:原球茎的诱导、原球茎的继代增殖、壮苗的培育。蝴蝶兰组培的快繁技术,包括外植体的选择、不同基本培养基、激素、添加物对其增殖与分化的影响、外植体褐变的防治以及生根壮苗的方法等。 外植体的选择:诱导蝴蝶兰原球茎采用的外植体主要有根段、花梗苗根尖、花梗腋芽、茎尖、叶片、胚、花葶节间(花葶:地上无茎植物从地表,通常自基生莲座抽出的无叶花序梗)、花梗节或花梗节间切段、种子等。蝴蝶兰不同外植体的成活率有差异,其中花梗侧芽的成活率最高,其次为花梗,叶片和根尖最差。针对不同外植体,取材方法也不同,通常取花梗节之间1~2cm 长的幼嫩部分,切取长2~3mm 的切段作为外植体。如利用2~3cm 长的根尖段,将其切成0.5~0.8cm,接种2 周后根端切口处开始膨大,产生淡绿色瘤状愈伤组织;采用无菌种子苗茎尖作为外植体时,培养30d 后基部出现愈伤组织,出愈率达85%以上;而利用正在培养的花梗苗生长旺盛的根尖进行培养,20d 左右外植体膨大且表面颜色明显加深;用花梗腋芽为起始材料诱导花葶,由花葶节间切片可以高频率诱导分化不定芽。 基本培养基的选择:蝴蝶兰组织培养所采用的基本培养基包括 MS、1/2MS、VW、B5、KC、花宝及其改良型等。但由于蝴蝶兰品种差异及外植体来源不同对最适培养基的选择是不同的:以红花品种为试材,以改良KC 的效果最好,1/2MS 次之,MS 最差;蝴蝶兰的原球茎增殖培养以较低的无机盐浓度为好,大量元素对原球茎增殖有很大影响,1/2MS 对原球茎增殖最有利。在花梗节间切段诱导原球茎的实验过程中对培养基进行筛选,也发现1/2MS 或改良MS 较MS 效果好,减少MS 中大量元素和部分微量元素及有机成分,适当增加少量的叶酸和生物素有利于原球茎的增殖生长;但MS 培养基最适合蝴蝶兰种子的萌发。也有报道B5 培养基更有利于蝴蝶兰根段原球茎的诱导和增殖。 植物生长调节剂对蝴蝶兰原球茎增殖与分化的影响:蝴蝶兰组织培养中常用的细胞分裂素为6-BA,较高浓度(1~8mg/L)的6-BA 能促进蝴蝶兰原球茎增殖,较低浓度(0.1~0.5mg/L)的6-BA 则能促进原球茎分化。有研究表明,低浓度6-BA有利于原球茎的增殖,而高浓度(6mg/L)的6-BA 刺激多酚氧化酶作用,使原球茎容易产生褐化。低浓度的NAA 对原球茎增殖和出苗均有促进作用,高浓度的则不利。研究表明,适宜浓度的6-BA 配合较低浓度的NAA,更有利于原球茎的增殖,2.0mg/L 6-BA 和0.3mg/L NAA 配合使用是蝴蝶兰原球茎增殖的最佳组合。高浓度的NAA 对蝴蝶兰原球茎增殖有一定的抑制作用,NAA 浓度从1mg/L 增加到3mg/L,增殖率相应从98.3%下降到38.3%;采用3.0mg/L 6-BA + 0.2mg/L NAA 配方,能够有效的诱导原球茎,同时还发现提高激素配比(5.0mg/L 6-BA + 0.2mg/LNAA + 活性碳1.0g/L),则有利于原球茎的增殖,提高增殖系数,且不用转接就可直接生根成苗,避免转接过程带来的污染损失,简化了培养过程,因而是一种值得推广的方法;此外,在培养基中加入1.0mg/L GA3 对原球茎分化成芽有一定的抑制效果,为获得大量原球茎而避免分化成芽,适当添加GA3 是有一定作用的。 添加物对蝴蝶兰原球茎增殖和分化的影响:一些氨基酸类添加物,也可以作为培养基中的有机氮源,例如甘氨酸能促进离体根的生长。丝氨酸和谷氨酰胺有利于花药、胚状体或不定芽的分化。水解酪蛋白和水解乳蛋白对胚状体或不定芽或多胚的分化有良好的促进作用。而在培养基中加入一些天然有机物,如椰乳、香蕉泥、番茄汁等,也能提供一些必要的微量营养成分、生理活性物质和生长激素等,如加入100~200mg/L 香蕉泥,具有较大的pH 缓冲作用,对幼苗发育有促进作用。水解酪蛋白对蝴蝶兰原球茎增殖有明显促进作用,而水解酪蛋白和香蕉匀浆相结合却对原球茎增殖有抑制作用,有机添加物之间的相互作用或有机添加物与培养基之间的相互作用可能对原球茎增殖有影响。许多研究也表明,添加适量的香蕉泥、椰乳或含胶质的果菜汁等均对原球茎增殖有明显促进效果。培养基中添加活性炭,低浓度(0.5~