2019高考化学二轮复习选择题标准练五
- 格式:doc
- 大小:292.50 KB
- 文档页数:3

选择题标准练(十)(分值42分,建议用时:10~15分钟)7.化学与生活息息相关。
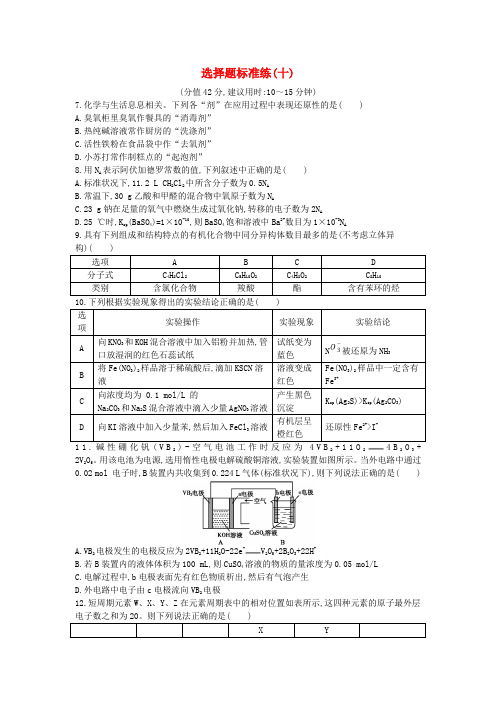
下列各“剂”在应用过程中表现还原性的是( ) A.臭氧柜里臭氧作餐具的“消毒剂” B.热纯碱溶液常作厨房的“洗涤剂” C.活性铁粉在食品袋中作“去氧剂” D.小苏打常作制糕点的“起泡剂”8.用N A 表示阿伏加德罗常数的值,下列叙述中正确的是( ) A.标准状况下,11.2 L CH 2Cl 2中所含分子数为0.5N A B.常温下,30 g 乙酸和甲醛的混合物中氧原子数为N AC.23 g 钠在足量的氧气中燃烧生成过氧化钠,转移的电子数为2N AD.25 ℃时,K sp (BaSO 4)=1×10-10,则BaSO 4饱和溶液中Ba 2+数目为1×10-3N A9.具有下列组成和结构特点的有机化合物中同分异构体数目最多的是(不考虑立体异被还原为Fe(NO 11.碱性硼化钒(V B2)-空气电池工作时反应为4V B 2+11O 24B 2O 3+ 2V 2O 5。
用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。
当外电路中通过0.02 mol 电子时,B 装置内共收集到0.224 L 气体(标准状况下),则下列说法正确的是( )A.VB2电极发生的电极反应为2VB 2+11H 2O-22e -V 2O 5+2B 2O 3+22H +B.若B 装置内的液体体积为100 mL,则CuSO 4溶液的物质的量浓度为0.05 mol/LC.电解过程中,b 电极表面先有红色物质析出,然后有气泡产生D.外电路中电子由c 电极流向VB 2电极12.短周期元素W 、X 、Y 、Z 在元素周期表中的相对位置如表所示,这四种元素的原子最外层B.原子半径大小:Z>W>Y>XC.工业上用电解熔融的W与Y所形成的化合物来制取WD.X的一种氢化物可以和Z的单质反应生成大量白烟13.pc类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。

选择题标准练(九)(分值42分,建议用时:10~15分钟)7.生产、生活中常涉及化学知识,下列说法正确的是( )A.ClO 2、酒精、双氧水均能杀菌消毒,其原理相同B.天然纤维的主要成分都是纤维素C.煤的干馏和煤的液化均为化学变化D.蛋白质、油脂、烧碱、碳酸钙分别是纯净物、混合物、电解质和非电解质8.下列说法正确的是( )A.麦芽糖的水解产物不能发生银镜反应B.油脂在酸性或碱性条件下均可发生水解反应,最终产物不相同C.蛋白质溶液里加入饱和硫酸铵溶液,蛋白质析出,再加水不再溶解D.用甘氨酸和丙氨酸缩合最多可形成3种二肽学奖。
轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH 2Cl 2、丙烯、戊醇、苯,下列说法不正确的是( )A.CH 2Cl 2有两种同分异构体B.丙烯能使溴水褪色C.戊醇在一定条件下能与乙酸发生酯化反应D.苯与足量氢气在镍催化作用下会发生加成反应生成环己烷11.硼酸(H 3BO 3)为一元弱酸,已知H 3BO 3与足量NaOH 溶液反应的离子方程式为H3BO 3+OH -B(OH ,H 3BO 3可以通过电解的方法制备。
其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。
下列说法错误的是( )A.a 与电源的正极相连接B.阳极的电极反应式为2H2O-4e -O 2↑+4H +C.当电路中通过3 mol 电子时,可得到1 mol H 3BO 3D.B(OH 穿过阴膜进入产品室,Na +穿过阳膜进入阴极室 12.X 、Y 、Z 、W 、R 属于短周期主族元素。
X 的原子半径在短周期主族元素中最大,Y 核素的最外层电子数为m,次外层电子数为n, Z 原子的L 层电子数为m+n, M 层电子数为m-n ≠0 , W 与Z 同主族,R 与Y 的核外电子数之比为2∶1,下列叙述错误的是( )A.X 与Y 形成的两种常见化合物中阴、阳离子的个数比均为1∶2B.Y 的氢化物比R 的氢化物稳定,沸点高C.Y 分别与Z 、W 、R 以两种元素组成的常见化合物均有3种D.Z 、W 、R 最高价氧化物对应水化物的酸性由强到弱顺序是R>W>Z13.若用AG 表示溶液的酸度,其表达式为AG=lg。

选择题标准练(二) (分值42分,建议用时:10~15分钟) 7.化学与生产、生活和社会密切相关,下列有关说法正确的是( ) A.英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2 B.农作物收获后,可以就地焚烧秸秆,增加土壤中钾肥含量 C.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体 D.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳”涉及的操作方法是升华 8.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
下列说法错误的是( ) A.设计步骤①、②、③的主要目的是富集MgCl2 B.脱水时在HCl气氛中进行可防止MgCl2发生水解 C.电解得到的炽热镁粉可在二氧化碳气氛中冷却 D.上述工艺流程中未涉及置换反应 9.下列说法正确的是( ) A.油脂发生皂化反应后,向反应混合物中加入食盐可将肥皂分离出来 B.控制甲烷与氯气的物质的量比例,在光源下反应,可得到某一纯净的有机取代产物 C.植物油与裂化汽油可用酸性KMnO4溶液鉴别 D.由于乙酸和乙醇中都有羟基,因此两者都能与Na和NaOH溶液反应 10.短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数之和为13,X的原子半径比Y的小,X与W同主族,X与Z形成的化合物X2Z2常用于消毒和制备少量Z的单质。下列说法错误的是( ) A.X、Y、Z三种元素可以形成离子化合物 B.元素X和W形成的二元化合物能与水反应 C.元素Y的简单气态氢化物的热稳定性比Z的氢化物弱 D.元素Y、Z、W形成的简单离子中,Y的离子半径最小 11.设NA为阿伏加德罗常数的数值。下列有关叙述错误的是( ) A.28 g由N2与CO组成的混合气体中所含的原子数为2NA B.78 g Na2O2中所含的阴离子数为NA C.0.1 mol SO2与0.1 mol O2充分反应后生成的SO3分子数为0.1NA D.0.1 mol Cu溶于足量稀硝酸中,转移的电子数为0.2NA 12.如图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是( ) A.放电时溶液中的K+移向负极 B.充电时阴极附近的pH会降低 C.理论上负极质量每减少6.5 g,溶液质量增加6.3 g D.放电时正极反应为H++NiOOH+e-Ni(OH)2 13.某化学兴趣小组用如图装置探究硝酸银受热分解的产物,在a处充分加热固体后,b中观察到红棕色气体,d中收集到无色气体,a中残留黑色固体,下列叙述错误的是( )
选择题标准练(五)
(分值42分,建议用时:10~15分钟)
7.以下生产或生活过程不涉及化学反应的是( )
A.用含NaHCO3的干粉灭火剂灭火
B.用活性炭口罩防护空气中的粉尘等有害物质
C.向95%酒精中加生石灰蒸馏来制取无水乙醇
D.含活性炭、细铁、食盐及蛭石等的暖手宝,在被使用时会发热
8.NA表示阿伏加德罗常数的数值。下列说法正确的是( )
A.在标准状况下,11.2 L丙烷含有的极性键数目为5NA
B.7 g锂在空气中完全燃烧时转移的电子数为NA
C.1 mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D.常温下,0.2 L 0.5 mol· L-1NH4NO3溶液中含有的氮原子数小于0.2NA
9.位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径
r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数
之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是( )
A.丙的简单氢化物分子内存在氢键
B.由甲、乙两元素组成的化合物中,只含有极性键
C.由甲和丙两元素组成的分子不止一种
D.乙和丁两元素的最高价氧化物的水化物之间能发生反应
10.下列实验操作规范且能达到目的的是( )
目的 操作
A 鉴别CO2和SO2气体 将气体分别通入硝酸酸化的BaCl2溶液
B 制备氢氧化铁胶体 向沸水中一次加入大量的FeCl3饱和溶液
C
检验蔗糖水解产物中是否含有葡萄糖 在蔗糖溶液中加入3~5滴稀硫酸,煮沸几分钟,冷却后加入
银氨溶液,在水浴中加热
D
比较Fe3+和Cu2+对H2O2分解的催化效果 向两支装有2 mL 5% H2O2溶液的试管中分别滴入0.1
mol·L-1FeCl3和CuSO4溶液各1 mL
11.NaS电池的结构如图所示,电池反应为2Na+S8Na2Sn。下列说法不正确的是( )
A.熔钠电极作电池的负极
B.放电时Na+向正极移动
C.充电时熔钠电极与电源的正极相连
D.充电时阳极反应式为8-16e-nS8
12.25 ℃时,H2SO3及其钠盐的溶液中,H2SO3、HS、S的物质的量分数(α)随溶液pH变
化关系如图所示,下列叙述错误的是( )
A.溶液的pH=5时,硫元素的主要存在形式为HS
B.当溶液恰好呈中性时:c(Na+)>c(S)+c(HS)
C.向pH=8的上述溶液中滴加少量澄清石灰水,的值增大
D.向pH=3的上述溶液中滴加少量稀硫酸,α(HS)减小
13.下列实验方案、现象、结论均正确的是( )
选
项
实验及现象 结论
A
在KSCN与FeCl3的混合液中再加入KCl固体,溶液颜色不变 增大Cl-浓度,平衡不移
动
B 向NaHCO3溶液中加入过量盐酸振荡、静置、有气泡产生
证明非金属性:
Cl>C
C 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
证明氧化性:
H2O2>Fe3+
D
AgCl的浊液中加入 0.1 mol·L-1 K2CrO4溶液,生成Ag2CrO4砖红色沉淀 Ag2CrO4的溶度积比AgCl
的小
7.B A项,NaHCO3受热分解可以产生CO2、水,能灭火,用干粉灭火器涉及分解反应;B项,活性
炭吸附性属于物理性质,不涉及化学反应;C项,涉及CaO+H2O
Ca(OH)2这个化合反应;D项,涉及原电池反应。所以B符合题目要求。
8.B 每个丙烷分子含有8个C—H极性键,所以标准状况下 11.2 L 即0.5 mol丙烷含极性
键为4NA,故A错误;Li燃烧产生 Li2O,7 g锂即1 mol锂转移电子为NA,故B正确;每个葡萄
糖分子含有5个羟基,所以1 mol葡萄糖含有羟基数目为5NA,故C错误;根据原子守恒知N
原子数等于0.2NA,故D错误。
9.C 甲、乙、丙、丁四种短周期元素原子序数依次增大,原子半径r(丁)>r(乙)
>r(丙)>r(甲),由序数及半径关系可知:甲与乙、丙不在同一周期,乙、丙与丁也不在同一周
期,故甲只能在第一周期,乙、丙在第二周期,丁在第三周期,则甲为H元素;四种元素中只有
一种为金属元素,四种元素处于不同的主族,乙和丙原子的最外层电子数之和为丁原子的最
外层电子数的3倍,乙为C元素,丙为N元素,丁为Al元素。丙为N元素,丙的简单氢化物为
NH3,NH3分子间存在氢键,NH3分子内没有氢键,A错误;甲为H元素,乙为C元素,甲、乙组成的
化合物有CH4、C2H4等烃,CH4中只有极性键,其余烃中既有极性键又有非极性键,B错误;H与N
可形成NH3、N2H4,C正确;乙的最高价氧化物对应水化物为H2CO3,丁的最高价氧化物对应水化
物为 Al(OH)3,Al(OH)3与H2CO3不反应,D错误。
10.A CO2与BaCl2溶液不反应,SO2先与硝酸反应生成H2SO4,再和BaCl2溶液反应生成BaSO
4
白色沉淀,A项能达到目的;向沸水中滴入FeCl3饱和溶液才能生成Fe(OH)3胶体,一次性加入
大量FeCl3饱和溶液,生成Fe(OH)3量太多,易生成沉淀,B项不能达到目的;银氨溶液检验蔗糖
水解产物要在碱性环境中进行,加入银氨溶液之前应先加入NaOH中和硫酸,C项不能达到目
的;FeCl3和CuSO4溶液所含阴离子不同,不能排除Cl-和S对反应的影响,D项不能达到目
的。
11.C 放电时,熔钠电极失电子发生氧化反应,所以放电时熔钠电极作电池的负极,A正确;
原电池中电解质的阳离子移向正极,即Na+向正极移动,B正确;充电时,原电池的负极和电源
的负极相连,原电池的正极和电源的正极相连,放电时熔钠电极是负极,充电时熔钠电极与电
源的负极相连,C不正确;充电时阳极发生失电子的氧化反应,电极反应式为
8-16e-nS8,D正确。
12.C 分析题给图像知,溶液的pH=5时,硫元素的主要存在形式为HS,A正确;根据电荷守
恒知,c(Na+)+c(H+)=2c(S)+c(HS)+c(OH-),当溶液恰好呈中性时c(H+)=c(OH-),则
c(Na+)>c(S)+c(HS),B正确;向pH=8的上述溶液中滴加少量澄清石灰水发生反
应:HS+OH-S+H2O,Ca2++SCaSO3,参加反应的HS比S多,的值
减小,C错误;向pH=3的上述溶液中滴加少量稀硫酸发生反应:H++HSH2SO3,α(HS)
减小,D正确。
13.A Fe3+和SCN-的浓度不变,Cl-浓度的变化对平衡Fe3++3SCN-Fe(SCN)3没有影响,A正
确;HCl不是氯元素最高价氧化物对应的水化物,不能据此实验比较Cl元素和C元素的非金
属性强弱,B错误;该溶液中有2种氧化剂:H2O2、HNO3,无法判断是哪种物质将Fe2+氧化,也就
无法得知H2O2、Fe3+的氧化性强弱,C错误;Ag2CrO4和AgCl是不同类型的难溶电解质,不能据
此实验比较两者Ksp的相对大小,D错误。