苯甲酸的合成工艺
- 格式:doc
- 大小:18.50 KB
- 文档页数:3
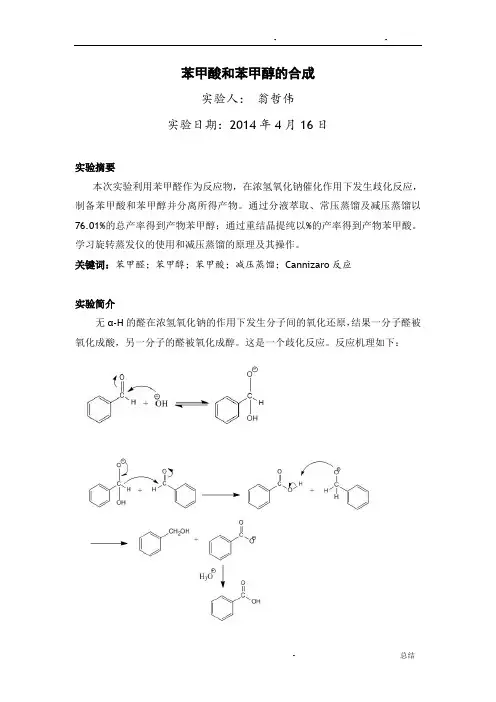
苯甲酸和苯甲醇的合成实验人:翁哲伟实验日期:2014年4月16日实验摘要本次实验利用苯甲醛作为反应物,在浓氢氧化钠催化作用下发生歧化反应,制备苯甲酸和苯甲醇并分离所得产物。
通过分液萃取、常压蒸馏及减压蒸馏以76.01%的总产率得到产物苯甲醇;通过重结晶提纯以%的产率得到产物苯甲酸。
学习旋转蒸发仪的使用和减压蒸馏的原理及其操作。
关键词:苯甲醛;苯甲醇;苯甲酸;减压蒸馏;Cannizaro反应实验简介无α-H的醛在浓氢氧化钠的作用下发生分子间的氧化还原,结果一分子醛被氧化成酸,另一分子的醛被氧化成醇。
这是一个歧化反应。
反应机理如下:反应实质是OH-作为亲核试剂进攻一个苯甲醛分子的羰基生成负离子,此负离子使原来醛基上的氢带着一对电子对另一分子苯甲醛进行亲核加成。
该实验使用到旋转蒸发仪,旋转蒸发仪使烧瓶在合适速度下旋转以增大蒸发面积,同时通过真空泵使烧瓶处于负压状态,连续蒸馏易挥发溶剂,提高蒸馏效率。
当外界压力减少时,液体物质的沸点就随压力降低而降低。
若使用真空泵与蒸馏装置相连接,使体系压力降低,可以在较低的温度下进行蒸馏。
本实验中的产物中有苯甲醇,在常压下沸点在205℃,较难蒸馏。
而在减压蒸馏过程中可以控制在较低的温度下进行蒸馏。
苯甲醛是最简单,也是工业上最常使用的芳香醛,是重要的化工原料。
苯甲醇可用作香精调配的定香剂,同时可用作照相显影剂、合成树脂和油脂的溶剂等。
苯甲酸可用于皮肤真菌病、浅部真菌感染的治疗,也可用于食品和药物制剂的防腐剂。
实验试剂性质相对分子质量熔点沸点相对密度折射率苯甲醛106.12 -26℃178~179℃ 1.044 1.5450苯甲酸122.12 122~123℃249℃苯甲醇108.41 -15.3℃205℃ 1.045 1.5400乙醚74.12 -116.3℃34.6℃ 2.6 1.3556实验装置实验步骤分液装置常压蒸馏装置重结晶装置减压蒸馏装置1、制备过程:在150mL锥形瓶称取10.02g氢氧化钠(0.2505mol)加入10mL水,振摇使其溶解,冷却至室温。

间甲基苯甲酸生产工艺
间甲基苯甲酸的生产工艺通常包括以下几个步骤:
1. 原料准备:准备苯和甲酸作为原料。
苯是一种有机化工原料,可以通过提炼石油或裂解原油得到。
甲酸可以通过合成或者提取天然产物得到。
2. 反应步骤:苯和甲酸经过醋酸或者亲水性催化剂的催化下,在适当的条件下进行反应。
常见的条件包括高温和高压。
反应生成的产物是苯甲酸和甲酸。
3. 分离步骤:将反应产物进行分离。
常见的分离方法包括蒸馏、结晶和过滤等。
通常会得到苯甲酸和未反应的甲酸。
4. 精馏步骤:通过精馏过程对产物进行纯化,去除杂质。
精馏通常使用提纯柱或者等效装置进行。
5. 降解步骤:苯甲酸和甲酸混合后,经过一定的降解条件,可以将其转化为间甲基苯甲酸。
常见的降解条件包括溶剂选择和温度控制等。
6. 后处理步骤:对产物进行后处理,包括过滤、干燥和包装等。
最终得到的产物是纯度较高的间甲基苯甲酸。
需要注意的是,不同的生产厂家可能会有不同的工艺流程和条件,上述步骤仅供参考,具体工艺可能因厂家而异。

苯甲醇和苯甲酸的制备实验报告实验报告:苯甲醇和苯甲酸的制备实验目的:本实验旨在通过还原苯甲醛和进行氧化反应制备苯甲醇和苯甲酸,并通过对反应的观察和数据分析,掌握有关苯甲醇和苯甲酸的制备方法及其反应规律。
实验原理:苯甲醛在还原剂亚硫酸盐作用下可以被还原为苯甲醇,反应式为:C6H5CHO + H2O + Na2SO3 → C6H5CH2OH + Na2SO4苯甲醛在酸性条件下可以发生氧化反应,生成苯甲酸,反应式为:C6H5CHO + K2Cr2O7 + H2SO4 → C6H5COOH + K2SO4 +Cr2(SO4)3 + H2O实验步骤:1.称取5g苯甲醛,加入50ml去离子水中,加入过量亚硫酸钠,并充分搅拌,直至完全溶解。
2.将反应混合物用5% HCl调节至pH=5-6,再滴加少量丁醇,将混合物过滤,并用少量水洗涤3.将获得的苯甲醇加入到精馏瓶中,在水浴中进行精馏,收集温度为197°C-200°C的馏分。
4.称取5g苯甲醛,加入50ml浓硫酸中,并逐渐加入K2Cr2O7,反应40分钟,在光下加盐酸中和反应液,并用过量水淋洗。
5.将得到的苯甲酸加入到烧杯中,用浓硫酸和水调节pH值至2-3,冷却后在冰浴中结晶,过滤后析出纯品。
实验结果:1.苯甲醇的收率为80%。
2.苯甲酸的收率为65%。
实验讨论:1.实验中误差原因主要是因为反应不完全或产物的挥发丢失,导致产率偏低。
2.苯甲醇和苯甲酸的制备方法都是利用化学反应从苯甲醛中提取所需产物,目前该方法已被广泛应用于工业生产中。
3.实验中采取同时进行两种反应的方法,可以节约反应时间,提高产量。
结论:通过本实验可以得到苯甲醇和苯甲酸的制备方法,并对反应规律进行了初步探索。
实验结果表明,在适当的反应条件下,可以得到较高的产率。

苯甲酸和苯甲醇的制备实验报告苯甲醇和苯甲酸的制备学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:实验八:苯甲醇和苯甲酸的制备一、实验目的1.学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法。
3.进一步掌握萃取、洗涤、蒸馏和干燥等基本操作。
二、产品介绍苯甲醇是最简单的芳香醇之一,可看作是苯基取代的甲醇。
在自然界中多数以酯的形式存在于香精油中。
中文别名苄醇;。
苄醇是极有用的定香剂,用于配制香皂;日用化妆香精。
但苄醇能缓慢地自然氧化,一部分生成苯甲醛和苄醚,使市售产品常带有杏仁香味,故不宜久贮。
苄醇在工业化学品生产中用途广泛;医药;合成树脂溶剂;可用作尼龙丝;纤维及塑料薄膜的干燥剂,染料;纤维素酯;酪蛋白的溶剂,制取苄基酯或醚的中间体。
同时,广泛用于制笔(圆珠笔油);油漆溶剂等。
苯甲酸为具有苯或甲醛的气味的鳞片状或针状结晶,具有苯或甲醛的臭味。
在100℃时迅速升华,它的蒸气有很强的刺激性,吸入后易引起咳嗽。
微溶于水,易溶于乙醇、乙醚等有机溶剂。
苯甲酸是弱酸,比脂肪酸强。
它们的化学性质相似,都能形成盐、酯、酰卤、酰胺、酸酐等,都不易被氧化。
苯甲酸的苯环上可发生亲电取代反应,主要得到间位取代产。
三:反应式CHO2+ NaOHCH2OH+COONaCOONaCOOH+ HCl+ NaClCOOH主反应:CHO副反应:+O2学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:四:主要试剂及产品的物理常数五:试剂与仪器1、主要仪器:125mL 圆底烧瓶、分液漏斗,蒸馏装置、烧杯等。
2、主要试剂规格及用量:学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:六:实验装置图图一:分液漏斗图二:抽滤装置图三:蒸馏装置七:实验步骤及现象学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:八:实验结果及分析得到苯甲醇4.6mL,处在参考值4.5—6g之间,说明实验操作基本正确;苯甲酸9.4g,高于参考值6g,说明在实验过程中还存在失误。

苯甲酸钠的生产工艺苯甲酸钠是一种重要的有机化工中间体,广泛应用于染料、香料、医药、农药等行业。
下面将详细介绍苯甲酸钠的生产工艺。
一、苯甲酸钠的原料及性质:苯甲酸钠的原材料是苯甲酸和氢氧化钠,苯甲酸是由苯和氧化剂在催化剂的作用下氧化生成的。
苯甲酸钠是无色结晶性粉末,可溶于水和乙醇,微溶于醚。
二、苯甲酸钠的生产工艺:1. 苯甲酸的氧化:苯甲酸可以通过苯的氧化反应得到,反应方程式如下:C6H6 + O2 →C6H5COOH反应较为剧烈,需要在高温下进行,常常在空气中把苯甲酸暴露在500以上,催化剂常采用钌催化剂或二氧化锰等。
2. 苯甲酸钠的制备:将氢氧化钠与苯甲酸反应,生成苯甲酸钠,反应方程式如下:C6H5COOH + NaOH →C6H5COONa + H2O反应需要在差不多常温下进行,反应物与中间过程产物都是固体,因此要想优化反应效率,需要提高反应的渗透性,例如利用搅拌、提高反应温度等手段。
3. 苯甲酸钠的结晶和分离:将反应得到的苯甲酸钠溶液进行脱水浓缩处理,得到苯甲酸钠结晶,再进行过滤和干燥操作,得到最终的苯甲酸钠产品。
4. 苯甲酸钠的精制:获取粗苯甲酸钠后,通常需要进行进一步的精制,以提高产品的纯度。
精制方法主要有结晶法、溶剂结晶法和再结晶法等。
5. 苯甲酸钠的应用:苯甲酸钠广泛应用于染料、香料、医药、农药等行业。
其中,苯甲酸钠在染料工业中用作染料的中间体,可以合成不同的染料结构。
在医药工业中,苯甲酸钠是制备非甾体抗炎药的重要原料。
此外,苯甲酸钠还可以作为食品添加剂、保护剂等多个方面的用途。
以上是苯甲酸钠的生产工艺的基本内容,苯甲酸钠的生产过程需要具备化工知识和先进的生产设备,同时还需要严格控制工艺参数来保证产品的质量。

苯甲醇与苯甲酸的制备实验一、实验原理利用坎尼扎罗(Cannizzaro)反应由苯甲醛制备苯甲醇和苯甲酸。
坎尼扎罗反应是指无α-活泼氢的醛类在浓的强NaOH或KOH水或醇溶液作用下发生的歧化反应。
此反应的特征是醛自身同时发生氧化及还原作用,一分子醛被氧化成羧酸(在碱性溶液中成为羧酸酸盐),另一分子醛则被还原成醇。
主反应:机理:醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
二、反应试剂、产物、副产物的物理常数三、药品四、实验流程图五、实验装置图图1 磁力搅拌器图2分液漏斗的振摇方法图3分液漏斗图4抽滤装置六、实验内容往锥形瓶中加12.0g(0.21mol)氢氧化钾和12ml水,放在磁力搅拌器上搅拌,使氢氧化钾溶解并冷至室温。
在搅拌的同时分批加入新蒸过的苯甲醛,每次加入2-3ml,共加入13.5ml(约14g,0.13mol)。
加后应塞紧瓶口,若锥形瓶内温度过高,需适时冷却。
继续搅拌60min,最后反应混合物变成白色蜡糊状。
(1)苯甲醇向反应瓶中加入大约45ml水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45ml 乙醚分三次萃取苯甲醇,合并乙醚萃取液。
保存水溶液留用。
依次用15ml25%亚硫酸氢钠溶液及8ml水洗涤乙醚溶液,用无水硫酸镁干燥。
水浴蒸去乙醚后,继续蒸馏,收集产品,沸程204-206℃,产率为75%。
纯苯甲醇有苦杏仁味的无色透明液体。
沸点bp=205.4℃,折光率=1.5463。
(2)苯甲酸在不断搅拌下,往留下的水溶液中加入浓盐酸酸化,加入的酸量以能使刚果红试纸由红变蓝为宜。
充分冷却抽滤,得粗产物。
粗产物用水重结晶后晾干,产率可达80%。
纯苯甲酸为白色片状或针状晶体。
熔点mp=122.4℃。
(一)制备阶段1.准备锥形瓶:一只100ml锥形瓶。
2.加药品与歧化反应:向锥形瓶中加12.0g氢氧化钾和12ml水,向瓶内放入一只搅拌子,然后将锥形瓶放在磁力搅拌器上搅拌,使氢氧化钾溶解并冷至室温。

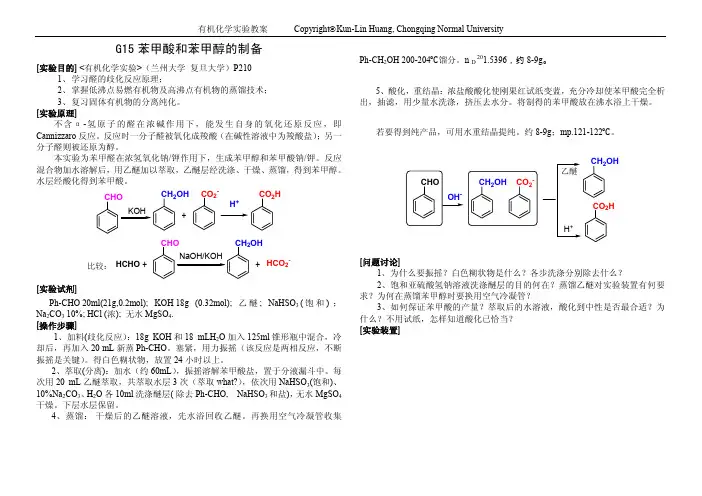
G15苯甲酸和苯甲醇的制备[实验目的] <有机化学实验>(兰州大学复旦大学)P2101、学习醛的歧化反应原理;2、掌握低沸点易燃有机物及高沸点有机物的蒸馏技术;3、复习固体有机物的分离纯化。
[实验原理]不含α-氢原子的醛在浓碱作用下,能发生自身的氧化还原反应,即Cannizzaro反应。
反应时一分子醛被氧化成羧酸(在碱性溶液中为羧酸盐);另一分子醛则被还原为醇。
本实验为苯甲醛在浓氢氧化钠/钾作用下,生成苯甲醇和苯甲酸钠/钾。
反应混合物加水溶解后,用乙醚加以萃取,乙醚层经洗涤、干燥、蒸馏,得到苯甲醇。
水层经酸化得到苯甲酸。
CHO CH2OH CO2-+CO2H H+KOHCHO+HCHO +HCO2-比较:[实验试剂]Ph-CHO 20ml(21g,0.2mol); KOH 18g (0.32mol); 乙醚; NaHSO3 (饱和) ;Na2CO3 10%; HCl (浓); 无水MgSO4.[操作步骤]1、加料(歧化反应):18g KOH和18 mLH2O加入125ml锥形瓶中混合,冷却后,再加入20 mL新蒸Ph-CHO。
塞紧,用力振摇(该反应是两相反应,不断振摇是关键)。
得白色糊状物,放置24小时以上。
2、萃取(分离):加水(约60mL),振摇溶解苯甲酸盐,置于分液漏斗中。
每次用20 mL乙醚萃取,共萃取水层3次(萃取what?),依次用NaHSO3(饱和)、10%Na2CO3、H2O各10ml洗涤醚层( 除去Ph-CHO, NaHSO3和盐),无水MgSO4干燥。
下层水层保留。
4、蒸馏:干燥后的乙醚溶液,先水浴回收乙醚。
再换用空气冷凝管收集Ph-CH2OH 200-204Ԩ馏分。
n D 201.5396,约8-9g。
5、酸化,重结晶:浓盐酸酸化使刚果红试纸变蓝,充分冷却使苯甲酸完全析出,抽滤,用少量水洗涤,挤压去水分。
将制得的苯甲酸放在沸水浴上干燥。
若要得到纯产品,可用水重结晶提纯。

实验:苯甲醇和苯甲酸的制备一、实验目的1.学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法。
3.进一步掌握萃取、洗涤、蒸馏和干燥等基本操作。
二、产品介绍苯甲醇是最简单的芳香醇之一,可看作是苯基取代的甲醇。
在自然界中多数以酯的形式存在于香精油中。
中文别名苄醇。
苄醇是极有用的定香剂,用于配制香皂;日用化妆香精。
但苄醇能缓慢地自然氧化,一部分生成苯甲醛和苄醚,使市售产品常带有杏仁香味,故不宜久贮。
苄醇在工业化学品生产中用途广泛;医药;合成树脂溶剂;可用作尼龙丝;纤维及塑料薄膜的干燥剂,染料;纤维素酯;酪蛋白的溶剂,制取苄基酯或醚的中间体。
同时,广泛用于制笔(圆珠笔油);油漆溶剂等。
苯甲酸为具有苯或甲醛的气味的鳞片状或针状结晶,具有苯或甲醛的臭味。
在100℃时迅速升华,它的蒸气有很强的刺激性,吸入后易引起咳嗽。
微溶于水,易溶于乙醇、乙醚等有机溶剂。
苯甲酸是弱酸,比脂肪酸强。
它们的化学性质相似,都能形成盐、酯、酰卤、酰胺、酸酐等,都不易被氧化。
苯甲酸的苯环上可发生亲电取代反应,主要得到间位取代产。
三、基本原理无α-H的醛在浓碱溶液作用下发生歧化反应,一分子醛被氧化成羧酸,另一分子醛则被还原成醇,此反应称坎尼扎罗反应。
本实验采用苯甲醛在浓氢氧化钠溶液中发生坎尼扎罗反应,制备苯甲醇和苯甲酸,反应式如下:主反应:CHO+ NaOH 2CH2OH+COONaCOONa+ HCl COOH+ NaCl副反应:四、主要试剂及产品的物理常数COOH +O2五、试剂与仪器1、主要仪器: 100mL 锥烧瓶、分液漏斗,蒸馏装置、烧杯等。
2、主要试剂规格及用量:六、实验装置本实验制备苯甲醇和苯甲酸,采用机械搅拌下的加热回流装置,如图1所示。
乙醚的沸点低,要注意安全,蒸馏低沸点液体的装置如图2所示。
图1 制备苯甲酸和苯甲醇的反应装置图图2 蒸乙醚的装置图七、实验步骤在100mL锥形瓶中,放入9g氢氧化钠和9ml水配置成的水溶液,振荡使氢氧化钠完全溶解。

甲苯氧化制备苯甲酸广东工业大学实验报告学院(系) 专业班成绩评定学号姓名老师签名实验 16 题目甲苯氧化制备苯甲酸第周星期一、实验目的了解由甲苯为原料制备苯甲酸的路径和方法,复习氧化反应及相转移催化反应,学习机械搅拌器的使用,复习回流、减压过滤等操作。
二、实验试剂与仪器甲苯,高锰酸钾,相转移催化剂(氧化铁、聚乙二醇400、溴化四丁铵),无水碳酸钠,盐酸,亚硫酸氢钠,氢氧化钠,酚酞指示剂,甲基橙指示剂。
圆底烧瓶,搅拌器,冷凝管,胶管,胶塞,减压过滤装置,烧杯,玻璃棒,电炉,石棉网。
三、实验操作1、仪器安装、加料及反应在250mL三口烧瓶中加入2.7mL甲苯、100mL水和一定量(约0.8g)的相转移催化剂,在石棉网上加热至沸。
分两批加入8.5g高锰酸钾,黏附于瓶口高锰酸钾用少量水冲入瓶内。
继续在搅拌下反应,直至甲苯层几乎消失、回流液不再出现油珠(约2h)。
2、分离提纯将反应混合物趁热减压过滤,用少量热水洗涤滤渣二氧化锰。
合并滤液和洗涤液,加入少量的亚硫酸氢钠还原未反应完的高锰酸钾,直至紫色褪去,成为无色透明的溶液。
再进行减压过滤,将滤液放于冰水浴中冷却,然后加入浓盐酸酸化,边加边搅拌,且用pH试纸测溶液的pH值直至强酸性,这时苯甲酸结晶析出。
将析出的苯甲酸减压过滤,得到粗的苯甲酸。
四、实验操作要点(1)反应得到的混合物一定要趁热过滤。
(2)要注意比较采用不同相转移催化剂的反应现象、过程与结果。
五、实验结果及讨论六、思考题(1)在氧化反应中,影相苯甲酸产量的主要因素有哪些,(2)反应完毕后,如果滤液呈紫色,加亚硫酸氢钠的原因是什么,。

苯 甲 醛 合 成 苯 甲 酸材料化学09-1 许军 0901130831羰基是醛的官能团,也是醛类化合物的反应中心。
苯甲醛的结构式如图1:羰基C O 作为吸电子的钝化基团(或称间位定位取代基,也称第二类取代基),通过吸电子共轭效应和诱导效应都能够使苯环上的电子云密度降低,因而降低了苯环上亲电取代反映的活性,即钝化了苯环H图2亲电取代反映的活性。
由图(2)亦可看出:电子云密度降低程度较大的位置是在邻位和对位,因此,相对而言,间位上更容易发生亲电取代反应。
苯甲醛中羰基上的碳原子(或直接与苯环相连的原子)为强极性缺电子原子或带有部分正电的原子,这是由于氧原子的电负性(χ)很大,其值为χ=3.5(仅次于电负性最大的F原子的电负性χ=4.0),因此,吸附了大量的电子而致使羰基碳原子上带有大量正电荷,所以,羰基碳原子易被带有一对未共用的电子的亲核试剂进攻,导致π键异裂,形成两个新的σ键,即发生亲核加成反应。
CHO+Y C O +HY增长: C O+O 2O CHOO +O⒊苯甲醛没有α活泼氢,可在强碱的作用下发生分子间的氧化还原,结果一分子醛被氧化成苯甲酸,另一分子的醛被还原成苯甲醇。
这是一个歧化反应(dismutation reaction),称之为Cannizzaro反应(康尼查罗)。
例如:苯甲醛在浓氢氧化钠溶液的作用下,得到等分子的的苯甲酸和苯甲醇:2CHO CH Array 2OH COO反应机理如下图所示:CH OH OOHCH 2OH COO COOHCH 2OH OH首先OH ¯和羰基进行亲核加成,由于氧原子带有负电荷,致使邻位碳原子排斥电子的能力大大增强,使碳上的氢带着一对电子以氢负离子的形式转移到另一分子苯甲醛的羰基碳原子上。
其中给出氢负离子的叫做授体,接受氢的叫做受体。
虽然反应过程中苯甲酸与苯甲醇同在溶液中,但是二者只在酸性条件下才发生酯化反应。
而且,高锰酸钾与硫酸锰在碱性条件下可制得二氧化锰,新制的二氧化锰可将不饱和键上的醇氧化得到相应的醛或酮,不饱和键不受影响,此处便可将副产物苯甲醇再氧化为苯甲醛,从而得到苯甲酸, 反应方成如下:2KMnO 44NaOH MnO 43522MnO 2K 2SO 4Na 2SO 4H 2OMnOCH2OH CHOC另一种氧化苯甲醇的方法可使用铬酸氧化。
苯甲醇与苯甲酸的制备实验一、实验原理利用坎尼扎罗(Cannizzaro)反应由苯甲醛制备苯甲醇和苯甲酸。
坎尼扎罗反应是指无α-活泼氢的醛类在浓的强NaOH或KOH水或醇溶液作用下发生的歧化反应。
此反应的特征是醛自身同时发生氧化及还原作用,一分子醛被氧化成羧酸(在碱性溶液中成为羧酸酸盐),另一分子醛则被还原成醇。
主反应:机理:醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
二、反应试剂、产物、副产物的物理常数三、药品四、实验流程图五、实验装置图图 1 磁力搅拌器图 2 分液漏斗的振摇方法图 3 分液漏斗图4 抽滤装置六、实验内容往锥形瓶中加 12.0g(0.21mol)氢氧化钾和12ml水,放在磁力搅拌器上搅拌,使氢氧化钾溶解并冷至室温。
在搅拌的同时分批加入新蒸过的苯甲醛,每次加入2-3ml,共加入13.5ml(约14g,0.13mol)。
加后应塞紧瓶口,若锥形瓶内温度过高,需适时冷却。
继续搅拌60min,最后反应混合物变成白色蜡糊状。
(1)苯甲醇向反应瓶中加入大约45ml水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45ml 乙醚分三次萃取苯甲醇,合并乙醚萃取液。
保存水溶液留用。
依次用15ml25%亚硫酸氢钠溶液及8ml水洗涤乙醚溶液,用无水硫酸镁干燥。
水浴蒸去乙醚后,继续蒸馏,收集产品,沸程204-206℃,产率为75%。
纯苯甲醇有苦杏仁味的无色透明液体。
沸点bp=205.4℃,折光率=1.5463。
(2)苯甲酸在不断搅拌下,往留下的水溶液中加入浓盐酸酸化,加入的酸量以能使刚果红试纸由红变蓝为宜。
充分冷却抽滤,得粗产物。
粗产物用水重结晶后晾干,产率可达80%。
纯苯甲酸为白色片状或针状晶体。
熔点mp=122.4℃。
(一)制备阶段1.准备锥形瓶:一只100ml锥形瓶。
2.加药品与歧化反应:向锥形瓶中加 12.0g氢氧化钾和12ml水,向瓶内放入一只搅拌子,然后将锥形瓶放在磁力搅拌器上搅拌,使氢氧化钾溶解并冷至室温。
23二甲氧基苯甲酸合成工艺
23二甲氧基苯甲酸可以通过苯甲酸和甲醇经过酯化反应合成。
具体的合成工艺如下:
1. 准备原料:苯甲酸和甲醇。
保证原料的纯度和质量。
2. 反应设备准备:准备反应釜、搅拌器、加热装置等反应设备,并确保设备的清洁和无杂质。
3. 反应操作:将苯甲酸和甲醇按一定摩尔比放入反应釜中,加入适量的催化剂(如硫酸)以促进酯化反应的进行。
4. 反应条件控制:将反应釜加热至适当的温度,一般为120-140°C,反应持续一定时间(一般数小时),并进行搅拌以增
加反应速度。
5. 反应结束处理:反应结束后,冷却反应釜,将反应液进行中性化处理去除催化剂等杂质。
6. 产物分离纯化:通过蒸馏、结晶等方法对反应产物进行分离和纯化,得到23二甲氧基苯甲酸。
7. 产品质量检验:对合成得到的23二甲氧基苯甲酸进行质量
检验和分析,确保产品符合要求。
8. 产品包装储存:将产品进行包装并储存,确保产品的质量和
安全。
需要注意的是,在合成过程中要注意安全操作,避免发生事故。
同时,在具体操作中,也可以根据实际需要进行条件的调整和改进。
苯甲醇催化氧化合成苯甲酸醇的催化氧化依据氧化剂的不同可以分为过氧化氢与金属氧化物无溶剂的氧化。
本工作以空气中的。
2为氧化剂、使用Cu( n )或Fe(HI)无机盐催化氧化苯甲醇制备苯甲酸,并初步探讨了该过程的反应机理。
实验部分1. 1试剂•苯甲醇、NaOH 无水CuSQ、Cu(N03) 2• 3H2 0、CuCl2• 2H2 0、FeCl 3 • 6H2O0苯甲酸的制备:称取适量的NaOl和Cu( n )无机盐(或FeCl3• 6巴0)。
研磨成粉末并混合均匀,然后与苯甲醇一起加入到50 mL 圆底烧瓶中,装上球形冷凝管,搅拌下加热回流,反应至所需时间后停止加热,冷却至室温。
将25 mL水加入到圆底烧瓶中,并加入几颗沸石,继续加热回流15 min 使反应完全,冷却后抽滤,所得固体用约5 mL水洗涤,在马弗炉中焙烧后回收红褐色的CuQ将滤液转移到烧杯中,用浓盐酸酸化至pH W 2, 有白色固体析出,静置后抽滤,将白色粉末烘干,得到产品。
用上海精密科学仪器有限公司SGW 一4型显微熔点仪检测产品的熔点为121〜122 oG与文献值心33相同。
用美国Nicolet 公司Magna- IR 550傅里叶变换红外光谱仪(KBr压片)表征产品,确认产品为苯甲酸。
2结果与讨论2. 1 Cu(n)无机盐催化氧化苯甲醇2. 1. 1 Cu(n)无机盐种类和反应时间对苯甲酸收率的影响选用Cu(n)无机盐作为催化剂,是因为离子态Cu的氧化性比单质Cu要强川J。
实验结果证实了上述推论,Cu(ll)无机盐可有效催化氧化苯甲醇,以高收率得到苯甲酸。
考察了Cu (n)无机盐种类和反应时问对苯甲酸收率的影响,实验结果见表1表1Cu(n)无机盐种类和反应时间对苯甲酸收率的影响Catalyst Catalyst):Benzyl alcohol)Reactiontime/minYield TO benzoicacid t %CuCI2 * 2H3O0.08860.79+30 0887588.6(LOSS9092.60.08810594.80.0881209& 2 CuSO40.0606027.50.0609056.90+ 06012098.0 Cu(NO^)i -3HJO0,0877068. 10.085907S.70.08512094.5由表1可看出,3种Cu(1I)无机盐都可有效催化苯甲醇氧化反应,且随反应时间的延长,苯甲酸收率逐渐提高。
苯甲酸制备甲苯氧化法[结构式] [物化性质]又名。
鳞片状或针结晶,具有苯或的气味,易燃。
相对密度1.2659,熔点122.4℃,沸点249℃,在100℃升华,闪点121~123℃。
蒸气易挥发。
微溶于水,溶于、、乙醚、氯仿、苯、甲苯、、和松节油。
[制备办法]苯甲酸的生产办法主要有甲苯氧化法、苯甲醛氧化法、苯甲醇氧化法等。
(1)甲苯氧化法①甲苯液相空气氧化法常用的催化剂为可溶性钴盐或锰盐,以乙酸为溶剂。
其反应机理为自由基反应,反应温度为165℃左右,压力为0.6~0.8MPa,反应为放热反应。
副产物主要有苯甲醛、苯甲醇、邻甲基联苯、联苯、对甲基联苯及酯类。
副产物均可回收和利用,尤其是苯甲醛和苯甲醇,其本身单价常为苯甲酸的4~5倍,可以大幅度提高装置的产值和利润。
②甲苯氯化水解法甲苯于100~150℃举行光氯化反应所得三氯苄基苯,在ZnCl2存在下(或用石灰乳及铁粉)与水反应得苯甲酸。
以三氯苄基苯计,苯甲酸产率为74%~80%。
反应式为:因为该法耗氯,HCI水溶液加热腐蚀极严峻,因此,此法只能是甲苯氯化水解制苯甲醛和苯甲醇的副产物回收利用的补充办法。
③高锰酸钾氧化法 a.以氧化铁为催化剂。
取110mL饱和溶液(含6g KMnO4)加入到250mL的三口瓶中,按n(甲苯):n(高锰酸钾)=1:1加入甲苯4mL,以氧化铁(0.20g)为催化剂,装上回流冷凝管,开动搅拌,分段加热反应4h(75℃加热1.5h、85℃加热1.5h、95℃加热1h)。
反应结束后,撤去回流冷凝管,装上直形冷凝管改成蒸馏装置(继续搅拌),加热蒸出未反应的甲苯(甲苯和水的共沸物)直至冷凝管无油珠止。
反应器中的混合物趁热过滤,滤渣用少量热水洗涤,滤液冷却,同时滴加浓盐酸酸化至pH值为2,苯甲酸所有析出,抽滤、少量冰水洗涤、干燥、称重。
产率可达74.32%。
b.以(TBAB)为相转移催化剂。
甲苯在氧化剂高锰酸钾及相转移催化剂四丁基溴化铵(TBAB)的作用下,生成苯甲酸钾;苯甲酸钾用浓盐酸酸化生成不溶于水的苯甲酸固体。
1.1合成苯甲酸的工作任务1.苯甲酸概述苯甲酸又名安息香酸,是一种重要的精细有机化工产品,世界年产量达数十万吨。
苯甲酸主要用于生产苯甲酸钠食品防腐剂、染料、农药、增塑剂、媒染剂、医药、香料的中间体,还可用作醇酸树脂和聚酰胺树脂的改性剂,用于生产涤纶的原料对苯二甲酸以及用作钢铁设备的防锈剂等。
2.苯甲酸合成任务书苯甲酸产品的《产品开发任务书》见表1-1。
表1-1 产品研发项目任务书编号:XXXXXX表中相关内容的解释:(1)CAS号:(CAS Registry Number或称CAS Number, CAS Rn, CAS #),又称CAS登录号,是某种物质(化合物、高分子材料、生物序列(Biological sequences)、混合物或合金)的唯一的数字识别号码。
美国化学会的下设组织化学文摘服务社(Chemical Abstracts Service, CAS)负责为每一种出现在文献中的物质分配一个CAS号,其目的是为了避免化学物质有多种名称的麻烦,使数据库的检索更为方便。
如今几乎所有的化学数据库都允许用CAS号检索。
苯甲酸的CAS号为65-85-0。
(2)有关执行标准:我国标准分为国家标准、行业标准、地方标准和企业标准四类。
食品防腐剂质量标准参见GB1902-2005。
产品研发任务书是新产品研究开发必要的文件依据,有时也会以产品供货合同来作为产品开发的依据。
1.2苯甲酸合成任务分析1.2.1 苯甲酸分子结构的分析首先要搞清需要合成的物质是什么?对于有机化合物而言,必须搞清楚其分子结构式、分子的基本骨架结构、相关基团组成以及连接的方式等。
①苯甲酸分子式:C6H5C00H。
②苯甲酸分子结构式:不难看出,目标化合物基本结构为苯的结构,在苯环上接有一个羧基。
1.2.2 苯甲酸的合成路线分析一种化合物的制备路线可能有多种,但并非所有的路线都能适用于实验室合成或工业化生产,选择正确的制备路线是极为重要的。
苯甲酸的合成工艺
材料化学09-2 张召举 200901130937
摘要:苯甲酸是一种重要的有机合成体,现在以经广泛应用于医药、食品、
染料化工等领域,可制备染料、和药物、防腐剂、杀菌剂、驱虫剂、增塑剂、改
良剂、香料等,苯甲酸的合成方法有很多种。近年来,以w(H2O2)=30 %的过氧
化氢为氧化剂,苯甲醛为原料合成苯甲酸的研究逐渐引起人们的兴趣。
关键词:苯甲酸 过氧化氢 氧化 甲苯
正文:苯甲酸俗称安息香酸,因最初得自安息香胶。其化学结构是由武勒
(Wöhelr)和利比希(Liebig)于1832 年确定的,是十九世纪首先被大量的用作药物
的有机化合物。如今,苯甲酸更多的是用于保存食品和水果等,同时也是一种重
要的化工原料,可用作食品的抑菌剂,也可作染色和印色的媒染剂,在合成树脂
方面可用作醇酸树脂和聚酰胺树脂的改性剂等。苯甲酸的合成方法很多,醇、醛
的氧化,腈的水解,甲基酮的卤仿反应等。
目前工业上制备苯甲酸的主要方法是甲苯液相氧化。但该方法存在耗能高、
环境污染大等缺点,因此很有必要开发苯甲酸的环境友好合成路线。近年来,以
w(H2O2)=30 %的过氧化氢为氧化剂,苯甲醛为原料合成苯甲酸的研究逐渐引起
人们的兴趣。纪明慧等[1]报道了在没有有机溶剂存在时,以苯甲醛为原料,
w(H2O2)=30 %过氧化氢为氧化剂,H3PW12O40 催化苯甲醛氧化合成苯甲酸的
活性及其影响因素。陈志敏等报道了在浓硫酸的作用下,用w(H2O2)=30 %的过
氧化氢氧化苯甲醛合成苯甲酸,苯甲酸的收率较高。刘春生等和李东胜等分别报
道了在酸性添加物和表面活性剂的作用下,Na2WO4·2H2O 为催化剂,苯甲醛催
化氧化为苯甲酸的收率也比较高。严红燕等以甲烷磺酸铜为催化剂,苯甲醛氧化
合成为苯甲酸的收率为70 %,但反应时间较长。王晓丽等研究了四丁基溴化铵催
化氧化苯甲醛合成苯甲酸的活性。甲苯的高锰酸钾氧化,也是合成苯甲酸的重要
方法之一。由于高锰酸钾是水溶性的,通常很难与油溶性的甲苯发生反应,所以
该反应过程时间很长,同时生成的二氧化锰多,产率低。
1.2过氧化氢氧化法
2000年,SATO等发现过氧化氢可氧化一些脂肪族和芳香族的醛,提出了一种新
的,对环境无害,高效的氧化方法,来源丰富,价格低廉,具有反应条件温和对
环境友好等特点在有机合成上的应用越来越广泛此合成苯甲酸的方法成为研究
的热点。
陈志敏等研究了以过氧化氢为氧化剂在无催化剂以及硫酸铜金属铜浓硫酸
为催化剂的不同条件下对催化氧化苯甲醛制备苯甲酸反应的影响,经实验分析,
浓硫酸的催化效果最好。刘春生等在以过氧化氢为氧化剂为催化剂催化氧化苯甲
醛制备苯甲酸体系中研究不同酸性添加物对苯甲酸收率的影响结果发现在最佳
的实验条件下选择对苯磺酸最为添加物时苯甲酸收率最高李东胜等以30%的
H2O2wei为氧源催化氧化苯甲醛制备苯甲酸并考察了氧化剂用量,反应时间,催
化剂和酸性添加物对苯甲酸收率的影响,以及在非酸性条件下,表面活性剂对苯
甲酸收率的影响,经实验发现非离子表面活性剂能够有效提高苯甲酸的收率,其
中以环糊精的效率最高,收率可达90.03%。李拓等以几类水滑石作为催化剂,双
氧水为氧化剂,催化氧化苯甲醛制备苯甲酸,经实验分析得到最佳优化条件,并
发现钴/Al水滑石作为催化剂,双氧水作为氧化剂,催化氧化苯甲醛制备苯甲酸
的产率最高。
季明慧、李敏和李桂贤等人分别以H3PW12O40自制的十六烷基三甲基磷钨
多酸铵以及四丁基溴化铵和磷钼酸反应合成一系列Keggin型磷钼酸季铵盐为催
化剂,过氧化氢为氧化剂,催化氧化苯甲醛合成苯甲酸,研究表明磷钨杂多酸类
催化剂的催化效果最好。
郑敏燕等研究了以1-丁基-3甲基咪四氟硼酸盐型离子液体作为溶剂和想转
移催化剂,过氧化氢为催化剂氧化苯甲醛制备苯甲酸,可使苯甲酸的产率达到
88%反映中无其他介质,无其他副产物,产物分离,离子液体可重复使用,实现
了反应的清洁、绿色氧化。
苯甲酸是重要的有机合成原料,可制备多种有机物质,应用范围涉及医药、
食品、染料、化工等领域。苯甲酸主要是通过氧化反应制得。利用过氧化氢是一
种优良的氧化剂,来源丰富,价格低廉具有反应条件温和、对环境友好等特点,
在有机合成中的应用越来越广泛。还可以通过二氧化碳羧化法制备,目前还发展
了电化学法,其反应速率有很大的提高,并减少对环境的污染。随着科学技术的
发展,研究的深入,合成技术将向高效、高速、高质量、节能、绿色环保方向发
展。
参考文献:
[1] 李和平,葛红.精细化工工艺学[M].北京科学出版社,.
[2] 郑公铭,何建鑫,等.苯甲酸制备新工艺研究[J].茂名学院学报.
[3] 王晓军,刘吉平.苯甲酸的制备工艺[J].化工进展,2011年第30卷 增刊
[4] 严红燕,程云,刘春生,等.甲烷磺酸铜催化氧化苯甲醛制苯甲酸[J] .抚
顺石油学院学报,.
[5] 王晓丽,姜恒,宫红,等.四丁基溴化铵催化过氧化氢氧化苯甲醛合成苯[J]
甲酸化工科技,.
[6] 罗志刚.基础化学实验技术[M].广州:华南理工大学出版社.