
里德伯常数的测定
氢原子的光谱现在按波长(或波数)大小的排列次序上显示出简单的规律性,测量氢灯各光谱线的波长值可以来了解原子的能级结构。本实验用分光计测量氢原子的光谱线波长,并通过巴尔末公式推算里德伯常数。
原理
氢原子的光谱线在可见光区共有四条,分别用αH (红线)βH (蓝绿线)γ
H (青线)和δH (紫线)记号来标志。他们的波数ν(波长λ的倒数)可以准确地用实验公式
)121(
2
2n R H ?=ν
(1)
表示,式中n 是大于2的整数,即3,4,5,…每一个数代表一条谱线,而H R 是一个实验常数,称为里德伯常数。式(1)就是著名的巴尔末公式。若利用分光计准确的测定上述四条谱线的波长,并分别代入(1)式,即可由实验方法确定里德伯常数。此外,根据玻尔关于原子构造的量子假设,里德伯常数与原子内部若干微观量和有关物理普适常数的关系是:
)
1(83
20
4
H
H M m m
h ce e R +=
(2)
式中e 为电子电荷,m 为电子质量,H M 为氢原子核的质量,
5
.18361
=H M m ,c 为光在真空中的传播速度,0ε为真空介电常数,h 为普朗克常数。由此算出里德伯常数的理论值 m R H /1009678.17×=
实验内容
1﹑以钠灯为光源,利用分光计及光栅测出衍射角,再算得光栅常数。 2﹑用氢气放电管作为光源,分别测出氢原子三条谱线(αH ,βH ,γH )所对
应的衍射角α?、β?、γ?,并由此求得他们的波长αλ,βλ,γλ(人眼对δH 线很不灵敏,故不作测量)
利用式(1)计算里德伯常数的实验值。 例1.利用钠灯测量光栅的光栅常数。
当nm 3.589=λ,测得光栅常数为 3(1.67740.0004)10d d mm σ?±=±×
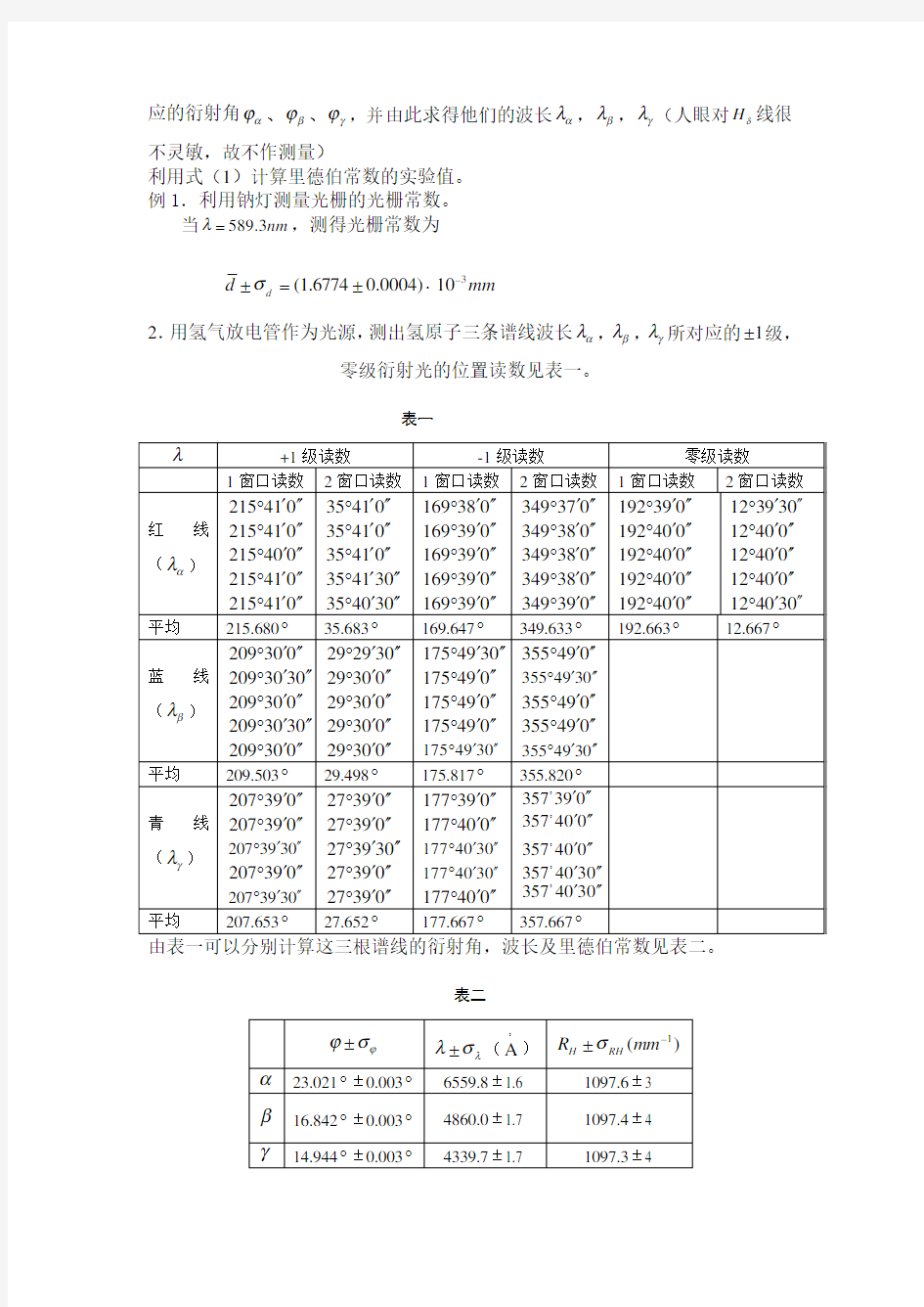
2.用氢气放电管作为光源,测出氢原子三条谱线波长αλ,βλ,γλ所对应的1±级,
零级衍射光的位置读数见表一。
表一
λ
+1级读数 -1级读数 零级读数
1窗口读数 2窗口读数 1窗口读数 2窗口读数 1窗口读数
2窗口读数
红线(αλ)
215410′′′°215410′′′°215400′′′°215410′′′°215410′′′° 35410′′′°35410′′′°35410′′′°354130′′′°354030′′′° 169380′′′°169390′′′°169390′′′°169390′′′°169390′′′° 349370′′′°349380′′′°349380′′′°349380′′′°349390′′′° 192390′′′°192400′′′°192400′′′°192400′′′°192400′′′° 123930′′′°12400′′′
°12400′′′
°12400′′′°124030′′′°
平均 215.680° 35.683° 169.647° 349.633° 192.663° 12.667°
蓝线(βλ)
209300′′′°2093030′′′°209300′′′°2093030′′′°209300′′′° 292930′′′°29300′′′°29300′′′°29300′′′°29300′′′° 1754930′′′°175490′′′°175490′′′°175490′′′°1754930′′′° 355490′′′
°3554930′′′
°355490′′′°355490′′′°3554930′′′°
平均 209.503° 29.498° 175.817° 355.820°
青线(γλ)
207390′′′°207390′′′
°2073930′′′°207390′′′°2073930′′′° 27390′′′°27390′′′°273930′′′°27390′′′
°27390′′′° 177390′′′°177400′′′°1774030′′′°1774030′′′°177400′′′° 093357′
′′
004357′
′′
004357′′′ 0304357′′′ 0304357′′′
平均 207.653° 27.652° 177.667° 357.667°
由表一可以分别计算这三根谱线的衍射角,波长及里德伯常数见表二。
表二
??σ±
λλσ±(A
) 1
()H RH
R mm σ?± α 23.021°±0.003° 6559.8±1.6 1097.6±3 β 16.842°±0.003° 4860.0±1.7 1097.4±4 γ 14.944°±0.003°
4339.7±1.7
1097.3±4
H R 的平均值及标准偏差为
7
?(1.09750.0001)10/H R R m σ±=±×。
思考题
1. 氢原子在可见区、红外区、紫外区的所有谱线可统一用一个简单的公式表示:
2211
(H oi R n n
ν
=? 式中oi n =1﹑2﹑3﹑… ;n=oi n +1﹑oi n +2…。根据什么原则来选定各氢光谱线的n 的可能值?又怎么来判别某个n 值的可能值是正确值?oi n 又怎么求得呢?(提示:可作2
1
n ν
? 图线来判断所选定n 的正确性及求得oi n 。) 2.光谱中若出现不属于氢的谱线,应如何判断?
北京航空航天大学基础物理实验 氢原子光谱和里德伯常数的测量 第一作者XXX 第二作者XXX 指导老师:XXX
一、 实验要求 实验重点 ○ 1 巩固、提高从事光学实验和使用光学仪器的能力(分光仪的调整和使用) ○ 2掌握光栅的基本知识和方法 ○ 3了解氢原子光谱的特点并使用光栅衍射测量巴尔末系的波长和里德伯常数 ○4巩固与扩展实验数据处理的方法——测量结果的加权平均,不确定度和误差的计算,实验结果的讨论等 1、 预习思考题 ○ 1如何由(5.11-1)出发证明:在相邻的两个主极大之间由N-1个极小,N-1个次极大;N 越大,主极大的角宽度越小? 答:光栅衍射可以看作是单缝衍射和多缝干涉干涉的综合。当平面单色光正入射到光栅上时,其衍射光振幅的角分布正比于单缝衍射因子 sin α α 和缝间干涉因子 sin sin N β β 的乘积,及沿着 θ 方向的的衍射光强22 0sin sin ()( )( )sin N I I α βθα β =,式中sin sin ,,a d N θθαβλλ==是光栅的总缝数。当sin 0β=时,sin N β也等于0, sin sin N N β β =,()I θ形成干涉极大;当 sin 0N β=但sin 0β≠时,()0I θ=,为干涉极小。它说明:两个相邻的主极大之间有N-1 个极小,N-2个次极大;N 数越多,主极大的角宽度越小。 ○ 2 氢原子里德伯常数的理论值等于什么?氢原子光谱的巴尔末系中对应的n=3,4,5的3条谱线应当是什么颜色? 答:理论值R H =(10967758.1±0.8)1 m -。谱线分别是红色、蓝色、与紫色。 ○ 3 总结分光仪调整的关键步骤,在调整望远镜接受平行光、望远镜光轴垂直仪器主轴、平行光管射出平行光、平行光管主轴垂直仪器主轴的过程中应分别调整什么?调整完成的标志
普朗克常数测量的实验 一、实验仪器 GD-4型智能光电效应(普朗克常数)实验仪(由光电检测装置和实验仪主机两部分组成) 光电检测装置包括:光电管暗箱GDX-1,高压汞灯箱GDX-2;高压汞灯电源GDX-3和实验基准平台GDX-4。 二、实验目的 1、通过实验深刻理解爱因斯坦的光电效应理论,了解光电效应的基本规律; 2、掌握用光电管进行光电效应研究的方法; 3、学习对光电管伏安特性曲线的处理方法,并用以测定普朗克常数。 三、实验原理 1、普朗克常数的测定 根据爱因斯坦的光电效应方程: P s E hv W =- (1) (其中:P E 是电子的动能,hv 是光子的能量,v 是光的频率,s W 是逸出功, h 是普朗克常量。) s W 是材料本身的属性,所以对于同一种材料s W 是一样的。当光子的能量s hv W <时不能产 生光电子,即存在一个产生光电效应的截止频率0v (0/s v W h =) 实验中:将A 和K 间加上反向电压KA U (A 接负极),它对光电子运动起减速作用.随着反向电压KA U 的增加,到达阳极的光电子的数目相应减少,光电流减小。当KA s U U =时,光电流降为零,此时光电子的初动能全部用于克服反向电场的作用。即 s P eU E = (2) 这时的反向电压叫截止电压。入射光频率不同时,截止电压也不同。将(2)式代入(1)式, 得 0s h U v v e =-() (3) (其中0/s v W h =)式中h e 、都是常量,对同一光电管0v 也是常量,实验中测量不同频率下的s U ,做出s U v -曲线。在(3)式得到满足的条件下,这是一条直线。 若电子电荷e ,由斜率h k e = 可以求出普朗克常数h 。由直线上的截距可以求出溢出功s W ,由直线在v 轴上的截距可以求出截止频率0v 。如图(2)所示。
里德伯常数的测定 氢原子的光谱按波长(或波数)大小的排列次序上显示出简单的规律性,测量氢灯各光谱线的波长值可以来了解原子的能级结构。本实验用分光计测量氢原子的光谱线波长,并通过巴尔末公式推算里德伯常数。 原理 氢原子的光谱线在可见光区共有四条,分别用αH (红线)βH (蓝绿线)γH (青线)和H δ(紫线)记号来标志。他们的波数ν(波长λ的倒数)可以准确地用实验公式 )1 21( 22n R H -=ν (1) 表示,式中n 是大于2的整数,即3,4,5,…每一个数代表一条谱线,而H R 是一个实验常数,称为里德伯常数。式(1)就是著名的巴尔末公式。若利用分光计准确的测定上述四条谱线的波长,并分别代入(1)式,即可由实验方法确定里德伯常数。此外,根据玻尔关于原子构造的量子假设,里德伯常数与原子内部若干微观量和有关物理普适常数的关系是 ) 1(83 204 H H M m m h c e R += ε (2) 式中e 为电子电荷,m 为电子质量,H M 为氢原子核的质量, 5 .18361 =H M m ,c 为光在真空中的传播速度,0ε为真空介电常数,h 为普朗克常数。由此算出里德伯常数的理论值 m R H /1009678.17?= 光栅衍射 有大量等宽间隔的平行狭缝构成的光学元件成为光栅.设光栅的总缝数为N ,缝宽为a ,缝间不透光部分为b ,则缝距d = a + b ,称为光栅常数.按夫琅和费光栅衍射理论,当一束平行光垂直入射到光栅平面上时,通过不同的缝,光要发生干涉,但同时,每条缝又都要
发生衍射,且N 条缝的N 套衍射条纹通过透镜后将完全重合.如图1所示,当衍射角 满足光栅方程d sin k (k 0、1、 、…)时,任何两缝所发出的两 束光都干涉相长,形成细而亮的主极大明条纹. θd O d P G i ? d 图1 光栅衍射光路图 图2 斜入射时光栅的衍射 若入射光束不是垂直入射至光栅平面(图2),则光栅的衍射光谱的分布规律将有所变化.理论指出:当入射角为i 时,光栅方程变为 d (sin θ sin i )k (k 0、1、2、…), (2) 式(2)中,+ 号表示衍射光与入射光在法线同侧,- 号则表示衍射光与入射光位于法线异侧.若只考虑一级衍射,则 2 ) sin (sin 11-++= θθλd 实验内容 1﹑用氢气放电管作为光源,分别测出氢原子三条谱线(αH ,βH ,γH )所对应的衍射角 α?、β?、γ?,利用光栅衍射方程计算波长,求得相应的波长αλ,βλ,γλ(人眼对H δ线 很不灵敏,故不作测量)。其中所使用光栅的光栅常数由实验室提供。 2﹑每组数据重复测量6次,利用式(1)计算里德伯常数的实验值。 3﹑写出里德伯常数的实验结果。 表一
实验四 碱性磷酸酶米氏常数的测定 一.实验目的 1.通过碱性磷酸酶米氏常数的测定,了解其测定方法及意义。 2.学会运用标准曲线测定酶的活性,加深对酶促反应动力学的理解。 二.实验原理 当温度、pH 及酶浓度恒定的条件下,酶促反应的初速度随作用物浓度[S]增大而增大,但增大到一定限度时,作用物浓度再增加,则反应速度不再增加。此时反应速度为最大速度(V max )。如图5-1所示。 Michaelis Menten 对酶促反应速度与作用物浓度之间的这种关系进行了大量实验研究,并于1913年提出了数学方程式,即著名的米一曼(Michaelis-Menten )方程式: 式中Km 即为米氏常数,Vmax 为最大反应速度,当v =Vmax/2时,则Km=[S]。Km 是酶的特征常数,测定Km 是研究酶的一种方法。由于用Michaeis-Menten 方程中的V 与[S]作图求Km ,不方便,Lineweaver-Burk 将上式变形,以1/v 对1/[S]作图,如图5-2: Vm 1/2Vm Km [S] 图5-1
图5-2 作图后,将各点连线延长,直线与横轴的交点为,根据在横轴上的截距,可以计算出该酶的Km。 本实验以碱性磷酸酶为例,用磷酸苯二钠为其作用物,碱性磷酸酶能分解磷酸苯二钠产生酚和磷酸,酚在碱性溶液中与4氨基安替比林作用,经铁氰化钾氧化生成红色的醌衍生物,根据红色深浅可测出酶活力高低。其反应式如下: 利用在不同作用物浓度的条件下,测定的酶活性(A),按Lieweaver-Burk二氏法作图,从 x 轴上的截距求得其Km值。 三.预习题 试说明米氏常数Km的物理意义和生物学意义。 四.实验器材与试剂
氢原子光谱和里德伯常量测定 —-以及实验数据处理方法的选择
摘要: (3) Abstract:Key words: (3) 1.实验背景 (3) 2. 实验要求 (3) 2.1实验重点 (3) 2.2实验要点 (3) 3.实验原理 (4) 3.1光栅及其衍射 (4) 3.2光栅的色散本领与色散分辨本领 (5) 3.3氢原子光谱 (6) 4.测量结果的加权平均 (7) 5.实验仪器介绍 (8) 6.实验内容 (8) 7.实验数据记录及处理 (8) 1.光栅常数测量 (9) 2.氢原子光谱测里德波尔常数 (10) 3.色散率和色分辨本领 (12) 8.不同的数据处理方法 (13) 8. 1 波数为因变量的一般直线拟合 (13) 8.2波长为因变量的直线拟合 (14) 8.3加权平均法求RH (14) 8. 4 波数为因变量的过原点直线的加权拟合 (14)
9.实验感想与总结 (14) 10.参考文献 (15) 摘要: 关键字: Abstract: Key words: 1.实验背景 衍射光栅在现代光谱分析中具有重要应用。无论发射光谱仪器,还是吸收光谱仪器中的色散元件,大多使用性能优良的光栅。光栅的刻槽密度可达4800条/mm。进入纳米科学范围,属于光、机、电结合的高科技领域。衍射光栅作为各种光谱仪器的核心元件,广泛应用于石油化工、医药卫生、食品、生物、环保等国民经济和科学研究的诸多部门。光谱分析就是利用物质发射的光谱对其元素组成做出分析和判断,它在诸如地质找矿、冶金成分的分析、材料的超纯检测或微量元素识别等国民经济和教学科研各部门被广泛才用。在高科技领域,如各种激光器特别是强激光核聚变、航空航天遥感成像光谱仪、同步辐射光束线等,都需要各种特殊光栅。现代高科技的发展,使光栅有了更广泛的重要应用,许多高科技项目应用的特种光栅还有待于进一步开发。 发射光谱有三种类型:线状光谱、带状光谱和连续光谱。氢原子光谱是一种典型的线状光谱,它是量子力学理论得以建立的最重要的是要基础之一。把作为分光元件的光栅和精密测角仪器的分光仪结合起来进行氢原子光谱的测量和观察,不仅可以巩固和强化光学实验的基础训练,还可以了解现代光谱仪器的基本知识,增加有关量子物理的一些感性知识和基本概念。 2.实验要求 2.1实验重点 ①巩固、提高从事光学实验和使用光学仪器的能力(分光仪的调整和使用); ②掌握光栅的基本知识和使用方法; ③了解氢原子光谱的特点并用光栅测量巴耳末系的波长和里德伯常数; ④巩固与扩展实验数据处理的方法,即测量结果的加权平均,不确定度和误差的计算,试验结果的讨论等。 2.2实验要点
实验题目:光电效应测普朗克常量 实验目的: 了解光电效应的基本规律。并用光电效应方法测量普朗克常量和测定光电管的光电特性曲线。 实验原理: 当光照在物体上时,光的能量仅部分地以热的形式被物体吸收,而另一部分 则转换为物体中某些电子的能量,使电子逸出物体表面,这种现象称为光电 效应,逸出的电子称为光电子。 光电效应实验原理如图1所示。 1. 光电流与入射光强度的关系 光电流随加速电位差U 的增加而增加,加速电位差增加到一定量值后, 光电流达到饱和值和值I H ,饱和电流与光强成正比,而与入射光的频率无关。 当U= U A -U K 变成负值时,光电流迅速减小。实验指出,有一个遏止电位差U a 存在,当电位差达到这个值时,光电流为零。 2. 光电子的初动能与入射频率之间的关系 光电子从阴极逸出时,具有初动能,在减速电压下,光电子逆着电场力方向由K 极向A 极运动。当U=U a 时,光电子不再能达到A 极,光电流为零。所以电子的初动能等于它克服电场力作用的功。即 a eU mv 2 2 1 (1) 每一光子的能量为hv ,光电子吸收了光子的能量hν之后,一部分消耗于克服电子的逸出功A,另一部分转换为电子动能。由能量守恒定律可知:A mv hv 2 2 1 (2) 由此可见,光电子的初动能与入射光频率ν呈线性关系,而与入射光的强度无关。 3. 光电效应有光电存在 实验指出,当光的频率0v v 时,不论用多强的光照射到物质都不会产生光电效应,根据式(2), h A v 0,ν0称为红限。 由式(1)和(2)可得:A U e hv 0,当用不同频率(ν1,ν2,ν3,…,νn )的单色光分 别做光源时,就有:A U e hv 11,A U e hv 22,…………,A U e hv n n ,
实验2 氢原子光谱的观察与测定 每一种原子都有其特定的线状光谱线。氢原子的光谱线最为简单,且具有明显的规律。测定氢原子可见光谱线的波长对认识原子的分离能级、以及由于能级间的跃迁而产生的光辐射的规律起着重要作用。本实验用读谱仪测量氢原子可见谱线的波长,并通过巴耳末公式推算出氢原子的里德伯常数。 【实验目的】 (1)观察氢原子的可见光谱。 (2)了解读谱仪的结构,掌握读谱仪的调节与使用方法。 (3)通过测量氢原子可见光谱线的波长,验证巴耳末公式的正确性。 (4)准确测定氢原子的里德伯常数。 (5)理解曲线拟合法的意义。 【仪器用具】 WPL —2型读谱仪,氢谱光源,氦氖谱光源,会聚透镜。 【仪器介绍】 整个实验的装置简图如图1所示。 读谱仪是由棱镜摄谱仪改进设计而成。它是利用棱镜分光在物镜上观察光谱的光学仪器。其结构大致可以分为三部分:平行光管系统、色散系统、接收系统。 (1)平行光管系统 平行光管系统包括入射狭缝和入射物镜。入射物镜的作用是使入射狭缝发出的光线变成平行光,所以入射狭缝应放在入射物镜的焦平面上。 (2)色散系统 色散系统实际上就是一个恒偏向棱镜,如图2所示。 它的作用是将光束分解,使不同波长的单色光束沿不同 的方向射出。符合最小偏向角条件的单色光,其入射光束和出射光束的夹角为900。 (3)接收系统 接收系统由出射物镜及放在该物镜焦平面上的目镜组成。不同方向的单色光束经出射物镜聚焦,在其焦平面上得到连续或不连续的依照波长次序排列的入射狭缝的单色像,即光谱。调节光谱的位置时,可以使用水平方向左右移动的手轮、丝杠、滑块、导轨和支架,还包括读出目镜位置用的标尺和100分度的手轮刻度。 手轮转一圈平移mm 1,每分度mm 01.0,要求估读到 1.0分度。目境内的叉丝用来对准被测谱线的中心。 【实验原理】 图 1 图2
1 利用光电效应测普朗克常数 注意事项 1.灯和机箱均要进行预热20分钟。 2.汞灯不宜频繁开关。 3.不要直接观看汞灯。 4.行测量时,各表头数值请在完全稳定后记录,如此可减小人为读数误差。 实验目的 1.了解光电效应的规律,加深对光的量子性的理解。2.测量普朗克常数。 实验原理 光电效应是指一定频率的光照射在金属表面上时,会有电子从金属表面溢出的现象。光电效应实验原理如右图所 示。图中A、K组成抽成真空的光电管,A为阳极,K为阴极。当一定频率ν的光射到金属材料做的阴极K上,就有光 电子逸出金属。若在A、K两端加上电压U AK后,光电子将由K定向地运动到A,在回路中就形成光电流I。改变外加电 压U AK,测量出光电流I的大小,即可得出光电管的伏安特性曲线。 光电流随着加速电位差U AK的增加而增加,加速电位差加到一定量值后,光电流达到饱和值I h,饱和电流与光强 成正比,而与入射光的频率无关。当U AK =U A -U K变成负值时,光电流迅速减小。实验指出,有一个截止电压U0存在, 当电压达到这个值时,光电流为零,截止电压U0同入射光的频率成正比,如右图所示。 由爱因斯坦光电效应方程:hν=mV2/2+A和eU0= mV2/2,可以得到hν=eU0+A,只要用实验的方法得到不同的频率对 应的截止电压,求出斜率,就可以算出普朗克常数 实验步骤 (一)测试前准备 1、将测试仪及汞灯电源接通,预热20分钟。把汞灯及光电管遮光盖盖上,将汞灯光输出口对准光电管光输入口,调整光电管与汞灯距离为30cm(实验中不能移动该位置)。 2、测试前调零:在未连接光电流输入与光电流输出的情况下,将“电流量程”选择开关打在10-13档,旋转“电流调零”旋钮,使电流指示为000。(注意:调零后“电流调零”旋钮不能再改变,只改变“电压调节”旋钮). ’.
物理学常量表 真空中的光速 181099792458.2-??=s m c 电子由荷 C e 19106021892.1-?= 普朗克常数 s J h ??=-3410)40(6260755.6 s J h ??==-3410)63(05457266.12/π 玻耳兹曼常数 12310)12(380658.1--??=K J k 斯忒藩-玻耳兹曼常数 4128234210)19(67051.560----????==K s m J c k πσ 阿伏伽德罗常数 ()123010)36(0221367.6-?=mol N 标准条件下的摩尔体积 ()130224136.0-?=mol m V m ol 真空介电常数 1120108542.8--??=m F ε 真空磁导率 2727010566370614.12104----??=??=A N A N πμ 电子静质量 231)15(51099906.010)54(1093897.9--?=?=c MeV kg m e 质子静质量 227)28(27231.93810)10(6726231.1--?=?=c MeV kg m p 中子静质量 22755.9391067482.1--?=?=c MeV kg m n 原子质量单位 22748.931106605655.1--?=?=c MeV kg u 玻尔半径 m e m h a e 102010)24(529177249.04-?==πε 里德伯常数 1701009737312.1-?=m R 171009677576.1-?=m R H 精细结构常数 036.1371402==c e a πε 电子的康普顿波长 m c m h e c 12 104263.2-?==λ
碱性磷酸酶米氏常数测定 P60 【实验原理】 在环境的温度、pH和酶的浓度一定时,酶促反应速度与底物浓度之间的关系表现在反应开始时,酶促反应的速度(V)随底物浓度(S)的增加而迅速增加。若继续增加底物浓度,反应速度的增加率将减少。当底物浓度增加到某种程度时,反应速度会达到一个极限值,即最大反应速度(V max),如图所示。 底物浓度与酶促反应速度的这种关系可用Michaelis-Menten方程式表示。 V = V max[S]/(K m+[S]) 上式中V max为最大反应速度,[S]为底物浓度,K m为米氏常数(Michaelis constant),而其中V则表示反应的起始速度。当V= V max/2时,K m=[S]。所以米氏常数是反应速度等于最大反应速度一半时底物的浓度。因此K m的单位以摩尔浓度(mol/L)表示。 K m是酶的最重要的特征性常数,测定K m值是研究酶动力学的一种重要方法,大多数酶的K m值在0.01-100(mmol/L)间。 酶促反应的最大速度V max实际上不易准确测定,K m值也就不易准确测出。林-贝(1ineweaver - Burk)根据Michaelis-Menten方程,推导出如下方程式,即:1/V = (K m +[S])/ V max[S]或1/V = K m/ V max·(1/[S])+1/ V max 此式为直线方程,以不同的底物浓度1/[S]为横坐标,以1/V为纵坐标,并将各点连成一直线,向纵轴方向延长,此线与横轴相交的负截距为-1/ K m,由此可以正确求得该酶的K m值,如图所示。
本实验以碱性磷酸酶为例,测定不同底物浓度的酶活性,再根据Lineweaver-Burk法作图,计算其K m值。 可以作为碱性磷酸酶底物的物质很多,底物反应的酶对于不同的底物有不同的K m值。本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。故可以从标准曲线上查知酚的含量,从而计算化学反应速度。反应式如下: 【实验方法】 一.底物浓度对酶促反应速度的影响 (1) 取6支试管,作好标记,按下表操作。 管号123456 0.04mol/L 基质液/mL0.10 0.20 0.30 0.40 0.80 0.0 0.1mol/L碳酸盐缓冲液/mL0.70 0.70 0.70 0.70 0.70 0.70 蒸馏水/mL 1.10 1.00 0.90 0.80 0.40 1.20 37℃水浴5min 血清/mL0.10 0.10 0.10 0.10 0.10 0.10 最终基质浓度/mmol?L-1 2.00 4.00 6.00 8.00 16.00 0.00 (2) 加入血清后,各管混匀并且立即记录时间,将上述各管置37℃水浴中准确保温15 分钟。 (3) 保温结束,立即加碱性溶液1.1mL终止反应。 (4) 各管分别加入0.3%4-氨基安替比林1.0mL,0.5%铁氰化钾2.0mL,充分混匀,放置10分钟,以6号空白管作对照,于510nm波长处比色测定,根据酚标准曲线计算酚含量。 (5) 以各管基质浓度的倒数1/[S]为横坐标,以各管反应速度的倒数1/V(μmol.L-1.min-1为单位)作纵坐标,作图求出K m值。 二.酚标准曲线的绘制 (1) 取洁净干燥试管6支,按下表依次加入试剂。
过氧化氢酶米氏常数的测定 傅璐121140012 一、实验目的 1. 了解米氏常数的测定方法 2. 学习提取生物组织中的酶 二、实验原理 1.米氏反应动力学 (Michaelis-Menten Equation): 米氏方程 2.米氏常数的意义: ①反映酶的种类:Km是一种酶的特征常数,只与酶的种类有关,与酶浓度、 底物浓度无关。 ②米氏常数是酶促反应达到最大反应速度Vmax一半时的底物浓度。其数值大 小反映了酶与底物之间的亲和力:Km值越大,亲和力越弱,反之Km值越小,亲和能力越强。 ③Km可用来判断酶(多功能酶)的最适底物:Km值最小的酶促反应对应底物 就是该酶的最适底物。 3.米氏常数的求法: 该方法的缺点是难以确定最大 反应速度Vmax。
该作图法应用最广。但在低浓度是v值误差较大,在[S]等差值实验时作图点较集中于纵轴。因此在设计底物浓度时,最好将1/[S]配成等差数列,这样可使点距较为平均,再配以最小二乘回归法,就可以得到较为准确的结果。 此法优点是横轴上点分布均匀,缺点是1/v会放大误差,同时对底物浓度的选择有要求。[S]<
综合、设计性实验报告 年级 ***** 学号********** 姓名 **** 时间********** 成绩 _________
一、实验题目 光电效应测普朗克常数 二、实验目的 1、通过实验深刻理解爱因斯坦的光电效应理论,了解光电效应的基本规律; 2、掌握用光电管进行光电效应研究的方法; 3、学习对光电管伏安特性曲线的处理方法,并用以测定普朗克常数。 三、仪器用具 ZKY—GD—3光电效应测试仪、汞灯及电源、滤色片(五个)、光阑(两个)、光电管、测试仪 四、实验原理 1、光电效应与爱因斯坦方程 用合适频率的光照射在某些金属表面上时,会有电子从金属表面逸出,这种现象叫做光电效应,从金属表面逸出的电子叫光电子。为了解释光电效应现象,爱因斯坦提出了“光量子”的概念,认为对于频率为的光波,每个光子的能量为 式中,为普朗克常数,它的公认值是 = 。 按照爱因斯坦的理论,光电效应的实质是当光子和电子相碰撞时,光子把全部能量传递给电子,电子所获得的能量,一部分用来克服金属表面对它的约束,其余的能量则成为该光电子逸出金属表面后的动能。爱因斯坦提出了著名的光电方程: (1)式中,为入射光的频率,为电子的质量,为光电子逸出金属表面的初速度,为被光线照射的金属材料的逸出功,为从金属逸出的光电子的最大初动能。 由(1)式可见,入射到金属表面的光频率越高,逸出的电子动能必然也越大,所以即使阴极不加电压也会有光电子落入阳极而形成光电流,甚至阳极电位比阴极电位低时也会有光电子落到阳极,直至阳极电位低于某一数值时,所有光电子都不能到达阳极,光电流才为零。这个相对于阴极为负值的阳极电位被称为光电效应的截止电压。 显然,有 (2)代入(1)式,即有 (3)由上式可知,若光电子能量,则不能产生光电子。产生光电效应的最低频率是,通常称为光电效应的截止频率。不同材料有不同的逸出功,因而也不同。由于光的强弱决定于光量子的数量,所以光电流与入射光的强度成正比。又因为一
碱性磷酸酶米氏常数的测定 [目的与要求] 通过碱性磷酸酶米氏常数的测定,了解其测定方法及意义。学会运用标准曲线测定酶的活性,加深对酶促反应动力学的理解。 [原理] 在环境的温度、pH和酶的浓度一定时。酶促反应速度与底物浓度之间的关系表现在反应开始时。酶促反应的速度(V)随底物浓度(S)的增加而迅速增加。若继续增加底物浓度,反应速度的增加率将减少。当底物浓度增加到某种程度时,反应速度会达到一个极限值,即最大反应速度(V max),如图37所示。 底物浓度与酶促反应速度的这种关系可用Michaelis-Menten方程式表示。 V = V max[S]/(K m+[S]) 上式中V max为最大反应速度,[S]为底物浓度,K m为米氏常数(Michaelis constant),而其中V则表示反应的起始速度。当V= V max/2时,K m =[S]。所以米氏常数是反应速度等于最大反应速度一半时底物的浓度。因此K m的单位以摩尔浓度(mol/L)表示。 K m是酶的最重要的特征性常数,测定K m值是研究酶动力学的一种重要方法,大多数酶的K m值在0.01-100(mmol/L)间。 酶促反应的最大速度V max实际上不易准确测定,K m值也就不易准确测出。林-贝(1ineweaver - Burk)根据Michaelis-Menten方程,推导出如下方程式,即: 1/V = (K m +[S])/ V max[S]或1/V = K m/ V max·(1/[S])+1/ V max 此式为直线方程,以不同的底物浓度1/[S]为横坐标,以1/V为纵坐标,并将各点连成 一直线,向纵轴方向延长,此线与横轴相交的负截距为-1/ K m,由此可以正确求得该酶的K m 值,如图38所示。 图37 底物浓度对反应速度的影响图38 Lineweaver-Burk作图法 本实验以碱性磷酸酶为例,测定不同底物浓度的酶活性,再根据Lineweaver-Burk法作图,计算其K m值。 可以作为碱性磷酸酶底物的物质很多,底物反应的酶对于不同的底物有不同的K m值。本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。根据吸光度的大小可以计算出酶的活性,也可以从标准曲线上查知酚的含量,进而算出酶活性的大小。反应式如下:
竭诚为您提供优质文档/双击可除光电效应测量普朗克常量实验报告 篇一:光电效应测普朗克常量实验报告 三、实验原理1.光电效应 当一定频率的光照射到某些金属表面上时,可以使电子从金属表面逸出,这种现象称为光电效应。所产生的电子,称为光电子。光电效应是光的经典电磁理论所不能解释的。当金属中的电子吸收一个频率为v的光子时,便获得这光子的全部能量hv,如果这能量大于电子摆脱金属表面的约束所需要的脱出功w,电子就会从金属中逸出。按照能量守恒原理有: (1) 上式称为爱因斯坦方程,其中m和?m是光电子的质量和最大速度,是光电子逸出表面 后所具有的最大动能。它说明光子能量hv小于w时,电子不能逸出金属表面,因而没有光电效应产生;产生光电效应的入射光最低频率v0=w/h,称为光电效应的极限频率(又称红限)。不同的金属材料有不同的脱出功,因而υ0也
是不同的。由(1)式可见,入射到金属表面的光频率越高,逸出的电子动能必然也越大,所以即使阴极不加电压也会有光电子落入阳极而形成光电流,甚至阳极电位比阴极电位低时也会有光电子落到阳极,直至阳极电位低于某一数值时,所有光电子都不能到达阳极,光电流才为零。这个相对于阴极为负值的阳极电位 被称为光电效应的截止电压。 显然,有 代入(1)式,即有 (3) 由上式可知,若光电子能量 ,则不能产生光电子。产生光电效应的最低频率是 (2) ,通常称为光电效应的截止频率。不同材料有不同的逸出功,因而也不同。由于光的强弱决定于光量子的数量,所以光电流与入射光的强度成正比。又因为一个电子只能吸收一个光子的能量,所以光电子获得的能量与光强无关,只与光子ν的频率成正比,,将(3)式改写为 (4) 上式表明,截止电压 是入射光频率ν的线性函数,如图2,当入射光的频率 时,
底物浓度对酶促反应速度的影响 ——米氏常数的测定 一.目的要求 1.1了解底物浓度对酶促反应的影响。 1.2掌握测定米氏常数K m 的原理和方法。 二.实验原理 酶促反应速度与底物浓度的关系可用米氏方程来表示: 式中: v ——反应初速度(微摩尔浓度变化/min ); V ——最大反应速度(微摩尔浓度变化/min ); [s]——底物浓度(mol/L ); K m ——米氏常数(mol/L )。 这个方程表明当已知K m 及V 时,酶促反应速度与底物浓度之间的定量关系。K m 值等于酶促反应速度达到最大反应速度一半时所对应的底物浓度,是酶的特征常数之一。不同的酶,K m 值不同,同一种酶与不同底物反应K m 值也不同,K m 值可以近似地反应酶与底物的亲和力大小:K m 值越大,表明亲和力小;K m 值小,表明亲和力大。则测K m 值是酶学研究的一个重要方法。大多数纯酶的K m 值在0.01~100mmol/L 。 Linewaeaver-Burk 作图法(双倒数作图法)是用实验方法测K m 值的最常用的简便方法: 实验时可选择不同的[s],测定对应的v ,以 对 作图,得到一个斜率为V K m 的直线,其截距 ][1s 则为m K 1,由此可求出K m 的值(截距的负倒数)。 本实验以胰蛋白酶消化酪蛋白为例,采用Linewaeaver-Burk 双倒数作图法测定双倒数作图法。胰蛋白酶催化蛋白质中碱性氨基酸(L-精氨酸和L-赖氨酸)的羧基所形成的肽键水解。水解时有自由氨基生成,可用甲醛滴定法判断自由氨基增加的数量而跟踪反应,求得初速度。 ] [][s K s V v m += V s V K v m 1 ][1.1+ =v 1][1s
专题实验1 光谱的测量与分析 1.1 氢(氘)原子光谱 原子光谱是建立量子理论的实验基础。1885年,巴尔末(J. J. Balmer )根据已有的观测结果,提出氢光谱线的经验公式。波尔(N. Bohr )1913年2月看到这一公式,3月6日就建立了氢原子理论;海森堡(W. Heisenberg )在1925年提出量子力学理论也是基于原子光谱的实验成就;光谱的精细结构使人们认识到核外电子的运动状态除了存在主能级量子化以外,还有亚能级量子化。 1932年,尤里(H. C. Urey )将3 liter 液态氢在低压下缓慢蒸发至1 ml 后,注入放电管,拍摄其巴尔末线系光谱,发现在普通氢(氕)每条谱线的短波侧都出现一条弱的伴线,从而证实了氘的存在。这是原子核质量差异导致里德伯常数发生变化的结果,称为同位素移位。对于重核,同位素移位并不明显,但是中子数不同会引起核自旋发生改变,光谱结构还是会复杂化,这就是所谓的超精细结构。今天,原子光谱仍然是研究原子结构的重要方法。 一、实验目的 (1)了解光栅光谱仪等常见光谱分析仪器的原理和使用方法; (2)通过测量巴尔末线系的谱线波长,计算氘的里德伯常数。 二、实验原理 原子虽然是元素的最小单元,但还具有复杂的核式内部结构,核外是绕核运动的电子。α粒子散射实验肯定了原子的核式结构,而对核外结构的认识则是从光谱研究开始的。光谱记录了电磁辐射随波长变化的强度分布,是研究原子结构的重要手段。通过测量原子发光光谱中各谱线的波长,可以推算出原子的能级结构,从而得到有关原子微观结构的信息。光谱主要指发射光谱或吸收光谱。发射光谱是由发光体直接产生的光谱,例如,由炽热的固体、液体和高压气体发光形成的连续光谱和由稀薄气体或者金属蒸汽发光形成的明线光谱都属于发射光谱。吸收光谱则是连续光谱中某些波长的光被物质吸收后产生的光谱。吸收光谱中的每条暗线都与物质的特征谱线相对应。 在所有的元素中,氢的原子结构最简单,从氢原子明线光谱理解原子的核外结构也最直观。氢原子光谱对原子物理学的早期发展做出了特殊的贡献。 到1885年,从星体的光谱中共观察到14条氢原子的谱线,瑞士数学教师巴尔末发现这些谱线的波长λ可以纳入一个统一的公式 4 22 -=n n B λ(n = 3,4,5,…), (1.1.1) B 为常数。这14条谱线称为巴尔末线系。为了更清楚地表明谱线分布规律,瑞典物理学家里德伯将巴尔末公式改写成如下形式 ??????-==2211 1 ~n m R H λγ (n = m +1,m +2,m +3,…) (1.1.2)
过氧化氢酶米氏常数的测定一、实验目的 了解并掌握米氏常数的意义和测定方法 二、实验原理 H 2O 2 被过氧化氢酶分解出H 2 O和O 2 ,未分解的H 2 O 2 用KMnO 4 在酸性环境中滴 定,根据反应前后H 2O 2 的浓度差可求出反应速度。 2H 2O 2 = 2H 2 O + O 2 2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 5O 2 ↑ + 8H 2 O 本实验由马铃薯提供过氧化氢酶。在保持恒定的条件下,用相同浓度的过 氧化氢酶催化不同浓度的H 2O 2 分解。在一定限度内,酶促反应速度与H 2 O 2 浓度 成正比。用双倒数作图法(即以1/v对1/[S]作图)可求得过氧化氢酶的Km值。三、实验器材 锥形瓶(6个) 吸管、酸式滴定管 四、实验试剂 1、0.02mol/L 磷酸缓冲液(pH=7) 2、0.004 mol/L KMnO 4 (需标定) 3、0.05 mol/L H 2O 2 (需标定) 4、25% H 2 SO 4 五、实验操作 1、酶液的提取:称取马铃薯(去皮)5克,加0.02mol/L 磷酸缓冲液10mL,再加少量海砂,研磨成匀浆,离心(3000r/ min,10min),上清液即为酶液。 2、滴定:取干燥锥形瓶6只,按下表顺序加入试剂:
先加好0.05mol/L H 2O 2 及蒸馏水,加酶液后立即混合,依次记录各瓶的起 始反应时间。各瓶时间达5min时立即加2.0mL 25% H 2SO 4 终止反应,充分混 匀。用0.004 mol/L KMnO 4滴定各瓶中剩余的H 2 O 2 至微红色,记录消耗的KMnO 4 体积。 六、实验计算 分别求出1─5瓶的底物浓度[S]和相应的反应速度v。 C 1V 1 10 [S] = 5 ∕2C2V2 C 1V 1 – v = 式中 [S]:为底物物质的量浓度(mol/L) C 1:为H 2 O 2 物质的的量浓度(mol/L)
基础物理实验研究性报告 氢原子光谱实验中里德伯常数计算方法的探讨On different methods of estimating the Rydberg constant in the Hydrogen atoms spectrum experiment 第一作者:彭志伟 学号:10041189 所在院系:能源与动力工程学院 第二作者:贾林江 学号:10041152 所在院系:能源与动力工程学院
目录 氢原子光谱实验中里德伯常数计算方法的探讨 (1) 摘要 (3) 关键词 (3) Abstract (3) Key Words (4) 一、引言 (1) 二、氢原子光谱实验综述 (2) 三、实验原理 (2) 3.1 氢原子光谱 (2) 3.2 光栅及其衍射分光原理 (3) 四、里德伯常数数据处理方法 (3) 4.1 可能的一些数据处理方法 (3) 4.1.1 算数平均与加权平均 (3) 4.1.2 一元线性回归法 (5) 4.1.3 线性回归与最小二乘加权平均的比较 (8) 4.2 结论 (10) 五、结语 (11) 六、参考文献 (12) 七、附录——原始实验数据 (13) 7.1 钠黄光校准光栅常数 (13) ±级谱线校准光栅常数 (13) 7.1.1 1 ±级谱线计算色分辨率 (13) 7.1.2 2 7.2 氢光源测定里德伯常数 (13) 7.2.1 红光原始数据 (13) 7.2.2 蓝光原始数据 (13) 7.2.3 紫光原始数据 (14)
摘要 本文讨论了氢原子光谱实验中里德伯常数的几种不同的数据处理方法。理论上定量分析了不同算法的不确定度及置信水平,得出了应用不同波长求出里德伯常数后再采用加权最小二乘平均得到里德伯常数的最小方差无偏估计的算法较为合理的结论,并以原始实验数据进行了验证。 关键词:里德伯常数;数据处理;最小二乘法;加权平均Abstract This paper discusses several data processing methods in the Hydrogen atoms spectrum experiment. By applying basic theory of mathematical statistics, the uncertainties and confidence levels of different methods are analyzed and compared. In conclus ion, it’s better to utilize Weighted Least Squares method (WLS) to get the minimum-variance unbiased estimate of the Rydberg constant after calculating the Rydberg constant of different wavelengths.
里德伯常数的测定 氢原子的光谱现在按波长(或波数)大小的排列次序上显示出简单的规律性,测量氢灯各光谱线的波长值可以来了解原子的能级结构。本实验用分光计测量氢原子的光谱线波长,并通过巴尔末公式推算里德伯常数。 原理 氢原子的光谱线在可见光区共有四条,分别用αH (红线)βH (蓝绿线)γ H (青线)和δH (紫线)记号来标志。他们的波数ν(波长λ的倒数)可以准确地用实验公式 )121( 2 2n R H ?=ν (1) 表示,式中n 是大于2的整数,即3,4,5,…每一个数代表一条谱线,而H R 是一个实验常数,称为里德伯常数。式(1)就是著名的巴尔末公式。若利用分光计准确的测定上述四条谱线的波长,并分别代入(1)式,即可由实验方法确定里德伯常数。此外,根据玻尔关于原子构造的量子假设,里德伯常数与原子内部若干微观量和有关物理普适常数的关系是: ) 1(83 20 4 H H M m m h ce e R += (2) 式中e 为电子电荷,m 为电子质量,H M 为氢原子核的质量, 5 .18361 =H M m ,c 为光在真空中的传播速度,0ε为真空介电常数,h 为普朗克常数。由此算出里德伯常数的理论值 m R H /1009678.17×= 实验内容 1﹑以钠灯为光源,利用分光计及光栅测出衍射角,再算得光栅常数。 2﹑用氢气放电管作为光源,分别测出氢原子三条谱线(αH ,βH ,γH )所对
应的衍射角α?、β?、γ?,并由此求得他们的波长αλ,βλ,γλ(人眼对δH 线很不灵敏,故不作测量) 利用式(1)计算里德伯常数的实验值。 例1.利用钠灯测量光栅的光栅常数。 当nm 3.589=λ,测得光栅常数为 3(1.67740.0004)10d d mm σ?±=±× 2.用氢气放电管作为光源,测出氢原子三条谱线波长αλ,βλ,γλ所对应的1±级, 零级衍射光的位置读数见表一。 表一 λ +1级读数 -1级读数 零级读数 1窗口读数 2窗口读数 1窗口读数 2窗口读数 1窗口读数 2窗口读数 红线(αλ) 215410′′′°215410′′′°215400′′′°215410′′′°215410′′′° 35410′′′°35410′′′°35410′′′°354130′′′°354030′′′° 169380′′′°169390′′′°169390′′′°169390′′′°169390′′′° 349370′′′°349380′′′°349380′′′°349380′′′°349390′′′° 192390′′′°192400′′′°192400′′′°192400′′′°192400′′′° 123930′′′°12400′′′ °12400′′′ °12400′′′°124030′′′° 平均 215.680° 35.683° 169.647° 349.633° 192.663° 12.667° 蓝线(βλ) 209300′′′°2093030′′′°209300′′′°2093030′′′°209300′′′° 292930′′′°29300′′′°29300′′′°29300′′′°29300′′′° 1754930′′′°175490′′′°175490′′′°175490′′′°1754930′′′° 355490′′′ °3554930′′′ °355490′′′°355490′′′°3554930′′′° 平均 209.503° 29.498° 175.817° 355.820° 青线(γλ) 207390′′′°207390′′′ °2073930′′′°207390′′′°2073930′′′° 27390′′′°27390′′′°273930′′′°27390′′′ °27390′′′° 177390′′′°177400′′′°1774030′′′°1774030′′′°177400′′′° 093357′ ′′ 004357′ ′′ 004357′′′ 0304357′′′ 0304357′′′ 平均 207.653° 27.652° 177.667° 357.667° 由表一可以分别计算这三根谱线的衍射角,波长及里德伯常数见表二。 表二 ??σ± λλσ±(A ) 1 ()H RH R mm σ?± α 23.021°±0.003° 6559.8±1.6 1097.6±3 β 16.842°±0.003° 4860.0±1.7 1097.4±4 γ 14.944°±0.003° 4339.7±1.7 1097.3±4