欧盟 动物源产品 病毒安全指导书
- 格式:pdf
- 大小:52.42 KB
- 文档页数:14

控制PED病毒需要一个完善的生物安全策略作者:廖学文姜美建来源:《国外畜牧学·猪与禽》2015年第01期猪流行性腹泻(Porcine Epidemic Diarrhoea,PED)是一种只影响养猪生产的疾病,对人类健康没有影响。
猪流行性腹泻(Porcine Epidemic Diarrhoea,PED)是一种只影响养猪生产的疾病,对人类健康没有影响。
PED于20世纪70年代开始在欧洲暴发,之后传播到东南亚与中国。
美国的首次发病于2013年4月发生在俄亥俄州,之后传播到墨西哥与加拿大。
此病的重要性在于能造成养猪业令人揪心的经济损失,如,美国养猪业于该病暴发后在不到一年的时间内损失了500多万头猪。
PED由冠状病毒科的一种病毒引起,但是与同属于冠状病毒科的传染性胃肠炎病毒具有不同的基因型。
1 严重脱水PED会造成患病猪严重的腹泻与脱水,病毒主要通过口-粪途径传播。
发病率可高达100 %;在发病期间,幼龄猪的死亡率为80 %~100 %,会影响整个猪群的生产指标。
目前尚无经过实践证明行之有效的商用疫苗,因此养猪生产者在这个时期绝不能忽视生物安全,并且应该采取额外的预防措施来阻止PED病毒的传播。
该病毒在粪便中存活可超过28 d,在水中的存活时间可超过13 d。
另外,需要重点指出的是,它具有高度传染性。
业已证明,在实验条件下将1 mL PED病毒感染过的排泄物用100 000 L水稀释后仍可引起猪暴发PED。
感染猪可以通过粪便排出病毒5 d~9 d。
研究证明,该病毒也可经鼻途径排出。
例如,2~3日龄仔猪每毫升粪便可排出109个病毒。
这意味着100 mL粪便将含有100×109个病毒。
假定一个中等的生物安全策略表现出99.999 %的有效性,则仍将有106个病毒保持活力。
生物安全在阻止PED病毒在猪场间与猪场内的传播上起着重要的作用。
然而,为了阻断该病的传播,确定生物安全的漏洞以及采取正确的措施来优化生物安全策略显得非常重要。

浅议克隆动物食品及其食品安全性摘要:克隆动物是什么?克隆动物食品的前景如何?社会上议论纷纷,究竟可以接受克隆动物食品吗?它会给我们带来什么利害呢?让我们一起探讨,一起期待吧!关键词:克隆动物食品、安全性Abstract: What’s animal cloning?How is the foreground of animal cloning food ? It is talked about in succession at world. However, can we accept the animal cloning food? What will it give us advantages or disadvantages? Let’s discuss and wait together.Keywords:animal Cloning food、security克隆动物和克隆动物食品:时下流行克隆:动物克隆、植物克隆。
连电脑都出现Ghost——克隆软件!可见克隆已经深深影响我们人类社会了!但你是否知道:什么是克隆动物呢?克隆动物食品又是什么呢?克隆动物和克隆动物食品克隆动物是指不经过有性繁殖,通过对母本动物进行基因复制而得到的一模一样的另一只动物,它和母本动物就像不同时出生的双胞胎。
世界上第一只体细胞克隆动物是1996年出生于英国的克隆羊多利,随后克隆牛、克隆猪等不断诞生。
克隆动物技术可以使一些优良动物品种快速产出大量“后代”,比起传统培育和繁殖方法,采用这种技术有时间和数量上的优越性。
而克隆动物食品是指通过基因技术进行复制,以后代作为来源所制造的食品。
多涉及克隆的牛、羊和猪等。
克隆动物的发展历程:1952年:科学家证明,他们能把细胞核从一枚青蛙卵子中取出,然后把另一个青蛙胚胎细胞的细胞核注入这个卵子中,并让这个卵子孵化为一条蝌蚪。
这种“核转换”可以把一个动物的基因注入一个卵子。
这条蝌蚪就是提供了细胞核的那个胚胎细胞的克隆产物。

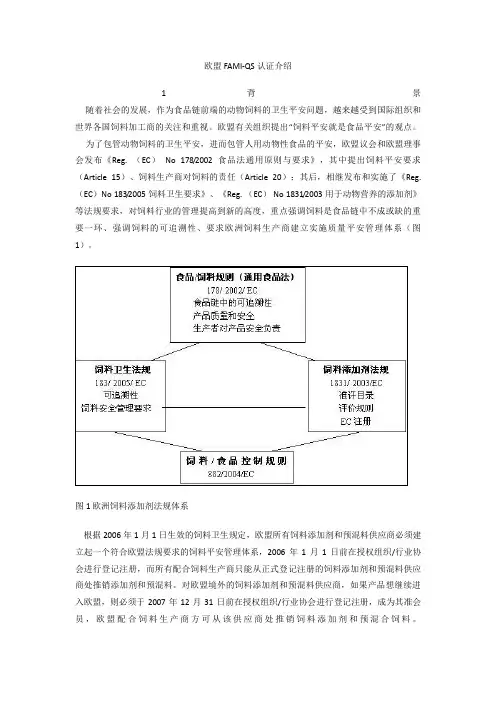
欧盟FAMI-QS认证介绍1 背景随着社会的发展,作为食品链前端的动物饲料的卫生平安问题,越来越受到国际组织和世界各国饲料加工商的关注和重视。
欧盟有关组织提出“饲料平安就是食品平安”的观点。
为了包管动物饲料的卫生平安,进而包管人用动物性食品的平安,欧盟议会和欧盟理事会发布《Reg. (EC)No 178/2002食品法通用原则与要求》,其中提出饲料平安要求(Article 15)、饲料生产商对饲料的责任(Article 20);其后,相继发布和实施了《Reg.(EC)No 183/2005饲料卫生要求》、《Reg. (EC) No 1831/2003用于动物营养的添加剂》等法规要求,对饲料行业的管理提高到新的高度,重点强调饲料是食品链中不成或缺的重要一环、强调饲料的可追溯性、要求欧洲饲料生产商建立实施质量平安管理体系(图1)。
图1 欧洲饲料添加剂法规体系根据2006年1月1日生效的饲料卫生规定,欧盟所有饲料添加剂和预混料供应商必须建立起一个符合欧盟法规要求的饲料平安管理体系,2006年1月1日前在授权组织/行业协会进行登记注册,而所有配合饲料生产商只能从正式登记注册的饲料添加剂和预混料供应商处推销添加剂和预混料。
对欧盟境外的饲料添加剂和预混料供应商,如果产品想继续进入欧盟,则必须于2007年12月31日前在授权组织/行业协会进行登记注册,成为其准会员,欧盟配合饲料生产商方可从该供应商处推销饲料添加剂和预混合饲料。
2 FAMI-QS的实施组织FAMI-QS(欧洲饲料添加剂和预混合饲料质量体系)就是欧洲饲料添加剂生产商协会(FEFANA)根据上述法规制定的关于饲料添加剂和预混合饲料的质量管理体系。
图2 欧洲饲料添加剂管理机构体系FEFANA成立于1963年,是欧盟饲料添加剂和预混合饲料行业非营利性行业自律管理组织,是饲料添加剂和预混合饲料行业与饲料欧盟当局之间的纽带。
它由欧盟饲料添加剂和预混合饲料商及相关利益方代表组成,目前有14个国家协会会员和70多个企业会员。






COVER STORY l封面专题 HACCP最初是美国航天局用来保 证航天员食品安全的制度。HACCP要求 制造商全面分析可能影响食品安全的潜 在风险,制定监测的关键控制点,将风险 降低到最低限度,并详细保留相关记录。 HACCP覆盖整个流向管理,既包括食品 生产及销售等中下游的安全问题,也包括 食品源头的安全管制。 1997年,《水产品HACCP管制要 点》生效;2003年((肉类及家禽加工厂 的HACCP计划》生效;2004年,《果汁 HACCP要点》生效。2000年前后,FDA 及相关部门促使《优良农业作业标准》和 优良制造作业标准》出台。 食品安全起始计划还利用网络技术, 建立国家细菌DNA图谱资料库,进行 细菌DNA图谱与病人或食物的对比。此 举可以在疾病暴发时更快地完成检测工 作,进行疾病原因判定,加速防治工作的 进行。 食品安全起始计划,对养殖种植、生 产加工、包装运输、仓储销售以及进出口 等所有与食品安全有关的环节进行监管, 覆盖“从农田到餐桌”食品链的所有方面, 通过全程管制系统确保食品安全。 评估预警防范风险 风险评估与预警机制是保障食品安 全的一道重要防线。FDA下设的食品安 全与应用营养中心,在2003年确立了有 害事件通报系统。其科学家开发出快速 方法检测被微生物及病毒污染的食物,可 以快速鉴定、及时控制食源性疾病的暴 发。FDA之下还有一个毒性检测中心,为 FDA提供证据性研究数据,尤其是对潜 在的食品安全问题主动进行评估,并提供 评估报告,供FDA决策和管理之用。 在生物技术愈加发达的今天,以致病 性微生物或毒物进行生物恐怖袭击的可 能性增大。美国在遭受9・11攻击之后, 欧盟:谁敢肇事就可能倾家荡产 。文/姚艳霞 尽职的食品安全管理机构 自上个世纪80年代起,欧洲发生了一 连串的食品安全事件。先有比利时戴奥辛 污染食用油事件,后有1996年缘起英国 弥漫整个欧洲的疯牛病和口蹄疫等事件。 欧洲的食品安全亮起了红灯。为此, 2000年1月欧盟委员会发布了《食品安 全白皮书》,提出了成立欧盟食品安全局 (EFSA)的建议。2002年2月,食品安全 局正式成立。 食品安全局不是一个政策的制定机 构,而是一个科技咨询机构。它具有独立 性,不受欧盟委员会、欧盟其他的机构和 成员国的管理机构管辖,独立开展工作。 负责对各成员国国内和成员国之间及第三 国进口到欧盟的食品的安全性提供科学意 见。范围涉及动、植物健康,动、植物保护, 食品生产、动物饲料、食品标签的使用等 方面。并与成员国国内有相同性质的机构 建立工作网络,通过这个网络对成员国进 行工作指导。 26 1资治文摘I 2Ol1.o6 食品安全局的建立无疑完善了欧盟 的食品安全监控体系,为欧盟对内逐渐统 一各种食品安全标准,对外逐步标准化各 项管理制度提供了科学依据。此外,欧盟 还设有一个执行机构——食品和兽医办 公室。欧盟委员会指定食品和兽医办公室 负责监督各成员国执行欧盟相关立法的情 况,及第三国进口到欧盟的食品安全情况。 1999年改革后,食品和兽医办公室的 监督权限也在不断扩展。它的监督范围扩 大到食品生产的每个过程,如对饲料和非 动物源食品,甚至对有的收费标准也要监 督。它可以用听证会和现场调查的方式对 成员国和第三国进行调查,并将结果、意 见报告给相关各国、欧盟委员会和公众。 每年该办公室都有计划地到相关国家进 行实地考察。 完备的食品安全法律体系 欧盟的食品安全立法肇始于上世纪 60年代,上世纪90年代后立法活动渐趋 FDA、卫生部疾病控制与预防中心和美国 农业部密切合作,建立了“食品紧急反应 网络”,以应对食品安全突发性事件。 对于基因工程食品,FDA在1992年 首先制定了基因改造食品的指导原则,此 后,FDA评估近百个基因改造食品,以保 障其安全性如同传统食品。 尽管法律比较健全,日常管理也非常 严格,但美国每年召回的农产品、食品都 还能列出一份不短的清单。根据FDA的 统计,2010年发生召回案件3799起,产品 达到9361种。 新法案虽然赋予管理机关以强制召回 权,但一直以来,美国的食品召回方式只 是一种,即主动召回。主动召回模式鼓励 企业诚信自律,勇于承认问题,在监管部 门还没有下禁令时就发出产品召回令撤回 自己的产品;在召回过程中与FSIS或FDA 合作,主动提交问题报告要求召回缺陷食 品,一般都能得到宽大处理。圈

动物性食品兽药及化学物残留的危害(朔州职业技术学院山西朔州036002)摘要:本文主要阐述了兽药及化学污染物在动物性食品中的残留以及食用这些食品对人类造成的危害,并提出对畜产品安全达标的初步对策。
关键词:动物性食品;兽药;化学物;残留;危害近几年来,由动物或动物食品引发的食品安全事件屡屡发生,在对养殖业造成巨大损失的同时,对人类健康也构成了极大的威胁。
一系列食品安全事件的发生向人们敲响了警钟:人类正面临着食品安全的严重挑战。
动物性食品安全问题已经引起世界范围的广泛关注。
比如在国内造成很大的金华“毒火腿案”,在2003年11月2日,为防火腿在加工过程中腐烂,竟然用兑入“敌敌畏”农药浸泡火腿,此事被曝光后,在社会上引起强烈反响。
2006年,北京友谊医院接受了因生食福寿螺而引发广州管圆线虫病感染的患者,据了解,大部分患者都是在“蜀国演义”酒楼食用了“凉拌螺肉”和“麻辣福寿螺”之后感染发病的。
经北京市卫生监督所调查,该酒楼用淡水螺替换了原来的海螺,在加工工艺上存在问题,导致寄生虫没有被完全杀死。
因此,导致了寄生虫寄生在人的中枢神经系统而发病的。
2008年9月,位于兰州市的解放军第一医院收治了首例患“肾结石”病症的婴儿,据家长们反映,孩子出生就一直食用三鹿婴幼儿配方奶粉,就有关部门调查,是因为奶粉受到三聚氰胺污染,而导致了人体泌尿系统产生结石。
一波未平,一波又起。
正当人们还在因“三鹿奶粉事件”中的三聚氰胺而心有余悸时,一向被认为很安全的鸡蛋却又被查出含有三聚氰胺。
记者了解到,生产环节上肯定没问题,可能是饲料的原料里有三聚氰胺,而生产鸡饲料的韩伟集团大型饲料厂,会对原料进行严格的控制,杜绝不合格的原料使用,如肉骨粉等动物性蛋白饲料,同时也会检测沙门氏菌等致病菌污染,但目前并没有专门针对三聚氰胺的检测。
三聚氰胺是一种化工原料,在奶粉事件中,部分批次奶粉中的三聚氰胺是为增加原料奶或奶粉蛋白含量而人为加入的。
所以,事实告诉我们,动物性食品中的残留兽药及化学物不仅影响人类肉食安全,而且影响动物性食品的对外贸易。
欧盟禁用饲料药物添加剂的历史和法规王湘如;王旭;戴梦红;赵月;冯家伟;崔潞晴;袁宗辉;程古月;黄玲利;王玉莲;彭大鹏【摘要】欧盟考虑到抗生素耐药性的发展和抗生素耐药基因可能从动物到人微生物的转移,决定从2006年1月1日起禁止抗生素作为生长促进剂,甚至还建议禁止在动物饲料中全面使用所有的抗菌剂.收集和整理欧盟饲料药物添加剂的禁用清单和法规,介绍欧盟禁用饲料药物添加剂的历史及其对动物健康的影响,以期为中国饲料药物添加剂的使用和管理提供借鉴和参考.【期刊名称】《中国兽药杂志》【年(卷),期】2019(053)006【总页数】8页(P72-79)【关键词】欧盟;饲料药物添加剂;禁用;历史;清单;法规【作者】王湘如;王旭;戴梦红;赵月;冯家伟;崔潞晴;袁宗辉;程古月;黄玲利;王玉莲;彭大鹏【作者单位】华中农业大学动物医学院,武汉430070;湖北省生猪健康养殖协同创新中心,武汉430070;华中农业大学动物医学院,武汉430070;国家兽药残留基准实验室( HZAU)/农业部兽药残留检测重点实验室,武汉430070;华中农业大学动物医学院,武汉430070;湖北省生猪健康养殖协同创新中心,武汉430070;华中农业大学动物医学院,武汉430070;湖北省生猪健康养殖协同创新中心,武汉430070;华中农业大学动物医学院,武汉430070;湖北省生猪健康养殖协同创新中心,武汉430070;华中农业大学动物医学院,武汉430070;湖北省生猪健康养殖协同创新中心,武汉430070;华中农业大学动物医学院,武汉430070;国家兽药残留基准实验室( HZAU)/农业部兽药残留检测重点实验室,武汉430070;华中农业大学动物医学院,武汉430070;国家兽药残留基准实验室( HZAU)/农业部兽药残留检测重点实验室,武汉430070;华中农业大学动物医学院,武汉430070;国家兽药残留基准实验室( HZAU)/农业部兽药残留检测重点实验室,武汉430070;华中农业大学动物医学院,武汉430070;国家兽药残留基准实验室( HZAU)/农业部兽药残留检测重点实验室,武汉430070;华中农业大学动物医学院,武汉430070;国家兽药残留基准实验室( HZAU)/农业部兽药残留检测重点实验室,武汉430070【正文语种】中文【中图分类】S851.66欧盟自20 世纪50、60年代开始允许在动物饲料中使用抗生素。
The European Agency for the Evaluation of Medicinal ProductsHuman Medicines Evaluation Unit
7 Westferry Circus, Canary Wharf, London E14 4HB, UKSwitchboard: (+44-171) 418 8400 Fax: (+44-171) 418 8551E_Mail: mail@emea.eudra.org http://www.eudra.org/emea.html
London, 14 February, 1996CPMP/BWP/268/95
COMMITTEE FOR PROPRIETARY MEDICINAL PRODUCTS(CPMP)
NOTE FOR GUIDANCE ON VIRUS VALIDATION STUDIES:THE DESIGN, CONTRIBUTION AND INTERPRETATION OFSTUDIES VALIDATING THE INACTIVATION AND REMOVALOF VIRUSES
Revised *
DISCUSSION IN THE BIOTECHNOLOGY WORKING PARTY (BWP)3-4 July 1995TRANSMISSION TO THE CPMP11-13 July 1995TRANSMISSION TO INTERESTED PARTIES12 July 1995DEADLINE FOR COMMENTS1 November 1995RE-SUBMISSION TO THE BIOTECHNOLOGY WORKING PARTY5-6 February 1996RE-SUBMISSION TO THE CPMP12 February 1996APPROVAL BY THE CPMP14 February 1996PROPOSED DATE FOR COMING INTO OPERATION14 August 1996
* Note:This guideline has been rewritten taking into consideration the International Conference of
Harmonisation (ICH) guideline “Quality of biotechnological products: viral safetyevaluation of biotechnological products derived from cell lines of human or animal origin(ICH Topic Q5A, Step 3 document) (CPMP/ICH/295/95)VIRUS VALIDATION STUDIES:THE DESIGN, CONTRIBUTION AND INTERPRETATION OF STUDIESVALIDATING THE INACTIVATION AND REMOVAL OF VIRUSES
Note for Guidance[EMEA status as of 13 March 1996]
CONTENTSSectionPage1.Introduction22.Sources of Viral Contamination33.The Validation Process44.The Choice of Viruses for Validation55.Design of Validation Studies66.Interpretation of Data77.Limitations of Validation Studies98.Re-evaluation Studies10
Appendix I:Statistical evaluation of virus titres11Appendix II:Calculation of reduction factors12Table of viruses used in validation studies131.INTRODUCTION1.1This guideline discusses the need for and the contribution of viral validation studiestowards the viral safety of biological products. The principal aims of the guideline are toprovide guidance on the design of a validation study including the choice of viruses to beused and on the interpretation of the ensuing data especially with respect to defining aprocess step which can be considered to be effective in the inactivation and/or removalof viruses.
1.2The guideline concerns the validation of virus inactivation and/or removal proceduresfor all categories of medicinal biological products for human use with the exception oflive viral vaccines including genetically engineered live vectors. The type of productscovered include:
• products derived from in vitro culture of cell lines of human or animal origin,• products derived from in vivo culture of cell lines, or from organs or tissues ofhuman or animal origin,
• products derived from blood or urine or other biological fluids of human or animalorigin.
1.3The risk of viral contamination is a feature common to all biologicals whose productioninvolves the use of material of animal or human origin. Viral contamination of abiological may arise from the source material, e.g. cell banks of animal origin, humanblood, human or animal tissues, or as adventitious agents introduced by the productionprocess, e.g. the use of animal sera in cell culture.
1.4In the past, a number of biologicals administered to humans have been contaminatedwith viruses. In several instances, the virus was only identified many years after theproduct had been introduced into the market since contamination occurred prior toadequate knowledge concerning the presence of the infectious agents. The primarycause of these viral transmissions has been contamination of the starting or sourcematerials. Examples include Yellow Fever vaccine which was contaminated by avianleukosis virus by virtue of its production in naturally infected hens eggs, whilst SV40 wasa contaminant of poliovirus and adenovirus vaccines prepared in the 1950’s on primarycultures of kidney cells obtained from Rhesus monkeys naturally harbouring a clinicallyinapparent infection with SV40. In addition, viruses present in human plasma, e.g., HIVand HCV, have contaminated blood products whilst human growth hormone extractedfrom the pituitaries of cadavers has been implicated in the transmission of theaetiological agent responsible for Creutzfeldt-Jakob disease. Contamination of abiological can also arise from the use of infected material during production or as anexcipient. Perhaps the most notable was Yellow Fever vaccine contaminated with HBVpresent in human serum used as a stabiliser in the 1940's.