酶的竞争性抑制作用
- 格式:ppt
- 大小:1.07 MB
- 文档页数:20

酶的抑制名词解释酶是一类生物催化剂,能够加速并调控化学反应的速率。
它们通过与底物相互作用,降低活化能,从而促进反应发生。
然而,在生物体内,有时抑制酶的活性是至关重要的,因为某些物质的产生或活性过高可能会对生物体产生负面影响。
这就引出了酶的抑制,即通过特定的机制减少酶的活性。
酶的抑制可以分为两类:可逆性抑制和不可逆性抑制。
可逆性抑制是指酶与抑制剂结合后,该结合是不稳定的,抑制剂可以通过离开或与酶分离并恢复酶的活性。
这种抑制包括竞争性抑制、非竞争性抑制和混合型抑制。
竞争性抑制是指抑制剂与酶底物竞争结合到酶的活性位点上,从而阻止底物结合。
抑制剂通常与底物具有结构上的相似性,因此它们可以竞争地结合到酶上。
通过增加底物浓度,可以部分缓解竞争性抑制。
非竞争性抑制是指抑制剂与酶结合到除活性位点以外的其他位点上,从而改变酶的构象,使其无法与底物结合。
与竞争性抑制相比,非竞争性抑制不受底物浓度的影响。
混合型抑制是竞争性抑制和非竞争性抑制的综合体,即抑制剂可以同时与酶的活性位点和其他位点结合。
这种抑制对底物的影响是复杂的,可能会增加或减少底物的结合。
不可逆性抑制是指抑制剂与酶结合后形成稳定的复合物,无法恢复酶的活性。
这种抑制通常涉及化学反应,例如抑制剂与酶发生共价结合,破坏了酶活性所需的关键结构。
酶的抑制在生物体内发挥着各种重要的生理和药理作用。
在生物过程中,抑制酶可以用于控制代谢途径,调节信号转导或抑制病原体的生长。
同时,对某些疾病的治疗也可以利用酶的抑制来干扰异常代谢或病原体的功能。
总结起来,酶的抑制是一种重要的调节机制,有助于维持生物体的正常生理功能。
了解酶的不同类型的抑制是理解生物化学过程和开发药物的关键。
通过研究和应用酶的抑制,我们能够更好地理解生物体的功能,并开发出更有效的治疗手段。

酶的抑制作用分析酶是生物体内的一种重要生物催化剂,它们能够加速化学反应的进行,使生命活动得以顺利进行。
然而,酶的活性并非总是不受限制的,存在着各种因素可以对其产生抑制作用。
酶的抑制作用在生物化学、药理学、毒理学等领域都具有重要的意义。
酶的抑制作用可以分为不可逆抑制和可逆抑制两大类。
不可逆抑制是指抑制剂与酶活性中心的必需基团共价结合,使酶永久性失活。
这种抑制作用一旦发生,通常难以通过简单的方法恢复酶的活性。
例如,有机磷农药就是一种不可逆抑制剂,它们能够与乙酰胆碱酯酶活性中心的丝氨酸羟基结合,导致酶的活性丧失,使得神经递质乙酰胆碱不能被及时分解,从而引起中毒症状。
可逆抑制则相对较为温和,抑制剂与酶的结合是可逆的,通过改变条件可以使酶的活性恢复。
可逆抑制又可以分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
竞争性抑制是较为常见的一种可逆抑制方式。
在这种情况下,抑制剂和底物竞争酶的活性中心。
也就是说,抑制剂和底物的结构相似,它们都试图与酶的活性中心结合。
当抑制剂占据了活性中心,底物就无法结合,从而抑制了酶促反应的进行。
例如,磺胺类药物就是通过竞争性抑制细菌体内的叶酸合成酶,发挥抗菌作用的。
因为磺胺类药物的结构与细菌合成叶酸所必需的对氨基苯甲酸相似,它们竞争结合酶的活性中心,从而阻止了叶酸的合成。
非竞争性抑制中,抑制剂结合的部位不是酶的活性中心,而是活性中心以外的调节位点。
抑制剂的结合并不会影响底物与酶活性中心的结合,但会改变酶的构象,从而降低酶的催化活性。
例如,某些重金属离子如汞离子、银离子等,可以与酶分子中的巯基结合,导致酶的构象发生改变,抑制酶的活性。
反竞争性抑制则相对较为复杂。
在这种情况下,抑制剂只能与酶底物复合物结合,形成一种不能进一步释放出产物的中间复合物,从而降低了反应的速率。
酶的抑制作用在生物体内具有重要的调节作用。
例如,在代谢途径中,通过对关键酶的抑制,可以控制代谢的流向和速率,以适应细胞和生物体的生理需求。

酶的竞争性抑制名词解释
1. 竞争性抑制作用(competitive inhibition)指的是有些抑制剂和酶底物结构相似,可与底物竞争酶活性中心,从而抑制酶和底物结合成中间产物。
2. 通过增加底物浓度可以逆转的一种酶抑制类型。
一个竞争性抑制剂通常与正常的底物或配体竞争同一个酶的结合部位。
这种抑制使得Km增大,而Vmax不变。
3. 酶的竞争性抑制剂作用原理:与被抑制的酶的底物通常有结构上的相似性,能与底物竞相争夺酶分子上的结合位点,从而产生酶活性的可逆的抑制作用。

酶的抑制作用分析酶作为生物体内的催化剂,对于维持生命活动的正常进行起着至关重要的作用。
然而,在某些情况下,酶的活性会受到抑制,这种抑制作用可以是可逆的,也可以是不可逆的。
深入理解酶的抑制作用对于生物学、医学、化学等领域都具有重要意义。
酶的抑制作用可以分为不可逆抑制和可逆抑制两大类。
不可逆抑制是指抑制剂与酶的活性中心或活性部位发生共价结合,导致酶永久性地失去活性。
这种抑制作用通常是强烈而持久的,一旦发生,很难通过简单的方法恢复酶的活性。
例如,有机磷农药就是一种常见的不可逆抑制剂。
它们能够与乙酰胆碱酯酶的活性中心结合,使该酶失去分解乙酰胆碱的能力。
乙酰胆碱在体内积累,会导致神经系统功能紊乱,引起中毒症状。
相比之下,可逆抑制则相对温和,并且在一定条件下可以解除抑制,恢复酶的活性。
可逆抑制又可细分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
竞争性抑制是指抑制剂与底物竞争酶的活性中心。
由于抑制剂和底物在结构上相似,它们都能与酶结合,但抑制剂与酶结合后,酶就无法再与底物结合,从而降低了酶促反应的速率。
举个例子,磺胺类药物就是通过竞争性抑制叶酸合成途径中的关键酶,从而发挥抗菌作用。
叶酸对于细菌的生长和繁殖至关重要,磺胺类药物的竞争抑制能够有效地抑制细菌的代谢过程。
非竞争性抑制则有所不同,抑制剂结合的部位不是酶的活性中心,而是酶的另一个部位。
抑制剂的结合导致酶的构象发生改变,从而降低了酶对底物的催化能力。
例如,某些重金属离子如汞离子、铅离子等,可以与酶分子中的巯基结合,改变酶的构象,引起非竞争性抑制。
反竞争性抑制则是抑制剂仅与酶底物复合物结合,降低了形成产物的量,从而抑制了反应的进行。
酶的抑制作用在生物体内具有重要的调节意义。
例如,在代谢途径中,通过对关键酶的抑制,可以有效地控制代谢的速度和方向,使生物体内的物质和能量代谢保持平衡。
在医学领域,酶的抑制作用也为药物研发提供了重要的思路。
许多药物就是通过抑制特定的酶来发挥治疗作用的。


抑制酶活性是一种常见的生物学过程,它是指抑制酶活性以改变生物体内特定代谢途
径的正常功能。
抑制酶活性可以通过多种机制实现。
其中最常见的机制是通过竞争性抑制
来抑制酶的活性。
在竞争性抑制中,抑制剂会与酶的活性部位竞争结合,从而使得酶无法结合到它自身的底物上,从而阻止酶发挥其功能。
另一种常见的机制是非竞争性抑制,它是通过抑制酶的活性来抑制酶的活性。
非竞争
性抑制可以通过阻断酶的反应途径,例如阻断酶的结合到底物的反应,从而抑制酶的活性。
此外,还可以通过抑制酶的结构改变来抑制酶的活性,例如将酶的活性部位进行变构,从
而阻断其对底物的结合,从而抑制酶的活性。
此外,还可以通过抑制酶的合成来抑制酶的活性。
通过抑制酶的合成,可以减少酶的
活性,从而抑制其发挥功能。
抑制酶合成也可以通过抑制其mRNA的合成实现,也可以
通过阻断酶蛋白的合成实现。
总之,抑制酶活性是一种重要的生物学过程,它可以通过多种机制实现,例如竞争性
抑制、非竞争性抑制、阻断酶结构改变、抑制酶合成等。
抑制酶活性可以改变生物体内特
定代谢途径的正常功能,在药物研发、农药研发等方面具有重要作用。


酶的抑制的名词解释酶是一种生物催化剂,能够加速生物体内化学反应的速度,并在反应结束后保持不被消耗。
然而,有时候酶的活性需要被控制,这就是酶抑制的概念。
酶抑制指的是通过某种物质或机制,使酶的催化活性受到一定程度的阻碍或停止。
1. 介绍酶的基本工作原理酶是由蛋白质组成的生物催化剂,其通过降低化学反应的活化能,加速反应的速率。
酶的催化活性与其三维结构密切相关,而酶抑制则可以通过改变酶的结构或干扰酶与底物之间的相互作用来实现。
2. 酶抑制的分类酶抑制可分为可逆性抑制和不可逆性抑制。
可逆性抑制指的是抑制剂与酶形成的复合物是可逆转的,当抑制剂离开后,酶的活性可以恢复。
而不可逆性抑制则是指抑制剂与酶形成的复合物是不可逆转的,对于酶的活性产生持久的影响。
3. 酶抑制的机理酶抑制的机理多样,可以分为竞争性抑制、非竞争性抑制和混合性抑制。
- 竞争性抑制:抑制剂与底物竞争结合于酶的活性位点,从而阻断底物与酶的相互作用,降低酶的催化效率。
- 非竞争性抑制:抑制剂与酶结合于酶的非活性位点,改变酶的三维结构,使酶失去活性。
- 混合性抑制:抑制剂通过结合于酶的活性位点或非活性位点,引起酶活性的降低,同时改变酶的底物结合能力。
4. 酶抑制的应用酶抑制在生命科学研究和药物开发中具有广泛的应用。
通过了解酶抑制的机制和特点,科学家可以设计和开发出更加有效和选择性的药物。
许多药物被设计为酶抑制剂,用于治疗各种疾病,如癌症、高血压和抑郁症等。
5. 酶抑制与疾病酶抑制在疾病的发展和治疗中起到重要作用。
某些疾病的产生与酶的活性过高或过低有关。
通过选择性地抑制特定的酶,可以调节疾病过程中的相关生物化学反应,从而实现治疗目的。
6. 酶抑制剂的发展趋势随着对酶抑制机理的深入研究,人们不断开发新型的酶抑制剂。
近年来,新一代酶抑制剂被开发出来,具有更好的选择性和疗效,同时减少了副作用。
这些新药物的开发为疾病的治疗带来了新的希望。
总结:酶抑制是一种调控酶活性的机制,通过改变酶催化反应的速率,对生物体的正常功能发挥至关重要。

详细解读酶的抑制作用一、酶的概述酶是生物体内的一种特殊的蛋白质,具有催化作用,能够加速生物体内的化学反应。
酶在生物体内扮演着至关重要的角色,它们参与了细胞代谢、能量转化、物质转运等许多重要的生物过程。
二、酶的抑制作用定义酶的抑制作用是指通过某种方式抑制酶的活性,使酶不能正常发挥其催化作用。
这种抑制作用可以是可逆的,也可以是不可逆的。
可逆抑制作用是指抑制剂与酶结合后,可以与酶分离,从而恢复酶的活性;不可逆抑制作用是指抑制剂与酶结合后,不能分离,从而永久地失去酶的活性。
三、酶抑制作用的类型根据抑制作用的机理,酶的抑制作用可分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
1. 竞争性抑制:抑制剂与底物竞争结合酶的活性中心,使底物无法与酶结合,从而抑制了酶的活性。
2. 非竞争性抑制:抑制剂与酶的非活性中心结合,不影响底物与酶的结合,但影响了酶的构象,从而抑制了酶的活性。
3. 反竞争性抑制:底物与酶结合后,抑制剂再与底物结合,使底物无法从酶上解离下来,从而抑制了酶的活性。
四、酶抑制作用的机理酶的抑制作用主要通过以下三种方式实现:1. 占据酶的活性中心:抑制剂与酶的活性中心结合,阻止底物与酶的结合,从而抑制了酶的活性。
2. 改变酶的构象:抑制剂与酶的非活性中心结合,改变了酶的构象,影响了酶与底物的结合和催化反应的进行,从而抑制了酶的活性。
3. 占据底物结合位点:抑制剂占据了底物结合位点,使底物无法与酶结合,从而抑制了酶的活性。
五、酶抑制作用的应用1. 疾病治疗:某些药物可以抑制体内某种酶的活性,从而达到治疗疾病的目的。
例如,磺胺类药物可以抑制细菌体内二氢叶酸合成酶的活性,从而达到治疗细菌感染的目的。
2. 农业应用:某些农药可以抑制植物体内某种酶的活性,从而达到防治病虫害的目的。
例如,氨基甲酸酯类农药可以抑制植物体内乙酰胆碱酯酶的活性,从而达到防治病虫害的目的。
3. 工业应用:在化工、食品、纺织等行业中,可以利用酶的抑制作用实现某些特定的工艺过程。

2014高考生物知识点总结:酶的竞争性抑
制作用
导读:本文2014高考生物知识点总结:酶的竞争性抑制作用,仅供参考,如果能帮助到您,欢迎点评和分享。
高考频道在考试后及时公布各科高考试题答案和高考作文及试卷专家点评。
请广大考生家长关注,祝福广大考生在2013年高考中发挥出最佳水平,考出好成绩!同时祝愿决战2014高考的新高三学员能倍加努力,在2014年高考中也能取得优异的成绩。
酶的竞争性抑制作用
按事物发生的条件、发展、结果分层次记忆:
(1)“竞争”需要双方——底物与抑制剂之间;
(2)为什么能发生“竞争”——二者结构相似;
(3)“竞争的焦点”——酶的活性中心;
(4)“抑制剂占据酶活性中心”——酶活性受抑。
酶的抑制作用分析酶是生物体内具有催化作用的蛋白质或 RNA 分子,它们能够加速化学反应的进行,使得生命活动能够高效有序地进行。
然而,酶的活性并非总是处于不受约束的状态,会受到各种因素的影响,其中酶的抑制作用就是一种重要的调节方式。
酶的抑制作用可以分为不可逆抑制和可逆抑制两大类。
不可逆抑制是指抑制剂与酶活性中心的必需基团共价结合,导致酶活性丧失且这种抑制作用不能通过透析、超滤等物理方法去除。
例如,有机磷农药能与胆碱酯酶活性中心的丝氨酸羟基结合,使酶不可逆地失活。
一旦发生不可逆抑制,酶的功能通常难以恢复,这可能会对生物体的正常生理过程产生严重影响。
可逆抑制则相对温和,它与酶的结合是可逆的,通过改变反应条件,如去除抑制剂、改变 pH 值或温度等,可以使酶的活性得以恢复。
可逆抑制又可以进一步分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
竞争性抑制是一种常见的可逆抑制形式。
在这种情况下,抑制剂和底物竞争酶的活性中心。
这意味着抑制剂的结构与底物相似,它们都试图与酶的活性中心结合。
由于抑制剂的存在,底物与酶结合的机会减少,从而使反应速度降低。
但如果增加底物的浓度,底物与酶结合的机会就会增加,从而可以克服抑制剂的影响,使反应速度逐渐接近没有抑制剂存在时的水平。
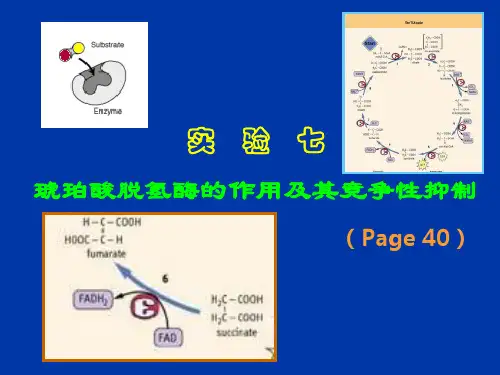
例如,丙二酸对琥珀酸脱氢酶的抑制就属于竞争性抑制。
丙二酸的结构与琥珀酸相似,会与琥珀酸竞争结合琥珀酸脱氢酶的活性中心。
非竞争性抑制则有所不同。
在非竞争性抑制中,抑制剂结合的部位不是酶的活性中心,而是活性中心以外的调节位点。
抑制剂与酶结合后,会改变酶的构象,使得酶对底物的亲和力降低,或者使酶催化底物转变为产物的能力下降。
即使增加底物的浓度,也无法克服这种抑制作用。
例如,某些重金属离子如汞离子、银离子可以与酶分子中的巯基结合,从而抑制含巯基的酶的活性。
反竞争性抑制相对较为复杂。
抑制剂仅与酶底物复合物结合,降低了酶底物复合物形成产物的能力。
这种抑制作用会导致酶促反应的最大反应速度降低,而且表观 Km 值也会减小。
竞争性抑制的概念竞争性抑制(competitive inhibition)是指在生物学或化学反应中,一种物质通过与酶活性部位结合而阻碍酶底物复合物的形成,从而抑制酶的活性。
竞争性抑制的概念最早由德国化学家恩斯特·弗赖登赫尔提出。
他在1913年对亚硫酸酶催化反应进行研究时,观察到在反应过程中添加亚硫酸盐会降低该酶的活性。
他发现,亚硫酸盐分子与酶底物分子有着相似的结构,因此它们可以与酶结合,竞争性地占据酶活性部位,从而抑制酶底物复合物的形成,导致酶的活性下降。
竞争性抑制是一种常见的酶活性调节机制,可以通过调节底物浓度等方式对酶的活性进行调控。
竞争性抑制分为可逆性和不可逆性两种,其中可逆性抑制是指竞争性抑制剂与酶的结合可解离,从而恢复酶的活性;而不可逆性抑制是指竞争性抑制剂与酶形成牢固的结合,导致酶活性完全丧失。
竞争性抑制的机制可以解释一些生物体内的调节过程。
例如,在人体内,抗生素青霉素就是通过竞争性抑制作用来抑制细菌的生长。
青霉素的结构与细菌细胞壁的合成物质相似,它可以与细菌细胞壁合成的酶结合,从而阻碍细菌细胞壁的合成,导致细菌死亡。
此外,竞争性抑制还被广泛应用于药物研发领域。
根据竞争性抑制的原理,科学家们可以设计和合成一系列具有高亲和力的分子,用于特异性地抑制某些酶的活性。
这些竞争性抑制剂可以被用于治疗一些疾病,比如肿瘤、病毒感染等。
通过抑制疾病相关酶的活性,竞争性抑制剂可以有效地阻断病理反应通路,从而起到治疗疾病的效果。
总结起来,竞争性抑制是一种重要的酶活性调节机制,它通过竞争性地与酶活性部位结合,阻碍底物与酶的结合,从而抑制酶的活性。
竞争性抑制在生物学和化学反应中起着重要的作用,不仅可以解释生物体内的调节机制,还可以应用于药物研发领域。
对竞争性抑制的深入研究可以为药物设计和治疗疾病提供新的思路和方法。
酶的抑制作用分析酶是生物体内具有催化作用的蛋白质或 RNA 分子,它们在细胞代谢、生物合成和分解等过程中起着至关重要的作用。
然而,酶的活性并非一成不变,常常会受到各种因素的影响,其中酶的抑制作用就是一种重要的调节机制。
酶的抑制作用可以分为不可逆抑制和可逆抑制两大类。
不可逆抑制是指抑制剂与酶的活性中心或活性中心之外的调节位点以共价键的方式结合,从而导致酶的活性永久性丧失。
这种抑制作用通常是强烈而持久的。
例如,有机磷农药就是一种不可逆抑制剂,它们能够与乙酰胆碱酯酶活性中心的丝氨酸残基共价结合,使乙酰胆碱酯酶失去活性,导致乙酰胆碱在体内大量积聚,引起中毒症状。
可逆抑制则相对较为温和,抑制剂与酶通过非共价键结合,在一定条件下这种结合是可以解除的,酶的活性也能够得以恢复。
可逆抑制又可以进一步分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
竞争性抑制是最为常见的一种可逆抑制方式。
在这种情况下,抑制剂和底物竞争酶的活性中心。
抑制剂的结构通常与底物相似,能够与底物争夺酶的活性中心结合位点。
这就好比两个人在争抢同一个座位,谁先抢到谁就能坐下。
由于抑制剂与酶结合后,底物无法再与酶结合,从而导致酶促反应速率下降。
但是,如果增加底物的浓度,底物在竞争中获胜的机会就会增加,从而可以克服抑制剂的影响,使反应速率逐渐接近正常水平。
一个典型的例子是磺胺类药物,它们与对氨基苯甲酸竞争二氢叶酸合成酶的活性中心,从而抑制细菌叶酸的合成,达到抗菌的效果。
非竞争性抑制则有所不同。
抑制剂结合的位点不是酶的活性中心,而是活性中心之外的调节位点。
抑制剂与酶结合后,会改变酶的构象,导致酶对底物的亲和力降低,或者使酶的最大反应速率下降。
无论底物浓度如何增加,都无法完全克服抑制剂的影响。
例如,重金属离子如汞离子、银离子等可以与某些酶活性中心之外的巯基结合,导致酶活性受到抑制。
反竞争性抑制则是抑制剂只与酶底物复合物结合。
这种抑制作用不仅降低了酶对底物的亲和力,还降低了酶的最大反应速率。
酶的抑制剂类型及特点1. 引言酶(enzyme)是一类在生物体内起催化作用的蛋白质分子。
酶通过增加反应的速率,降低活化能,从而促使化学反应的发生。
然而,在某些情况下,抑制酶活性可以带来一些重要的效果,例如控制代谢过程、治疗疾病等。
因此,酶抑制剂的研究和开发对于生物医药领域具有重要意义。
本文将介绍几种常见的酶抑制剂类型及其特点。
2. 竞争性抑制剂竞争性抑制剂(Competitive inhibitor)是一种与底物结合在酶活性中心相同位点上的分子。
竞争性抑制剂与底物竞争结合在活性中心上,从而阻止底物与酶发生反应。
竞争性抑制剂的特点包括:(1)可逆性:竞争性抑制剂与酶结合的作用是可以逆转的,啮合键不稳定;(2)结构类似性:竞争性抑制剂与底物的结构类似,从而能够与酶活性中心相互竞争结合。
竞争性抑制剂可以通过增加底物浓度来减少其抑制效果。
3. 反竞争性抑制剂反竞争性抑制剂(Non-competitive inhibitor)是一种结合在酶活性中心以外的位点上的分子。
反竞争性抑制剂与酶结合后,会改变酶的构象,从而影响酶的活性。
反竞争性抑制剂的特点包括:(1)不可逆性:反竞争性抑制剂与酶结合的作用是不可逆转的,啮合键稳定;(2)结构非类似性:反竞争性抑制剂与底物的结构不类似,因此不与底物竞争结合。
反竞争性抑制剂的抑制效果不受底物浓度的影响。
4. 不可逆性抑制剂不可逆性抑制剂(Irreversible inhibitor)是一种与酶发生共价键结合的分子。
不可逆性抑制剂与酶结合后,形成稳定的共价结合,使酶失去活性。
不可逆性抑制剂的特点包括:(1)不可逆性:不可逆性抑制剂与酶结合的作用是不可逆转的,共价键稳定;(2)高选择性:不可逆性抑制剂具有高度选择性,能够特异性地与目标酶发生共价结合。
不可逆性抑制剂因其高选择性,常被用于治疗疾病。
5. 反向竞争性抑制剂反向竞争性抑制剂(Uncompetitive inhibitor)是一种结合在酶-底物复合物上的分子。
一、实验目的1. 掌握酶抑制类型的基本概念和原理。
2. 了解不同类型酶抑制剂的特性和作用机制。
3. 通过实验验证竞争性抑制、非竞争性抑制和反竞争性抑制的特点。
二、实验原理酶抑制剂是指能够降低酶催化活性或酶促反应速度的物质。
根据抑制剂与酶结合的特性和抑制作用的动力学特点,酶抑制类型主要分为以下三种:1. 竞争性抑制:抑制剂与底物竞争与酶的活性中心结合,从而干扰底物与酶的结合,降低酶的催化活性。
竞争性抑制剂与底物结构相似,能与底物竞争酶的活性中心。
2. 非竞争性抑制:抑制剂与酶的非活性中心结合,改变酶的构象,使酶活性降低。
非竞争性抑制剂与底物结构无关,不与底物竞争酶的活性中心。
3. 反竞争性抑制:抑制剂与酶-底物复合物结合,阻止产物的生成,降低酶的催化活性。
反竞争性抑制剂与底物结构无关,但需要底物存在才能发挥作用。
三、实验材料与仪器1. 实验材料:底物、酶、竞争性抑制剂、非竞争性抑制剂、反竞争性抑制剂、缓冲溶液、试剂等。
2. 实验仪器:酶标仪、分光光度计、移液器、恒温水浴锅、离心机等。
四、实验方法1. 竞争性抑制实验:- 将底物、酶和不同浓度的竞争性抑制剂加入反应体系中,在一定条件下进行反应。
- 通过测定反应体系中底物的消耗量或产物的生成量,计算酶促反应速度。
- 比较不同抑制剂浓度下的酶促反应速度,验证竞争性抑制的特点。
2. 非竞争性抑制实验:- 将底物、酶和不同浓度的非竞争性抑制剂加入反应体系中,在一定条件下进行反应。
- 通过测定反应体系中底物的消耗量或产物的生成量,计算酶促反应速度。
- 比较不同抑制剂浓度下的酶促反应速度,验证非竞争性抑制的特点。
3. 反竞争性抑制实验:- 将底物、酶和不同浓度的反竞争性抑制剂加入反应体系中,在一定条件下进行反应。
- 通过测定反应体系中底物的消耗量或产物的生成量,计算酶促反应速度。
- 比较不同抑制剂浓度下的酶促反应速度,验证反竞争性抑制的特点。
五、实验结果与分析1. 竞争性抑制实验结果:- 随着竞争性抑制剂浓度的增加,酶促反应速度逐渐降低,呈现竞争性抑制特点。