酶的竞争性抑制机制
- 格式:ppt
- 大小:1.51 MB
- 文档页数:31

1 .不行逆性抑制剂
不行逆抑制剂主要与酶共价结合,降低酶活性。
共价结合结合紧密,不能用简洁透析、稀释等物理方法除去抑制作用。
2 .可逆性抑制剂
可逆性抑制剂通过非共价键结合,结合力弱,因此既能结合,又易解离,快速的达到平衡。
可逆性抑制剂又分为竞争性抑制剂和非竞争性抑制剂两大类。
(1)竞争性抑制剂的结构与底物相像,主要与必需基团的结合基团相互结合,与底物竞争酶,所以称竞争性抑制作用。
抑制剂与底物竞争酶的结合位点的力量取决于两者的浓度。
如抑制剂浓度恒定,底物浓度低时,抑制作用最为明显。
随着底物浓度的增加,酶•底物复合物浓度增加,抑制作用减弱。
当底物浓度远远大于抑制剂浓度时,几乎全部的酶均被底物夺取,此时,酶促反应的VmaX不变,但Km值变大。
许多药物都属酶的竞争性抑制剂。
磺胺药物与对氨基苯甲酸具有类似结构,而对氨基苯甲酸是二氢叶酸合成酶的底物,因此磺胺药通过竞争性地抑制二氢叶酸合成酶,使细菌缺乏二氢叶酸乃至四氢叶酸,不能合成核酸而增殖受抑制。
(2)非竞争性抑制剂与酶活性中心外的位点相结合,不影响酶与底物的结合,底物也不影响酶与抑制剂结合,底物与抑制剂之间无竞争关系,但底物-酶-抑制剂复合物不能进一步释放出产物,所以称作非竞争性抑制作用,表现为VmaX值减小,而Km值不变。
⑶反竞争性抑制剂仅与酶-底物复合物结合使中间产物的量下降。
这种抑制作用称为反竞争性抑制作用。
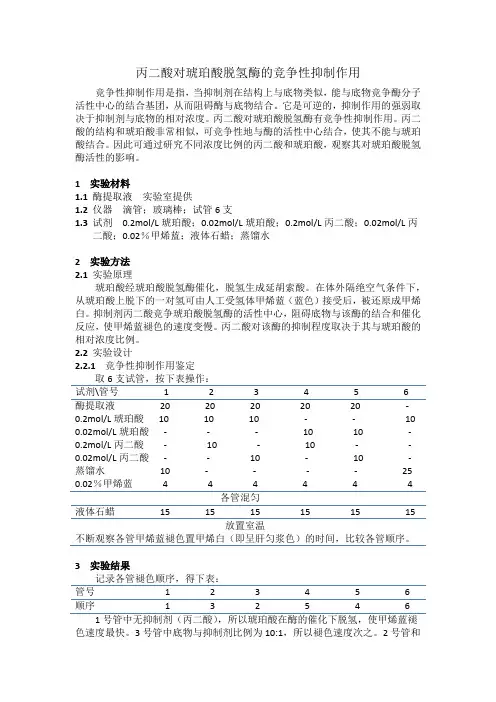
丙二酸对琥珀酸脱氢酶的竞争性抑制作用竞争性抑制作用是指,当抑制剂在结构上与底物类似,能与底物竞争酶分子活性中心的结合基团,从而阻碍酶与底物结合。
它是可逆的,抑制作用的强弱取决于抑制剂与底物的相对浓度。
丙二酸对琥珀酸脱氢酶有竞争性抑制作用。
丙二酸的结构和琥珀酸非常相似,可竞争性地与酶的活性中心结合,使其不能与琥珀酸结合。
因此可通过研究不同浓度比例的丙二酸和琥珀酸,观察其对琥珀酸脱氢酶活性的影响。
1实验材料1.1酶提取液实验室提供1.2仪器滴管;玻璃棒;试管6支1.3试剂0.2mol/L琥珀酸;0.02mol/L琥珀酸;0.2mol/L丙二酸;0.02mol/L丙二酸;0.02%甲烯蓝;液体石蜡;蒸馏水2实验方法2.1实验原理琥珀酸经琥珀酸脱氢酶催化,脱氢生成延胡索酸。
在体外隔绝空气条件下,从琥珀酸上脱下的一对氢可由人工受氢体甲烯蓝(蓝色)接受后,被还原成甲烯白。
抑制剂丙二酸竞争琥珀酸脱氢酶的活性中心,阻碍底物与该酶的结合和催化反应,使甲烯蓝褪色的速度变慢。
丙二酸对该酶的抑制程度取决于其与琥珀酸的相对浓度比例。
2.2实验设计2.2.1竞争性抑制作用鉴定取6支试管,按下表操作:试剂\管号 1 2 3 4 5 6酶提取液20 20 20 20 20 - 0.2mol/L琥珀酸10 10 10 - - 10 0.02mol/L琥珀酸- - - 10 10 - 0.2mol/L丙二酸- 10 - 10 - - 0.02mol/L丙二酸- - 10 - 10 -蒸馏水10 - - - - 25 0.02%甲烯蓝 4 4 4 4 4 4各管混匀液体石蜡15 15 15 15 15 15放置室温不断观察各管甲烯蓝褪色置甲烯白(即呈肝匀浆色)的时间,比较各管顺序。
3实验结果记录各管褪色顺序,得下表:管号 1 2 3 4 5 6顺序 1 3 2 5 4 6 1号管中无抑制剂(丙二酸),所以琥珀酸在酶的催化下脱氢,使甲烯蓝褪色速度最快。

酶的调节与抑制机制酶是生物体内负责加速化学反应的蛋白质分子。
它们在维持生命活动中起着重要的调节作用。
酶的调节可以通过多种机制实现,包括底物浓度的调节、酶活性的调节以及酶的抑制。
本文将探讨酶调节与抑制的机制,并分析它们在生物系统中的重要性。
一、底物浓度的调节底物浓度是酶催化速率的重要影响因素。
当底物浓度增加时,酶的活性常常呈现正相关关系。
这是因为底物浓度的增加会提高酶与底物之间的碰撞频率,从而增强酶催化反应的速率。
底物浓度调节酶活性是一种重要的自身调控机制。
在某些情况下,底物浓度还可以通过反馈机制调节酶的活性。
这种调节方式被称为反馈抑制。
反馈抑制通过产物的积累来抑制酶的活性,以维持反应的平衡。
典型的例子是糖酵解途径中的磷酸果糖激酶,它受到反馈抑制以调控糖代谢过程。
二、酶活性的调节除了底物浓度,酶活性的调节也对生物体的正常运作至关重要。
酶活性的调节机制多种多样,其中最典型的包括酶的磷酸化和去磷酸化、酶的翻译后修饰以及酶的构象变化等。
酶的磷酸化和去磷酸化是常见的酶活性调节机制。
酶的磷酸化通常由激酶催化,而去磷酸化则由磷酸酶催化。
这种反应可以在酶活性、局部构象以及蛋白质的亲和性上发挥作用,从而调节酶的催化活性。
酶的翻译后修饰也是重要的调节机制之一。
这类修饰方式包括如甲基化、乙酰化、泛素化等。
翻译后修饰可以通过改变酶蛋白质的结构、稳定性和亲和性等来调节其活性。
酶的构象变化是一种常见的调节机制。
酶活性可能受到底物结合后酶蛋白质的构象变化影响。
这种构象变化不仅与酶活性密切相关,还与酶与底物之间的相互作用和信号转导等过程有关。
三、酶的抑制机制除了调节酶活性,抑制酶活性也对维持细胞内环境的稳定至关重要。
酶的抑制通常可以通过竞争性抑制、非竞争性抑制和未竞争性抑制等方式实现。
竞争性抑制是指抑制剂与底物竞争结合到酶的活性部位上,从而降低酶与底物的结合能力,减少酶活性。
非竞争性抑制则是抑制剂结合到酶的其他位点,导致酶构象改变,降低其催化能力。



详细解读酶的抑制作用一、酶的概述酶是生物体内的一种特殊的蛋白质,具有催化作用,能够加速生物体内的化学反应。
酶在生物体内扮演着至关重要的角色,它们参与了细胞代谢、能量转化、物质转运等许多重要的生物过程。
二、酶的抑制作用定义酶的抑制作用是指通过某种方式抑制酶的活性,使酶不能正常发挥其催化作用。
这种抑制作用可以是可逆的,也可以是不可逆的。
可逆抑制作用是指抑制剂与酶结合后,可以与酶分离,从而恢复酶的活性;不可逆抑制作用是指抑制剂与酶结合后,不能分离,从而永久地失去酶的活性。
三、酶抑制作用的类型根据抑制作用的机理,酶的抑制作用可分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
1. 竞争性抑制:抑制剂与底物竞争结合酶的活性中心,使底物无法与酶结合,从而抑制了酶的活性。
2. 非竞争性抑制:抑制剂与酶的非活性中心结合,不影响底物与酶的结合,但影响了酶的构象,从而抑制了酶的活性。
3. 反竞争性抑制:底物与酶结合后,抑制剂再与底物结合,使底物无法从酶上解离下来,从而抑制了酶的活性。
四、酶抑制作用的机理酶的抑制作用主要通过以下三种方式实现:1. 占据酶的活性中心:抑制剂与酶的活性中心结合,阻止底物与酶的结合,从而抑制了酶的活性。
2. 改变酶的构象:抑制剂与酶的非活性中心结合,改变了酶的构象,影响了酶与底物的结合和催化反应的进行,从而抑制了酶的活性。
3. 占据底物结合位点:抑制剂占据了底物结合位点,使底物无法与酶结合,从而抑制了酶的活性。
五、酶抑制作用的应用1. 疾病治疗:某些药物可以抑制体内某种酶的活性,从而达到治疗疾病的目的。
例如,磺胺类药物可以抑制细菌体内二氢叶酸合成酶的活性,从而达到治疗细菌感染的目的。
2. 农业应用:某些农药可以抑制植物体内某种酶的活性,从而达到防治病虫害的目的。
例如,氨基甲酸酯类农药可以抑制植物体内乙酰胆碱酯酶的活性,从而达到防治病虫害的目的。
3. 工业应用:在化工、食品、纺织等行业中,可以利用酶的抑制作用实现某些特定的工艺过程。


酶活性的抑制剂名词解释酶活性的抑制剂是一类能够降低或抑制酶活性的化学物质,它们在生物和化学研究中起着重要的作用。
酶是生物体内一种催化反应的蛋白质,它们能够加速化学反应的速率,从而在细胞代谢中起到调节和控制的作用。
然而,有时候我们需要抑制某些特定的酶活性,以实现特定的目的,比如研究细胞代谢途径的调控,开发新药物等。
这时候就需要使用酶活性的抑制剂。
酶活性的抑制剂可以根据其作用机制的不同分为三类:竞争性抑制剂、非竞争性抑制剂和混合性抑制剂。
竞争性抑制剂是一类与底物分子在酶活性部位上发生竞争的化合物。
它们与酶结合,形成酶-抑制剂复合物,从而阻碍底物与酶结合,降低酶催化反应的速率。
竞争性抑制剂与酶的亲和力相近,因此可以通过增加底物的浓度来减轻竞争性抑制剂的抑制作用。
典型的例子是生物体内的调节剂,它们能够控制酶活性以维持代谢平衡。
非竞争性抑制剂是一类能够与酶结合在除了活性部位之外的其它位点上,从而改变酶的构象,使其失去催化活性的化合物。
与竞争性抑制剂不同,非竞争性抑制剂的抑制作用不依赖于底物浓度。
它们通常通过与酶的构象变化相互作用来抑制酶活性,进而影响相关的生物过程。
混合性抑制剂是一类兼具竞争性和非竞争性抑制作用的化合物。
它们既可以与酶的活性部位竞争底物结合,也可以与酶的其他位点结合,并改变酶的构象。
混合性抑制剂的抑制作用是复杂的,通常具有高度选择性和特异性。
这类抑制剂的开发对于药物研究和治疗疾病具有重要意义。
值得注意的是,不同的抑制剂对于酶的抑制效果和作用机制也有差异。
有些抑制剂只能在特定的pH、温度和离子强度条件下起作用,而有些则可以在广泛的条件下起作用。
因此,在设计和应用酶活性的抑制剂时,需要综合考虑生物体内的环境因素和酶的特性,以期达到预期的抑制效果。
总结起来,酶活性的抑制剂是一类能够降低或抑制酶活性的化学物质,它们可以通过竞争性、非竞争性或混合性的机制来实现抑制作用。
研究和应用酶活性的抑制剂对于理解细胞代谢的调控机制、开发新药物和治疗疾病具有重要的意义。

竞争性抑制酶促反应动力学特点竞争性抑制酶促反应动力学(Competitive inhibitory enzyme-catalyzed reaction kinetics)是生物化学研究中的常见现象,即集中的抑制酶促活性受目标物质的存在或加入而被竞争性抑制。
抑制酶促反应动力学一般包括一个反应速率和一个反应抑制系数。
抑制酶促反应动力学主要是针对非竞争性(非竞争性)和竞争性(竞争性)抑制情况进行描述,并用于提供有关抑制酶促反应和物质之间关系、反应特性及相关变化的详细信息。
竞争性抑制酶促反应动力学是根据Michaelis-Menten动力学而发展的。
该学说认为,当进入有限的底物时,通常随着底物的增加而减少,而抑制物则于此相反。
因此,当底物和抑制剂同时存在时,抑制酶反应速率会受到竞争性抑制,而且随着物质浓度增加,反应速率线性下降。
此外,竞争性抑制反应力学还可以用来描述物质与酶之间的动力学变化,从而更好地推测其逆反应的机制。
竞争性抑制酶促反应动力学还可以用来揭示药物靶点和多个药物之间的反应特性,并发现新的具有潜在治疗影响的药物。
例如,在不同的药物靶点上,可以评估药物对抑制酶反应的影响,从而识别新的药物,用于治疗疾病。
此外,竞争性抑制酶促反应动力学也可以提供在不同体系中活性和/或特性蛋白质或物质之间的联系,以便更好地研究和管理相关蛋白质活性,特别是研究不同药物在人体内的作用机制,对药学研究意义重大。
总之,竞争性抑制酶促反应动力学是一门重要的研究领域,主要是为了研究药物的作用机制,治疗疾病提供有价值的洞察。
竞争性抑制酶反应动力学的实验和模型研究开展,正在帮助研究人员理解抑制酶反应的机制,为医药研发和药物治疗提供重要的线索。

酶的抑制作用酶的抑制作用是指特定物质可以干扰酶的正常功能,从而降低酶的催化活性。
酶的抑制作用在生物体内起着重要的调控作用,它可以通过抑制或增强某些代谢途径来维持生物体的稳态。
酶的抑制作用主要有两种类型:可逆性抑制和不可逆性抑制。
可逆性抑制是指抑制物与酶之间的结合是可逆的,一旦抑制物被移除,酶的活性可以恢复。
不可逆性抑制是指抑制物与酶之间的结合是不可逆的,酶的活性无法恢复。
可逆性抑制又可以分为竞争性抑制和非竞争性抑制。
竞争性抑制是指抑制物与底物争夺结合酶活性部位,从而降低酶与底物的结合,进而降低酶的催化活性。
这种抑制作用可以通过增加底物浓度来逆转。
非竞争性抑制是指抑制物与酶或底物结合,改变酶的构象,从而降低酶的催化活性。
这种抑制作用通常不能通过增加底物浓度来逆转。
不可逆性抑制通常是由于抑制物与酶之间发生共价键结合,从而使酶的活性部位发生永久性改变,无法再参与催化反应。
由于这种抑制作用无法逆转,所以往往具有较高的毒性。
酶的抑制作用在生物体内有着广泛的应用。
例如,抗生素可以抑制细菌体内特定酶的活性,从而阻止细菌生长。
这是因为抗生素可以与细菌酶发生相互作用,从而实现抑制效果。
抑制剂还可以用于治疗一些疾病,如癌症。
在癌症治疗中,可以通过抑制肿瘤细胞中的某些特定酶的活性,从而阻断癌细胞的生长和分裂。
此外,酶的抑制作用还可以用于研究和发展药物。
研究人员可以设计和合成分子来模拟酶的底物,从而通过与酶发生竞争性抑制,来研究酶的结构和活性。
这些研究可以揭示酶的催化机制,并为药物设计和开发提供重要的理论基础。
总之,酶的抑制作用在生物体内起着重要的调控作用。
抑制剂可以通过可逆性或不可逆性抑制酶的活性,从而干扰代谢途径和生物反应,对生物体的生长和发育产生重要影响。
了解酶的抑制作用有助于我们更好地理解生物体内的化学反应,并为药物开发和疾病治疗提供重要的研究依据。

酶的抑制名词解释酶是一类生物催化剂,能够加速并调控化学反应的速率。
它们通过与底物相互作用,降低活化能,从而促进反应发生。
然而,在生物体内,有时抑制酶的活性是至关重要的,因为某些物质的产生或活性过高可能会对生物体产生负面影响。
这就引出了酶的抑制,即通过特定的机制减少酶的活性。
酶的抑制可以分为两类:可逆性抑制和不可逆性抑制。
可逆性抑制是指酶与抑制剂结合后,该结合是不稳定的,抑制剂可以通过离开或与酶分离并恢复酶的活性。
这种抑制包括竞争性抑制、非竞争性抑制和混合型抑制。
竞争性抑制是指抑制剂与酶底物竞争结合到酶的活性位点上,从而阻止底物结合。
抑制剂通常与底物具有结构上的相似性,因此它们可以竞争地结合到酶上。
通过增加底物浓度,可以部分缓解竞争性抑制。
非竞争性抑制是指抑制剂与酶结合到除活性位点以外的其他位点上,从而改变酶的构象,使其无法与底物结合。
与竞争性抑制相比,非竞争性抑制不受底物浓度的影响。
混合型抑制是竞争性抑制和非竞争性抑制的综合体,即抑制剂可以同时与酶的活性位点和其他位点结合。
这种抑制对底物的影响是复杂的,可能会增加或减少底物的结合。
不可逆性抑制是指抑制剂与酶结合后形成稳定的复合物,无法恢复酶的活性。
这种抑制通常涉及化学反应,例如抑制剂与酶发生共价结合,破坏了酶活性所需的关键结构。
酶的抑制在生物体内发挥着各种重要的生理和药理作用。
在生物过程中,抑制酶可以用于控制代谢途径,调节信号转导或抑制病原体的生长。
同时,对某些疾病的治疗也可以利用酶的抑制来干扰异常代谢或病原体的功能。
总结起来,酶的抑制是一种重要的调节机制,有助于维持生物体的正常生理功能。
了解酶的不同类型的抑制是理解生物化学过程和开发药物的关键。
通过研究和应用酶的抑制,我们能够更好地理解生物体的功能,并开发出更有效的治疗手段。
酶的抑制作用分析酶是生物体内具有催化作用的蛋白质或 RNA 分子,它们在细胞代谢、生物合成和分解等过程中起着至关重要的作用。
然而,酶的活性并非一成不变,常常会受到各种因素的影响,其中酶的抑制作用就是一种重要的调节机制。
酶的抑制作用可以分为不可逆抑制和可逆抑制两大类。
不可逆抑制是指抑制剂与酶的活性中心或活性中心之外的调节位点以共价键的方式结合,从而导致酶的活性永久性丧失。
这种抑制作用通常是强烈而持久的。
例如,有机磷农药就是一种不可逆抑制剂,它们能够与乙酰胆碱酯酶活性中心的丝氨酸残基共价结合,使乙酰胆碱酯酶失去活性,导致乙酰胆碱在体内大量积聚,引起中毒症状。
可逆抑制则相对较为温和,抑制剂与酶通过非共价键结合,在一定条件下这种结合是可以解除的,酶的活性也能够得以恢复。
可逆抑制又可以进一步分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
竞争性抑制是最为常见的一种可逆抑制方式。
在这种情况下,抑制剂和底物竞争酶的活性中心。
抑制剂的结构通常与底物相似,能够与底物争夺酶的活性中心结合位点。
这就好比两个人在争抢同一个座位,谁先抢到谁就能坐下。
由于抑制剂与酶结合后,底物无法再与酶结合,从而导致酶促反应速率下降。
但是,如果增加底物的浓度,底物在竞争中获胜的机会就会增加,从而可以克服抑制剂的影响,使反应速率逐渐接近正常水平。
一个典型的例子是磺胺类药物,它们与对氨基苯甲酸竞争二氢叶酸合成酶的活性中心,从而抑制细菌叶酸的合成,达到抗菌的效果。
非竞争性抑制则有所不同。
抑制剂结合的位点不是酶的活性中心,而是活性中心之外的调节位点。
抑制剂与酶结合后,会改变酶的构象,导致酶对底物的亲和力降低,或者使酶的最大反应速率下降。
无论底物浓度如何增加,都无法完全克服抑制剂的影响。
例如,重金属离子如汞离子、银离子等可以与某些酶活性中心之外的巯基结合,导致酶活性受到抑制。
反竞争性抑制则是抑制剂只与酶底物复合物结合。
这种抑制作用不仅降低了酶对底物的亲和力,还降低了酶的最大反应速率。
原创酶的抑制作用有哪些类型试述酶的抑制剂类型及特点引言酶是生物体内起促进化学反应的重要催化剂,对生物体的正常生理功能具有至关重要的作用。
然而,有时候我们需要抑制酶的活性,例如在医药领域中,抑制某些酶的活性可以用于治疗疾病。
酶的抑制剂通常可分为竞争性抑制剂、非竞争性抑制剂和不可逆抑制剂三类。
本文将依次介绍这三类抑制剂的类型及其特点。
1. 竞争性抑制剂竞争性抑制剂是一类与酶底物争夺结合位点的化合物,其结构与酶底物非常相似。
在酶与竞争性抑制剂共存的条件下,这些抑制剂将竞争性地与酶结合,从而阻止酶与底物结合,并降低酶的催化活性。
竞争性抑制剂的特点包括:•反应可逆性:竞争性抑制剂与酶结合的过程是可逆的,当竞争性抑制剂被移除时,酶的活性可以恢复。
•阈值效应:竞争性抑制剂的抑制效果受到底物浓度的影响。
当底物浓度足够高时,竞争性抑制剂对酶的抑制作用会减弱。
•结构相关性:竞争性抑制剂与底物的结构相似,其与酶的结合位点也类似。
2. 非竞争性抑制剂非竞争性抑制剂是一类直接与酶结合但不与底物结合的化合物。
它们通过改变酶的构象和催化中心的结构,从而抑制酶的活性。
非竞争性抑制剂的特点包括:•反应可逆性:非竞争性抑制剂与酶结合的过程是可逆的。
但与竞争性抑制剂不同的是,非竞争性抑制剂的结合并不受到底物浓度的影响。
•阈值无效性:非竞争性抑制剂对酶的抑制作用不受底物浓度的影响。
即使底物浓度非常高,非竞争性抑制剂仍然能有效地抑制酶的活性。
•结合位点多样性:非竞争性抑制剂可以与酶的不同位点结合,改变酶的构象。
3. 不可逆抑制剂不可逆抑制剂是一类与酶结合后无法解离的化合物,它们通过与酶催化中心发生共价结合,从而永久抑制酶的活性。
不可逆抑制剂的特点包括:•反应不可逆性:不可逆抑制剂与酶结合后无法解离,酶的活性将永久丧失,直到新的酶分子合成。
•反应特异性:不可逆抑制剂通常与酶催化中心的特定部位发生共价结合,从而特异地抑制酶的活性。
•抑制效果持久性:不可逆抑制剂的抑制效果持久,即使不可逆抑制剂被稀释,酶的活性也无法完全回复。
酶的抑制作用分析酶作为生物体内的催化剂,对于维持生命活动的正常进行起着至关重要的作用。
然而,在某些情况下,酶的活性会受到抑制,这种抑制作用可以是可逆的,也可以是不可逆的。
深入理解酶的抑制作用对于生物学、医学、化学等领域都具有重要意义。
酶的抑制作用可以分为不可逆抑制和可逆抑制两大类。
不可逆抑制是指抑制剂与酶的活性中心或活性部位发生共价结合,导致酶永久性地失去活性。
这种抑制作用通常是强烈而持久的,一旦发生,很难通过简单的方法恢复酶的活性。
例如,有机磷农药就是一种常见的不可逆抑制剂。
它们能够与乙酰胆碱酯酶的活性中心结合,使该酶失去分解乙酰胆碱的能力。
乙酰胆碱在体内积累,会导致神经系统功能紊乱,引起中毒症状。
相比之下,可逆抑制则相对温和,并且在一定条件下可以解除抑制,恢复酶的活性。
可逆抑制又可细分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。
竞争性抑制是指抑制剂与底物竞争酶的活性中心。
由于抑制剂和底物在结构上相似,它们都能与酶结合,但抑制剂与酶结合后,酶就无法再与底物结合,从而降低了酶促反应的速率。
举个例子,磺胺类药物就是通过竞争性抑制叶酸合成途径中的关键酶,从而发挥抗菌作用。
叶酸对于细菌的生长和繁殖至关重要,磺胺类药物的竞争抑制能够有效地抑制细菌的代谢过程。
非竞争性抑制则有所不同,抑制剂结合的部位不是酶的活性中心,而是酶的另一个部位。
抑制剂的结合导致酶的构象发生改变,从而降低了酶对底物的催化能力。
例如,某些重金属离子如汞离子、铅离子等,可以与酶分子中的巯基结合,改变酶的构象,引起非竞争性抑制。
反竞争性抑制则是抑制剂仅与酶底物复合物结合,降低了形成产物的量,从而抑制了反应的进行。
酶的抑制作用在生物体内具有重要的调节意义。
例如,在代谢途径中,通过对关键酶的抑制,可以有效地控制代谢的速度和方向,使生物体内的物质和能量代谢保持平衡。
在医学领域,酶的抑制作用也为药物研发提供了重要的思路。
许多药物就是通过抑制特定的酶来发挥治疗作用的。
应用酶的竞争性抑制原理简介在生物化学和药物研究领域,酶的竞争性抑制是一种常见的策略,用于调控酶的活性。
通过使用特定的物质,可以与酶的底物或活性位点竞争结合,从而阻断酶的催化过程。
本文将介绍应用酶的竞争性抑制原理及其在生物科学领域的应用。
竞争性抑制原理竞争性抑制是一种酶抑制的机制,其中一个分子(抑制剂)能够与酶的底物或活性位点竞争结合。
当抑制剂与底物或活性位点竞争结合时,它会占据酶的结合位点,阻止底物结合并干扰酶的催化过程。
这种方式的抑制可以通过调整抑制剂的浓度来控制,因此被称为竞争性抑制。
应用酶的竞争性抑制应用酶的竞争性抑制原理在生物科学研究和药物开发中具有重要意义。
以下是该原理的一些应用:•药物研发:竞争性抑制可以用于酶的底物分子的设计,目的是通过阻断酶的催化过程来抑制特定的生物反应。
例如,抗生素可以通过竞争性抑制靶向特定酶的底物结合位点,从而抑制细菌的生长。
•生物工程:在生物工程中,竞争性抑制原理可以应用于酶的活性调控。
通过引入具有竞争性抑制活性的分子,可以降低酶的活性,从而实现对生化反应的精确控制。
•生物传感器:竞争性抑制也被广泛应用于生物传感器的设计。
通过选择性地引入竞争性抑制剂,可以在生物传感器中实现对特定酶活性的监测和调控。
•酶动力学研究:竞争性抑制常常在酶动力学研究中被用于测定酶的底物亲和力和催化常数。
通过测定在不同底物浓度下的酶活性,可以分析竞争性抑制对酶催化过程的影响,进一步研究酶的特性和功能。
总结应用酶的竞争性抑制原理在生物科学领域具有广泛应用。
竞争性抑制可以用于药物研发、生物工程、生物传感器和酶动力学研究等领域,对于调控酶的活性和生化反应具有重要作用。
通过理解和应用竞争性抑制原理,我们可以进一步探索酶的特性和功能,为生物科学研究和药物开发提供有力支持。