聚山梨酯80检验记录
- 格式:doc
- 大小:60.50 KB
- 文档页数:4

分光光度法检测人纤维蛋白胶制品中聚山梨酯80残留量王艺
【期刊名称】《中国药品标准》
【年(卷),期】2004(5)3
【摘要】目的:建立用分光光度法检测人纤维蛋白胶制品中聚山梨酯80残留量.方法:制品经沉淀蛋白、浓缩、抽提处理后以分光光度仪比色检测.结果:本法操作简便,可靠,不受温度影响.聚山梨酯80在0~100μg/ml浓度范围内线性关系良好,相关系数r=0.9992,平均回收率103. 4%,RSD2.53%(n=6).
【总页数】2页(P29-30)
【作者】王艺
【作者单位】上海新兴医药股份有限公司,200135
【正文语种】中文
【中图分类】R92
【相关文献】
1.一阶导数分光光度法测定白蛋白制品中利凡诺残留量计算方法的改进 [J], 安仕萍;杨玉荣
2.流动注射分光光度法测定鱼肉及其制品中挥发酚残留量 [J], 程银棋;郑欣;柳迪;冯灏;朱影;彭青枝;周陶鸿
3.冻干人纤维蛋白胶制品中磷酸三丁酯残留量的气相色谱法测定 [J], 盛凤仙
4.荧光分光光度法测定白蛋白制品中的利凡诺残留量 [J], 王大杰;焦丽华
5.一阶导数分光光度法测定白蛋白制品中利凡诺残留量 [J], 余蓉;刘文芳
因版权原因,仅展示原文概要,查看原文内容请购买。

供注射用吐温80的质量控制分析供注射用吐温80的质量控制分析审评四部八室陈海峰吐温80,正式品名为聚山梨酯80,为药物制剂中常见的辅料之一。
其化学名称为聚氧乙烯20山梨醇酐单油酸酯,属于亲水型非离子表面活性剂,可用于口服制剂的润滑剂。
由于其具有较好的助溶作用,在制备难溶性药物的注射剂时,常用作助溶剂、乳化剂和稳定剂。
该辅料已收入多国药典,包括中国药典(CP)、欧洲药典(EP)、英国药典(BP)、美国药典(USP)、日本药局方(JP)。
国内目前有多种药物的注射剂中使用该辅料作为助溶剂,涉及化学药品和中药制剂,剂型包括粉针剂、小针和大输液。
该辅料静脉用于人体具有一定的安全性,但在应用该辅料的注射剂的临床中,仍可见一些安全性问题的报道,如过敏、溶血等不良反应,在动物的药理毒理试验中也发现吐温80可能对心血管等系统有一定的影响[1-3],因此应重视该辅料的安全性。
有文献报道,吐温80的纯度与不良反应可能具有一定的关系。
因此在应用该辅料时应注意对注射用聚山梨酯80加强质量控制。
目前,国内的注册申请人使用的吐温80一般符合中国药典的要求,但中国药典标准只是注明为“药用辅料”,并未明确符合该标准的吐温80是否可供注射用。
为此,作者查阅了国内外药典收载的吐温80的质量标准,以分析中国药典标准可否作为供注射用标准。
可见,各国药典对吐温80的控制有所不同,CP和USP基本一致。
各国药典对羟值、皂化值、酸值、重金属、炽灼残渣、水分、粘度、密度等指标规定无大的差别。
但总体而言,EP和BP的控制标准较CP、USP、JP更为严格,主要体现在对以下所含杂质和含量的控制水平:1、BP对二氧六环和环氧乙烷进行了严格控制,EP还较BP增加了2-氯乙醇、乙二醇、二甘醇的控制,这五种杂质均为吐温80合成中使用的环氧乙烷的副产物,很可能残留于终产品中,且上述杂质具有一定的毒性。
EP对这五种杂质的控制可以更好地保证产品的安全性。
2、BP和EP对过氧化值进行了控制,不得过10.0。

目的:制订聚山梨酯80质量标准及内控标准。
适用范围:聚山梨酯80的质量控制。
责任:检验室、生产车间、原辅料仓库及供应部执行本标准,质管部负责监督本标准的执行。
标准内容:1.品名:聚山梨酯802.辅料编号:F113.标准依据:《中华人民共和国药典》2000版二部。
4.法定规格标准本品为聚乙烯20山梨醇酐单油酸酯。
【性状】本品为淡黄色至橙黄色的黏稠液体;微有特臭,味微苦略涩,有温热感。
本品在水、乙醇、甲醇或醋酸乙酯中易溶,在矿物油中极微溶解。
相对密度本品的相对密度(附录VI A韦氏比重秤法)为1.06~1.09。
黏度本品的运动黏度(附录VI G第一法),在25℃时(毛细管内径为3.4~4.2mm)为350~550mm2/s。
酸值取本品10g,精密称定,置250ml锥形瓶中,加中性乙醇(对酚酞指示液显中性)50ml,溶解后,附回流冷凝器煮沸10分钟,放冷,加酚酞指示液5滴,用氢氧化钠定液(0.1mol/L)滴定,酸值(附录VⅡ H)不大于2.2。
皂化值本品的皂化值(附录VⅡ H)为45~60。
羟值本品的羟值(附录VⅡ H)为65~80。
碘值本品的碘值(附录VⅡ H)为18~24。
【鉴别】(1)取本品的水溶液(1→20)5ml,加氢氧化钠试液5ml,煮沸数分钟,放冷,用稀盐酸酸化,显乳白色浑浊。
(2)取本品的溶液(1→20),滴加溴试液,溴试液即褪色。
(3)取本品6ml,加水4ml混匀,呈胶状物。
(4)取本品的溶液(1→20)10ml,加硫氰酸钴铵溶液(取硫氰酸铵17.4g与硝酸2.8g,加水溶解成100ml)5ml,混匀,再加氯仿5ml,振摇混合,静置后,氯仿层显蓝色。
【检查】酸碱度取本品0.50g,加水10ml溶解后,照《PH值测定法标准操作规程》(SOP-QC-083-00)测定,PH值应为5.0~8.0。
颜色取本品10ml,与同体积的对照液(取比色用重铬酸钾液8.0ml与比色用氯化钴液0.8ml,加水至10ml)比较,不得更深。

聚山梨酯80对维生素K1注射液质量的影响摘要目的:考察不同厂家聚山梨酯80对维生素K1注射液质量的影响。
方法:采用气相色谱法测定聚山梨酯80中脂肪酸的含量,并考察使用不同厂家聚山梨酯80制备的维生素K1注射液的稳定性。
结果:聚山梨酯80中油酸含量越高,其他脂肪酸含量越低表明其纯度越高,质量越好,制备的维生素K1注射液产品越稳定。
结论:聚山梨酯80的质量是影响维生素K1注射液质量的重要因素。
ABSTRACT Objective:To evaluate the effect of polysorbate 80 on vitamin K1 injection by comparing the quality of polysorbate 80 from different manufacturers. Methods:The content of fatty acids in polysorbate 80 was determined by gas chromatography and the stability of vitamin K1 injection prepared with polysorbate 80 from different manufacturers was investigated. Results:The higher the oleic acid content in polysorbate 80,the lower the other fatty acid content,the higher is the quality of vitamin K1 injection and furthermore the prepared vitamin K1 product is more stable. Conclusion:Polysorbate 80 is an important factor affecting the quality of vitamin K1 injection.KEY WORDS polysorbate 80;vitamin K1 injection;gas chromatography;fatty acid藥物制剂是由活性成分和辅料组成。


聚山梨酯-80对白色洗剂质量的影响陈建强1林滔2*林葳3(1.福建省莆田市涵江区平民医院莆田351115;2.福建医科大学附属第一医院福州350000;3.福建省漳州市芗城区妇幼保健院漳州363000)摘要:目的:探讨添加聚山梨酯-80对白色洗剂制剂质量的影响。
方法:以白色洗剂的性状、沉降系数和重新分散性为质量评价指标,考察添加聚山梨酯-80对白色洗剂质量的影响。
结果:添加聚山梨酯-80后白色洗剂颜色乳白均匀,外观与未添加的配方无异,但显微图片显示沉淀生成颗粒簇集呈不规则桥连团块,前1h沉降速度相对较快,但3h后沉降体积明显大于未添加的,48h沉降系数为0.584,重新分散平均次数为1.6。
而未添加聚山梨酯-80的白色洗剂48h沉降系数为0.485,重新分散平均次数为4.6。
结论:添加聚山梨酯-80会对白色洗剂质量产生明显影响,能降低药物沉降和重新分散次数,可制得性状符合规定、质量较佳的白色洗剂。
关键词:白色洗剂聚山梨酯-80制剂质量中图分类号:R917文献标识码:A文章编号:1672-8351(2019)04-0004-03Effect of polysorbate-80on the quality of white LotionChen Jianqiang1Lin Tao2*Lin wei3(1.Hanjian g District civilian hospital,Putian City,Fujian province351115;2.The First Affiliated Hospital of Fujian Medical University350000;3.Xiangcheng maternal and child health care hospital,Zhangzhou City,Zhangzhou Province363000)Abstract:Objective:To investigate the effect of polysorbate-80on the quality of white lotion formulations.Methods:The effect of adding polysorbate-80on the quality of white lotion was investigated with the properties of white lotion,sedimentation coefficient and redispersibility as the quality evaluation index.Results:After adding polysorbate-80,the color of the white lotion is even and white. The appearance is the same as that of the formula without polysorbate-80.However,the microscopic images showed irregular bridged clusters of precipitated particles.The sedimentation rate of the first1hour was relatively fast.The sedimentation volume after3hours was yet significantly larger than that without polysorbate-80.The sedimentation coefficient at48hour is0.584and the average number of redistributions is1.6.However,the sedimentation coefficient of white lotion without polysorbate-80is0.485and the average number of redistributions is4.6at48hour.Conclusion:The addition of polysorbate-80has a significant effect on the quality of white lotion. Drug sedimentation and the redispersion time can be reduced.White lotions with specified properties and good quality can be obtained by adding SDS.Key words:White lotion Polysorbate-80Preparation quality白色洗剂(White Lotion)是一种皮肤科临床常用的局部外用混悬型洗剂,亦称含硫钾洗剂,具有抑制皮脂分泌、杀灭疥虫等作用[1]。


药用辅料聚山梨酯80(吐温80)质量状况分析郭志鑫;孙会敏;杨锐;高志峰;王华【摘要】目的考察我国目前药用辅料聚山梨酯80的质量状况.方法通过对全国10家药用辅料聚山梨酯80的抽样、检验和探索性研究,探讨聚山梨酯80质量差异及注射剂中致敏性较强原因.结果对药用辅料聚山梨酯80存在的质量问题提出建议与对策.结论应进一步规范吐温80在注射剂中的使用.%Objective To study the quality state of pharmaceutical Tween 80 in China. Methods Pharmaceutical Tween 80 from 10 factories were sampled and examined . The irregular qualify and sensitization in TCM injection of Tween were discussed. Results Some suggestions and strategies were presented about the quality problem of pharmaceutical Tween 80. Conclusion The use of Tween 80 in injection should be further specificated.【期刊名称】《药学实践杂志》【年(卷),期】2012(030)006【总页数】3页(P459-461)【关键词】药用辅料聚山梨酯80;质量状况;分析;过敏性【作者】郭志鑫;孙会敏;杨锐;高志峰;王华【作者单位】中国食品药品检定研究院,北京100050;中国食品药品检定研究院,北京100050;中国食品药品检定研究院,北京100050;中国食品药品检定研究院,北京100050;沈阳药科大学工商管理学院,辽宁沈阳110016【正文语种】中文【中图分类】R94药品是一种特殊的商品,其药效与质量直接关系到人体健康和安全,药用辅料是药物制剂的基础材料和重要组成部分,是保证药物制剂生产和发展的物质基础,在制剂剂型和生产中起着关键的作用。

基于吸收系数的生脉注射液中聚山梨酯80含量测定新方法聂黎行;常艳;戴忠;马双成【摘要】聚山梨酯80又名吐温80,为一种亲水型非离子表面活性剂,是食品、保健品和药品中常用的辅料,作为增溶剂和澄清剂广泛用于中药注射剂.近年来,不良反应的发生使得聚山梨酯80的质量和应用愈加受到重视,有研究认为其加入可能引起注射剂不良反应增加.为避免超量使用,有必要对该辅料的投料加以严格控制.中药注射剂中聚山梨酯80的含量测定是当下研究的热点和难点,可以通过分光光度法、分子排阻-蒸发光散射检测法(SEC-ELSD)、液质联用法(LC-MS)直接测定,也可以水解后法经液相色谱-紫外检测法(HPLC-UV)或气相色谱法(GC)间接测定.但由于聚山梨酯80为聚氧乙烯聚合数目不同的混合物、不同厂家生产的聚山梨酯80化学组分及比例存在较大差异,难以采用统一的转换公式或对照品准确定量.此外,中药注射剂的复杂基质造成的假阳性干扰也对定量提出了挑战.为解决以上问题,以生脉注射液为例,提出基于吸收系数的中药注射剂中聚山梨酯80含量测定新方法.优化检测波长、显色剂种类、液液萃取过程振荡和静置时间,在6个不同品牌仪器上测得聚山梨酯80-硫氰酸钴配合物的吸收系数(E1%1 cm)为104.23,相对标准偏差(RSD)为2.08%.生脉注射液稀释10倍后,精密量取供试品溶液1.0 mL,精密加入硫氰酸钴溶液10 mL,二氯甲烷20 mL,涡旋振荡3 min.将混合液移至分液漏斗中,静置30 min,取下层二氯甲烷液,将前1 mL弃去,接收约15 mL,在320 nm处测定吸光度,再根据Lambert-Beer定律,利用获得的吸收系数计算得到聚山梨酯80的含量.方法阴性无干扰,精密度和重复性相对标准偏差均低于3%,平均回收率为98.42%.为进一步验证方法的准确性,分别采用吸收系数法和标准曲线法测定了2个厂家的10批生脉注射液,并与实际投料量比较.配对t检验结果表明,当置信度为95%时,两种方法无显著性差异,吸收系数法测得结果与企业生产中聚山梨酯的实际投料量也无显著性差异.研究采用前人未采用的、灵敏度更高的320 nm为检测波长,显著降低了基质干扰,克服了中药注射剂中聚山梨酯80测定结果与实际投料量难以吻合的问题.吸收系数法无需使用对照品,亦不用制备标准曲线,可为中药注射剂中聚山梨酯80的检查标准提供切实可行的解决方案.所建方法灵敏、准确、快速、简便,为含聚山梨酯80制剂的质量控制提供了关键常数及新的思路.【期刊名称】《光谱学与光谱分析》【年(卷),期】2019(039)001【总页数】5页(P199-203)【关键词】聚山梨酯80;生脉注射液;吸收系数;硫氰酸钴;含量测定【作者】聂黎行;常艳;戴忠;马双成【作者单位】中国食品药品检定研究院 ,北京 100050;中国食品药品检定研究院 ,北京 100050;中国食品药品检定研究院 ,北京 100050;中国食品药品检定研究院 ,北京 100050【正文语种】中文【中图分类】R284.1引言聚山梨酯80(polysorbate 80)又名吐温80(tween-80),作为增溶剂、乳化剂、稳定剂或润滑剂用于药品制剂过程[1-5],为提高澄明度和稳定性,其在中药注射剂中的应用尤为广泛。

中药注射剂中添加聚山梨酯80的快速检测董媛;张赟华;刘莹莹;李忠琼;张雯洁【期刊名称】《西北药学杂志》【年(卷),期】2010(025)004【摘要】目的建立中药注射剂中添加聚山梨酯80的快速检测方法 ,并做了方法学验证.方法采用化学反应,快速、简便地检测出处方中未标示而添加的聚山梨酯80.结果测定了血塞通注射液247批次和灯盏花素注射液141批次,其中6批标示添加了聚山梨酯80和4批未标示添加了聚山梨酯80的灯盏花素注射液样品检测结果为阳性,经HPLC验证确实存在并测出其含量.结论该研究为中药注射剂中添加聚山梨酯80的快速检测提供了思路与方法 .【总页数】2页(P248-249)【作者】董媛;张赟华;刘莹莹;李忠琼;张雯洁【作者单位】云南省食品药品检验所,云南,昆明,650011;云南省食品药品检验所,云南,昆明,650011;云南省食品药品检验所,云南,昆明,650011;云南省食品药品检验所,云南,昆明,650011;云南省食品药品检验所,云南,昆明,650011【正文语种】中文【中图分类】R927.2【相关文献】1.聚山梨酯80对药典方法检查中药注射剂蛋白的影响 [J], 祖金玥;冯孟鑫;王小红;李莉;徐文英;马长华2.卤肉制品中食品添加剂及非食品原料添加物快速检测体系的研究 [J], 汤明河3.聚山梨酯80在中药注射剂中的应用现状 [J], 李文龙4.高效液相色谱-三重四极杆复合离子阱质谱法快速检测保健食品中30种缓解疲劳、改善睡眠类违禁添加药物 [J], 甘凝岚;孙春华;周玮;刘长宇5.胶体金快速检测技术在中兽药散剂中违法添加化学药物检测的应用 [J], 赵兴鑫;田梅;何立宁;苏青;张云霄;杨晓霞因版权原因,仅展示原文概要,查看原文内容请购买。
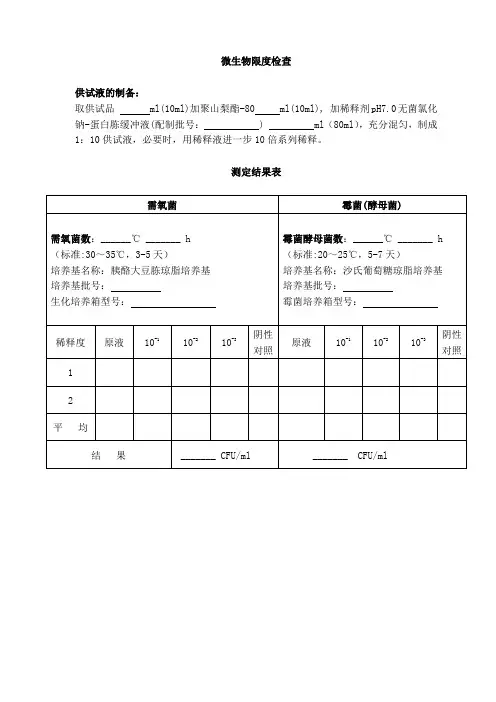
××××××××有限公司培养基适用性检查记录第1页 培养基名称 胰酪大豆胨琼脂培养基 批号规 格 有效期生产单位 检验日期配制批号 报告日期检查依据一、对照培养基规格: 批号: 生产单位:二、试验菌种金黄色葡萄球菌〔CMCC(B)26 003〕代次:批号/编号:铜绿假单胞菌〔CMCC(B)10 104〕代次:批号/编号:枯草芽孢杆菌〔CMCC(B)63 501〕代次:批号/编号:白色念珠菌〔CMCC(F)98 001〕代次:批号/编号:黑曲霉〔CMCC(F)98 003〕代次:批号/编号:三、试验仪器×××生化培养箱,编号:×××、××××××四、菌液的制备将金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌分别接种于胰酪大豆胨液体培养基中,30~35℃培养18~24小时; 将白色念珠菌接种于沙氏葡萄糖液体培养基中,20~25℃培养2~3天;将黑曲霉接种于沙氏葡萄糖琼脂培养基中,20~25℃培养5~7天(至获得丰富的孢子)。
取上述新鲜培养物,用pH7.0无菌氯化钠-蛋白胨缓冲液制成适宜浓度的菌悬液;取黑曲霉的新鲜培养物加入3~5ml含0.05%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液,将孢子洗脱。
然后吸出孢子悬液至无菌试管内,用含0.05%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液制成适宜浓度的黑曲霉孢子悬液。
试验中各菌液的浓度:菌悬液 浓度 菌悬液 浓度 金黄色葡萄球菌白色念珠菌铜绿假单胞菌黑曲霉枯草芽孢杆菌五、阴性对照×××××××有限公司·培养基适用性检查记录- 2 -接种1ml pH7.0无菌氯化钠-蛋白胨缓冲液至胰酪大豆胨琼脂培养基平板,置30~35℃培养,培养时间不超过3天。
南京圣和药业试验文件编号:三种方法测定消癌平注射液中吐温80含量的试验方案起草人: 日期年月日审核人:日期年月日批准人:日期年月日目录一、试验背景 (1)二、试验依据 (1)三、试验设计及组织 (1)四、试验参加人员及职责 (1)五、试验目的 (1)六、试验内容 (1)1. 试验用材料 (1)2. 试验仪器及设备 (1)3. 试验过程 (2)七、试验结果 (2)一、试验背景:消癌平注射液是一种广谱抗癌药物,不论是单独用于抗癌治疗还是联合放化疗都有较好的疗效,其处方是通关藤浸膏和吐温80,其中通关藤浸膏是主药,吐温80为药用辅料,做增溶剂用,能够改善注射剂的澄明度,有文献记载中药注射液中吐温80的用量一般为0.02%~2%,本品不能盲目使用,高纯度的吐温80近无色,但一般市售的多为浅黄色,其间含有较多杂质,医学界证实,含吐温80的注射剂可能会引起过敏反应,有研究表明这些不良反应并非吐温80造成,而是吐温80中的杂质造成的,所以其杂质不彻底去除,单靠增加用量难以达到药用目的,不仅起不到很好的增溶效果,甚至会影响药物的吸收。
其次吐温80因加热及贮藏会造成PH值下降,可使溶液变浊,起不到很好的增溶效果,这就要求我们要对吐温80的质量探究,以明确其用量,本实验首先建立消癌平注射液中吐温80含量的测定方法。
二、试验依据:根据查阅有关文献,目前有三种方法来测定消癌平注射液中吐温80的含量,分别是用液相和比色法,其中液相测定方法包括两种子方法。
三、试验设计及组织:1.本次试验选取三批消癌平注射液(加入已知量的吐温80),利用三种方法测定注射液中吐温80的含量,测出的含量与已知加入量做对比,筛选出专属性强、准确度高的试验方案。
2.根据1中筛选出的方法,建立消癌平注射液中吐温80含量测定的标准方案。
四、试验参加人员及职责:1.消癌平攻关项目组分析人员负责试验方案及报告的起草工作。
2.消癌平攻关项目组分析负责人负责试验方案及报告的审核、检验和监督等工作。
第一页
【依据】中华人民共和国药典(年版二部)。
【性状】本品为。
结论:
相对密度仪器:韦氏比重秤
照相对密度测定法第一法韦氏比重法测定。
测定温度:水密度:
同温度测定供试品水校准时游码读数:
供试品相对密度:
(规定:相对密度为1.06~1.09)结论:
黏度照黏度测定法第一法。
取毛细管内径为3.4~4.2mm的平氏黏度计1支,在支管F 上连接一橡皮管,用手指堵住管口2,倒置黏度计,将管口1插入供试品中,自橡
皮管的另一端抽气,使供试品充满球C与A并达到测定线m2处,提出黏度计并迅
速倒转,抹去黏附于管外的供试品,取下橡皮管使连接于管口1上,将黏度计垂直
固定于恒温水浴中,并使水浴的液面高于球C的中部,放置15分钟后,自橡皮管
的另一端抽气,使供度品充满球A并超过测定线m1开放橡皮管口,使供试品在管内
自然下落,用秒表准确记录液面自测定线m1下降至测定线m2处的流出时间。
依法重
复测定3次以上,每次测定值与平均值的差值不得超过平均值的±5%。
另取一份供
试品同样操作,并重复测定3次以上。
以先后两次取样测得的总平均值按下式计
算,即为供试品的运动黏度或供试溶液的动力黏度。
平氏黏度计内径为4mm,K= mm2/s2
温度:25 ℃
流出时间(t): 1 2 3 平均
⑴s
⑵s
两份平均:(+ )÷2 =
计算:运动粘度(mm2/s) = Kt =
(规定:本品的运动黏度在25℃时为350~550mm2/s)结论:
酸值精密取本品 g,置250ml锥形瓶中,加中性乙醇(对酚酞指标液显中性)
50ml,溶解后,附回流冷凝器煮沸腾10 分钟,放冷,加酚酞指标液5滴,用氢氧化钠滴定液(0.1mol/L)滴定,消耗氢氧化钠滴定液(0.1mol/L)的毫升数: ml;
供试品酸值=5.61V/ W=
(规定:酸值不大于2.2)结论:
检验员:复核员:年月日
第二页
皂化值精密称取本品 g,置250ml锥形瓶中,精密加入乙醇制氢氧化钾滴定液(
0.5mol/L)25ml,加热加流30分钟,然后用乙醇10ml冲洗冷凝器的内壁和塞的下
部,加酚酞指示液1.0ml,用盐酸滴定液(0.5 mol/L)滴定剩余的氢氧化钾,至溶
液的粉红色刚好褪去,加热至沸,如溶液又出现粉红色,再滴定至粉红色刚去褪
去;同时做空白试验。
以供试品消耗的盐酸定液(0.5 mol/L)的容积(ml)为A,
空白试验消耗的容积(ml)为B,供试品的重量(g)为G,照下式计算皂化值:
消耗盐酸滴定液(0.5mol/L)的毫升数:空白: ml; A: ml;B: ml;
计算:
(规定:皂化值为45~60)结论:
羟值精密称取供试品 g,置干燥的250ml具塞锥形中,精密加入酰化剂(取对甲苯磺酸14.4g,置500ml锥形瓶中,加醋酸乙酯360ml,振摇溶解后,缓缓加入醋酐
120ml,摇匀,放置3日后备用)5ml,用吡啶少许湿润瓶塞,稍拧紧,轻轻摇动使完全溶解,置50℃0C±1℃水浴中25分钟(每10分钟轻轻振动)后,放冷,加
吡啶一水(3∶5)20ml,5分钟后加甲酚红-麝香草酚蓝混合指示液8~10滴,用氢
氧化钠滴定液(1mol/L)滴定至溶液显灰蓝色或蓝色,同时做空白试验。
以供试品
消耗的氢氧化钠滴定液(1 mol/L)的容积(ml)为A,空白试验消耗的容积(ml)为
B,供试品的重量(g)为G,供试品的酸值为D,照下式计算羟值:
消耗盐酸滴定液(0.5mol/L)的毫升数:空白: ml; A: ml;B: ml;
(规定:本品的羟值应为65~80)结论:
碘值精密称取供试品 g,置250ml的干燥碘瓶中,加氯仿10ml,溶解后,精密加入溴化碘溶液25ml,密塞,摇匀,在暗处放置30分钟。
加入新制的碘化钾试液
10ml与水100ml,摇匀,用硫代硫酸钠滴定液(0.1mol/L)滴定剩余的碘,滴定时注意充分振摇,待混合液的棕色变为淡黄色,加淀粉指示液1ml,继续滴定至蓝色消
失;同时做空白试验。
供试品消耗硫化硫酸钠滴定液(0.1mol/L)的容积:A:ml;
空白试验消耗的容积:B:ml。
(规定:本品的碘值应为18~24)结论:
【鉴别】⑴取本品的水溶液(1→20)5ml加氢氧化钠试液5ml,煮沸数分钟,放冷,
第三页
用稀盐酸酸化,。
(规定:应显乳白色浑浊)结论:
⑵取本品的水溶液(1→20),滴加溴试液,。
(规定:溴试液应即褪色)结论:
⑶取本品6ml,加水4ml,混匀,。
(规定:应呈胶状物)结论:
⑷取本品的溶液(1→20)10ml,加硫氰酸钴铵溶液(取硫氰酸铵17.4g与硝酸钴
加水溶解成100ml)5ml,混匀,再加氯仿5ml,振摇混合,静置后,。
(规定:氯仿层应显蓝色)结论:
【检查】室温:相对湿度:
酸碱度仪器:
定位用标准缓冲液:磷酸盐标准缓冲液(pH7.43 20℃
校准用标准缓冲液:邻苯二甲酸氢钾标准缓冲液(pH4.00 20℃)
硼砂标准缓冲液(pH9.23 20℃)
取本品 g,加水10ml溶解后,依法检查,
pH值:;,平均:
(规定:pH值应为5.0~8.0)结论:
颜色取本品10ml,与同体积的对照液(取比色用重铬酸钾液8.0ml与比色用氯化钻液
0.8ml,加水至10ml)比较,。
(规定:不得更深)结论:
冻结试验取本品,置玻璃容器内,于5℃±2℃放置24小时,。
(规定:不得冻结)结论:
水分照水分测定法第一法A。
取本品⑴ g,⑵ g,加吡啶溶解,依法测定,空白:ml;⑴ml;⑵ml;
计算:
平均:% (规定:含水分不得过3.0%)结论:
炽灼残渣仪器:
第四页
在500~600℃空坩埚恒重:①g / g ;②g / g
精密称取样品:①样+坩埚:②样+坩埚:
-坩埚:-坩埚:
依炽灼残渣检查法将供试品炭化后,置500~600℃灰化30分钟后,降温至300℃后
取出放置干燥器中放置30分钟使至室温,称定重量,再重复灰化直至恒重:
①g / g ;②g / g
减失重量:
平均:%(规定:遗留残渣不得过0.2%)结论:
重金属照重金属检查法第二法。
取炽灼残渣项下遗留的残渣,加硝酸0.5ml,蒸干,至氧化氮蒸气除尽后,放冷,加盐酸2ml,置水浴上蒸干后加水15ml,滴加氨试液至对酚
酞指示液显中性,再加醋酸盐缓冲液(pH3.5)2ml,微热溶解后,移置纳氏比色管
中,加水稀释成25ml,另取配制供试液的试剂,置瓷皿中蒸干后,加醋酸盐缓冲液
(pH3.5)2ml与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液2ml,再
用水稀释成25ml,放置2分钟同置白色纸上,自上向下透
视,。
(规定:≤0.001%)结论:
【微生物限度检查】按《微生物限度检查法操作规程》检查,结论:。