山东省青州一中高三化学一轮复习课件(鲁科版)第4章 第1讲 钠及其化合物
- 格式:ppt
- 大小:1.92 MB
- 文档页数:71

第1讲钠及其化合物基础热身1.下列关于化学学习和研究的说法错误的是( )A.化学模型有助于解释一些化学现象B.质量守恒定律是大量实验事实的总结C.化学家提出的假设都能被实验证实D.化学基本原理的应用是有一定条件的2.钠与水反应时的现象与钠的下列性质无关的是( )A.钠的熔点低B.钠的密度小C.钠的硬度小D.钠有强还原性3.在庆祝中华人民共和国成立60周年的晚会上,焰火贯穿了晚会的始终,成为最吸引“眼球”的晚会印象。
焰火与高中化学中“焰色反应”知识相关,下列说法中正确的是( )A.非金属单质燃烧时火焰均为无色B.所有金属及其化合物灼烧时火焰均有颜色C.焰色反应均应透过蓝色钴玻璃观察D.NaCl与Na2CO3灼烧时火焰颜色相同4.潜艇上的核反应堆内使用了液体铝钠合金作载热介质,大大提高了热能的传递和转化效率。
下列有关说法不正确的是( )A.原子半径:Na>AlB.将铝钠合金投入一定量的水中若无固体残留,则n(Al)≤n(Na)C.铝钠合金投入足量氯化铜溶液中,肯定有氢氧化铜沉淀生成,也可能有铜析出D.m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小5.根据下列实验内容得出的结论不正确的是( )能力提升6.16.8 g NaHCO3和7.8 g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500 ℃。
最后容器内的物质是( )A.Na2CO3、Na2O2和O2B.Na2CO3、O2和H2O(g)C.Na2CO3、CO2、O2和H2O(g)D.NaHCO3、Na2CO3和O27.[2020·南江模拟] 表面已被氧化的金属钠的质量为10.8 g,投入水中完全反应后,收集到H2的质量为0.2 g,则被氧化的钠的质量为( ) A.9.2 g B.7.8 gC.4.6 g D.2.3 g8.[2020·南昌调研] Na 3N 和NaH 都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )A .两种物质的阴离子半径都比阳离子半径小B .与水反应时,水都做氧化剂C .与盐酸反应都只生成一种盐D .溶于水,所得溶液都能使无色酚酞变红9.[2020·南昌调研] 下列各组物质混合后,不能同时产生无色气体和白色沉淀的是( )A .少量过氧化钠投入AlCl 3溶液B .Ba(OH)2溶液与(NH 4)2SO 4C .FeCl 3溶液与NaHCO 3溶液混合加热D .明矾溶液与小苏打溶液混合10.[2020·济宁期末] 已知A 、B 为单质,C 为化合物。




2018版高考化学一轮总复习第1章认识化学科学第1节钠及其化合物检测鲁科版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018版高考化学一轮总复习第1章认识化学科学第1节钠及其化合物检测鲁科版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018版高考化学一轮总复习第1章认识化学科学第1节钠及其化合物检测鲁科版的全部内容。
第1章认识化学科学第1节钠及其化合物[基础知识自查]1.钠的性质(1)物理性质:ρ=0。
97 g/cm3,比水的密度小、比煤油的密度大,质软,熔点为97.81 ℃,沸点为882。
9 ℃。
(2)化学性质(写出化学方程式)①与非金属反应错误!②与H2O反应:2Na+2H2O===2NaOH+H2↑。
③与乙醇反应:2Na+2C2H5OH―→2C2H5ONa+H2↑.④与酸(HCl)反应:2Na+2HCl===2NaCl+H2↑。
⑤与盐(CuSO4)溶液反应:2Na+2H2O===2NaOH+H2↑,CuSO4+2NaOH===Cu(OH)2↓+Na2SO4。
2.钠的保存与用途(1)保存:少量钠保存在煤油或石蜡油中.(2)用途:制Na2O2,Na-K合金可用于原子反应堆的导热剂,制高压钠灯,冶炼某些金属如4Na+TiCl4错误!4NaCl+Ti(g)。
3.Na与H2O(含酚酞)的实验探究4.焰色反应定义很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫作焰色反应,属于元素的物理性质火焰颜色Na:黄色,K:紫色(观察时要透过蓝色钴玻璃)1.判断正误(1)金属钠着火时,应使用泡沫灭火器灭火。
( )(2)钠在空气中燃烧可生成多种氧化物,23 g钠充分燃烧时转移电子数为N A。
第1讲钠及其化合物【2021·备考】最新考纲素养落地1.了解钠及其化合物在生产生活中的应用。
2.了解钠及其重要化合物的主要性质及其应用。
结合钠的原子结构认识钠的性质,理解“结构决定性质”的内涵;了解钠及其化合物在生产、生活中的应用,树立化学服务于社会的责任心与使命感。
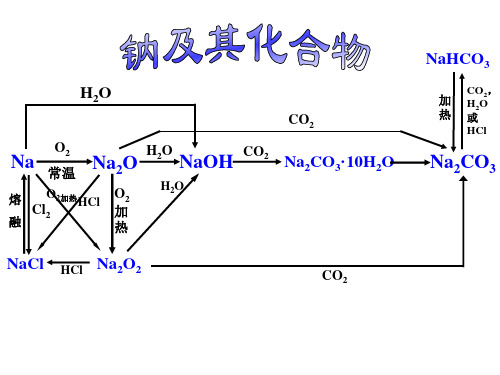
考点一钠的性质及应用『知识梳理』1.钠的物理性质(金属的)通性个性颜色导电性、导热性熔点硬度密度银白色良好小于100 ℃质地柔软ρ(水)>ρ(钠)>ρ(煤油)2.钠的化学性质从原子结构认识钠的化学性质:Na――→O2、Cl2、H2O、H+等Na+⇒还原性(1)与非金属单质反应O2⎩⎨⎧常温:4Na+O2===2Na2O(白色)加热:2Na+O2=====△Na2O2(淡黄色)Cl2:2Na+Cl2=====点燃2NaCl(黄色火焰,白烟)S:2Na+S===Na2S(研磨爆炸)(2)与水反应①离子方程式:2Na+2H2O===2Na++2OH-+H2↑。
②钠与水(含酚酞)反应的实验现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
(4)钠与盐反应 ①钠与盐溶液反应Na ――→水NaOH ――→盐溶液发生复分解反应如Na 投入CuSO 4溶液中,反应的离子方程式为2Na +2H 2O +Cu 2+===2Na ++Cu(OH)2↓+H 2↑。
②钠与熔融盐反应: 4Na +TiCl 4=====熔融Ti +4NaCl 3.钠的制取及保存4.钠的用途[链接新教材]①(新教材LK 第一册P 194习题精选练)金属钠和氯气的用途都非常广泛。
根据金属钠和氯气的性质完成下列各题。
(1)将金属钠放入CuSO 4溶液中会产生蓝色沉淀,请解释这一现象:_____________________________________________________________________ ____________________________________________________________________。