植酸酶活性测定
- 格式:docx
- 大小:23.53 KB
- 文档页数:4

饲用植酸酶活性的测定分光光度法1范围本标准规定了以分光光度法测定饲用植酸酶活性的方法。
本标准适用于作饲料添加剂用的植酸酶产品,也适用于添加有植酸酶的配合饲料、浓缩饲料和添加剂预混合饲料。
样品最低检出量为90U/kg。
2 引用标准下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。
本标准出版时,所示版本均为有效。
所有标准都会被修订,使用本标准的各方应探讨使用下列标准的最新版本的可能性。
GB/T 6682—1992 分析实验室用水规格和试验方法(neq ISO 3696:1987)3 植酸酶活性单位定义样品在植酸钠浓度为5.0 mmol/L、温度37℃、PH值5.00的条件下,每分钟从植酸钠中释放1μmol无机磷,即为一个植酸酶活性单位,以U表示。
4 方法原理植酸酶在一定温度和pH条件下,水解底物植酸钠,生成正磷酸和肌醇衍生物,在酸性溶液中,用钒钼酸铵处理会生成黄色的[(NH4)3PO4NH4VO3·16MoO3]复合物,在波长415nm 下进行比色测定。
5 试剂和溶液本标准中所用试剂,在没有注明其他要求时,均指分析纯试剂和符合GB/T 6682中规定的三级水。
清洗试验用容器不要用含磷清洗剂。
5.1 0.25mol/L 乙酸缓冲液(I)称取34.02g三水乙酸钠于1000mL容量瓶中,加入900mL水溶解,用冰醋酸调节pH至5.00±0.01,并用蒸馏水定容至1000mL,室温下存放2个月有效。
5.2 0.25mol/L乙酸缓冲液(Ⅱ)称取34.02g三水乙酸钠,0.5g TritonX-100,0.5g牛血清白蛋白(BSA)于1000mL容量瓶中,加入900mL水溶解,用冰醋酸调节pH至5.00±0.01,并用蒸馏水定容至1000mL,室温下存放2个月有效。
5.3 7.5mmol/L植酸钠溶液 c(C6H6O24P6Na12)为7.5mmol/L称取0.6929g肌醇六磷酸钠(C6H6O24P6Na12)于100mL。

植酸酶活性测定植酸(Phyticacid).其化学名称为六磷酸肌醇,由1分子肌醇和6分于鳞酸结合而成,分子式是C6H18O24P6,通式为C6H6[OPO(OH)2]6,分子660.8。
植酸及植酸盐中的磷即为植酸磷,植酸广泛存在于谷物籽实和油料作物种子。
植酸酶(phytases)能将磷酸残基从植酸上水解下来,因此破坏了植酸对矿物元素强烈的亲和力,所以说植酸酶能增加矿物元素的营养效价,而且由于释放出的Ca2÷可参加交联或其他反应中去,从而改变了植物性食品的质地。
植酸酶一般只适于在单胃动物中使用。
反刍动物由于瘤胃微生物能合成植酸酶,因此在饲料中一般不需要使用植酸酶。
植物体中的植酸一般不以游离形式存在,而是与钙、镁、钠、钾等结合形成复合盐,植酸盐在多数植物中以植酸钙镁复盐的形式存在,但大麦中主要是植酸钾镁复盐,小麦中主要是植酸铁。
饲料中的无机磷可直接为肠道所吸收,而有机磷则需要先经酶的作用水解为无机磷,然后方能为肠道吸收。
单胃动物消化道中无分解植酸的植酸酶,故对植酸磷的利用率很低。
植酸的抗营养作用不仅表现在植酸磷的低利用率上,还通过整合或络合作用影响其它矿物元素如铁、锌、铜、钙以及蛋白质的可消化性,并抑制淀粉酶、胰蛋白酶、胄蛋白酶的活性。
测定原理植酸酶可以水解植酸钠释放出无机磷,通过加入锐铝酸核显色/终止液使水解反应停止,同时与水解释放出的无机磷产生颜色反应,形成黄色的帆铝磷络合物(NHQPO4NH4VO3-16M O O3;,在415nm波长下测定磷的含量,以标准磷溶液为参照,计算酶活。
植酸酶的含量以酶活性单位表示。
1植酸酶单位定义为:在37℃、pH5.5的条件下,1分钟内从0.005ImOI1的植酸钠溶液中释放出1微摩尔(UmoD无机磷所需要的植酸酶量。
操作步骤样品准备样品粉碎过后过60目筛。
称取2.0g左右粉碎样品,放入4个IOom1烧杯中(每种样品4个重复)。
加入50m1浓度为0.25m1、PH为5.50、在冰箱中冷却的乙酸缓冲液并用磁力搅拌器搅动60分钟,使酶蛋白充分溶出,制成一个悬浮液。


科技信息植酸酶是催化植酸及植酸盐水解成肌醇与磷酸的一类酶的总称 [1]。
植酸酶是一种胞外酶 [2], 广泛存在于自然界中, 植物、动物、微生物均可产生植酸酶。
植酸酶的活性因来源不同而有差异。
植酸酶能将肌醇六磷酸 (植酸分解成为肌醇和磷酸。
植酸酶可以专一性地水解植酸中的磷酯键, 使磷酸游离出来, 植酸酶将植酸分子上的磷酸基团逐个切下, 形成中间产物肌醇五磷酸、肌醇四磷酸、肌醇三磷酸、肌醇二磷酸、肌醇一磷酸、终产物为肌醇和磷酸 [3]。
植酸酶的作用机理见图 1。
图 1植酸酶的作用机理1. 植酸酶酶活力测定的意义酶活力也称酶活性, 是指酶催化一定化学反应的能力, 用在一定条件下, 酶所催化某一反应的速率表示。
酶活性是研究酶的特性, 分离纯化以及酶制剂生产和应用时的一项不可缺少的指标。
酶活力单位是以酶活力为根据而定义的。
国际生化协会酶委员会规定, 1min 内将1μmol 的底物转化为产物的酶量定为 1个单位,称为标准单位, 同时规定了酶作用的条件。
因标准单位在实际应用时不够方便, 故在生产上往往根据不同的酶, 制定各自不同的酶活力单位。
在测定酶活力时, 对反应温度、 pH 、底物浓度、作用时间都有统一规定, 以便同类产品互相比较。
但是酶活力单位并不能直接反映酶的绝对数量, 只不过是一种相对比较的依据 [4]。
植酸酶活性的定义为:在最适宜条件下, 每分钟从一定浓度的植酸钠溶液中释放1μmol 的无机磷所需要的酶量为一个酶活力单位。
确定植酸酶的酶活, 可以提高实验的标准性和效率。
2. 植酸酶活力测定的原理及方法酶活力测定的原理都是利用酶水解植酸钠形成无机磷,然后测定无机磷的释放量。
植酸酶活性的测定方法较多 , 但至今尚没有被世界普遍公认的植酸酶的定量分析方法。
方法包括:钒 -钼酸铵法、硫酸亚铁 -钼蓝法、 Vc-钼蓝法、丙酮 -磷钼酸铵法、微板法和微量比色法等 [5]。
可根据实验需要选择不同的方法。
2.1钒 -钼酸铵法该方法是利用植酸酶可以水解植酸磷释放出无机磷的原理。

饲料中植酸酶活性检测方法的比较与研究植酸酶是催化植酸及其盐类水解为肌醇与磷酸(盐)的一类酶的总称,属磷酸单酯水解酶。
植酸酶具有特殊的空间结构,能够依次分离植酸分子中的磷,将植酸(盐)降解为肌醇和无机磷,同时释放出与植酸(盐)结合的其它营养物质。
由于植酸酶可将底物植酸钠水解,生成正磷酸和肌醇衍生物,并在酸性溶液中与钒钼酸铵生成黄色的复合物,因此,在波长 415 nm 下进行比色,可测定植酸酶活性。
目前已形成国标GB/T 18634—2009《饲用植酸酶活性的测定分光光度法》。
但是,饲料中植酸酶活性的测定却存在以下问题:①由于植酸酶在饲料中的添加量较低,现有方法不能将饲料中的植酸酶完全浸提出来;②饲料中存在大量物质可在酸性条件下与钒钼酸铵发生显色反应,干扰 415 nm 波长下的比色反应,从而影响酶活测定。
本实验旨在研究现有饲料中植酸酶测定方法的优势与缺陷,并寻找有效的检测途径。
1 材料与方法1.1 主要试剂与仪器1.1.1 仪器分析天平;恒温水浴锅;分光光度计;磁力搅拌器;涡流式混合器;酸度计;离心机:转速为4 000 r/min以上;超声波溶解器;回旋式振荡器;透析袋(截留分子量 1 万、10 万和 30~100 万);超滤离心柱(YM-30,密理博公司生产)。
1.1.2 试剂植酸酶:市售商品,酶活 5 000 U/g,酶活定义参照GB-T 18634—2009。
饲料:市售商品蛋鸡料,原配方中不含植酸酶。
磷酸二氢钾(KH2PO4)基准物。
乙酸缓冲液(1),c (CH3COONa) =0.25 mol/l:称取20.52 g 无水乙酸钠于 1 000 ml 烧杯中,加入 900 ml水搅拌溶解,用冰乙酸调节pH 值至(5.50±0.01),再转移至 1 000 ml 容量瓶中,并用蒸馏水定容至刻度;室温下存放 2 个月内有效。
乙酸缓冲液(2),c(CHCOONa) =0.25 mol/l:称取20.52 g 无水乙酸钠,0.5 g 曲拉通 X-100 (Triton X- 100),0.5 g 牛血清白蛋白(BSA)于 1 000 ml 烧杯中,加入900 ml 水搅拌溶解,用冰乙酸调节 pH 值至(5.50±0.01),再转移至 1 000 ml 容量瓶中,并用蒸馏水定容至刻度;室温下存放 2 个月内有效。
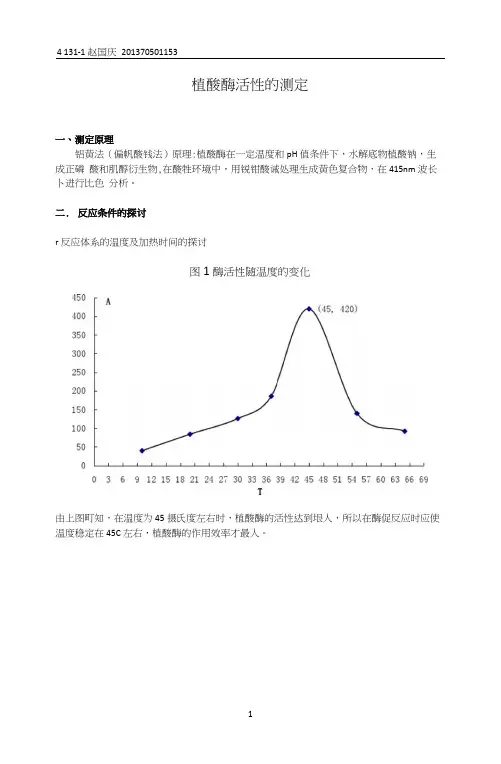
植酸酶活性的测定一、测定原理铝黄法(偏帆酸钱法)原理:植酸酶在一定温度和pH值条件下,水解底物植酸钠,生成正磷酸和肌醇衍生物,在酸牲环境中,用锐钳酸诫处理生成黄色复合物,在415nm波长卜进行比色分析。
二.反应条件的探讨r反应体系的温度及加热时间的探讨图1酶活性随温度的变化由上图町知,在温度为45摄氏度左右时,植酸酶的活性达到垠人,所以在酶促反应时应使温度稳定在45C左右,植酸酶的作用效率才最人。
2酶活性随pH变化pH由匕图可知,在PH为5左右时,植酸酶的活性达到最人,所以植酸酶缓冲液提供的的PH 环境应在5左右3、不同的离子及离子浓度对植酸稱活性的影响图3离子对酶活性的影响由上图町知,Ca离子和Na离子对酶的活性影响最小.Zn离子利Cu离子对酶的活•性抑制影响较大。
图4离子浓度对酶的影响Con圆点系列表示Cu"浓度对酶的活性的影响,随着浓度增加,酶的活性增加: 三角形系列表示Zn 2*浓度对酶活性的影响,随着Zn"浓度增加,酚的活性増加。
4、不同反应体系条件对植酸酶活性测定影响不同温度和PH 下的酶比活性变化3.64.2 55.86.87.2PH图5所示为正交实验时,不同温度和pH 的组介的条件下测得的植酸酚的比活性,在pH 为 5,温度在45C 左右时植酸酶活性达到最大。
酶比活性5.酶促反应时间的确定0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.537rhr由上图町知,在05h以前,酶作用底物的速度呈直线关系.所以测定时反应的时间应该在30mm左右。
斜率=0.854523227相关性=0.997923599碱距=3.383740831根据上图町求得[S m]=2.53mmol/L7.酶的稳定性图8酶的稳定性time 由图町得,酶活性随时间而降低,故酚样品溶液需要现配现用三、实验步骤1、标准曲线的制作准确称取0.680g在105-C烘至恒朿的基准磷酸二氢钾()于100ml容最瓶中,用乙酸缓冲液溶解,并定容至刻度,浓度为50.0mmol/L按卜表的比例用乙酸缓冲液稀释成不同的浓度,与待测样-•起反应测定。

植酸酶活性的测定——钼蓝法1 原理针对预混料复杂的物料体系,用不同的缓冲液对其进行抽提,最大限度的减少饲料中无机磷,微量元素,多维及其他成分对植酸酶测定的影响,用钼蓝法对抽提液中植酸酶活性进行定量。
植酸酶在一定温度和pH条件下,水解底物植酸钠生成正磷酸和肌醇衍生物,在酸性环境中与钼酸铵显色剂反应生成蓝色的(Mo2O3•MoO3)复合物,在波长700nm下比色测定。
酶活力单位定义:在37℃、pH5.0条件下,每分钟从5.0mM植酸钠溶液中释放出1微摩尔的无机磷定义为1个酶活力单位(U)2 试剂本规定中所用试剂,在没有注明其它要求时,均指分析纯试剂;所用溶剂和水无注明时,均指蒸馏水。
清洗实验用容器不要用含磷清洗剂。
2.1 乙酸缓冲液A(0.25mol/L):称取14.355g无水乙酸钠,加入0.5gTriton X-100和0.5g牛血清白蛋白,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.2乙酸缓冲液B(0.25mol/L):称取14.355g无水乙酸钠,加入1.0g吐温-20和30gEDTA,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.3 植酸钠溶液(6.25mmol/L):称取577.4mg肌醇六磷酸钠,加入574.2mg无水乙酸钠,90ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至100ml,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
2.4 终止液:5%三氯乙酸(5%TCA)。
2.5 1.5%钼酸铵(试剂A):7.5g钼酸铵溶于400ml水中,慢慢加入22ml浓硫酸,水定容到500ml,冰箱储存,有效期1个月。
2.6 2.7%硫酸亚铁(试剂B):冰箱储存,有效期1个月。
2.7 显色剂:移取4份试剂A(2.5),1份试剂B(2.6)混合后使用,现用现配。
2.8 磷酸二氢钾:称量前于烘箱中烘至恒重,用乙酸缓冲液(2.2)配制50mmol/L标准液,再用50mmol/L 配制成4.0mmol/L磷酸二氢钾,溶剂为乙酸缓冲液(2.2),冰箱储存。

植酸酶活性测定的影响因素北京昕大洋科技发展有限公司周良娟现在,使用植酸酶的厂家越来越多,但一些使用厂家在测定含量时,容易出现测定偏差大,平行样间变异大的情况,这与植酸酶测定步骤繁多,测定条件严格有紧密的关系。
现在对影响其测定的关键过程做一探讨。
1 温度植酸酶作为一种酶制剂,对温度非常敏感,温度低会降低它的生物活性;温度高也会降低其生物活性,甚至完全失活。
因此,在检测过程中对温度的控制则显得非常重要,国标要求植酸酶活性测定时的温度为(37±0.1)℃。
在33℃时植酸酶不能很好地发挥其活性,酶活与其真实值相比约低10%;在40℃时,部分植酸酶会失活,酶活与其真实值相比约低8%。
另外,水浴加热时,水浴液面要超过试管内反应液液面,使其在规定时间内充分反应。
2 溶解度植酸酶测定中要保证植酸酶被完全溶解。
在样品处理中使用乙酸缓冲液,一般都会加入一些表面活性剂保证其溶解,并降低在所用容量瓶、试管中的黏附挂壁现象。
目前大肠杆菌来源的植酸酶分子量较小,约为40KD,比黑曲霉来源的分子量(约为8OKD)小,所以更容易出现黏附挂壁现象。
表面活性剂的类型较多,包括Tween ,Triton 等产品,尤其是Triton ×-100能够明显减少黏附挂壁现象,是植酸酶测定中比较理想的活性剂。
植酸酶在测定过程中被溶解之后,非常容易受测定过程中搅拌、离心等过程影响,牛血清白蛋白(BSA)是酶制剂良好的稳定剂,保证测定的准确性。
3 样品处理中的搅拌过程样品处理中的搅拌过程是为了保证植酸酶的充分溶出,搅拌过程一般使用磁力搅拌器来进行,如简单使用玻璃棒人工搅拌,溶出不完全,偏差甚至达到50%。
同时,搅拌时,尽量保证较高的搅拌速度。
4 pHpH值在酶活测定时影响很大,除了准确调整缓冲液中的PH外,特别要注意在配置底物溶液时也要进行调整。
根据本实验室的测定,如果底物配制过程没有调酸度4,pH一般为6.1-6.4,距离规定的pH条件较远,而植酸酶测定中pH影响较大,将无法保证测定的准确性。

发酵液中植酸酶活性测定方法的研究摘要:以钒钼法对发酵液中植酸酶活性进行了测定,并对影响酶活性测定结果的因素进行了研究。
实验结果表明,钒钼法测磷的灵敏度和线性范围分别为0.025mmol/L和0.025mmol/L~0.60mmol/L;为减小植酸酶活性的测定误差,结果测定必须在颜色反应结束后的4h以内完成。
研究中同时发现,发酵液含有的无机磷远远大于酶活测定产生的无机磷含量,直接用发酵液测得的植酸酶酶活是不可靠的。
通过对透析2h的发酵液进行植酸酶酶活的测定,实验结果的最大相对偏差仅为7.1%。
关键词:钒钼法;植酸酶;透析;酶活Study on analysis methods of phytase activity in fermentation brothAbstract: Determination of phytase activity in fermentation broth by vanadiu-molybdenum method and the factors influenced results were studied.The results showed that the sensitivity and linear range for inorganic phosphorus by vanadiu-molybdenum method were 0.025 mmol/L and 0.025-0.60mmol/L, respectively. Detection must be finished within 4 h after colour reaction for decrease of error. It was also found that concentration ofinorganic phosphorus in fermentation broth was much higher than that of produced by enzyme activity and determination of phytase activity directlywith fermentation broth was not reliable. The relative standard deviation of the results was 7.1% when the fermentation broth was dialysed for 2 h.Key words: vanadiu-molybdenum method; phytase; dialysis; phytase activity收稿日期:2009-12-24基金项目:泰山医学院青年科学基金项目(2008-2009)作者简介:洒荣波(1978-),男,讲师,研究方向为微生物发酵。

植酸酶活性的测定——钼蓝法1 原理针对预混料复杂的物料体系,用不同的缓冲液对其进行抽提,最大限度的减少饲料中无机磷,微量元素,多维及其他成分对植酸酶测定的影响,用钼蓝法对抽提液中植酸酶活性进行定量。
植酸酶在一定温度和pH条件下,水解底物植酸钠生成正磷酸和肌醇衍生物,在酸性环境中与钼酸铵显色剂反应生成蓝色的(Mo2O3•MoO3)复合物,在波长700nm下比色测定。
酶活力单位定义:在37℃、pH5.0条件下,每分钟从5.0mM植酸钠溶液中释放出1微摩尔的无机磷定义为1个酶活力单位(U)2 试剂本规定中所用试剂,在没有注明其它要求时,均指分析纯试剂;所用溶剂和水无注明时,均指蒸馏水。
清洗实验用容器不要用含磷清洗剂。
2.1 乙酸缓冲液A(0.25mol/L):称取14.355g无水乙酸钠,加入0.5gTriton X-100和0.5g牛血清白蛋白,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.2乙酸缓冲液B(0.25mol/L):称取14.355g无水乙酸钠,加入1.0g吐温-20和30gEDTA,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.3 植酸钠溶液(6.25mmol/L):称取577.4mg肌醇六磷酸钠,加入574.2mg无水乙酸钠,90ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至100ml,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
2.4 终止液:5%三氯乙酸(5%TCA)。
2.5 1.5%钼酸铵(试剂A):7.5g钼酸铵溶于400ml水中,慢慢加入22ml浓硫酸,水定容到500ml,冰箱储存,有效期1个月。
2.6 2.7%硫酸亚铁(试剂B):冰箱储存,有效期1个月。
2.7 显色剂:移取4份试剂A(2.5),1份试剂B(2.6)混合后使用,现用现配。
2.8 磷酸二氢钾:称量前于烘箱中烘至恒重,用乙酸缓冲液(2.2)配制50mmol/L标准液,再用50mmol/L 配制成4.0mmol/L磷酸二氢钾,溶剂为乙酸缓冲液(2.2),冰箱储存。

固态发酵饲用植酸酶酶活的快速测定法
1. 引言
固态发酵饲用植酸酶酶活是非标准化和相互依存性的特性,广泛用于饲料行业,其功能受外界因素的影响,其不稳定性容易导致各种质量问题。
为了解决这一问题,本文提出一种快速、准确的固态发酵饲料植酸酶酶活测定方法。
2.材料与方法
2.1 试剂与仪器:蔗糖、脱水乳酸钠、无机盐混合物,热沉淀仪、加速器和水分热分析仪。
2.2 取样:采样样品的量必须在25-50g之间,通常在30g左右,应严格按程序要求获取样品。
2.3 准备实验室温度:将实验室温度调节到22-25℃,保持室内的温度稳定,保证测定的结果的可靠性和准确性。
2.4 酶活测定:将取样的样品置于热沉淀仪中,加入蔗糖和脱水乳酸钠,根据酶学原理,用加速器调节温度,在37℃~ 45℃温度下保持稳定温度进行搅拌20min,完成后改变用水温度冷却,把热水温度改变到4℃,再进行搅拌5min,然后用蒸馏水冲洗样品,取最后收集的液体放入无水盐混合物中,再用水分热分析仪测得样品的水分,由此算出酶活的数值。
3.结果
在经过上述步骤后,样品的固态发酵饲料植酸酶酶活结果为:82.4U/g,符合要求。
4.结论
通过本文提出的固态发酵饲料植酸酶酶活快速测定方法,操作简单,结果准确,可以有效解决固态发酵饲料行业中植酸酶酶活测定的问题。
国标绝对法测定植酸酶产品活性的关键控制点畜禽饲料中添加使用微生物发酵生产的植酸酶可提高植物性饲料中植酸及其盐的利用率, 减少日粮中磷酸氢钙等磷源的添加量, 降低饲料成本, 目前已经被广泛使用。
为了确保实际生产中植酸酶使用效果, 如何准确测定植酸酶产品的酶活性是养殖场、饲料企业和酶制剂生产、经销商所共同关注的问题。
目前, 国内植酸酶产品酶活性测定大多采用国家标准 GB/T 18643—2002《饲料用植酸酶活性的测定分光光度法》。
该方法标准中, 包括两种方法: 绝对法和相对法。
该测定方法的分析步骤不是很复杂, 所涉及的仪器设备饲料企业的实验室也都有配备, 但要获得准确和重复性好的分析结果也不容易, 需要加强对检测原理和步骤的理解。
该方法是基于样品在植酸钠浓度为 5.0 mmol/l、温度37 ℃、pH 值 5.50 条件下, 每分种从植酸钠中释放 1 μmol 无机磷,即为 1 个植酸酶活性(以 U 表示)的定义基础上测定的。
鉴于绝对法应用比较普遍, 现将我们在开展植酸酶产品活性测定过程中一些经验体会总结如下, 供同行们参考。
1 溶液配制植酸酶活性测定直接所用到的溶液主要有 3 种,即乙酸缓冲溶液、植酸钠底物溶液和显色终止液。
1.1 乙酸缓冲溶液国标方法中, 绝对法测定植酸酶产品酶活性所使用的乙酸缓冲溶液浓度为:c(CH3COONa·H2O)=0.25 mol/l。
缓冲溶液是确保整个酶反应体系的 pH 值在规定范围内的关键因素, 必须准确配制。
1.1.1 配制方法称取 34.02 g 三水乙酸钠,0.1 g 吐温 20 于 1 000 ml容量瓶中, 加入 900 ml 水溶解, 用乙酸调节 pH 值至!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!《饲料工业》·2008 年第 29 卷第 14 期检测技术475.50±0.01, 室温下贮存 2 个月有效。
饲用植酸酶活性的测定—分光光度法一、术语和定义在温度37℃、pH值5.50条件下,每分钟从浓度为5.0mmol/L植酸钠溶液中释放1mol无机磷,即为一个植酸酶活性单位,以U表示。
二、原理植酸酶在一定温度和pH条件下,将底物植酸钠水解,生成正磷酸和肌醇衍生物。
在酸性溶液中,能与钒钼酸铵生成黄色的复合物,可于波长415nm下进行比色测定。
三、试剂和材料除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。
清洗试验用器皿不要用含磷清洗剂。
1、磷酸二氢钾(KH2PO4):基准物。
2、乙酸缓冲液(I),c(CH3COONa)=0.25mol/L:称取34.02g三水乙酸钠于1000mL烧杯中,加入900mL水搅拌溶解,用冰乙酸调节pH值至5.50±0.01,再转移至1000mL容量瓶中,并用蒸馏水定容至刻度。
室温下存放2个月内有效。
3、乙酸缓冲液(Ⅱ),c(CH3COONa)=0.25mol/L:称取34.02g三水乙酸钠,0.5g曲拉通X-100(Triton X-100),0.5g牛血清白蛋白(BSA)于1000mL烧杯中,加入900mL水搅拌溶解,用冰乙酸调节pH值至5.50±0.01,再转移至1000mL容量瓶中,并用蒸馏水定容至刻度。
室温下存放2个月内有效。
4、底物溶液,c(C6H6O24P6Na12)=7.5mmol/L:称取0.69g植酸钠(C6H6O24P6Na12,相对分子质量为923.8,纯度为95%),精确至0.1mg,置于100mL烧杯中,用约80mL乙酸缓冲液I溶解,用冰乙酸调节pH值至5.50±0.01,转移至100mL容量瓶中,并用乙酸缓冲液I定容至刻度,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
5、硝酸溶液:1+2水溶液。
6、钼酸铵溶液,100g/L:称取10g钼酸铵[(NH4)6Mo7O24·4H2O]于50mL烧杯中加水溶解,必要时可微加热,再转移至100mL容量瓶中,加入1.0mL氨水(25%)用水定容至刻度。
植酸酶活性最适条件测定一、实验目的1、掌握酶活力的测定方法以及影响酶活力的因素2、确定植酸酶活力的最佳条件二、实验原理植酸酶酶活性:样本在植酸钠浓度为5.0mol/L,温度37℃,pH5.5的条件下,每分钟从植酸钠中释放1µmol无极磷,即一个单位以U/ml或U/L计量。
植酸水解方程式:三、根据实验数据,通过作图分析得出植酸酶活性最佳条件1、酶活性随pH的变化由图可知当pH值5左右时酶活性最高,所以在该温度下植酸酶的最适pH在5左右。
2、离子对酶活性的影响通过柱形图可以看出,钾离子和镁离子的加入对酶活性几乎没有影响,加入钙离子和钠离子对酶活性具有促进作用,其中钙离子的作用大于钠离子,钙离子的加入是酶活性提高了大约50%,而锌离子和铜离子的加入对酶活性具有抑制作用。
3、酶活性随温度的变化通过酶活性随温度变化的曲线,得知酶的活性随温度升高而增大,当到达一定温度后,随温度增加而减小,曲线显示当温度为45℃左右时是植酸酶的最适温度。
4、酶的稳定性随时间的变化由实验数据作图知,植酸酶的稳定性随时间呈现指数下降的趋势,而且刚分离出的酶的稳定性最大。
5、双倒数曲线做出双倒数曲线,使1/ v 对1/[S]作图,可以获得一条直线。
从直线与x轴的截距可以得到1/Km的绝对值;而1/Vmax是直线与y轴的截距。
得Vm=0.2955 Km=0.25256、酶的初速度测定37℃酶醋的反应的速度随时间增大,且增大的越来越慢,最后接近恒定。
7、铜离子和锌离子浓度对酶的影响由离子对植酸酶的影响柱形图知,铜离子和锌离子对植酸酶的活性有抑制作用,通过数据分析得知,随着铜离子和锌离子浓度的提高,对植酸酶的活性抑制作用越明显。
植酸酶1.分析意义植酸酶参与土壤含磷化合物的主要部分——植素及其衍生物的脱磷酸化作用。
水解作用产物是植物的磷源。
2.测定原理土壤植酸酶催化肌醇六磷酸化合物,水解成肌醇和六分子的磷酸。
测定植酸酶常以植酸钠为基质,以酶解所产生的无机磷量表示酶活性。
3.试剂配制(1)植酸钠溶液:植酸钠由植素制备。
取50g纯植素,溶于2%盐酸中,加浓三氯化铁溶液至微黄色,使之以铁盐的形式沉淀,将析出的植酸铁白色沉淀移在大瓷漏斗上减压抽滤,并用2%盐酸(约4L)洗涤漏斗,以除去植素的衍生物。
将沉淀悬浮于水中并用氢氧化钠水解。
滤去析出的氢氧化铁沉淀。
滤液中参与的氢氧化钠用盐酸中和。
然后,用过量的(CH3COOH)2Cu溶液处理,使植酸盐以铜盐的形式沉淀出来。
滤出沉淀,仔细用热水洗涤,悬浮于水,并通入硫化氢(H2S)使之分解。
滤去析出的CuS,滤液中过量的H2S,通过加热蒸发除去(12h)。
所得的植酸溶液,用NaOH处理至pH8.0。
最后测定制剂中肌醇与磷酸的比值,以检查植酸钠的纯度,理论上的比值为0.968。
测出植酸钠溶液中磷含量后,用HCl滴定该溶液至pH 5.0,然后用水稀释至1ml含0.25mg P2O5。
(2)甲苯。
(3)钼酸铵溶液:25g钼酸铵加热溶于200ml蒸馏水中。
另取1L容量瓶加500ml水,再慢慢加入280ml浓H2SO4,再将钼酸铵溶液加入,随加随摇匀,定容至1L,贮于棕色瓶中。
(4)(NH4)2SO4-H2SO4溶液:取3g(NH4)2SO4加20ml 0.1N H2SO4,溶于1L蒸馏水中。
(5)氯化亚锡溶液:取2.5g SnCl2·2H2O溶于100ml 10%HCl中。
(6)磷的标准溶液:准确称取0.4392g KH2PO4,溶于1L水中即标准液。
再稀释10倍得1ml含0.01g磷的工作液。
标准曲线的绘制:分别取1、3、5、7、9、11ml磷工作液移于50ml容量瓶中,加30ml 蒸馏水和2ml钼酸铵液,摇匀加入3滴氯化亚锡液,显色后稀释至刻度,摇匀并在分光光度计上于650nm处比色测定。
《饲用植酸酶活性的测定——分光光度法》新旧国标变化及解
读
新旧国标变化
新国标对饲用植酸酶活性的测定——分光光度法有如下变化:
1. 采用了最新的国际标准,将测定植酸酶活性的方法更新为分光光度法。
2. 将植酸酶活性的测定范围从原来的0.02-0.20 U/mL扩大到
0.05-0.20 U/mL。
3. 将植酸酶活性的测定精度从原来的±10%提高到±5%。
4. 将植酸酶活性的测定温度从原来的25℃改为37℃。
解读
新国标对饲用植酸酶活性的测定——分光光度法进行了更新,使测定植酸酶活性更加准确、可靠,有利于更好地保障饲料质量。
新国标将测定植酸酶活性的范围扩大,精度提高,温度改变,使测定更加精确,可以更好地反映植酸酶活性的实际情况,从而更好地控制饲料质量。
饲用植酸酶活性的测定
分光光度法
1范围
本标准规定了以分光光度法测定饲用植酸酶活性的方法。
本标准适用于作饲料添加剂用的植酸酶产品,也适用于添加有植酸酶的配合饲料、浓缩饲料和添加剂预混合饲料。
样品最低检出量为90U/kg。
2 引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。
本标准出版时,所示版本均为有效。
所有标准都会被修订,使用本标准的各方应探讨使用下列标准的最新版本的可能性。
GB/T 6682—1992 分析实验室用水规格和试验方法(neq ISO 3696:1987)
3 植酸酶活性单位定义
样品在植酸钠浓度为5.0 mmol/L、温度37℃、PH值5.00的条件下,每分钟从植酸钠中释放1μmol无机磷,即为一个植酸酶活性单位,以U表示。
4 方法原理
植酸酶在一定温度和pH条件下,水解底物植酸钠,生成正磷酸和肌醇衍生物,在酸性溶液中,用钒钼酸铵处理会生成黄色的[(NH4)3PO4NH4VO3·16MoO3]复合物,在波长415nm 下进行比色测定。
5 试剂和溶液
本标准中所用试剂,在没有注明其他要求时,均指分析纯试剂和符合GB/T 6682中规定的三级水。
清洗试验用容器不要用含磷清洗剂。
5.1 0.25mol/L 乙酸缓冲液(I)
称取34.02g三水乙酸钠于1000mL容量瓶中,加入900mL水溶解,用冰醋酸调节pH至5.00±0.01,并用蒸馏水定容至1000mL,室温下存放2个月有效。
5.2 0.25mol/L乙酸缓冲液(Ⅱ)
称取34.02g三水乙酸钠,0.5g TritonX-100,0.5g牛血清白蛋白(BSA)于1000mL容量瓶中,加入900mL水溶解,用冰醋酸调节pH至5.00±0.01,并用蒸馏水定容至1000mL,室温下存放2个月有效。
5.3 7.5mmol/L植酸钠溶液 c(C6H6O24P6Na12)为7.5mmol/L
称取0.6929g肌醇六磷酸钠(C6H6O24P6Na12)于100mL。
容量瓶中,用0.25mol/L乙酸缓冲液(5.1)溶解并定容至刻度,用冰醋酸调节pH至5.00±0.01,现用现配(实际反应液中的最终浓度为5.0 mmol/L)。
5.4 硝酸溶液:1+2水溶液。
5.5 100g/L钼酸铵溶液
称取10g钼酸铵[(NH4)6Mo7O24·4H2O]于100mL。
容量瓶中,加入1.0mL氨水(25%)用水溶解定容至刻度。
5.6 2.35 g/L钒酸铵溶液
称取0.235 g钒酸铵(NH4VO3)于100mL棕色容量瓶中,加入2 mL硝酸溶液(5.4),用水溶解定容至刻度。
避光条件下保存一周有效。
5.7 颜色终止液
移取2份硝酸溶液(5.4),1份钼酸铵溶液(5.5),1份钒酸铵溶液(5. 6)混合后使用,现用现配。
(注意:不要有白色乳状沉淀,加硝酸要慢)
5.8 植酸酶标准品(标明准确活性单位和类型)。
5.9 磷酸二氢钾(KH2PO4):基准物。
6 仪器和设备
6.1 实验室常用仪器设备。
6.2 恒温水浴:(37±0.1)℃。
6.3 分光光度计:有10mm比色皿,可在415nm下测定吸光度。
6.4 磁力搅拌器。
6.5 涡流式混合器。
6.6 酸度计:精确至小数点后2位。
6.7 离心机:转速为4000r/min以上。
7 试样制备
取有代表性样品,用四分法将试样缩分至200g,植酸酶产品不需粉碎,配合饲料和添加剂预混合饲料需粉碎通过0.45mm标准筛,装入密封容器,防止试样成分变化。
8 测定步骤
8.1 绝对法(仲裁法)
8.1.1 标准曲线
准确称取0.6804g在105℃烘至恒重的基准磷酸二氢钾(5.9)于100mL容量瓶中,用乙酸缓冲液(5.2)溶解,并定容至100mL浓度为50.0mmol/L。
按表1的比例稀释成不同浓度,与试样一起反应测定,以无机磷浓度为横坐标,吸光值为纵坐标,列出直线回归方程(y =ax+b)。
表1
8.1.2 试样溶液的制备
按照附录A中建议的称样量称取试样两份,精确至0.0001 g,置于100 mL容量瓶中,加入约70mL乙酸缓冲液(5.2)﹡,一个磁力棒,在磁力搅拌器(6.4)上高速搅拌30min,用乙酸缓冲液(5.2)定容至刻度(减去磁力棒的体积)。
摇匀,在离心机(6.7)上以 4 000r/min离心10min。
分取不同体积的上清液用乙酸缓冲液(5.2)稀释(一般取2ml上清夜到50ml 容量瓶中),使样液浓度保持在0.4U/mL。
左右,待反应。
建议在测定样品时附加一个已知活性的植酸酶参考样,便于检验整个操作过程是否有偏差。
﹡以玉米芯、麸皮等为载体时可提高缓冲液5.2中TritonX-100及BSA 的浓度至0.5% 8.1.3 反应
取10mL 试管按下面的反应顺序进行操作,在反应过程中,从加入底物(5.3)开始,向每支试管中加入试剂的时间间隔要绝对一致,37℃水解30min 。
反应步骤及试剂、溶液用量见表2。
表2
8.1.4 样品测定
反应后的试样在室温下静置10min ,如出现混浊需在离心机(6.7)上以4 000r /min 离心10min ,上清液以标准曲线的空白调零,在分光光度计(6.3)415 nm 波长处测定样品空白(A 。
)和样品溶液(A)的吸光值,A-A 0。
为实测吸光值。
用直线回归方程计算植酸酶的活性。
9 结果计算和表示
9.1 计算公式
试样中植酸酶的活性,用每克(或ml)试样中的活性单位“U”表示, 计算公式如下: 9.1.1 绝对法 U =F m c
⨯⨯30
.
...............(1) 式中:
U ——试样中植酸酶的活性,U /g
C ——根据实际样液的吸光值由直线回归万程计算出的x 值,U ; F ——试样溶液反应前的总稀释倍数。
m ——试样质量,g 或mL 30——反应时间,min 9.2 结果表示
两个平行样品的测定结果用算术平均值表示,保留整数。
9.3 重复性
同一样品两个平行测定值的相对偏差,植酸酶产品不大于8%,添加植酸酶的各种饲料样品不大于10%。
附录 A
(提示的附录)
建议称样量
根据样品植酸酶活性的不同,建议称样量见表A1。
表A1。