【精品推荐】人教版高中数学选修三高三化学复习精选训练题:
- 格式:docx
- 大小:96.14 KB
- 文档页数:10

最新人教版高中化学选修三测试题全套及答案第一章综合测试题注意事项:1.本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分;考试用时90分钟,满分100分。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cu-64第Ⅰ卷(选择题,共48分)一、选择题(本题包括16小题,每小题3分,共48分。
每小题只有一个选项符合题意)1.已知,a A n+、b B(n+1)+、c C n-、d D(n+1)-具有相同的电子层结构。
关于A、B、C、D四种元素的叙述正确的是()A.气态氢化物的稳定性:D>CB.原子序数:b>a>c>dC.最高价氧化物对应水化物的碱性:B>AD.A、B、C、D四种元素处在同一短周期中2.下列能级能量由小到大排列顺序正确的是()A.3s 3p 3d 4s B.4s 4p 3d 4dC.4s 3d 4p 5s D.1s 2s 3s 2p3.下列关于原子核外电子排布式或运动状态的描述中,不完全是专指碳原子的是()A.原子核外电子有六种运动状态B.L能层p能级只有一个空轨道C.L能层有两个未成对的电子D.最外层p能级电子数与次外层电子数相等4.根据电子排布的特点,Cu在周期表属于()A.ds区B.p区C.d 区D.s区5.下列各原子或离子的基态电子排布式正确的是()A.Fe [Ar]3d64s2B.O2-1s22s22p4C.Ca [Ar]3d2D.P [Ne]3s23p56.下列说法中不正确的是( )A.已知原子的核电荷数,可以推知该原子的周期序数B.原子的电子层数等于该原子的周期序数C.知道原子的周期序数,就能确定该元素在周期表中的位置D.知道原子的周期序数,还不能确定该元素在周期表中的位置7.现有A、B、C、D、E为五种原子序数依次增大的短周期元素,A原子的最外层电子数是其内层电子数的一半;B和D原子最外层电子数之比为1:1,而两者的原子序数之比为1:2;C元素的氢氧化物既能溶于强碱又能溶于强酸溶液。

高中化学学习材料(灿若寒星**整理制作)2014-2015学年宜阳一高培优部高二年级选修3物质结构与性质复习备考强化训练二(带解析)一.填空题(共30小题)1.A、B、C三种短周期元素,它们原子的电子层数相同;C﹣与Ar原子具有相同的电子层结构;A原子半径是所在周期主族元素中最大的;B的氧化物既能与盐酸反应又能与NaOH溶液反应.请回答;(1)A、D、C的元素符号分别是_________、_________、_________.(2)A元素在周期表中的位置是_________.(3)A与C形成的化合物的化学式是_________,其电子式是_________.(4)B的最高价氧化物对应水化物的化学式是_________.(1)A、C最高价氧化物对应水化物的溶液相互反应的离子方程式是_________.2.X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布.H2在X单质中燃烧,产生苍白色火焰;Y元素的气态氢化物是H2Y,其最高价氧化物中Y的质量分数为40%;Z元素在焰色反应中焰色呈紫色.(1)根据以上条件,可推出X是_________,Y是_________,Z是_________(填元素符号).(2)X元素在元素周期表中的位置是_________.(3)X、Y、Z三种元素的原子半径最大的是_________(填元素符号).(4)Y、Z的最高价氧化物对应水化物的化学式分别为:_________,_________.3.X、Y、Z是原子序数依次增大的3种短周期元素(稀有气体除外).其中,X的+1价阳离子的电子层结构与氖相同,Y元素原子的K、M层电子数之和比L层电子数少3,Z元素的最高化合价是其最低化合价绝对值的3倍.(1)X在元素周期表中的位置是_________.(2)Z的一种氧化物,其氧元素质量分数为50%,它具有的性质是_________(填序号).①能使品红溶液褪色②能使酚酞试液变红③在一定条件下能被氧气氧化④能使紫色石蕊试液变红(3)X与Z组成的某种化合物,其相对分子质量为78.该化合物含有的化学键是_________(填序号).①离子键②极性共价键③非极性共价键(4)X的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物之间反应的离子方程式为_________.4.已知A、B、C、D、E、F均为前四周期元索.A元索的原子价电子排布为ns2np2,B元索的最外层电子数是其电子层数的3倍,C元索原子的M电子层的P亚层中有3个未成对电子.D元素原子核外的M层中只有2对成对电子.B离子与E离子具有相同的电子层结构,可形成E2B2、E2B型化合物.F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数.请回答下面的问题:(1)根据以上信息推断:①B元素为_________,F原子核外的价电子排布为_________.D元素在_________区.(2)当n=2时,A与氢元素形成相对分子质量为28的分子中有_________个σ键.(3)当n=3时,A与B形成的晶体属于_________晶体.A单质的晶体结构中,A原子采用_________杂化,A原子数与A﹣A键数之比为_________.(4)DCl2分子中,中心原子D有_________对孤对电子,用价层电子对互斥模型推测:DCl2分子的空间构型为_________形.(5)元素F的某种氧化物的晶体晶胞结构如右图所示,其中实心球表示F原子,则该氧化物的化学式为_________.(6)F元素的醋酸盐晶体局部结构如右图,该晶体中含有的化学键是_________(填选项序号).①极性键②非极性键③配位键④金属键(7)A﹣F六种元素中,有一种元素的部分电离能数据如下,它可能是_________(写元索符号)(其中I1﹣I2分别表示该元素第一电离能﹣﹣第七电离能).电离能I,I2 I3 U I5 h I7(KJ.mol﹣1)14.5 29.6 47.4 77.5 97.9 551.9 666.85.前四周期中的A、B、C、D、E、F六种元素,原子序数依次增大.其中A元素的一种核素的质量数为12,中子数为6;B是空气中含量最多的元素;C的基态原子核外5个原子轨道上填充了电子,且有2个未成对电子;D 与C同一主族,E的原子序数为22,F3+离子最外层3d轨道电子为半满状态.回答下列问题(答题时用对应元素符号表示):(1)AC2分子中A原子轨道的杂化类型为_________,含有σ键与π键数目之比为_________.(2)B、C、D三种元素电负性由大到小的顺序为_________.(3)由氢与B组成的一种化合物化学式为BH5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式_________,该物质属于_________(填“离子”或“共价”)化合物.(4)C和D元素的氢化物(分子式分别为H2C2、H2D)的主要物理性质如下表熔点/K 沸点/K 标准状况时在水中的溶解度H2D 187 202 2.6H2C2272 423 以任意比互溶H2D 和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是(要求详细叙述):_________.(5)F和G(质子数为25)两元素的第三电离能分别为:2957KJ/mol和3248KJ/mol,G的第三电离能大于F的第三电离能的原因是_________.(6)E的一种氧化物晶胞结构如图所示,该氧化物的化学式为_________;若该晶胞的三个晶胞参数为:a=b=460pm c=300pm 则该氧化物的密度为:_________g/cm3;(写出表达式即可)6.氮、磷、锌、铁等是与生命活动密不可分的元素.请回答下列问题:(1)NH3和PH3都是极性分子,其中极性较大的是_________,理由是_________.(2)20mL0.1mol•L﹣1次磷酸(H3PO2)溶液与20mL 0.1mol•L﹣1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是_________.(3)如图1所示为血红蛋白和肌红蛋白的活性部分﹣﹣血红素的结构式血红素中N原子的杂化方式为_________,在图2的方框内用“→”标出Fe2+的配位键.(4)N2与CO互为等电子体.表是两者的键能数据(单位:kJ•mol﹣1):结合数据说明CO比N2活泼的原因:_________.(5)Zn2+基态时的电子排布式是_________,ZnO和ZnS的晶体结构相似,其中熔点较高的是_________,理由是_________.A﹣B A═B A≡BCO 357.7 798.9 1071.9N2154.8 418.4 941.77.已知物质M由属于同一周期的X.Y两种短周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y 元素最高正价与它的负价代数和为6.M与其他物质的转化关系如下(部分产物已略去):(1)已知元素Z与Y是最外层电子数相同的短周期元素,那么Z与Y分别与氢形成的氢化物中沸点较高的是_________(填化学式),原因是_________;(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则E溶液与F溶液反应的离子方程式是:_________;(3)若A是与X、Y同周期元素的一种常见金属单质,且A与B溶液能够反应,则其化学方程式是:_________;(4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式_________,G的电子式是:_________;(5)若A是一种溶液,只可能含有H+.NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的离子是_________(微粒次序按摩尔质量从小到大,下同),物质的量浓度之比为_________.8.X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素.X原子最外层电子数是次外层电子数的2倍;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂.Z、W原子最外层电子数之和是X原子最外层电子数的2倍,且Y与W同族.请填空:(1)固态的XY2属于_________晶体.X的氢化物中含氢的质量分数最高的分子的空间构型为_________.(2)W与X可形成化合物XW2.①XW2为_________(填“极性”或“非极性”)分子;②Z的单质在XY2气体中燃烧的现象为_________.(3)工业制Z的方法为_________.(4)WY2→WY3的工业反应条件是_________其方程式为_________.9.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:(1)化合物M的结构简式为_________.(2)在元素周期表中,E元素位于第_________周期_________族.用电子排布式写出E元素基态原子的价电子构型_________.(3)元素C与D的第一电离能的大小关系是C_________D(填“>”、“<”或“=”).(4)在一密闭容器中发生反应2CD2(g)⇌2CD(g)+D2(g)△H>O,反应过程中CD2的浓度随时间变化的情况如图所示.①依曲线A,反应在3min内D2的平均反应速率为_________.②若曲线A、B分别表示该反应在某不同条件下的反应情况,则此条件是_________(填“浓度”、“压强”、“温度”或“催化剂”).③曲线A、B分别对应的反应平衡常数大小关系是K A_________K B(填“>”、“<”或“=”)(5)甲同学用图1所示装置对E元素单质与浓硫酸的反应进行实验.①检查装置气密性后,将过量的E元素单质和一定量的浓硫酸放入烧瓶,塞紧橡皮塞,开始计时.t1时开始加热,在铁屑表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变.甲同学将收集到的气体体积与时间的关系粗略地表示为图2.在0~t1时间段,E表面没有气泡生成,说明E在浓硫酸中发生了_________;t1~t2时间段,反应生成的气体是_________.写出开始加热时发生反应的化学方程式_________.10.有关元素X、Y、Z、D、E的信息如下元素有关信息X 元素主要化合价为﹣2,原子半径为0.074nmY 所有主族序数与所在周期序数之差为4Z 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰D 最高价氧化物既能溶于强酸又能溶于强碱E 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏用化学用语答下列问题:(1)E在元素周期表中的位置为_________;Z的氢化物电子式为_________(2)沸点:硒化氢_________X的氢化物(填“>”或“<”).X、Y、D形成的简单离子的半径由大到小为_________.(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为_________,D的最高价氧化物溶于强碱的离子方程式为_________.(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_________.①保存EY2溶液时,需向溶液加入少量E单质②EY2、E2Y3均能通过化合反应生成③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒④向煮沸的NaoH溶液中滴加几滴饱和EY3溶液,可以制得胶体(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式_________.11.A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.期中B的单质在常温下为双原子分子,它与A 的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子.回答下列问题:(1)C与D形成的化合物的化学式是_________,它的性质决定了它在物质的分类中应属于_________;该化合物的水化物的电离方程式是_________.(2)将X气体通入A与F形成的化合物的水溶液中,使之恰好完全反应.此时溶液呈_________性,(填“酸”、“碱”、中”);溶液中离子浓度由大到小的顺序为_________.(3)F的单质在反应中常作_________剂,该单质的水溶液与E的低价氧化物反应的化学方程式是_________.(4)写出X分子的等电子体(原子数和电子数均相等的粒子)_________(用电子式表示),并写出该等电子体与X溶液反应的离子方程式:_________.12.下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:元素有关信息A 元素主要化合价为﹣2,原子半径为0.074n mB 所在主族序数与所在周期序数之差为4C 原子半径为0.102n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰D 最高价氧化物的水化物,能按1:1电离出电子数相等的阴、阳离子E 原子半径为0.075n m,最高价氧化物的水化物与其氢化物组成一种盐X(1)画出B的离子结构示意图_________;写出D元素最高价氧化物的水化物电子式_________.(2)盐X水溶液显_________(填“酸”“碱”“中”)性,用离子方程式解释其原因_________.(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为_________.(4)已知E元素的某种氢化物Y与A2的摩尔质量相同.Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液.该燃料电池放电时,正极的电极反应式是_________.(5)如图是一个电解过程示意图.假设使用Y﹣空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)_________L.13.X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素.其中Y元素的单质在空气中可形成两种氧化物,其阴、阳离子个数比均为1:2.另有一常见金属W与常温下为液态的化合物A在一定条件下可发生如下变化:请完成下列问题:(1)、X、Y、Z三种元素的离子半径由大到小的顺序为_________(用离子符号表示).(2)、X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为_________(用氢化物的分子式表示).(3)、Y元素最高价氧化物对应水化物的电子式为_________.(4)、W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)_________.(5)、B为黑色固体,在上述变化中,生成1molB转移电子_________mol.(6)、以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为_________,电池总反应为_________.14.现有1﹣﹣20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:元素物质性质或微粒结构A M层上有2对成对电子B B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂C 常温下单质为双原子分子,其氢化物水溶液呈碱性D 元素最高正价是+7价(1)元素A的原子最外层共有_________种不同运动状态的电子,有_________种能量不同的电子.B的离子与D的离子相互组合形成的干燥剂的化学式是_________.(2)元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式(用元素符号表示)_________(3)元素A与元素D相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________A.常温下A的单质和D的单质状态不同B.A的氢化物比D的氢化物稳定C.一定条件下D能从A的氢化物水溶液中置换出A单质D.HD的酸性比HA酸性强(4)C的氢化物固态时属于_________晶体,该氢化物与A的最高价氧化物水化物反应的化学方程式是_________.15.【化学一物质结构与性质】A、B、C、D、E、F六种短周期元素,核电荷数依次增加.只有E为金属,A与F同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两队成对电子.E+与C3﹣具有相同的电子层结构.请回答下列问题:(1)F的价电子排布为_________.其B、F形成的化合物晶体类型是_________(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式_________(3)A、C形成的分子属于_________(极性或非极性)分子.该分子有_________对孤对电子_________个σ键,中心原子杂化方式_________(4)A、E形成的化合物的电子式_________(5)CA3与FA4的稳定性:_________;离子半径:E+_________C3﹣.16.有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:元素编号元素特征信息A A的单质是密度最小的物质B B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子C C的原子最外层电子数是其内层电子数的三倍D D与B同周期,该周期中D的简单离子半径最小E B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分F F元素最高正价与最低负价的代数和为4(1)写出元素B在周期表中的位置:_________,化合物Y所含的化学键名称_________;(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)_________;(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式_________;(4)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n)与反应时间(t)的曲线如下图所示.则t2时刻消耗氢氧化钙质量为_________g,此时反应的化学方程式为_________.(5)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠化合物.写出它与乙醇反应的化学方程式_________.17.短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大.C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物.(1)写出E的单质与A、D两元素形成其常见化合物反应的离子方程式_________.(2)由A、C、D三元素所形成的常见盐溶液呈_________性(填“酸”、“中”、“碱”),其原因用离子方程式表示为_________.(3)B的相对分子质量最小的氢化物的燃烧热为8903kJ•mol﹣1,写出其燃烧的化学方程式_________.(4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如图:①X的化学式是_________.②图中a、b、c、d四点中,表示反应处于平衡状态的是_________.③该温度下,反应Y转化为X的平衡常数为_________.④反应进行到t2时刻,改变的条件可能是_________.18.a A、b B、c C、d D四种短周期元素,它们的原子序数有如下关系:c﹣b=b﹣a=1 且b+c=d,B的最高价氧化物对应水化物为强酸.(1)A、B、C、D四种元素都能形成多种氢化物,这些氢化物中,原子个数最少而沸点最高的是_________;(2)B与D形成的单质分别为甲、乙,下列判断正确的是_________.a.非金属性:D>B,活泼性:甲>乙b.非金属性:B>D,活泼性:甲>乙c.非金属性:B>D,活泼性:乙>甲d.非金属性:D>B,活泼性:乙>甲(3)1993年7月,美国哈佛大学传出轰动性的科技新闻:利用激光溅射技术研制由A和B两种元素组成的新材料,而新材料硬度将超过目前世界上最硬的金刚石晶体,成为首屈一指的超硬新材料.该新材料的化学式为_________;(4)C能形成一种分子结构如图所示的具有18电子结构的分子.电解该化合物只有三种单质产生,其中两种互为同素异形体且质量相等,请写出该电解反应的化学反应方程式_________.(5)B的一种氢化物与B的最高价氧化物对应水化物在甲醇介质中反应生成一种相对分子质量为158、威力为TNT 的142%的炸药,该炸药的化学式为_________.19.A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.请回答以下问题:(1)E在周期表中的位置为_________.(2)由A、D、E三种元素形成的化合物是一种很重要的化工原料,该化合物的电子式为_________.(3)由A、B组成的化合物M的产量可以用来衡量一个国家的石油化工生产水平,则化合物M分子空间构型是_________.已知14g该化合物M燃烧,产物是气体时,放出的热为705.5kJ,写出该化合物M燃烧的热化学方程式:_________.图Ⅰ是M燃料电池(电解质为KOH溶液)的结构示意图,请回答:①Ⅰ中负极的电极反应式是_________.②若在Ⅱ中实现锌片上镀铜,则b的电极材料是_________,N溶液为_________溶液.③若在Ⅱ中实现Cu+H2SO4=CuSO4+H2↑,则a的电极反应式为_________.20.A、B、C、D、E、F、G是原子序数依次递增的常见元素,其中A、B、C、D、E、F为短周期元素,B与E同主族,A的最高价氧化物对应水化物与其气态氢化物能生成一种盐,B与C形成的一种的淡黄色粉末能与水反应生成B的一种单质,D原子最外层电子数等于其电子层数,G与F可形成GF2、GF3两种盐.试回答以下问题:(1)B与C形成的一种的淡黄色粉末的电子式为_________,所含化学键类型为_________(2)D的单质与C的最高价氧化物对应水化物反应的离子方程式为_________(3)在GF3的溶液中通入E的低价氧化物反应的离子方程式为_________(4)A的最高价氧化物对应水化物与其气态氢化物生成盐的水溶液显_________性,原因是_________(写离子方程式)(5)已知Ksp[D(OH)3]=1×10﹣34,Ksp[G(OH)3]=1×10﹣38,向pH=1的DF3与GF3的混合溶液中逐滴滴加某强碱的稀溶液,先生成_________(化学式)沉淀,当该金属离子沉淀完全时,溶液的pH=_________(溶液中金属离子浓度≤1×10﹣5mol/L时可认为该金属离子沉淀完全)21.Ⅰ.如表是元素周期表的一部分,X、Y、Z、W、M均为短周期元素,X、W的质子数之和为23.回答下列问题:X YM Z W(1)M、Z、W的原子半径由大到小:_________(填元素符号)(2)比较X、Y的氢化物的稳定性由强到弱:_________,Z和W最高价氧化物对应水化物酸性由强到弱_________.(填化学式)(3)1mol Z的最高价氧化物中含有_________mol 共价键.(4)请写出M与NaOH溶液反应的离子方程式:_________;氧化剂的物质名称是_________.Ⅱ.通常情况下,微粒A和B为分子,C为5核阳离子,E为单核阳离子,D为阴离子,它们都含有10个电子;B 溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.写出A、B、E三种微粒反应的离子方程式:_________.22.A,B,C,D,E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A,B,D,E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为_________,以下三种说法中,可以验证C和E非金属性强弱的是_________.a.比较这两种元素的常见单质的沸点b.二者形成的化合物中,C元素显负价c.比较这两种元素的气态氢化物的稳定性(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为_________.(3)盐M中含有的化学键类型有_________,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的c(H+)M:c(H+)N=1:_________(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式_________,用离子方程式表示该反应生成的盐溶液显碱性的原因_________(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1mol 电子放出Q kJ的热量,试写出R与水反应的热化学反应方程式_________.23.已知X、Y、Z、L、M五种短周期元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:(1)L的元素符号为_________;X、Y、Z、L四种元素的电负性从大到小依次为从大到小的顺序是_________(用元素符号表示).(2)由X、Y、Z按1:1:1组成的XYZ分子中σ键与π键数目之比为_________.(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的基态原子核外电子排布式为_________.(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:_________;阴极的电极反应式:_________.24.A、B、C、D是原子序数依次增大的同一短同期元素,A、B是金属元素,C、D是非金属元素.(1)A、B各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_________.(2)A与C 可形成化合物A2C,该化合物的电子式为_________.(3)C的低价氧化物通入D单质的水溶液中,发生反应的化学方程式为_________.(4)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________.(5)四种元素中金属性最强的(填元素符号)_________;非金属性最强的_________(6)D的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量.写出该反应的热化学方程式:_________.25.元素周期表中第ⅤⅡA族元素的单质及其化合物的用途广泛.(1)与氯元素同族的短周期元素的原子结构示意图为_________.(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_________(填序号).a.Cl2、Br2、I2的熔点b.Cl2、Br2、I2的氧化性c.HCl、HBr、HI的热稳定性d.HCl、HBr、HI的酸性(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液NaClO3溶液KClO3固体沉淀完成①I中反应的总化学方程式:□NaCl+□H2O═□NaClO3+□_________.②Ⅱ中转化的基本反应类型是_________.(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:①步骤I若温度过高,将导致硝酸分解.硝酸分解的化学方程式为_________.②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O═2Fe2O3•nH2O+8HNO3,根据流程反应产生的稀HNO3又将废铁皮中的铁转化为Fe(NO3)2且没有气体生成,该反应的化学方程式为_________.③上述生产流程中,能体现“绿色化学”思想的是_________(任写一项).26.A、B、D、X、Y、Z为原子序数依次增大的六种元素,其中A、B、D、X、Y为短周期元素,Z为第四周期元素,Z还是前四周期中电负性最小的元素.已知:A原子的核外电子数与电子层数相等;B元素原子的核外p电子数比s电子数少1个;D原子的第一至第四电离能为I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol;X原子核外所有p轨道为全充满或半充满;Y元素的族序数与周期序数的差为3;(1)Z代表的元素对应的离子的核外电子排布式:_________.(2)某同学根据题目信息和掌握的知识分析X的核外电子排布为:该同学所画的轨道式违背了_________原理.(3)已知BA5为离子化合物,写出其电子式:_________.(4)元素X与元素Y相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________.a.常温下X的单质和Y的单质状态不同b.Y的氢化物比X的氢化物稳定c.一定条件下Y的单质能与氢氧化钠溶液反应,而X的单质不容易反应.d.Y的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物酸性强.(5)元素X和元素Y的第一电离能的大小关系为_________(填元素符号),理由为_________.27.A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.(1)当n=2时,AB2属于_________分子(填“极性”或“非极性”).(2)当n=3时,A与B形成的晶体属于_________晶体.。

人教版高中化学选修3同步练习及解析目录1.1 原子结构.doc1.1.1 能层、能级、构造原理1.1.2 能量最低原理、泡利原理、洪特规则1.2 原子结构与元素的性质1.2.1 原子结构与元素周期表1.2.2 元素周期律第1章单元质量检测试题及解析2.1.1 共价键2.1.2 键参数等电子体2.2 分子的立体构型2.2.1 价层电子对互斥理论2.2.2 杂化轨道理论2.2.3 配合物理论简介2.3 分子的性质第1课时键的极性和分子的极性2.3 分子的性质第2课时范德华力和氢键2.3.4 溶解性、手性、无机含氧酸分子的酸性第2章单元质量检测试题及解析3.1.1 晶体与非晶体3.1.2 晶胞3.2 分子晶体与原子晶体3.2.1 分子晶体3.2.2 原子晶体3.3 金属晶体3.3.1金属键、金属晶体的原子堆积模型.doc3.4 离子晶体3.4.1 离子晶体、晶格能第3章单元质量检测试题及解析1.1 原子结构基础落实知识点1 能层、能级、构造原理1.下列叙述正确的是A.能级就是电子层B.每个能层最多可容纳的电子数是2n2C.同一能层中的不同能级的能量高低相同D.不同能层中的s能级的能量高低相同2.下列有关认识正确的是A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n-1D.各能层含有的电子数为2n23.下列各项中,前面的能级先填入电子的是①3d和4s ②4p和5s ③5s和4d ④5p和4dA.①②B.②③C.②④D.③④知识点2 核外电子的排布规律4.下列电子排布图能表示氮原子的最低能量状态的是A.B.C.D.5.具有如下电子层结构的原子,其相应元素一定属于同一主族的是A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子B.3p亚层上只有1个空轨道的原子和4p亚层上只有1个空轨道的原子C.最外层电子排布为ns2的原子和最外层电子排布为ns2np6的原子D.最外层电子排布为3s2的原子和最外层电子排布为4s2的原子6.下列各组表述中,两个微粒一定不属于同种元素原子的是A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子C.最外层电子数是核外电子总数的的原子和最外层电子排布为4s24p5的原子D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子知识点3 原子光谱、电子云与原子轨道7.对充有氖气的霓虹灯管通电,灯管发出红色光。

高中化学精选内容重点知识精选高中更注重自学的能力,到大学之后这一能力会得到升华。
在开学之前就自己学习,不仅能纠正初中的学习方式,也能做到先人一步,做到温故而知新。
而对于升高二的同学,如果已经偏科了,那么可以利用假期把知识点巩固复习,不然后期就更难学习了!今天给大家整理了《高中化学全册笔记》每一章的基础知识点都有。
化学基础打好,内容知识熟记,肯定可以拿高分哟!高中化学和你一起共同进步学业有成!TB:小初高题库温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
课时训练·达标巩固区一、选择题1.(2015·烟台高二检测)下列晶体中属于原子晶体的是 ( )A.干冰B.食盐C.胆矾D.晶体硅【解析】选D。
常见的原子晶体中属于非金属单质的有金刚石、晶体硅、晶体硼等,属于非金属化合物的有二氧化硅、碳化硅、氮化硅等。
2.下列说法中不正确的是 ( )A.双键、叁键都有π键B.成键原子间原子轨道重叠越多,共价键越牢固C.因每个原子未成对电子数是一定的,故配对原子个数也一定D.所有原子轨道在空间都有自己的方向性【解析】选D。
s—sσ键无论s轨道从哪个方向重叠都相同,因此这种共价键没有方向性。
【易错提醒】(1)碳碳叁键和碳碳双键的键能不是碳碳单键键能的3倍和2倍,原因是这些键的类型不完全相同。
(2)键长约等于成键两原子的半径之和,实际上,由于轨道的重叠,前者比后者略短一些。
3.对σ键的认识不正确的是 ( )A.s-sσ键与s-pσ键的对称性相同B.σ键不属于共价键,是另一种化学键C.若分子中含有共价键,则至少含有一个σ键D.含有π键的化合物与只含σ键的化合物的化学性质不同【解析】选B。
因s轨道为球形对称,因此s-sσ键与s-pσ键的对称性相同,A 正确;σ键是共价键的一种,B错;若分子中含有共价键,则至少有一个σ键,C正确;形成π键时,一般会形成双键或叁键,因此与只含有σ键的化合物的化学性质不同,D正确。

高中化学学习材料唐玲出品河南省开封市板石高中2011-2012学年高二化学选修III综合测试题一、选择题:每小题只有一个正确答案,满分 48分1.下列表达方式错误的是A.CO2分子的比例模型 B.甲烷的电子式C.硫离子的核外电子排布式1s22s22p63s23p4 D.HClO的结构式:H-O-Cl2.气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是A.1s22s22p63s23p2→1s22s22p63s23p1 B.1s22s22p63s23p3→1s22s22p63s23p2C.1s22s22p63s23p4→1s22s22p63s23p3D.1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1 3.下列说法中正确的是A.在气体单质分子中,一定含有σ键,可能含有π键B.烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键C.等电子体结构相似,化学性质相同D.共价键的方向性决定了原子在形成分子时相互结合的数量关系4.据权威刊物报道,1996年科学家在宇宙中发现H3分子。
甲、乙、丙、丁四位学生对此报道的认识正确的是A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H+3D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展5.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是A.第一电离能Y可能小于X B.气态氢化物的稳定性:H m Y大于H n XC.最高价含氧酸的酸性:X对应的酸性强于Y对应的D.X和Y形成化合物时,X显负价,Y显正价6.下列价电子表示正确的是A.29Cu:3d94s2 B.20Ca:3d2 C.39Y :4d15s2 D.26Fe:3d54s27.下列有关晶体的叙述中,错误的是( )A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子B.白磷分子晶体中,微粒之间通过共价键结合,键角为60°C.在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl- (或Na+)D.离子晶体在熔化时,离于键被破坏,而分子晶体熔化时,化学键不被破坏8.下列各组元素性质的递变情况错误的是A.Li、Be、B原子最外层电子数依次增多 B.P、S、Cl元素最高正价依次升高C.N、O、F电负性依次增大 D.Na、Mg、Al第一电离能逐渐增大9.关于原子轨道的说法正确的是A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键10.向下列配合物的水溶液中加入AgNO3溶液不.能生成AgCl沉淀的是A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3] C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl211. 下列物质固态时,一定是分子晶体的是()A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸12.下列对一些实验事实的理论解释不正确...的是 ( )选项客观事实理论解释A.在水中,NaCl的溶解度比I2的溶解度大NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力B.酸性:HClO<H2CO3非金属:C>ClC.原子半径:Cl<S Cl、S原子电子层数相同,但氯原子核电荷数较硫多,对核外电子吸引能力比硫强D.水分子比H2S分子稳定H-O键比H-S键稳定13.下列分子中的中心原子杂化轨道的类型相同的是A.CO2与SO2 B.CH4与NH3 C.BeCl2与BF3 D.C2H2与C2H414.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
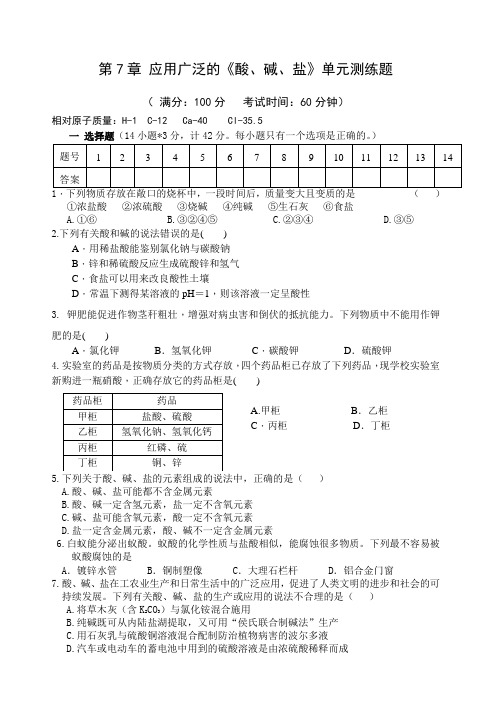
第7章 应用广泛的《酸、碱、盐》单元测练题( 满分:100分 考试时间:60分钟)相对原子质量:H-1 C-12 Ca-40 Cl-35.5 一 选择题(14小题*3分,计42分。
每小题只有一个选项是正确的。
)题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 答案1.下列物质存放在敞口的烧杯中,一段时间后,质量变大且变质的是 ( ) ①浓盐酸 ②浓硫酸 ③烧碱 ④纯碱 ⑤生石灰 ⑥食盐A.①⑥B.③②④⑤C.②③④D.③⑤2.下列有关酸和碱的说法错误的是( )A .用稀盐酸能鉴别氯化钠与碳酸钠B .锌和稀硫酸反应生成硫酸锌和氢气C .食盐可以用来改良酸性土壤D .常温下测得某溶液的pH =1,则该溶液一定呈酸性3. 钾肥能促进作物茎秆粗壮,增强对病虫害和倒伏的抵抗能力。
下列物质中不能用作钾肥的是( )A .氯化钾B .氢氧化钾C .碳酸钾D .硫酸钾4.实验室的药品是按物质分类的方式存放,四个药品柜已存放了下列药品,现学校实验室新购进一瓶硝酸,正确存放它的药品柜是( )A.甲柜 B .乙柜 C .丙柜 D .丁柜5.下列关于酸、碱、盐的元素组成的说法中,正确的是( )A.酸、碱、盐可能都不含金属元素B.酸、碱一定含氢元素,盐一定不含氧元素C.碱、盐可能含氧元素,酸一定不含氧元素D.盐一定含金属元素,酸、碱不一定含金属元素6.白蚁能分泌出蚁酸。
蚁酸的化学性质与盐酸相似,能腐蚀很多物质。
下列最不容易被 蚁酸腐蚀的是A .镀锌水管B .铜制塑像C .大理石栏杆D .铝合金门窗7.酸、碱、盐在工农业生产和日常生活中的广泛应用,促进了人类文明的进步和社会的可持续发展。
下列有关酸、碱、盐的生产或应用的说法不合理的是( )A.将草木灰(含K 2CO 3)与氯化铵混合施用B.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产C.用石灰乳与硫酸铜溶液混合配制防治植物病害的波尔多液D.汽车或电动车的蓄电池中用到的硫酸溶液是由浓硫酸稀释而成 药品柜 药品甲柜 盐酸、硫酸 乙柜 氢氧化钠、氢氧化钙 丙柜 红磷、硫 丁柜 铜、锌8.向一定量的氢氧化钠溶液中逐滴加入等质量分数的稀盐酸至过量,下列有关量的变化与所加入的稀盐酸质量的关系,不正确的是()图Z-2-29下列离子可在同一溶液中大量共存,形成无色溶液的一组是()A.K+、Na+、OH-、Cl-B.Ba2+、Cu2+、NO3-、SO42-C.Mg2+、Na+、OH-、SO42-D.H+、Ba2+、NO3-、OH-10.蚊虫叮咬时会分泌蚁酸,使叮咬处肿胀痛痒。
高中化学学习材料鼎尚图文收集整理2014-2015学年宜阳一高培优部高二年级选修3物质结构与性质复习备考强化训练二(带解析)一.选择题(共30小题)1.(2013•湖南二模)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍.下列说法不正确的是()A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸D.Z的氢化物比X的氢化物更稳定2.(2013•天河区一模)根据下列三种微粒结构示意图,所获取信息不正确的是()A.②③化学性质相同B.它们表示两种元素C.①表示的是原子,②表示的是离子D.②表示的元素是金属元素3.(2013•连云港一模)X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零.下列说法正确的是()A.单质的氧化性:X>MB.气态氢化物的热稳定性:M>NC.X与Y简单离子半径:r(X离子)<r(Y离子)D.化合物ZX2与ZN4含有相同类型的化学键4.(2013•烟台模拟)下列关于原子结构和元素周期律的说法不正确的是()A.32S与33S的中子数不等,属于两种不同的核素B.I IA族元素的金属性不可能比IA族元素的金属性强C.非金属元素之间既可以形成离子键又可以形成共价键D.H F、HC1、HBr、HI的稳定性依次减弱,还原性依次增强5.(2013•闵行区二模)现代无机化学对硫﹣氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫﹣氮化合物的分子结构.下列说法正确的是()A.该物质的分子式为SNB.该物质的分子中既含有极性键又含有非极性键C.该物质具有很高的熔、沸点D.该物质与化合物S2N2互为同素异形体6.(2013•海淀区一模)现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是()A.简单阳离子的氧化性:Y>XB.气态氢化物的稳定性:Z>MC.简单离子半径由大到小的顺序是:Z>M>YD.等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z>Y2Z7.(2013•南昌模拟)X、Y、Z、W为四种短期周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高价与最低负价的代数和为6.下列说法正确的是()A.原子半径大小的顺序为W>X>Y>ZB.Y、Z两元素形成的简单阴离子的还原性Z>YC.X与W形成的化合物W2X2中含有离子键和共价键D.X、Z两种元素最高价氧化物对应水化物的酸性Z>Y8.(2013•潍坊一模)短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是()A.B e、Na、Al B.C、Al、P C.0、P、Cl D.B、Mg、Si9.(2013•朝阳区一模)Se、Br两种元素的部分信息如图所示,下列说法正确的是()A.原子半径:Br>Se>P B.还原性:S2﹣>Se2﹣>Br﹣C.S eO2既有氧化性又有还原性D.在Se2Br2分子中只含有极性键10.(2013•青岛一模)元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是()A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素B.某微粒的结构示意简图为,则该元素在周期表中位于第三周期、VIA族C.B e(OH)2的碱性比Mg(OH)2的碱性强D.原子半径:Na>Si>O11.(2013•徐州模拟)X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是()A.X与Y能形成两种常见的气态化合物B.原子半径的大小顺序:r x>r y>r z>r RC.X、Z分别与R形成的化合物中化学键类型不同D.含有Y、Z、R三种元素的化合物最多只有2种12.(2013•江门一模)X,Y,Z,M,N五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y,M同主族,可形成MY2,MY3两种分子.一下列说法正确的是()A.原子半径:N>ZB.单质的氧化性:Y>MC.X、Z,\M的氧化物均为共价化合物D.M,N的最高价氧化物对应的水化物均属于强酸13.(2013•常州一模)X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示.Z元素原子最外层电子数是内层电子总数的.下列说法正确的是()X YZ WA.原子半径由小到大的顺序为X<Z<Y<WB.Y元素最高价氧化物对应的水化物化学式为H3YO4C.X、Z两种元素的氧化物中所含化学键类型相同D.Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高14.(2013•惠州一模)短周期元素X、Y、Z、R在周期表中的位置如图.下列说法正确的是()X YZ RA.气态氢化物的稳定性:X>YB.原子半径大小:Y>ZC.X和Y形成的化合物是离子化合物D.Z、R的最高价氧化物对应的水化物都是强酸15.(2013•枣庄二模)下列说法正确的是()A.镁、铝、铜、铁、钠五种元素中,铜和铁均为副族元素B.10Be和9Be是中子数不同质子数相同的同种核素C.元素X位于元素Y的上一周期,X原子得电子能力强于Y原子D.短周期的同主族元素原子序数差值可能为2、8、1016.(2012•北京)已知33As、35Br位于同一周期.下列关系正确的是()A.原子半径:As>Cl>P B.热稳定性:HCl>AsH3>HBrC.还原性:As3﹣>S2﹣>Cl﹣D.酸性:H3AsO4>H2SO4>H3PO417.(2012•岳阳二模)X、Y、Z和R分别代表四种元素.如果a X m+、b Y n+、c Z n﹣、d R m﹣四种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是()A.a﹣c=m﹣n B.a﹣b=n﹣m C.c﹣d=m+n D.b﹣d=n+m18.(2012•南开区一模)下列叙述正确的是()A.L i、Na、K的原子半径和密度随原子序数的增加而增大B.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强C.电解MgCl2、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、MgD.制备MgCl2、FeCl3、CuCl2均可采用将溶液直接蒸干的方法19.(2012•崇明县一模)下列分子中所有原子都满足最外层为8电子结构的是()A.S iCl4B.H2O C.B F3D.P Cl520.(2012•黄浦区一模)关于1s、2s、3s、4s原子轨道的说法,正确的是()A.电子只能在电子云轮廓图中运动B.能级不同,电子云轮廓图形状相同C.轨道数目相同,电子云轮廓图形状、大小完全相同D.能层不同,电子云轮廓图形状不相同21.(2012•湖北模拟)下列化学用语或表达式正确的是()A.N a+的电子排布式:1S22S22P6B.乙烯的结构简式CH2CH2D.C.N原子最外层轨道表示式:22.(2012•太原一模)X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体.W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.下列说法正确的是()A.原子半径:W>Y>Z>XB.气态氢化物的稳定性:X<ZC.最高价氧化物对应水化物的碱性:Y>WD.Y、Z的氧化物都有酸性和碱性23.(2012•湖北一模)元素X、Y、Z原子序数之和为33,X、Y在同一周期,X+与Z2﹣具有相同的核外电子层结构.下列推测不正确的是()A.同周期元素中X的金属性最强B.同族元素中Z的氢化物沸点最高C.原子半径X>Y,离子半径X+>Z2﹣D.Y的单质和氧化物有相同的晶体类型24.(2012•西城区一模)现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素.下列说法不正确的是()A.原子半径:Y<Q<WB.Z X3可使紫色石蕊溶液变蓝C.X、Z、Q 3种元素可组成离子化合物或共价化合物D.X2Q2、Y2X62种分子中含有的电子数、化学键种类都相同25.(2012•石景山区一模)已知短周期元素的四种离子:a A2+、b B+、c C3﹣、d D﹣都具有相同的电子层结构,则下列叙述中正确的是()A.原子序数d>c>b>aB.单质的还原性D<C<B<AC.离子半径C3﹣>D﹣>B+>A2+D.A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A26.(2012•大连模拟)已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,且Y的最外层上电子数比Z的最外层上电子数少1,则下列说法错误的是()A.Y和Z可以组成一种Y和Z的质量比为7:20的化合物B.X、Y、Z可以组成一种盐,其中X、Y、Z元素原子个数之比为4:2:3C.X和Z可以组成原子个数之比分别为1:1和2:1常温下为液态的两种化合物D.由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种27.(2012•杭州一模)W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是()A.W、X、Y形成的简单离子核外电子数相同B.Z和W可形成原子个数比为1:2和1:3的共价化合物C.Y和Z形成的化合物可以通过复分解反应制得D.X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应28.(2012•徐汇区一模)阴离子C8H﹣的结构简式为HC≡C﹣C≡C﹣C≡C﹣C≡C﹣.关于该粒子的推断正确的是()A.一个阴离子含有34个价电子B.该离子能与溴水、酸性高锰酸钾依次发生氧化、加成反应C.在一定条件下,1 mol C8H﹣与8 mol H2完全反应生成辛烷D.在酸性溶液中,该阴离子与H+反应生成1,3,5,7﹣辛四炔29.(2012•惠州模拟)X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是()A.原子半径:Y>Z>XB.气态氢化物的热稳定性:X<ZC.y和z的最高价氧化物对应水化物均为强酸D.若z的最高正价为+m,则X的最高正价也一定为+m30.(2012•镜湖区模拟)X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若W原子的最外层电子数是内层电子总数的,下列说法中正确的是()A.阴离子的半径从大到小排列顺序为:X>Y>Z>WB.X、Y两元素的氢化物分子间分别均可以形成氢键C.Y的两种同素异形体在常温下可以相互转化D.最高价氧化物对应的水化物的酸性:Z>W选修3第1章选择题2参考答案与试题解析一.选择题(共30小题)1.(2013•湖南二模)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍.下列说法不正确的是()A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸D.Z的氢化物比X的氢化物更稳定考点:原子结构与元素的性质.专题:元素周期律与元素周期表专题.分析:短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14,X与Y、Z位于相邻周期,则Y和Z位于同一周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍,原子最外层电子数不超过8,所以X内层为K层,K层电子数是2,所以Z最外层电子数是6,Y最外层电子数是3,X、Y、Z最外层电子数之和为14,所以X最外层电子数=14﹣6﹣3=5,所以X核外电子数是7,为N元素;N元素位于第二周期,Y和Z位于第三周期,Y的最外层电子数是3、Z原子最外层电子数是6,所以Y是Al、Z是S元素,再结合物质性质解答.解答:解:短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14,X与Y、Z位于相邻周期,则Y和Z位于同一周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍,原子最外层电子数不超过8,所以X内层为K层,K层电子数是2,所以Z最外层电子数是6,Y最外层电子数是3,X、Y、Z最外层电子数之和为14,所以X最外层电子数=14﹣6﹣3=5,所以X核外电子数是7,为N元素;N元素位于第二周期,Y和Z位于第三周期,Y的最外层电子数是3、Z原子最外层电子数是6,所以Y是Al、Z是S元素,A.X的氢化物是NH3,X的最高价氧化物的水化物是HNO3,氨水溶液呈碱性、硝酸溶液呈酸性,故A正确;B.Y的氧化物是Al2O3,氧化铝既可与强酸反应又可与强碱反应,属于两性氧化物,氧化铝熔点很高,所以并可用来制作耐火材料,故B正确;C.X和Z的最高价氧化物对应的水化物分别是HNO3、H2SO4,浓硝酸和浓硫酸都是强氧化性酸,故C正确;D.非金属性N>S,所以X的氢化物比Z的氢化物更稳定,故D错误;故选D.点评:本题考查了原子结构和元素周期律的关系,根据原子结构正确推断元素是解本题关键,再结合元素周期律来分析解答,知道氧化铝具有两性,熟练掌握元素化合物知识,题目难度不大.2.(2013•天河区一模)根据下列三种微粒结构示意图,所获取信息不正确的是()A.②③化学性质相同B.它们表示两种元素C.①表示的是原子,②表示的是离子D.②表示的元素是金属元素考点:原子结构与元素的性质.专题:原子组成与结构专题.分析:A.主族元素的化学性质与其最外层电子数有关;B.元素是具有相同质子数(或核电荷数)的同一类原子;C.原子中核内质子数=核外电子数,离子中核外电子数不等于核内质子数;D.先根据质子数确定该元素,然后确定是否是金属.解答:解:A.②③中最外层电子数不同,所以其化学性质不同,故A错误;B.①核内质子数是7,为N元素,②、③核内质子数是13,属于同一种元素,所以这三种微粒是两种元素,故B正确;C.①中核内质子数=核外电子数,所以是原子,②中核内质子数>核外电子数,所以是阳离子,故C正确;D.②是13号元素,为Al元素,属于金属元素,故D正确;故选A.点评:本题考查微粒的判断,难度不大,注意元素的化学性质与其价电子数有关.3.(2013•连云港一模)X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零.下列说法正确的是()A.单质的氧化性:X>MB.气态氢化物的热稳定性:M>NC.X与Y简单离子半径:r(X离子)<r(Y离子)D.化合物ZX2与ZN4含有相同类型的化学键考点:原子结构与元素的性质;原子结构与元素周期律的关系.专题:元素周期律与元素周期表专题.分析:X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,已知X的最外层电子数是次外层电子数的3倍,则X是O元素;X、M同主族,且M的原子序数大于X,所以M是S元素;Y在同周期主族元素中原子半径最大,且原子序数大于X的短周期元素,则Y是Na元素;Z的最高化合价与最低化合价的代数和为零,且原子序数大于Y,所以Z是Si元素;N是原子序数大于M的短周期主族元素,所以N是Cl元素.解答:解:X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,已知X的最外层电子数是次外层电子数的3倍,则X是O元素;X、M同主族,且M的原子序数大于X,所以M是S元素;Y在同周期主族元素中原子半径最大,且原子序数大于X的短周期元素,则Y是Na元素;Z的最高化合价与最低化合价的代数和为零,且原子序数大于Y,所以Z是Si元素;N是原子序数大于M的短周期主族元素,所以N是Cl元素,A.同一主族元素中,随着原子序数的增大元素的非金属性逐渐减弱,其单质的氧化性逐渐减弱,故A正确;B.同一周期非金属元素中,氢化物的稳定性随着原子序数的增大而增大,故B错误;C.电子层数相同的阴阳离子,阴离子半径大于阳离子半径,所以r(X离子)>r(Y离子),故C错误;D.化合物SiO2与SiCl4都是共价化合物,都只含共价键,所以含有相同类型的化学键,故D正确;故选AD.点评:本题以元素推断为载体考查元素化合物、元素周期律知识,正确推断元素的解本题关键,明确电子层结构相同离子半径的比较方法,为常考查点.4.(2013•烟台模拟)下列关于原子结构和元素周期律的说法不正确的是()A.32S与33S的中子数不等,属于两种不同的核素B.I IA族元素的金属性不可能比IA族元素的金属性强C.非金属元素之间既可以形成离子键又可以形成共价键D.H F、HC1、HBr、HI的稳定性依次减弱,还原性依次增强考点:原子结构与元素的性质.专题:元素周期律与元素周期表专题.分析:A.质子数相同中子数不同的同一元素互称同位素;B.第IIA族元素的金属性可能比IA族元素的金属性强;C.非金属元素之间易形成共价键,非金属元素形成的离子间存在离子键;D.同一主族元素,元素的非金属性随着原子序数的增大而减小,非金属性越强的元素,其氢化物越稳定,还原性越弱.解答:解:A.32S与33S是属于中子数不等同一元素,属于两种不同的核素,故A正确;B.第IIA族元素的金属性可能比IA族元素的金属性强,如镁的金属性比氢元素的强,故B错误;C.非金属元素之间既可以形成离子键又可以形成共价键,如氯化铵中既含离子键又含共价键,故C正确;D.非金属的非金属性越强,其氢化物越稳定,还原性越弱,F、C1、Br、I的非金属性逐渐减弱,所以其稳定性依次减弱,还原性依次增强,故D正确;故选B.点评:本题考查原子结构及元素性质,利用元素周期律来分析解答,注意某些特例,为易错点.5.(2013•闵行区二模)现代无机化学对硫﹣氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫﹣氮化合物的分子结构.下列说法正确的是()A.该物质的分子式为SNB.该物质的分子中既含有极性键又含有非极性键C.该物质具有很高的熔、沸点D.该物质与化合物S2N2互为同素异形体考点:物质的结构与性质之间的关系.专题:化学键与晶体结构.分析:A.该化合物属于分子晶体,该结构中的原子个数属于一个分子中的,根据结构确定其分子式;B.不同非金属元素之间形成极性键;C.根据晶体类型确定其熔沸点高低;D.由同种元素组成的不同单质互称同素异形体,同素异形体首先必须是单质.解答:解:A.由图知该物质的分子式为S4N4,故A错误;B.该物质的分子中既有极性键(N﹣S)又有非极性键(S﹣S),故B正确;C.该物质属于分子晶体,分子晶体的熔沸点一般较低,故C错误;D.由同种元素组成的不同单质互称同素异形体,S2N2和S4N4都是化合物,故D错误.故选:B.点评:本题考查分子式的确定、极性键、同素异形体等知识点,注意分子晶体的熔沸点一般较低,易错选项是A,注意不能利用均摊法确定其化学式.6.(2013•海淀区一模)现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是()A.简单阳离子的氧化性:Y>XB.气态氢化物的稳定性:Z>MC.简单离子半径由大到小的顺序是:Z>M>YD.等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z>Y2Z考点:位置结构性质的相互关系应用.专题:元素周期律与元素周期表专题.分析:短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,则X是H元素,Z的核电荷数是M的2倍且Z、M位于同主族,所以Z是S元素、M是O元素,因为Y、Z位于同周期,所以Y是Na元素,A.原子失电子能力越强,其简单阳离子得电子能力越弱;B.非金属的金属性越强,其气态氢化物越稳定;C.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小;D.酸或碱抑制水电离,含有弱离子的盐促进水电离.解答:解:短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,则X是H元素,Z的核电荷数是M的2倍且Z、M位于同主族,所以Z是S元素、M是O 元素,因为Y、Z位于同周期,所以Y是Na元素,即X、Y、Z、M分别是H、Na、S、O元素,A.原子失电子能力越强,其简单阳离子得电子能力越弱,Na失电子能力大于H,所以得电子能力:H+>Na+,即简单阳离子的氧化性:Y<X,故A错误;B.非金属的金属性越强,其气态氢化物越稳定,非金属性M>Z,所以气态氢化物的稳定性:Z<M,故B 错误;C.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,S 2﹣电子层数最多,所以其离子半径最大,Na+半径小于O2﹣,所以这三种离子半径大小顺序是Z>M>Y,故C 正确;D.酸或碱抑制水电离,含有弱离子的盐促进水电离,等浓度的H2S与Na2S的溶液中,硫化氢抑制水电离,硫化钠促进水电离,所以水的电离程度:X2Z<Y2Z,故D错误;故选C.点评:本题考查了元素位置结构性质相互关系及应用,解答此题时要熟悉元素周期表的结构及原子之间的关系,再结合元素周期律来分析解答,知道哪些物质促进水电离、哪些物质抑制水电离,同时考查学生灵活运用知识能力,题目难度中等.7.(2013•南昌模拟)X、Y、Z、W为四种短期周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高价与最低负价的代数和为6.下列说法正确的是()A.原子半径大小的顺序为W>X>Y>ZB.Y、Z两元素形成的简单阴离子的还原性Z>YC.X与W形成的化合物W2X2中含有离子键和共价键D.X、Z两种元素最高价氧化物对应水化物的酸性Z>Y考点:位置结构性质的相互关系应用.专题:元素周期律与元素周期表专题.分析:X原子最外层电子数是核外电子层数的3倍,则X为O元素,X、Z同族,则Z为S元素,Y的最高正价与最低负价的代数和为6,则Y的最高价为+7价,为第VIIA族元素,且与硫同周期,所以Y为Cl元素,W为H元素,结合元素周期律的递变规律来分析解答.解答:解:X原子最外层电子数是核外电子层数的3倍,则X为O元素,X、Z同族,则Z为S元素,Y的最高正价与最低负价的代数和为6,则Y的最高价为+7价,为第VIIA族元素,且与硫同周期,所以Y为Cl元素,W为H元素,A.元素周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则原子半径由小到大的顺序为H<O<Cl<S,故A错误;B.Y是Cl元素,Z是S元素,同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其阴离子的还原性越弱,所以Y、Z两元素形成的简单阴离子的还原性Z>Y,故B正确;C.O是H元素,W是H元素,X与W形成的化合物H2O2中含有极性共价键和非极性共价键,不含离子键,故C错误;D.X是O元素,Z是S元素,O元素没有最高价氧化物的水化物,故D错误;故选B.点评:本题考查了元素位置结构关系的应用,根据其结构关系来确定元素,并结合元素周期律来分析解答,难度中等.8.(2013•潍坊一模)短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是()A.B e、Na、Al B.C、Al、P C.0、P、Cl D.B、Mg、Si考点:位置结构性质的相互关系应用.专题:元素周期律与元素周期表专题.分析:A、B、C均为短周期元素,设A的原子序数为x,由图可知,B的原子序数为x+7,C的原子序数为x+9,B、C两元素的原子序数之和是A元素原子序数的4倍,以此来解答.解答:解:A、B、C均为短周期元素,设A的原子序数为x,由图可知,A为第二周期,B、C在第三周期,B的原子序数为x+7,C的原子序数为x+9,由B、C两元素的核电荷数之和是A元素原子序数的4倍,则x+7+x+9=4x,解得x=8,则A为O,B为P,C为Cl,故选C.点评:本题考查位置、结构、性质的关系,明确图中的位置得出原子序数的关系是解答本题的关键,难度不大.9.(2013•朝阳区一模)Se、Br两种元素的部分信息如图所示,下列说法正确的是()A.原子半径:Br>Se>P B.还原性:S2﹣>Se2﹣>Br﹣C.S eO2既有氧化性又有还原性D.在Se2Br2分子中只含有极性键考点:位置结构性质的相互关系应用.专题:元素周期律与元素周期表专题.分析:A.同一周期元素,原子半径随着原子序数增大而减小,不同周期元素,原子的电子层数越多其原子半径越大;B.同一周期元素,阴离子的还原性随着原子序数的增大而减小,同一主族元素,阴离子的还原性随着原子序数的增大而增大;C.中间价态的元素既有氧化性又有还原性,处于最低价态的元素只有还原性,处于最高价态的元素只有氧化性;D.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键.解答:解:A.硒和溴属于同一周期元素,硒的原子序数小于溴,所以原子半径Br<Se,P处于第二周期,溴处于第四周期,所以原子半径Br>P,故A错误;。
高中化学学习材料 (精心收集**整理制作) 河南省信阳市二高2016高三化学复习精选训练题: 选修3 物质结构与性质 综合训练(有解析) 1.据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60的结构。下列叙述正确的是 ( ) A.该物质有很高的熔点、很大的硬度 B.该物质形成的晶体属分子晶体 C.该物质分子中Si60被包裹在C60里面 D.C60易溶于水 2.如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl- 离子核间距为a cm,氯化铯的摩尔质量为M g/mol,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
A. B. C. D. 3.元素X的原子核外第三层上有3个电子,元素Y的负二价离子核外有10个电子,则这两种元素形成化合物的化学式为( ) A.XY2 B.X2Y3 C.X2Y D.X3Y2 4.下列叙述不正确的是( ) A.CH4O和C2H6O都符合CnH2n+2O的通式,它们可能互为同系物 B.16 g CH4与18 gNH4+所含质子数相等 C.32S与33S的质子数相等,属于同一种元素的不同核素 D.质量相等、体积不等的N2和C2H4的分子数一定相等 5.下图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子最外电子层电子数是其内层电子数的7/10,则下列说法中不正确...的是( ) A.X元素的氢化物水溶液呈碱性 B.气态氢化物的稳定性:Y>Z C.最高氧化物对应水化物的酸性:W>Z D.阴离子半径从大到小排列的顺序:Y>Z>W 6.下列物质中含有离子键的是( ) A.Cl2 B.H2O C.CH4 D.KOH 7.下列说法正确的是( ) A.难失电子的原子,得电子的能力一定强 B. 在地球上元素的分布和它们在元素周期表中的位置有密切关系 C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大 D.元素周期表中在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 8.元素的下列性质,随着原子序数的递增不呈周期性变化的是( ) A.单质的物理性质 B.化合价 C.原子半径 D.元素金属性、非金属性 9.下列物质:①CO2;②CCl4;③NH3;④BF3;⑤H2O;⑥HBr中,分子中电荷的空间分布是对称的是( A.①②④ B. C.④⑤ D.①② 10.下列物质属于离子化合物的是( ) A.C60 B.HCl C. C6H6 D.CaCI2 11.氯有两种稳定的天然同位素37Cl、35Cl,氯元素的相对原子质量为35.5,则对氯元素中37Cl的质量分数的判断正确的是( ) A.25% B.略大于25% C.75% D.略小于75% 12.我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
A.任何分子式中的“· ”都表示氢键 B.H2O2是极性分子,其结构简式为HO—OH C.H2O2既有氧化性又有还原性 D.H2NCONH2与H2O2是通过氢键结合的 13.关于11~17号元素的性质比较中:①元素的最高正化合价依次升高;②元素的非金属性逐渐增强;③元素的金属性依次减弱;④元素的最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强,正确的说法是 ( ) A.只有①②正确 B.只有③④正确 C.全都不正确 D.全都正确 14.下列物质属于离子化合物的是 ( ) A.C60 B.HCl C. C6H6 D.CaCI2 15.下列物质性质的变化规律,与共价键的键能大小有关的是( ) ①F2、Cl2、Br2、I2的熔点、沸点逐渐升高 ②HF、HCl、HBr、HI的热稳定性依次减弱 ③金刚石的硬度、熔点、沸点都高于晶体硅 ④NaF、NaCl、NaBr、NaI的熔点依次降低 A. 仅② B.仅③ C. ②③ D. ①②③ 16.下列叙述中能肯定A的金属性比B的金属性强的是( ) A.A原子的最外层电子数比B原子的最外层电子数少 B.A原子的电子层数比B原子的电子层数多 C.1mol A从酸中置换出的H2比1mol B从酸中置换出的H2多 D.常温时,A能从水中置换出氢,而B不能 17.下列叙述中的非金属元素,其氢化物最稳定的是( ) A.构成矿物和岩石的主要元素 B.空气中含量最多的元素 C.单质在常温下是液态的元素 D.地壳中含量最多的元素 18.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( ) A.质子数:c>d B.离子的还原性:Y2->Z- C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W 19.已知A、B、C、D、E是短周期中的5种元素,它们的原子序数依次增大。A在周期表中原子半径最小,B原子的最外层电子数是内层电子数的2倍,D元素与A元素同主族。E元素与C元素同主族;E的单质为黄色晶体,易溶于二硫化碳。 ①画出A的阴离子的结构示意图 。 ②C的单质和D的单质在点燃条件下反应生成化合物X,该反应的化学方程式为 。将产物加入滴有酚酞的水中,观察到的现象为 。 ③将9gB单质在足量的C单质中燃烧,所得气体通入1L1.0mol·L-1NaOH溶液中,完全吸收后,溶液中存在的离子按浓度由大到小的排列顺序是 。 ④将E的单质在足量的C的单质中燃烧,所得主要气体为Y。将Y通入X中,X与Y可能发生的反应的化学方程式有 。 20.某研究性学习小组设计了如下二组实验: (I)实验验证元素周期律中, 非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。设计了如下图装置以验证氮、碳、硅元素的非金属性强弱。 设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。 (1)写出所选用物质的化学式: A: ,B: ,C: 。 (2)写出烧杯中发生反应的离子方程式: 。 (Ⅱ )为比较Fe3+和Cu2+对H2O2的催化效果,甲、乙两位同学分别设计了如图一、图二所示的实验。 (1)图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,或者将FeCl3 溶液改成物质的量浓度为 mol/L 的Fe2(SO4)3溶液。
(2)检查图二装置气密性的方法是 ; 图二所示实验中需测量的数据是 。
21.(7分)已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。A元素原子形成的离子就是一个质子,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶入CS2 (1)请写出元素符号:B ;C ; (2)画出E的阴离子结构示意图: ; (3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为 ; (4)将9gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L的NaOH溶液中,完 全吸收后,溶液中(除Na+外)浓度最大的离子是 。 22.短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
乙 丙 丁
甲 戊 (1)甲在元素周期表中的位置是 。 (2)原子半径:甲 丁(填“>”或“<”)。 (3)乙与戊组成化合物的电子式为 ,其中化学键的类型是 (填“极性”或“非极性”)共价键。 (4)元素的非金属性:甲 丙(填“>”或“<”),下列事实能说明该结论的是 。 A、丙的氢化物稳定,甲的氢化物不稳定 B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸 C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶 (5)丙的单质的电子式为 ,乙与丁的原子构成的三原子分子的电子式为 。 23.某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。 I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。 (1)将X、Y、Z的元素符号填在右图所示元素周期表(局部)中的相应位置上。
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的化学方程式为___ ___。 (3)一定条件下,1mol XW3气体与O2完全反应生成X元素的单质和液态水,放出 382.8 kJ热量。该反应的热化学方程式为________________________。 II.若Z是形成化合物种类最多的元素。 (4)该氮肥的名称是______ (填一种)。 (5)HR是含Z元素的一元酸。室温时,用0.250mol•L—1 NaOH溶 液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。其中,a点表示两种物质恰好完全反应。
①右图中x______7(填“>”、“<”或“=”)。 ②室温时,HR的电离常数Ka=______ (填数值)。 参考答案 1.B 【解析】 试题分析:该物质的的分子式为C60Si60,这说明该物质形成的晶体类型是分子晶体,A不正确,B正确;碳原子半径小于硅原子半径,所以该物质分子中Si60不可能包裹在C60里面,C不正确。水是极性分子,该物质是非极性分子,难溶于水,D不正确,大啊啊阿香B。 考点:考查晶体类型、结构和性质判断 点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生的应试能力和学习效率。 2.C 【解析】
试题分析:根据晶胞的结构可知,两种离子的个数都是1个,所以13ANMa,解得ρ=
,答案选C。 考点:考查晶胞密度的计算 点评:该题是高考中的常见考点,属于中等难度题的考查。试题综合性强,难易适中,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是准确判断出晶胞中含有的原子个数,然后直接列式计算即可。 3.B 【解析】 4.B 【解析】 5.D 【解析】 6.D 【解析】 试题分析:活泼金属与活泼非金属之间易形成离子键,非金属之间易形成共价键,强碱属于离子化合物,含有离子键,选D。 考点:考查化学键的类型。 7.D 【解析】略 8.A 【解析】在元素周期律中,元素的性质主要是指化合价、原子半径和元素的金属性以及非金属性,而不是指单质的物理性质,答案选A。 9.A 【解析】分子结构的对称性决定了分子中电荷的空间分布的对称性,其中①②④的分子空间结构