
螺旋体染色液(Levaditi 硝酸银法)
简介:
螺旋体(spirochaeta)是一类细长、弯曲呈螺旋状、运动活波的原核细胞型微生物,具有细菌的基本结构,细胞壁有脂多糖和壁酸。螺旋体染色液(Levaditi 硝酸银法)是利用螺旋体具有的嗜银性,在一定条件下螺旋体可从银液中吸附银离子,经还原液处理后,螺旋体内吸附的银离子被还原为黑色的金属银而显色。该染色液主要用于显示梅毒螺旋体,亦可显示钩端螺旋体,但较少显示热回归螺旋体。
组成:
操作步骤(仅供参考):
1、 组织切片厚度1~2mm 为佳。
2、 流水冲洗过夜。
3、 95%乙醇浸泡。
4、 蒸馏水浸洗并不停摇动,直至组织下沉为止。
5、 更换新的蒸馏水浸。
6、 入硝酸银溶液,加盖置于恒温箱孵育。
7、 蒸馏水浸洗3次。
8、 入配制好的Levaditi 还原液,加盖室温避光孵育。
9、 蒸馏水浸洗3次,每次2min 。
10、常规脱水透明,浸蜡包埋。
11、切片厚度6~8μm ,贴片,烤干。
12、二甲苯脱蜡2次,中性树胶封固。
染色结果:
梅毒螺旋体、钩端螺旋体
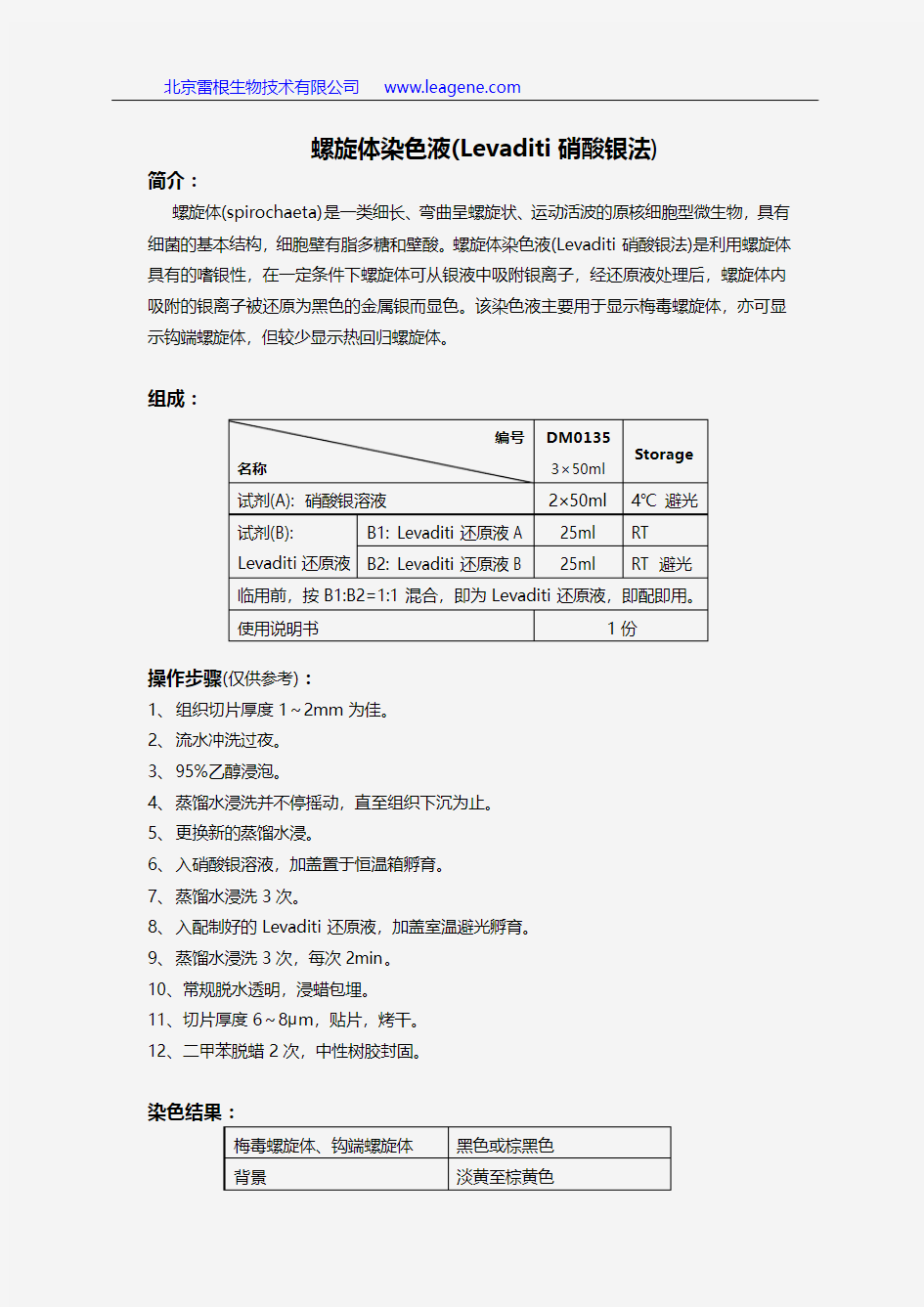
黑色或棕黑色 背景 淡黄至棕黄色 编号 名称 DM0135 3×50ml Storage 试剂(A): 硝酸银溶液 2×50ml 4℃ 避光 试剂(B): Levaditi 还原液 B1: Levaditi 还原液A 25ml RT B2: Levaditi 还原液B 25ml RT 避光 临用前,按B1:B2=1:1混合,即为Levaditi 还原液,即配即用。 使用说明书 1份
注意事项:
1、实验所用器皿需用硫酸洗液浸泡,洗干净。
2、某些细菌和真菌菌丝也会被该染液染成黑色,应注意螺线体为螺旋状形态。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。
微生物实验报告——细菌鞭毛染色及活菌运动观察摘要 关键词 前言 实验目的 实验原理 A.细菌鞭毛染色法的基本原理 B.压滴法观察活菌运动的基本原理实验器材 实验内容 (一)压滴法观察活菌运动 (二)细菌鞭毛染色 实验结果
参考文献 报告编写人:张行润 生命科学学院生科四班 200900140177 细菌鞭毛染色及活菌运动观察 摘要 鞭毛是细菌的运动“器官”,细菌是否具有鞭毛,以及鞭毛着生的位置和数目是细茵的一项重要形态特征.细菌的鞭毛很纤细,其直径通常为0 . 01 ~0.02um ,所以,除了很少数能形成毛束(由许多根鞭毛构成)的细菌可以用相差显微镜直接观察到鞭毛束的存在外,一般细菌的鞭毛均不能用光学显微镜直接观察到,而只能用电子显微镜观察.要用普通光学显微镜观查细菌的鞭毛,必须用鞭毛染色法。 细菌形态学观察包括细菌染色标本检查法和不染色标本检查法。压滴法属于最常用的不染色标本检查法,主要用于检查细菌的运动性。 关键词 鞭毛(flagellum)细菌(bacteria)鞭毛染色法(flagellum staining) 光学显微镜(Optical microscope)压滴法(Pressure drop method) 前言 细菌的鞭毛极细,直径一般为10—20nm,只有用电子显微镜才能观察。但是由于设备限制,我们希望能够在普通的光学显微镜下就能够看见细菌鞭毛。于是,便产生了鞭毛染色法。1958年Rhodes根据Fontana的螺旋体改良镀银染色法,建立了一种细菌鞭毛镀银染色法。试剂分为媒染剂和银染剂。但是试剂的稳定性低,容易变质。2002年谷海瀛发明了一种新的细菌鞭毛镀银染色法。该法将媒染剂分为A、B两种。A液为酸化FeCl3溶液,B液为15%单宁酸,含甲醛1 ml,用时A、B液等量混合,轻微加热,染片40s,再用银染液涂片加热至微冒蒸汽,染色10 s。这种方法不仅染色效果好,而且解决了试剂稳定性差的问题,此种试剂常温下至少可保存1年。通过鞭毛染色,可以观察到鞭毛形态、数量和鞭毛在菌体分布的位置,鞭毛数量和在菌体上的分布位置是鉴定细菌的重要依据之一,根据鞭毛的这些特征,可将有动力细菌分为单端极鞭毛菌、单端丛鞭毛菌、周鞭毛菌、侧鞭毛菌。有了这种简易的鞭毛染色方法,对于我们的细菌研究来说就更加方便容易了。 一.实验目的 1、学习并掌握鞭毛染色法并了解鞭毛的形态特征
细菌的常用染色技术 简单染色法:利用单一染料对细菌进行染色的一种方法。例如番红。 1.涂片:用灼烧灭菌冷却后的接种环挑取少量菌体与水滴充分混匀,涂成极薄的菌膜。 2.干燥:可自然晾干,或将涂片置于火焰高处微热烘干,但不能直接在火焰上烘烤。 3.固定:手执玻片一端,有菌膜的一面朝上,通过迅速通过火焰2-3次(用手指触涂片反面,以不烫手为宜)。 4.染色:加适量(以盖满菌膜为度)结晶紫染色液(或石炭酸复红液),染l~2min。5.水洗:用自来冲洗至流下的水中无染色液的颜色时为止。 6.干燥 7.镜检 复染色:利用用两种以上染料对细菌进行染色。例如革兰氏染色法。 革兰氏染色法一般包括初染、媒染、脱色、复染等四个步骤,需要碱性染料(basic dye)初染液;媒染剂(mordant);脱色剂(decolorising agent)和复染液(counterstain)。 碱性染料初染液的象在细菌的单染色法基本原理中所述的那样,而用于革兰氏染色的初染液一般是结晶紫(crystal violet)。媒染剂的作用是增加染料和细胞之间的亲和性或附着力,即以某种方式帮助染料固定在细胞上,使不易脱落,碘(iodine )是常用的媒染剂。脱色剂是将被染色的细胞进行脱色,不同类型的细胞脱色反应不同,有的能被脱色,有的则不能,脱色剂常用95%的酒精(ethanol)。复染液也是一种碱性染料,其颜色不同于初染液,复染的目的是使被脱色的细胞染上不同于初染液的颜色,而未被脱色的细胞仍然保持初染的颜色,而且将细胞区分成G+和G-两大类群,常用的复染液为番红。 1.载玻片固定。在无菌操作条件下,用接种环挑取少量细菌于干净的载玻片上涂布均匀,在火焰上加热以杀死菌种并使其粘附固定。 2.草酸铵结晶紫染1分钟。 3.自来水冲洗,去掉浮色。 4.用碘-碘化钾溶液媒染1分钟,倾去多余溶液。 5.用中性脱色剂如乙醇(95%)或丙酮酸脱色30秒,革兰氏阳性菌不被褪色而呈紫色,革兰氏阴性菌被褪色而呈无色。 6.用番红染液或者沙黄复染30秒,革兰氏阳性菌仍呈紫色,革兰氏阴性菌则呈现红色。
玻璃体切割手术护理常规 玻璃体手术是20世纪70年代初发展起来的高水准现代显微眼科手术,它的出现被认为是眼科治疗史的一大革命,打破很多以前不能治疗的手术禁区,给无数眼疾患者带去了光明。在发达国家的眼科治疗中心,玻璃体手术仅次于白内障摘除人工晶体植入术,成为第二位主要的眼科手术。 一、手术前护理 1、术前检查 (1)详细询问病史,了解心肝肺等重要脏器的功能; (2)检查角膜及晶体的透明度; (3)观察虹膜及瞳孔情况; (4)散瞳三面镜及直接的间接检眼镜详细检查; (5)检查视力、光定辨色力、ERG(视网膜电流图)、VEP(视觉诱发电位)检查; (6)眼部超声检查; (7)评估患者能否耐受手术,是否要全身麻醉等。 2、体位训练:为了适应术后卧位的要求,术前1天护士给患者示范术后常用的各种卧位。如俯卧位、头低位等。术后体位控制是成功的关键
3、心理护理许多玻璃体切割术的患者思想负担很重,担心预后,故在术前做好患者的心理护理是保证手术顺利进行的一个重要环节。首选要建立良好的护患关系,根据患者的心理变化,有目的地同患者进行交谈,认真介绍相关疾病知识,使患者对自己的病情有全面的了解;其次要掌握患者的心理特点,给予说服解释,想方设法解除患者的紧张、恐惧及忧虑心理,同时做好患者家属工作,使医、护、患及家属密切配合,共同战胜疾病。 二、术后护理 1、注入硅油或C3F8的患者需俯卧位,观察IOP变化,IOP升高必须对症治疗;注入硅油的患者俯卧位3个月,第1个月全天俯卧,第2个月每天保持8h,第3个月每天保持6h;C3F8填充的患者,气体量少于25%则停止俯卧位;填充无菌空气的患者,俯卧位1天。 2、常规抗生素眼药水点眼,庆大霉素、地塞米松结膜下注射7天,充分散瞳1个月,IOP(眼内压)高者可不散瞳,每日查IOP眼底,每周查1次B超,每个月查1次UBM超声生物显微镜检查)及眼底彩像情况。 3、加强生活护理玻璃体切割手术时间长,术后返回病房后,应加强生活护理,加强巡视,避免患者离床时碰撞术眼。术后取坐位的患者应注意保暖,同时调节室内光线强度,避免噪音。为患者创造一个良好舒适安静的环境。
1. 菌落形态观察 观察菌落的大小、形状、隆起度、边缘、表面性状、颜色与透明度、质地和干湿度。 2. 革兰氏染色 按照革兰氏染色方法进行制片、初染、媒染、脱色、复染、干燥、镜检;干燥后,用油镜观察。 3. 鞭毛染色 挑取18~30 h新鲜平板培养物制备菌悬液,制片,室温自然干燥。滴加硝酸银染色A液覆盖3~5 min,用蒸馏水充分洗去A液,再滴加B液染色约1 min,当涂面出现明显褐色时,立即用蒸馏水冲洗。自然干燥后用油镜观察。菌体呈深褐色,鞭毛显褐色。 4. 糖类分解试验 将被检菌接种于糖发酵培养基中,37℃培养2-3天。如果培养基变黄,说明产酸;如变黄的同时,还有气泡,说明既产酸又产气。培养基仍呈蓝色,说明未产酸。选取木糖、葡萄糖、半乳糖和蔗糖。 5. 吲哚(靛基质)试验 将待检菌种接种于邓享氏蛋白质的胨溶液中,37℃培养1-2天。于培养液中加入戊醇或二甲苯2-3ml,摇匀,静置片刻后,沿管壁加入试剂2ml,如出现红色沉淀,表示为阳性。 6. 淀粉水解试验 将LB琼脂加热融化,使冷到50℃,加入淀粉溶液,混匀后,倾注平板。将细菌划线接种于平板上,37℃培养24小时,生长后取出,在菌落处滴加革兰氏碘液少许,培养基呈深蓝色,能水许解淀粉的细菌菌落周围有透明环。 9. V-P试验 将被检菌接种于试验培养基中(葡萄糖、K2 HPO4、蛋白胨各5g,溶于1 000ml 水中,分装于试管中,0.075MPa灭菌10分钟),培养2-7天后,于培养物中加入1ml 10%的NaOH,混匀,再加入3-4滴2%氯化铁溶液。数小时后,培养基表面的下层出现红色者,为阳性。 10.甲基红(M.R)试验 接种细菌,于37℃培养2-7天后,于培养物中加入几滴甲基红酒精溶液(0.1g 甲基经溶于300ml 95%乙醇中,加蒸馏水至500 ml),如呈红色,表示阳性。 11. 柠檬酸盐利用试验 将被检菌接种到Simmons固体柠檬酸盐培养基上,37℃下培养2-4天,能利用柠檬酸盐的细菌表现为有细菌生长,培养基变为蓝色,不能利用柠檬酸盐的细菌不生长,培养基不变色。 12. 硝酸盐还原试验 将被检细菌接种于硝酸盐培养基中,37℃培养1-2天,每管中先加入甲试剂0.1ml,再加乙试剂数滴,如出现红色,表示阳性。 13. 接触酶试验 将1ml 3%的H2O2倾注于生长物(菌落或菌苔)上,有气泡(O2)发生者为阳性。也可于清洁小试管中加少量H2O2(30%),再用清洁无菌的细玻棒(或火焰封口的毛细管或镍铬做成的接种环)醮细菌少许,插入H2O2液面下,有气
玻璃体切割术治疗眼外伤的效果观察 发表时间:2018-07-30T14:11:31.207Z 来源:《航空军医》2018年9期作者:首盛发 [导读] 对眼外伤患者采用玻璃体切割术治疗,效果确切,值得临床上推广应用。 (炎陵县人民医院湖南株洲 412500) 摘要:目的观察探讨对眼外伤进行玻璃体切割术治疗的效果。方法选取我科室2017年5月—2017年10月期间所收治的118例眼外伤患者为临床研究对象,采用随机的方法分成观察组和对照组,观察组和对照组各59例,观察组采用玻璃体切割术治疗,常规组采用常规治疗,对比分析两组治疗后的临床效果。结果对照组采用常规治疗后的临床有效率明显低于观察组,两组数据对比差异明显,差异具有统计学意义,P﹤0.05。结论对眼外伤患者采用玻璃体切割术治疗,效果确切,值得临床上推广应用。 关键词:玻璃体切割术;眼外伤;治疗效果 眼外伤是由于化学性、机械性、物理性等因素对人眼部直接作用,人眼的功能和结构受到损害导致各种病理性变化发生。作为致盲的主要原因眼外伤近年来的发病率逐渐增加,患者的视功能和眼解剖受到很大影响,通过实施玻璃体切割手术对眼外伤治疗的效果显著,患者的视功能恢复和预后良好,现在选取我科室收治的眼外伤患者,对其眼外伤采用玻璃体切割术治疗后的临床有效率进行分析观察,并将结果报告如下。 1资料和方法 1.1一般资料 取我院2017年5月—2017年10月期间所收治的118例眼外伤患者为临床研究对象,所有患者均符合眼外伤的诊断标准,按照随机的方式分为观察组和对照组,观察组与对照组各59例。118例患者中接受玻璃体切割术治疗的59例为观察组;年龄范围为23—53岁,平均年龄(38.5±1.3)岁;接受常规治疗的59例为对照组;年龄范围为21—54岁,平均年龄(39.7±1.2)岁;两组患者的一般资料可以进行比较,P>0.05,无显著差异,无统计学意义,可作下一步研究。另外,本次研究的所有研究对象都签署了知情同意书,皆为主动参与。 1.2方法 对照组患者采用常规治疗方法,观察组患者采用玻璃体切割术进行治疗,具体措施有:手术前对患者的散瞳、结膜囊进行常规清洁,对结膜囊冲洗,铺无菌巾、消毒,将0.75%布比卡因和2%利多卡因取相同剂量混合行球周麻醉,开眼睑,缝合外伤伤口,缝合角巩膜、巩膜、角膜伤口[1]。按标准经睫状体扁平部三通道玻璃体切割术入路,对混浊晶体先行切除,将中央玻璃体积脓积血切除,制作玻璃体后脱离,切除后局部玻璃体,顶压下基底部玻璃体切除;对于眼球内有异物者,先确定异物位置,如果异物在玻璃体腔中没有损伤视网膜,可以将异物用镊子夹取出来,如果是感磁性异物可用医用电磁铁吸出[2]。如果视网膜上有异物嵌顿或视网膜受到损伤,再反弹到玻璃体腔中,可先将视网膜裂孔使用眼内激光光凝封闭,再将异物用眼内异物镊子取出或是用电磁铁将磁性异物吸出,根据实际情况对异物开口进行适当扩大。取出异物后将扩大的取异物开口缝合,之后行标准的玻璃体切割术[3]。 1.3观察指标 对两组患者的临床治疗效果进行统计比较。治愈:患者手术后视力恢复≥0.3,玻璃体透明,三个月没有视网膜脱落现象;好转:患者玻璃体透明,视网膜的解剖复位,眼球得到了成功的重建,但是视力方面没有达到标准;无效:患者手术手术后的视力没有得到改善并且进一步变差,视网膜再次脱离,玻璃体再次出血。 1.4统计学处理 文章数据用SPSS22.0软件处理,以χ2检验,若P<0.05,则有统计学意义。 2结果 见表1。结果显示,观察组经过玻璃体切割术治疗的临床效果明显高于对照组,P﹤0.05。 3讨论 玻璃体是一种眼睛内半固体胶状的物质,在玻璃体腔内填充。玻璃体在正常情况下透光性良好,脉络膜和视网膜相贴[4]。如果玻璃体发生病变,病情轻的患者看东西时会觉得有蚊虫在眼前飞舞,病情严重的患者光线可完全遮挡而失明,还有可能使周围组织发生病变,例如视网膜脱落等,导致整个眼球损毁。玻璃体切割术源于对玻璃体视网膜牵拉进行切除或将混浊的玻璃体进行切除为基础,使视网膜复位得以促进,屈光间质恢复透明,通过对玻璃体视网膜疾病进行治疗使患者视功能恢复。玻璃体切割术能够将玻璃体增生、浑浊屈光间质以及机化条索一次性切除,使患者因为受伤后并发症引发新的眼组织理化损伤得以避免或减少,同时将眼内炎等疾病的发生风险大大降低,使眼外伤患者视功能的恢复得到有力促进。目前临床上上对严重复杂的眼外伤治疗的重要术式就是玻璃体切割术[5]。 眼内炎大多是由于眼球穿孔导致引发感染,眼组织受到损害,一旦没有得到及时的治疗或是治疗不当,短时间内就可导致全眼球炎发生,患者的视功能降低以至于眼球萎缩。因此眼内炎一旦确诊后,必须立刻采用玻璃体注射抗生素联合玻璃体切割术对患者进行治疗,细菌毒性产物和眼内炎症组织能够有效摘除,屈光间质的清晰度能够得以确保,眼内致病菌的含量大大降低,药物可以大范围扩散同时炎症的蔓延得以抑制,治疗效果显著;眼内有异物的患者,采用传统摘除术即利用巩膜手术摘除,引发的并发症比较多且手术成功率不高,眼外伤患者需要接受分次手术,对视功能很容易造成进一步的损害。而玻璃体切割术可以将异物在直视状态下摘除,不会对眼组织造成很大
1.检验目的 指导瑞氏染色的操作,进行各种涂片的分类。 2.方法原理 瑞氏染色法使细胞着色既有化学亲和反应,又有物理吸附作用。各种细胞成分化学性质 不同,对刘氏染液(改良的瑞氏染液)中酸性染料曙红和碱性染料亚甲蓝的亲和力也不 一样,标本涂片经过刘氏染液染色后,各类细胞呈现不同的着色,从而达到辨别其形态、特征的目的。 3.方法性能参数(如线性、检出限、测量区间、不确定度、准确性、精密度、灵敏度和特异性) 3.1染色速度快,效果好。 3.2仅供形态学初学者初检观察染色使用。 3.3是临床最常用的染色技术之一,用于细胞分类、寄生虫检出及分类。 4.标本类型(如血浆、血清、尿液等) 4.1血细胞涂片、脱落细胞学标本(脑脊液、胸腹水等)。 4.2标本采集后要及时制片,以免时间久细胞形态发生退化改变。 5.要求的容器、防腐剂或添加物、仪器、试剂或分析系统 5.1试剂组分: 5.2试剂存储和有效期: 6.校准程序(计量学溯源性)
7.质量控制,控制品使用水平和频率,允许限的纠正措施 8.程序步骤 8.1标准方法: 8.1.1加刘A(0.5-0.8ml)染色30S。 8.1.2再将刘B滴加于A液上面(滴量为A液的两倍)。以洗耳球轻吹,让两液充分 混合,染色1min。 8.1.3水洗(不能先倒染色液,以流水轻轻冲去),待干后镜检。 8.2快速染色,适用于脱落细胞学标本: 8.2.1加刘A(0.5-0.8ml)后,立即将刘B滴加于A液上面(滴量为A液的两倍)。以 洗耳球轻吹,让两液充分混合,染色10-20S。 8.2.2水洗(不能先倒染色液,以流水轻轻冲去),待干后镜检。 9.计算结果原理 10.生物参考区间 11.警告值、危急值(适用时) 12.检验结果可报告区间 12.1红细胞呈淡红色,白细胞浆中颗粒清楚,并显示出各种细胞特有的色彩,细胞核染 紫红色,核染色质结构清楚。 12.2脱落细胞学标本如脑脊液、胸腹水沉渣涂片,因其细胞通透性较高,应行快速染色 如染色偏深,无法辨识核结构,应适当缩短染色时间,以免误判。 13.对超出可报告范围的结果的处理 14.实验室解释 15.安全防护措施 所有标本按具有潜在传染性的标本处理。 16.最常见的误差源。 17.方法的局限性(如乳糜血、溶血、高胆红素血等干扰影响、交叉反应等) 18.参考文献 18.1全国临床检验操作规程-第三版 18.2《刘氏染液厂家说明书》 19.有关引用程序与文件 20.SOP涉及的记录与表格
瑞氏-姬姆萨复合染色液使用说明 货号:G3990 保存:室温避光保存,有效期至少2年。 产品内容: 2×100ml2×500ml Storage 试剂(A):Wright-Giemsa Stain100ml500ml RT避光试剂(B):磷酸盐缓冲液100ml500ml RT 产品说明: 瑞氏色素是酸性染料伊红(Eosin)和碱性染料亚甲蓝(Methylene Blue)组成的复合染料,对原生质的染色有很好的区别作用。吉姆萨染液由天青Ⅱ与伊红混合而成,染色原理和结果与瑞氏染色法基本相同,姬姆萨染色液对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,特别对血液和骨髓细胞中的嗜天青、嗜酸性、嗜碱性颗粒,着色清晰,但是对胞核着色偏深,核结构显色不佳,常与故姬姆萨染液常与瑞氏染液联合使用。 Wright-Giemsa Stain以进口瑞氏色素和姬姆萨色素为主要原料,通过研磨配制而成,能呈现出清晰的细胞染色效果。经常用于血液和细胞涂片、骨髓细胞涂片、细菌染色。细胞质呈红色,细胞核及细菌呈蓝色,嗜酸性颗粒呈橘红色。染液中加中性甘油,防止甲醇挥发或氧化,同时也可使血细胞染色较清晰。该染液的特点:由瑞氏-姆姆萨复合染色液和磷酸盐缓冲液组成,等量混合使用或分别处理标本使用。 使用方法(仅供参考): 1、常规方法制备血液涂片或骨髓涂片或细菌涂片,待涂片自然干燥。 2、将血液涂片或骨髓涂片置于染色架上。
3、滴加适量Wright-Giemsa Stain覆盖涂片,室温染色1~2min。 4、涂片滴加等量磷酸盐缓冲液,轻轻晃动玻片或采用其他方式混合,使磷 酸盐缓冲液不Wright-Giemsa Stain混匀,室温静置3~10min。 5、步骤3、4亦可以采用如下方法:取Wright-Giemsa Stain和磷酸盐缓冲 液等量混合,即为Wright-Giemsa工作液,滴加该工作液于血液涂片或骨髓涂片上,室温静置3~10min。 6、用自来水或蒸馏水从玻片一端轻轻冲洗。(注:也可用磷酸盐缓冲液等量 稀释后,冲洗玻片,时间控制在30s左右。) 7、干燥。镜检:先用低倍镜观察血涂片,再用油镜。 染色结果: 细菌、细胞核蓝色 组织细胞的细胞质、血红蛋白、嗜酸性颗粒粉红或橘红色 注意事项: 1、血液涂片或骨髓涂片应厚薄均匀,以免影响染色效果。 2、涂片染色中,请勿先去除染液或直接对涂片用力冲洗。不能先倒掉染液,以免染料 沉着于涂片上。 3、染色液可重复使用,但不能多次重复,若有沉淀物应过滤后使用。 4、染色过深可用甲醇或乙醇适当脱色,最好不复染。 5、如果染色过深或过浅,应调整染色时间或工作液浓度。 6、为了您的安全和健康,请穿实验服并戴一次性手套操作。
细菌鞭毛染色 一、实验目的 学习并掌握鞭毛染色方法,并观察鞭毛的形态。 二、实验原理 细菌的鞭毛极纤细,直径一般为0.1—0.2um,只有用电子显微镜才能观察到。但是,如采用特殊的染色法,则在普通光学显微镜下也能看到它。 鞭毛染色的基本原理:即在染色前先用媒染剂(如单宁酸或明矾钾)处理,让它沉积在鞭毛上,使鞭毛直径加粗,然后再进行染色(如碱性复红、硝酸银、结晶紫)。常用的媒染剂由丹宁酸和氯化高铁或钾明矾等配制而成。(本次实验用硝酸银当染色剂) 三、实验器材及试剂 1.菌种:枯草芽孢杆菌(鞭毛周生)、铜绿假单胞菌(鞭毛端生)。 2.溶液和试剂:硝酸银鞭毛染色剂A液和B液、95%乙醇、蒸馏水。 3.仪器和其他物品:载玻片、酒精灯、显微镜、双层瓶、擦镜纸、接种环、镊 子、电热炉、大烧杯、洗衣粉 四、实验步骤 鞭毛染色——硝酸银染色法 1.载玻片准备:将载玻片用洗衣粉洗涤后,置于95%的乙醇溶液中浸泡20min,使用时取出再火焰上烧去乙醇及可能残留的油迹。 2.制片:取一块载玻片,在一端滴一滴蒸馏水,用接种环无菌操作从枯草芽孢杆菌(铜绿假单孢菌)斜面上挑取菌种在载玻片液滴上轻轻蘸一下,使液滴表面形成一薄层菌膜,随后倾斜玻片,使悬菌液缓慢流向另一端,用吸水纸在载玻片边缘处吸去多余菌悬液,自然干燥。 3.染色:滴加硝酸银染液A液覆盖菌面3-5min后用蒸馏水充分洗去A液,之后用B液洗去残留水分,再滴加B液覆盖菌面数秒至1min,其间可用微火加热,当菌面出现明显褐色时,立即用蒸馏水冲洗,自然干燥。 4.镜检:先低倍,再高倍,最后用油镜检查,菌体呈深褐色,鞭毛呈浅褐色。
四、实验结果记录 枯草芽孢杆菌鞭毛染色观察图 铜绿假单胞菌鞭毛染色观察图 五、实验结果分析 1.理论结果: 2.实验结果:
细菌的鞭毛染色和形态观察 胡雪芳 201300261033 【实验目的】 1.学习掌握鞭毛染色方法,观察鞭毛形态特征。 2.巩固显微镜的使用和无菌操作技术。 3.观察细菌的运动特征。 【实验原理】 1.鞭毛 鞭毛(flagellum)在某些细菌菌体上具有细长而弯曲的丝状物,称为鞭毛。鞭毛的长度常超过菌体若干倍。在某些菌体上附有细长并呈波状弯曲的丝状物,少则1-2根,多则可达数百根。这些丝状物称为鞭毛,是细菌的运动器官。 细菌鞭毛极纤细,直径一般为0.01-0.02μm,只有用电子显微镜才能观察到。但如采用特殊的染色法,则普通光学显微镜下也能看到。 2.鞭毛的分类 通常根据鞭毛的位置可 以将鞭毛分为两大类:端生 鞭毛和周生鞭毛,端生鞭毛 又可以细分为端生单鞭毛, 单端丛生鞭毛和两端丛生图1.鞭毛的种类鞭毛。形态如图1所示。 A端生单鞭毛,B单端丛生鞭毛,C两端丛生鞭毛,D周生鞭毛。
3.鞭毛染色法 鞭毛染色法的基本原理是:即在染色前先用媒染剂(丹宁酸或明矾钾)处理,让它沉积在鞭毛上,使鞭毛直径加粗,然后再进行染色。常用的媒染剂由丹宁酸和氯化高铁或钾明矾等配制而成。 采用鞭毛染色法虽能观察到鞭毛的形态、着生位置和数目,但此法既费时又麻烦。如果仅须了解某菌是否有鞭毛,可采用悬滴法或压滴法直接在光学显微镜下检查活细菌是否有运动能力,以此来判断细菌是否有鞭毛。 悬滴法就是将菌液滴加在洁净的盖玻片中央,在其周边涂上凡士林,然后将它倒盖在有凹槽的载玻片中央,即可放置在普通光学显微镜下观察。 压滴法是将菌液滴在普通的载玻片上,然后盖上盖玻片,置显微镜下观察。 【实验材料】 1.菌株及其培养条件 本次实验采用的是不同鞭毛着生方式的细菌,具体见表1。 表1. 不同鞭毛着生方式的细菌。
mydye 发表于 2006-3-4 14:37:00 AgNOR染色法: 1、试剂配制: (1)AgNOR染色液: 甲液:明胶2 g 溶于双蒸水至99 ml,在60℃使之完全溶解,再加入纯甲酸1 ml 摇匀待用。 乙液:硝酸银50 g 溶解于双蒸水中至100 ml,4℃冰箱保存。 (2)AgNOR工作液 取甲液10 ml,乙液20 ml 临用前混合。 2、步骤: (1)切片脱蜡至水 (2)双蒸水洗2次 (3)AgNOR 工作液中(25℃)浸染30分钟(暗处进行)(镜下观察)(4)双蒸水洗3次 (5)脱水,透明,封固 3、结果:油镜观察,细胞核及胞质背景为淡黄色, AgNOR呈棕黑色颗粒状。 B 鞭毛染色法: 1.试剂配制: 甲液:丹宁酸5克 氯化铁(FeCl3)1.5克 福尔马林(15%)2.0毫升 氢氧化钠(NaOH)1%1.0毫升 乙液:硝酸银(AgNO3)2克 蒸馏水100毫升 制备乙液时,待硝酸银溶解后,取出10毫升备用,向余下的90毫升硝酸银液中滴加浓氢氧化铵,先呈很浓厚的沉淀,再继续滴加至刚刚溶解沉淀成澄清液为止。再将备用的硝酸银溶液慢慢逐滴加入澄清液中,先呈现薄雾,但轻摇则消失,继续边滴加边摇动,待澄清液呈现略有轻微不消散的薄雾状为止。如雾重,则银盐沉淀,不宜使用。 2.染色方法: (1)将待检菌接种在新制备的肉汤琼脂斜面上,置37°培养16—20小时,备用。 (2)在载玻片的中部相隔一厘米处,用接种环各沾一滴蒸馏水,然后用接种环挑取湿润处的菌苔少许于一端的水滴中,倾斜玻片使培养物流至另一水滴中,两水滴自然相通,菌体从上位自然扩散到下位水滴中,待干燥后染色。 (3)在干燥涂片上加甲液3—5分钟,用蒸馏水冲洗。将残水沥干或用乙液冲去残水后,加适量乙液保持30—60秒钟。染色时在酒精灯上稍加热,使染液出现蒸汽即可,用蒸馏水冲洗。 (4)镜检:菌体及鞭毛皆染成茶色。
?检测技术? 细菌鞭毛镀银染色法的创新 谷海瀛 【摘要】 目的 发明一种新的细菌鞭毛镀银染色方法。方法 染色媒染剂由A 、B 2种溶液组成,A 液是酸化的FeCl 3溶液,B 液是含有甲醛的丹宁酸溶液,A 、B 液混合后,微加热,染涂片50s ,洗净涂片后镀银染色。共有19属34种228株细菌,每株菌都进行固体培养和液体培养进行鞭毛染色,并采用West 氏评分法对鞭毛染色质量进行评价。结果 鞭毛形态及其在菌体的位置极易观察。228株细菌获得良好的鞭毛染色质量,血琼脂平板培养平均每株菌获得4.7分,肉汤培养获得4.6分。与一些肠杆菌株不同,100株非发酵菌血琼脂平板培养鞭毛染色均获得5分,而99株肠杆菌肉汤培养鞭毛染色获得4分以上。一些弧菌科细菌鞭毛位置分布因这2种培养方法的不同而有差异。并发现1株非O1群霍乱弧菌有单侧毛和亚极端毛。结论 这种鞭毛染色方法操作简单、快速,试剂稳定,重复性好。由于可靠性好,可以作为常规方法。非发酵菌适合于固体培养进行鞭毛染色获得最佳效果,液体培养对于一些肠杆菌鞭毛染色更为适合。 【关键词】 细菌;鞭毛;镀银染色;媒染剂;培养基 A new silver 2plating method for staining flagella G U Haiying.Clinical Laboratory Department ,Hainan Provincial People ’s Hospital ,Haikou 570311,P.R.China (E 2mail :clinmicrobiollab @https://www.doczj.com/doc/a76605868.html, ) 【Abstract 】 Objective T o develope a new technique for bacterial flagella staining.Methods Reagent A was acidized ferric chloride s olution and B was tannic acid containing formalin.The mixture of A and B was heated slightly ,the smears were covered with the cooling mixture for 50sec.Washed gently with distilled water ,the smears were stained with silver s olution.228strains of 19genera 34species were dem onstrated for flagella.Each culture was incubated into a tube of flagella broth medium and onto a sheep blood agar (S BA )plate.All stained smears were rated by WEST ′s method.R esults The flagella and their position on the bacteria were easily dis 2cerned under the microscope ,228strains of organism growing on S BA plates and in broth medium had the highly ratings with the mean of 4.7and 4.6,each rating of 100cultures of non fermentative rods grown on S BA was highly scored 5different from that of 104cultures of enterobacteria grown in flagella broth medium with rating score above 4.As to s ome strains of Vibrioraceae ,flagellar arrangement may differ with the tw o kinds of incubation media.S in 2gle lateral flagellum and subterminal flagellum were dem onstrated in 1strain of V.cholerae non 2O1.Conclusions This simple and fast method with the stable m ordant was g ood in reliability.This technique overcomed alm ost all the difficulties in flagella staining and s o can be used as a routine method.N on fermentative bacilli growing on s olid medium and enterobacteria growing in flagella broth were m ore suitable for flagella 2staining. 【K ey w ords 】 Bacteria ;Flagella ;S ilver stain ;M ordant ;Culture 作者单位:570311海口,海南省人民医院检验科(E 2mail :clinmi 2 crobiollab @https://www.doczj.com/doc/a76605868.html, ) 细菌侧毛作为细菌分类主要依据之一〔1〕,说明细菌鞭毛染色在细菌鉴定中是很重要的技术。细菌 鞭毛染色的方法文献有很多报道,但基本方法可以 归纳为:Leifs on 法〔2〕、G ray 法〔2〕、镀银法〔3〕、Ryu 法〔4〕 ,但这些方法操作复杂或染液不稳定或着色欠佳,尽管科赫(K och )在一个世纪前就发明了细菌鞭毛染色技术,但至今仍没有一个稳定而简易可推行的方法。本文报告一种新的细菌鞭毛镀银染色方法,通过19属34种228株细菌鞭毛染色证实该方法操作简单、快速,可作为常规方法推广。 材料和方法 标准菌株(13株):E.coli ATCC25922、P.aerugi 2nosa ATCC27853(ATCC43088)、L.monocytogenes ATCC15313、V.parahaemolyticus ATCC17802、P.shigel 2loides ATCC14029、A.hydrophila ATCC7966、A.caviae ATCC 15468、V.mimicus ATCC33653、V.vulnificus ATCC 27562、B. pickettii ATCC27511、E.cloacae ATCC43091、P.mirabilis ATCC7002。 质控菌株(18株):P.penneri 、S.maltophilia 、S. putref aciens 、A.veronii biovar sobria 、P.pseudoalcali 2genes 、P.stutzeri 、S.enterica subsp.arizonae 、A.hy 2drophila 、A.caviae 、P.pudida 、B.cereus 、B.cepacia 、A.
瑞氏染色液说明书 【产品名称】 瑞氏染色液 【包装规格】 货号:DM0005 单瓶包装规格分别为:100ml、250ml、500ml、5000ml; 每套/盒包装规格分别为:2×20ml/盒、2×100ml/盒、2×250ml/盒、2×500ml/盒、2×5000ml/盒。 【预期用途】 主要用于对血细胞进行染色。 【检验原理】 瑞氏色素是酸性染料伊红(Eosin)和碱性染料亚甲蓝(MethyleneBlue)组成的复合染料,各种细胞成分化学性质不同对各种染料的亲和力也不一样,如血红蛋白、嗜酸性颗粒为碱性蛋白质,与酸性染料伊红结合,染粉红色,称为嗜酸性物质;细胞核蛋白、淋巴细胞、嗜碱性粒细胞胞质为酸性,与碱性染料结合后,染紫蓝色或蓝色,称为嗜碱性物质;中性颗粒呈等电状态与伊红和亚甲蓝均可结合,染淡紫红色,称为嗜中性物质;原始红细胞、早幼红细胞胞质、核仁含较多酸性物质,染成较浓厚的蓝色;中幼红细胞既含酸性物质,又含碱性物质,染成红蓝色或灰红色;完全成熟红细胞,酸性物质彻底消失后,染成粉红色。本染色液经常用于血液和细胞涂片、骨髓细胞涂片、细菌染色,细胞质呈红色,细胞核及细菌呈蓝色,嗜酸性颗粒呈橘红色。 【主要组成成分】 试剂组成主要成分 1、瑞氏染液瑞氏染料、甲醇 2、磷酸盐缓冲液磷酸盐
【储存条件及有效期】 5℃~35℃环境保存,原包装未开封染色液的有效期为24个月,在有效期内的已开封染色液应在开封后6个月内使用完,每次用后应及时拧紧瓶盖,以免挥发或变质。 【样本要求】 1、血细胞涂片染色:要求新鲜全血或EDTA.2K抗凝血。 2、阴道分泌物(妇科白带)涂片染色:新鲜标本离开人体涂片后,需尽快以火焰或酒精固定,以避免细胞变形。 3、骨髓涂片染色:涂片制成后,应在空气中快速摇动或扇干,防止细胞皱缩变形或固空气潮湿而溶血,不能用高温或火烤干燥。 4、脱落细胞涂片:取样本并涂片,待检涂片固定可采用自然干燥法或湿片固定法(具体操作可根据不同检体及所采用的固定液所对应的规范操作要求进行);若采用湿片固定法,标本浸泡时间稍长些,效果会更佳;若采用湿片固定液固定标本,固定液用后需经常过滤,更换,防止细胞交叉污染。 【检验方法】 1、滴加瑞氏染液于涂片上,并让染液覆盖整个标本涂片,染色; 2、将等量的磷酸盐缓冲液滴加于瑞氏染液上面,以嘴或洗耳球使两液充分混合,染色; 3、水洗,冲洗时不能先倒掉染色液,可缓慢从玻片一端冲洗,以防有沉渣沉淀在标本上; 4、干燥、镜检。 【检验方法的局限性】 仅供形态学初检观察染色使用。 【注意事项】
瑞氏-吉姆萨染色液说明书 【产品名称】 瑞氏-吉姆萨染色液 【包装规格】 货号:DM0007 单瓶包装规格分别为:100ml、250ml、500ml、5000ml; 每套/盒包装规格分别为:2×20ml/盒、 2×100ml/盒、2×250ml/盒、2×500ml/盒、2×5000ml/盒。【预期用途】 主要用于对血细胞进行染色 【检验原理】 瑞氏染料是酸性染料伊红(Eosin)和碱性染料亚甲蓝(Methylene Blue)组成的复合染料, 对原生质的染色有很好的区别作用;吉姆萨染料由天青Ⅱ与伊红混合而成,染色原理和结果与瑞氏染色基本相同,吉姆萨染色对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,特别对血液和骨髓细胞中的嗜天青、嗜酸性、嗜碱性颗粒,着色清晰,但是对胞核着色偏深,核结构显色不佳,常与瑞氏染色联合使用。 瑞氏-吉姆萨染色液是利用Romanowsky Stain技术原理改良而成的,细胞的着色过程是染料透入被染物并存留其内部的一种过程,此过程既有物理吸附作用,又有化学亲和作用,各种细胞及相关成分由于其化学性质不同,对瑞氏-吉姆萨染色液中的酸性染料(伊红)和碱性染料(亚甲蓝)的亲和力也不一样,标本涂片经瑞氏-吉姆萨染色后,相应各类细胞呈现不同的着色,从而达到辨别其形态特征的目的。 【主要组成成分】 试剂组成主要成分 1、瑞氏-吉姆萨染液瑞氏染料、吉姆萨染料、甲醇 2、磷酸盐缓冲液磷酸盐 【储存条件及有效期】 5℃~35℃环境保存,原包装未开封染色液的有效期为24个月,在有效期内的已开封染色液应在开封后6个月内使用完,每次用后应及时拧紧瓶盖,以免挥发或变质。 【样本要求】 1、血细胞涂片染色:要求新鲜全血或EDTA.2K抗凝血。 2、阴道分泌物(妇科白带)涂片染色:新鲜标本离开人体涂片后,需尽快以火焰或酒精固定,以避免细胞变形。 3、骨髓涂片染色:涂片制成后,应在空气中快速摇动或扇干,防止细胞皱缩变形或固空气潮湿而溶血,不能用高温或火烤干燥。 4、脱落细胞涂片:取样本并涂片,待检涂片固定可采用自然干燥法或湿片固定法(具体操作可根据不同检体及所采用的固定液所对应的规范操作要求进行);若采用湿片固定法,标本浸泡时间稍长些,效果会更佳;若采用湿片固定液固定标本,固定液用后需经常过滤,更换,防止细胞交叉污染。 【检验方法】 1、滴加瑞氏-吉姆萨染液于涂片上,并让染液覆盖整个标本涂片,染色; 2、将等量的磷酸盐缓冲液滴加于瑞氏-吉姆萨染液上面,以嘴或洗耳球使两液充分混合,染色; 3、水洗,冲洗时不能先倒掉染色液,可缓慢从玻片一端冲洗,以防有沉渣沉淀在标本上; 4、干燥、镜检。 【检验方法的局限性】 仅供形态学初检观察染色使用。 【注意事项】
染色液的配制 一、吕氏(Loeffler)碱性美蓝染液 A液:美蓝(methylene blue) 0.6g 95%酒精 30ml B液:KOH 0.01g 蒸馏水 100ml 分别配制A液和B液,配好后混合即可。 二、齐氏(Ziehl)石炭酸复红染色液 A液:碱性复红(basic fuchsin) 0.3g 95%酒精 10ml B液:石炭酸 5.0g 蒸馏水 95ml 将碱性复红在研钵中研磨后,逐渐加入95%酒精,继续研磨使其溶解,配成A 液。 将石炭酸溶解于水中,配成B液。 混合A液及B液即成。通常可将此混合液稀释5—10倍使用,稀释液易变质失效,一次不宜多配。 三、革兰氏(Gram)染色液 1.草酸铵结晶紫染液 A液:结晶紫(crystal violet) 2g 95%酒精 20ml B液:草酸铵(ammonium oxalate) 0.8g 蒸馏水 80ml 混合A、B二液,静置48小时后使用。 2.卢戈氏(Lugol)碘液
碘片 1.0g 碘化钾 2.0g 蒸馏水 300ml 先将碘化钾溶解在少量水中,再将碘片溶解在碘化钾溶液中,待碘全溶后,加足水分即成。 3.95%的酒精溶液。 4.番红复染液 番红(safranine O) 2.5g 95%酒精 100ml 取上述配好的番红酒精溶液10ml与80ml蒸馏水混匀即成。 四、芽孢染色液 1.孔雀绿染液 孔雀绿(malachite green) 5g 蒸馏水 100ml 2.番红水溶液 番红 0.5g 蒸馏水 100ml 3.苯酚品红溶液 碱性品红 11g 无水酒精 100ml 制法取上述溶液10ml与100ml5%的苯酚溶液混合,过滤备用。 4.黑色素(nigrosin)溶液 水溶性黑色素 10g 蒸馏水 100ml 称取10g黑色素溶于100ml蒸馏水中,置沸水浴中30分钟后,滤纸过滤
鞭毛染色液(改良Ryu 法) 简介: 细菌鞭毛是细菌的运动器官,幽门螺杆菌能够从强酸性的胃内腔穿过胃上皮细胞上的黏液层达到胃上皮细胞的中性环境,这就是鞭毛运动作用的很好例证。通过鞭毛染色,可以观察到鞭毛形态、数量和鞭毛在菌体分布的位置,鞭毛数量和在菌体上的分布位置是鉴定细菌的重要依据之一。 Leagene 鞭毛染色液采用改良Ryu 染色法,该染色法的优点是采用结晶紫作为核心染料,试剂比较稳定,操作简单,结果判断更可靠。 组成: 自备材料: 1、 载玻片 2、 蒸馏水 3、 接种环 4、 恒温箱 5、 显微镜 操作步骤(仅供参考): 1、 配制鞭毛染色工作液:使用前按试剂(A):试剂(B)=10:1混合,即为鞭毛染色工作液,室温保存待用。 2、 在洁净无油脂的载玻片上滴蒸馏水。 3、 用接种环挑取无菌蒸馏水,再与血平板上菌落接触,允许细菌游到接种环蒸馏水中,再将接种环移到玻片上蒸馏水顶部轻点。 4、 轻轻摇动玻片,使细菌分布均匀。切勿研磨和搅动,以防鞭毛脱落。 5、 置室温箱内干燥固定。 6、 滴加鞭毛染色工作液染色。 7、 轻轻水洗。 8、 自然晾干。 编号 名称 DM0030 50ml DM0030 100ml Storage 试剂(A): Ryu 稀释液 50ml 100ml RT 避光 试剂(B): Ryu 染色液 5ml 10ml RT 避光 使用说明书 1份
9、镜检:从涂片边缘开始,由外及里,逐渐移至中心。细菌分布少的地方,鞭毛容易观察。 细菌密集的地方,鞭毛被菌体挡住,不易观察。 染色结果:菌体和鞭毛皆为紫色,菌体染色较鞭毛为深。 注意事项: 1、固定时不宜用火焰固定。 2、为了您的安全和健康,请穿实验服并戴一次性手套操作。 有效期:6个月有效。 相关: 编号名称 CS0001 ACK红细胞裂解液(ACK Lysis Buffer) DC0032 Masson三色染色液 DC0041 天狼星红染色液 DG0005 糖原PAS染色液 DM0002 姬姆萨染色液(1:9) PS0013 RIPA裂解液(强) PW0053 Western抗体洗脱液(碱性) TC0713 葡萄糖检测试剂盒(GOD-POD比色法)
细菌的鞭毛染色和形态观察 胡雪芳201300261033 【实验目的】 1.学习掌握鞭毛染色方法,观察鞭毛形态特征。 2.巩固显微镜的使用和无菌操作技术。 3.观察细菌的运动特征。 【实验原理】 1.鞭毛 鞭毛(flagellum)在某些细菌菌体上具有细长而弯曲的丝状物,称为鞭毛。鞭毛的长度常超过菌体若干倍。在某些菌体上附有细长并呈波状弯曲的丝状物,少则1-2根,多则可达数百根。这些丝状物称为鞭毛,是细菌的运动器官。 细菌鞭毛极纤细,直径一般为0.01-0.02μm,只有用电子显微镜才能观察到。但如采用特殊的染色法,则普通光学显微镜下也能看到。 2.鞭毛的分类 通常根据鞭毛的位置可以 将鞭毛分为两大类:端生鞭 毛和周生鞭毛,端生鞭毛又 可以细分为端生单鞭毛,单 端丛生鞭毛和两端丛生图1.鞭毛的种类鞭毛。形态如图1所示。 A端生单鞭毛,B单端丛生鞭毛,C两端丛生鞭毛,D周生鞭毛。
3.鞭毛染色法 鞭毛染色法的基本原理是:即在染色前先用媒染剂(丹宁酸或明矾钾)处理,让它沉积在鞭毛上,使鞭毛直径加粗,然后再进行染色。常用的媒染剂由丹宁酸和氯化高铁或钾明矾等配制而成。 采用鞭毛染色法虽能观察到鞭毛的形态、着生位置和数目,但此法既费时又麻烦。如果仅须了解某菌是否有鞭毛,可采用悬滴法或压滴法直接在光学显微镜下检查活细菌是否有运动能力,以此来判断细菌是否有鞭毛。 悬滴法就是将菌液滴加在洁净的盖玻片中央,在其周边涂上凡士林,然后将它倒盖在有凹槽的载玻片中央,即可放置在普通光学显微镜下观察。 压滴法是将菌液滴在普通的载玻片上,然后盖上盖玻片,置显微镜下观察。 【实验材料】 1.菌株及其培养条件 本次实验采用的是不同鞭毛着生方式的细菌,具体见表1。 表1. 不同鞭毛着生方式的细菌。