高中化学检验各种离子的方法
- 格式:docx
- 大小:3.10 KB
- 文档页数:2


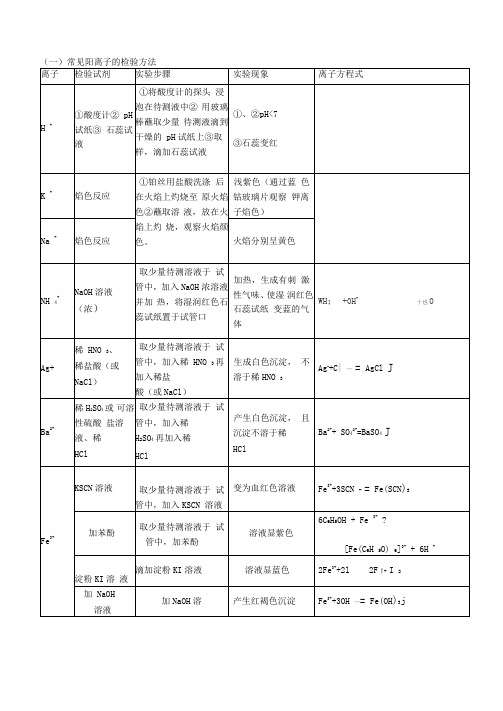
(一)常见阳离子的检验方法离子检验试剂实验步骤实验现象离子方程式Fe2+①KSCN溶液,新制的氯水取少量待测溶液于试管中,加入KSCN溶液,新制的氯水加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色.2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3②NaOH溶液取少量待测溶液于试管中,加入NaOH溶液并露置在空气中开始时生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀.Fe2++2OH - =Fe(OH)2↓4Fe(OH)2十O2+2H2O=4Fe(OH)3③酸性高锰酸钾(无其它还原性物质)取少量待测溶液于试管中,加入酸性高锰酸钾溶液加入酸性高锰酸钾溶液紫色褪去5Fe2+ + MnO4-+8H+5Fe3+ +Mn2++4 H2O④铁氰化钾K3[Fe(CN)6]取少量待测溶液于试管中,加入铁氰化钾溶液产生蓝色沉淀3 Fe2++2[Fe(CN)6] 3- ═Fe2 [Fe(CN)6] 3↓Al3+NaOH溶液取少量待测溶液于试管中,逐滴加入NaOH溶液至过量加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+ 2H2OCu2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成蓝色沉淀Cu2++2OH-=Cu(OH)2↓Mg2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成白色沉淀,该沉淀不溶于过量NaOH溶液中Mg2++2OH-=Mg(OH)2↓(仅用于鉴别Mg2+和Al3+)(二)常见阴离子的检验方法离子检验试剂实验步骤实验现象离子方程式注意:1.若SO42-与Cl-同时检验,需注意检验顺序.应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-.2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸.因为稀硝酸能把SO32-氧化成SO42-.3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+.4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出5.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-。

高中化学中常见离子检验方法总结高中化学中常见离子检验方法总结一、常见阴离子的检验1.阴离子的初步检验①与稀H2SO4作用,试液中加入稀H2SO4并加热,有气泡产生,可能有CO32-、SO32-、S2-、NO2-或CN-存在,再根据气体的特性不同,再进行判断。
②与BaCl2的作用。
试液中加入BaCl2溶液,生成白色沉淀,可能有SO42-、SO32-、PO43-、S2O32-根据沉淀性质不同进行检验。
③与AgNO3HNO3作用。
试液中加入AgNO3再加入稀HNO3若为白色沉淀为Cl-黄色沉淀可能有I-、Br-和CN-存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32-存在,Ag2S 为黑色沉淀。
④氧化性阴离子的检验试液用H2SO4酸化后,加入KI溶液和淀粉指示剂,若溶液变蓝,说明有NO2-存在。
⑤还原性阴离子检验a、强还原性阴离子与I2的试验,试液用H2SO4酸化后,加含0.1%KI的I2-淀粉溶液,若其蓝色褪去,可能有SO32-、C2O42-、S2O32-、S2-和CN-等离子存在。
b、还原性阴离子与KMnO4的试验,试液用H2SO4酸化后,加入0.03%KMnO4溶液,若能褪色,可能有SO32-、S2O32-、S2-、C2O42-、Br-、I-、NO2-等离子。
2.个别鉴定反应⑴SO42-加入BaCl2溶液生成BaSO4白色沉淀,该沉淀不溶于稀HCl或稀HNO3Ba2SO42-===BaSO4↓⑵SO32-a、加入BaCl2溶液生成BaSO3白色沉淀,加入稀HCl,沉淀溶解并放出有刺激性气味的气体SO2Ba2SO32-===BaSO3↓BaSO32H===Ba2H2O SO2↑b、加入少量I2-淀粉溶液,蓝色褪去SO32-I2H2O===SO42-2I-2H⑶Cl-加入AgNO3生成AgCl白色沉淀,该沉淀不溶于稀HNO3或稀HCl,但溶于浓NH3·H2OAgCl2NH3·H2O===[Ag(NH3)2]Cl-2H2O⑷Br-a、加入AgNO3生成淡黄色AgBr沉淀,该沉淀不溶于HCl或HNO3中,微溶于浓NH3·H2O。


罕见物质性质小结之离子检验篇之邯郸勺丸创作下面这些,完全可以在化学推断题、实验设计题中直接使用。
像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等(如实验条件限制,原溶液中所含离子颜色干扰等)一、阳离子1.氢离子(H+):取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子。
2.钠离子(Na+):焰色反应,火焰呈黄色。
3.钾离子(K+):焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色。
4.钡离子(Ba2+):取少量溶液,加稀盐酸酸化,无明显现象(排除Ag+),再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子。
5.镁离子(Mg2+):取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于NH4Cl溶液,则可证明溶液中含有镁离子。
6.铝离子(Al3+):取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子。
7.银离子(Ag+):取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子。
8.铵离子(NH4+):取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子。
9.亚铁离子(Fe2+):①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变成灰绿色,最后沉淀变成红褐色,则可证明溶液中含有亚铁离子。
(请注意“先”“迅速”“最后”,不要更改)②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色(或血红色),则可证明溶液中含有亚铁离子。
10.三价铁离子(Fe3+):①取少量黄色溶液,滴加KSCN溶液,溶液变成血红色,则可证明溶液中含有三价铁离子。
②取少量黄色溶液,滴加NaOH溶液,生成红褐色沉淀,则可证明溶液中含有三价铁离子。
11.铜离子(Cu2+):取少量蓝色溶液,加入NaOH溶液,生成蓝色沉淀,沉淀加热后变成黑色,则可证明溶液中含有铜离子。

高中化学检验各种离子的方法1、H+的检验采用试剂:石蕊试液,Na2CO3溶液或pH试纸操作步骤和反应现象: 取含有H+溶液于试管中,滴加Na2CO3溶液有气泡;取溶液用玻璃棒蘸取溶液少量滴到蓝色石蕊试纸或pH试纸上呈红色。
有关离子方程式; 2H++CO32- CO2↑+H2O2、Na+、K+的检验采用试剂:铂丝、HCl操作步骤和反应现象: 取含钠离子的溶液,用烧过的铂丝蘸溶液或固体少许在酒精灯焰上灼烧,观察有黄色火焰;用蘸HCl溶液烧铂丝进行清洗,直到看不出黄色为止,再取K+盐或其溶液在酒精灯焰上灼烧,透过钴玻璃片观察有紫色火焰。
3、NH4+的检验采用试剂:浓HCl、NaOH溶液、红色石蕊试纸操作步骤和反应现象: 取含NH4+的盐或溶液加入浓NaOH溶液后加热,使产生气体接触湿润红色石蕊试纸变蓝或用玻璃棒蘸上浓HCl挨近上述气体时冒大量白烟有关离子方程式或化学方程式:NH4++OH- NH3↑+H2ONH3+H2O NH3•H2ONH3+HCl NH4Cl4、Mg2+检验采用试剂:NaOH溶液操作步骤和反应现象: 含Mg2+的溶液中加入NaOH溶液时生成白色不溶于过量NaOH的沉淀有关离子方程式 Mg2++2OH- Mg(OH)2↓5、Al3+的检验采用试剂:NaOH溶液,HCl溶液操作步聚和反应现象: 在含有Al3+的溶液中滴加少量NaOH溶液产生白色絮状沉淀,过量NaOH溶液沉淀溶解;白色状沉淀也溶于盐酸有关离子方程式:Al3++3OH- Al(OH)3↓Al(OH)3+OH- AlO2-+2H2OAl(OH)3+3H+ Al3++3H2O6、Cu2+的检验采用试剂:NaOH溶液NH3•H2O操作步骤和反应现象: 取含Cu2+的蓝色溶液加入NaOH溶液生成蓝色的沉淀,再加NH3•H2O振荡呈深蓝色溶液有关离子方程式:Cu2++2OH- Cu(OH)2↓Cu(OH)2+4NH3 Cu(NH3)4(OH)27、Fe2+的检验采用试剂:NaOH溶液操作步骤和反应现象: 在含Fe2+溶液中加入NaOH溶液生成白色沉淀,在空气中逐渐变成红褐色沉淀. 有关反应的离子方程式及化学方程式Fe2++2OH-=Fe(OH)2↓(白色)4Fe(OH)2+2H2O+O2=4Fe(OH)3↓(红褐色)8、Fe3+的检采用试剂:NaOH溶液,KSCN溶液操作步骤和反应现象 (1)在含Fe3+溶液中加入NaOH溶液生成褐红色的沉淀,(2)在含Fe3+溶液中滴加KSCN溶液生成血红色溶液。

1.碳酸根离子:用稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了)2.氯离子:用硝酸银和稀硝酸(银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了)3.硫酸根离子:1)用硝酸钡和稀硝酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了)2)用稀盐酸和氯化钡(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了)4.银离子:用氯化钠(银离子会和氯离子结合成氯化银,生成沉淀)5.氢离子:1)活泼金属(有氢气生成,现象会产生气泡)2)酸碱指示剂:紫色石蕊试剂(石蕊变红)3)金属氧化物:如带锈的铁钉(铁锈会退去)6.氢氧根离子:酸碱指示剂:无色酚酞(酚酞变红)7.铁离子:1)溶液中呈淡黄色2)用氢氧化钠(铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀)8.亚铁离子:溶液中呈浅绿色9.铜离子:1)溶液中呈蓝色2)用氢氧化钠(铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀)10.铵根离子:用碱和和湿润的红色石蕊试纸(铵根离子和碱反应生成呈碱性的氨气,使石蕊试纸变蓝)11.钡离子:用稀硫酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀)化学】高中化学所有离子的鉴别采用试剂:石蕊、酚酞和甲基橙操作步骤和反应现象:含OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深Cl-的检验采用试剂:AgNO3溶液、HNO3溶液操作步骤和反应现象:滴加AgNO3溶液生成白色沉淀,再加稀HNO3沉淀不溶,有关的离子方程式:Ag++Cl- AgCl↓Br-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成浅黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水振荡后加几滴汽油,油层红棕色有关的离子方程式:Ag++Br- AgBr↓Cl2+2Br- 2Cl-+Br2I-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水,振荡用CCl4萃取呈紫色有关的离子方程式:I-+Ag+ AgI↓Cl2+2I- I2+2Cl-S2-的检验采用试剂:Pb(NO3)2或Pb(Ac)2操作步骤和反应现象:用玻璃棒蘸取被测液于Pb(NO3)2或Pb(Ac)2试纸上,试纸变为黑色有关的离子方程式:Pb2++S2- PbS↓SO42-的检验采用试剂:BaCl2、HNO3溶液操作步骤和反应现象:向被测溶液滴加BaCl2或Ba(NO3)2溶液,出现白色沉淀,再滴加稀HNO3沉淀不溶有关的离子方程式:Ba2++SO42- BaSO4↓SO32-的检验采用试剂:稀HNO3、BaCl2、HCl溶液操作步骤和反应现象:取含SO32-的溶液,滴加HCl溶液(少量)出现能使品红褪色的气体;如滴加BaCl2溶液生成白色沉淀;再加过量HCl能溶解,但用硝酸白色沉淀则不溶有关的离子方程式:SO32-+2H+ SO2↑+H2OSO32-+Ba2+ BaSO3↓BaSO3+2H+ Ba2++H2O+SO2↑3BaSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2OCO32-的检验采用试剂:HCl溶液、Ca(OH)2溶液操作步骤和反应现象:取含CO32-溶液于试管中滴加HCl溶液,发生气泡,再将气泡通入Ca(OH)2溶液中,溶液发浑浊有关的离子方程式:CO32-+2H+ CO2↑+H2OCO2+Ca2++2OH- CaCO3↓+H2ONO3-的检验采用试剂:Cu、浓H2SO4操作步骤和反应现象:在Cu屑和浓H2SO4混合物的试管中加入少许含NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式:2NO3-+4H++Cu Cu2++2NO2↑+2H2OPO43-的检验采用试剂:AgNO3、稀HNO3操作步骤和反应现象:向含有PO43-溶液的试管中滴加AgNO3溶液,生成黄色沉淀,再加HNO3后沉淀溶解有关的离子方程式:PO43-+3Ag+ Ag3PO4↓Ag3PO4+3H+ 3Ag++H3PO4。



高中化学阴离子的检验方法阴离子的检验是高中化学的重要知识点,因此大家一定要好好掌握!营养价值1、OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;2、Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓3、Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓4、I-:①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝5、S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓6、SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解: Ba2++SO42-=BaSO4↓7、SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色8、CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O9、HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
10、NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O11、PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。

⾼中化学离⼦的检验!史上最全!本⽂总结了⾼中常见的阴离⼦、阳离⼦的检验⽅法,⽅便学⽣进⾏系统复习。
希望对你有所帮助~阳离⼦1. H+①取样,加⼊锌,产⽣⽆⾊⽓体。
Zn + 2H+=Zn2++ H2↑②取样,加⼊Na2CO3溶液,产⽣⽆⾊⽓体。
③取样,滴加紫⾊⽯蕊试液,变红。
④⽤玻璃棒蘸取少量待测液滴到⼲燥的pH试纸上,pH<>⑤取样,滴加橙⾊的甲基橙试液,变红。
2. Na+、K+、Ca2+⽤焰⾊反应来检验,它们的⽕焰分别呈黄⾊、浅紫⾊(通过钴玻璃⽚)、砖红⾊。
3. Mg2+加⼊NaOH溶液,⽣成⽩⾊絮状沉淀Mg(OH)2,该沉淀不溶于NaOH溶液。
Mg2++ 2OH- = Mg(OH)2↓4. Al3+①加⼊NaOH溶液,⽣成⽩⾊絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨⽔。
Al3++ 3OH- = Al(OH)3↓Al(OH)3 + OH- = AlO2-+2H2O②加⼊氨⽔,产⽣⽩⾊絮状沉淀。
A13++3NH3·H2O= Al(OH)3↓+3NH4+5. Ba2+加⼊稀硫酸或可溶性硫酸盐溶液,⽣成⽩⾊沉淀BaSO4,该沉淀不溶于稀硝酸。
Ba2+ + SO42- = BaSO4↓6. Ag+①加⼊稀盐酸或可溶性盐酸盐,⽣成⽩⾊沉淀AgCl,该沉淀不溶于稀硝酸。
Ag+ + Cl- =AgCl↓②加⼊氨⽔,⽣成⽩⾊沉淀,继续滴加氨⽔,沉淀溶解。
Ag++NH3·H2O=AgOH↓+NH4+AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O③加⼊NaOH溶液,⽣成⽩⾊沉淀,并迅速变为棕⿊⾊。
Ag++OH-=AgOH↓2AgOH=Ag2O+H2O7. NH4+加⼊浓NaOH溶液,加热,产⽣刺激性⽓味⽓体NH3,该⽓体能使湿润的红⾊⽯蕊试纸变蓝。
8. Cu2+(蓝⾊(浓的CuCl2溶液显绿⾊))①加⼊NaOH溶液,⽣成蓝⾊沉淀Cu(OH)2,加热后可转变为⿊⾊的CuO沉淀。

高中化学中常见离子的分析与鉴定方法总结化学是一门研究物质组成、性质和变化规律的科学,而离子则是化学反应中不可或缺的重要角色。
在高中化学教学中,学生需要了解常见离子的分析与鉴定方法,以便能够准确判断和分析不同物质中的离子成分。
本文将总结一些常见离子的分析与鉴定方法,帮助学生更好地理解和掌握这一知识点。
一、阳离子的分析与鉴定方法1. 铵离子的分析与鉴定:铵离子是一类带正电荷的离子,常见的有氨根离子(NH4+)。
铵离子可以通过加热试样并用红色湿润的红石蕊试纸接近试样蒸发处,如果试纸变蓝,则可以判断存在铵离子。
2. 钠离子的分析与鉴定:钠离子(Na+)是一种常见的碱金属离子,可以通过火焰试验进行鉴定。
将待测溶液滴在铂丝环上,然后放入蓝色火焰中加热,如果火焰变成黄色,则可以判断存在钠离子。
3. 铜离子的分析与鉴定:铜离子(Cu2+)是一种常见的过渡金属离子,可以通过加入氨水进行鉴定。
当氨水加入含铜离子的溶液中时,溶液会由蓝色变为深蓝色,这是因为铜离子与氨水形成了配合物。
二、阴离子的分析与鉴定方法1. 硫酸根离子的分析与鉴定:硫酸根离子(SO42-)是一种常见的阴离子,可以通过加入钡离子进行鉴定。
当钡离子与硫酸根离子反应时,会生成白色沉淀,这是硫酸钡(BaSO4)的产物。
2. 氯离子的分析与鉴定:氯离子(Cl-)是一种常见的阴离子,可以通过加入银离子进行鉴定。
当银离子与氯离子反应时,会生成白色沉淀,这是氯化银(AgCl)的产物。
3. 碳酸根离子的分析与鉴定:碳酸根离子(CO32-)是一种常见的阴离子,可以通过加入酸进行鉴定。
当碳酸根离子与酸反应时,会产生气体释放,这是因为碳酸根离子分解产生二氧化碳气体。
三、其他离子的分析与鉴定方法1. 硝酸根离子的分析与鉴定:硝酸根离子(NO3-)可以通过加入铁离子进行鉴定。
当硝酸根离子与铁离子反应时,会生成棕色沉淀,这是亚硝酸铁(Fe(NO2)3)的产物。
2. 硫酸根离子的分析与鉴定:硫酸根离子(HSO3-)可以通过加入酸进行鉴定。

高中化学离子检验总结前言离子检验是高中化学实验中非常重要的内容之一。
通过离子检验,我们可以准确地鉴定不同离子的存在与否,从而帮助我们确定未知物质的组成。
在进行离子检验实验时,我们需要熟悉不同离子的特性和检验方法,以及实验中常用的反应方程式。
本文将对常见的离子检验方法进行总结,帮助同学们更好地进行离子检验实验。
阳离子的检验铵离子铵离子是一类氨基阳离子,常见的有NH4+。
我们可以通过加入碱溶液,例如NaOH溶液,在产生氨气的同时,将溶液浓度较小的酸酸化,出现白烟的特性来判断铵离子的存在。
反应方程式:NH4+ + NaOH → NH3↑ + H2O钠离子钠离子是一种常见的单价阳离子,其存在可以通过以下几种方法来检验。
火焰试验将待检物质放在铂丝上,然后将铂丝放入火焰中加热,观察火焰颜色的变化。
钠离子存在时,会发出明亮的黄色光。
沉淀法将待测溶液加入氯化银溶液(AgNO3),如果出现白色沉淀,则表明溶液中含有钠离子。
反应方程式:Na+ + AgNO3 → AgCl↓ + NaNO3钾离子钾离子是一种常见的单价阳离子,其存在可以通过以下几种方法来检验。
火焰试验将待检物质放在铂丝上,然后将铂丝放入火焰中加热,观察火焰颜色的变化。
钾离子存在时,会发出紫色光。
钡氯化物法将待测溶液加入氯化钡溶液(BaCl2),如果出现白色沉淀,则表明溶液中含有钾离子。
反应方程式:2 K+ + BaCl2 → 2 KCl + Ba↓阴离子的检验硝酸根离子硝酸根离子是一种常见的阴离子,其存在可以通过以下几种方法来检验。
铁氰化钾法将待测溶液加入铁氰化钾溶液(K4[Fe(CN)6]),如果出现深蓝色溶液或沉淀,则表明溶液中含有硝酸根离子。
反应方程式:NO3- + 3 K4[Fe(CN)6] → KNO3 + K[Fe(CN)6]↓氯离子氯离子是一种常见的阴离子,其存在可以通过以下几种方法来检验。
银镜反应法将待测溶液加入硝酸银溶液(AgNO3),如果溶液变黑或出现黑色沉淀,则表明溶液中含有氯离子。

高中氯离子的检验方法
高中氯离子的检测方法
高中氯离子的检测主要是通过能检测氯离子的物质 (如:碱性物质, 金属离子, 含氧物) 和特定的化学方法来进行的。
一、利用碱性物质检测氯离子
1、乙醇金属溶液法
将氯离子溶液添加少量乙醇金属溶液, 如由镁, 钙, 铌制成的氯离子检测溶液, 若氯离子结合乙醇金属溶液产生“乙醇金属氯离子”缔合物, 氯离子数量过多则形成深绿色沉淀, 进而用称量瓶称量, 就可以检测氯离子的含量。
2、碱氢比法
检测氯离子的原理是参照它所离子化成的碱(碱性物质)和它所滴定出来的氢所构成的碱氢量比较来计算出氯离子的数量。
由于碱氢量比例是可以被准确测量出来的, 因此可以用它检验氯离子的浓度。
1、氯化铁比色法
氯化铁比色法是指定标度的可溶性铁和氯离子混合后, 于反应杯中添加某种比色法解析试剂, 将氯和铁的结合物转变成不溶性的二氧化铁, 产生比色之后, 用比色计量出氯离子的浓度。
2、试剂滴定法
把氯离子溶液加入表格滴定容量比定义到定容度, 然后添加指定的滴定剂慢慢循环加入, 随着滴定剂加入的增加, 在指定浓度时, 滴定剂反应产生某种明显的色变, 再用称量瓶加以称量, 就可以准确测定出氯离子的浓度。
四、金属离子检测氯离子
金属离子吸收法用于检测氯离子。
原理是把金属离子溶液与氯离子溶液混合, 当金属离子与氯离子结合后, 生成沉淀, 沉淀的形成可以用作氯离子浓度的判断依据。

高中常见离子检验方法
1. 火焰试验:将待检离子溶液挂在锥形玻璃棒上,送入酒精灯火焰中,观察火焰的颜色和特点变化。
2. 沉淀法:将待检离子溶液与特定试剂混合,观察是否生成沉淀或颜色变化。
3. 电化学法:利用电化学方法,如电解或电沉积法来检验离子。
4. 复分析法:通过多种化学反应组合,将待检离子与已知离子进行比较,以确定待检离子的种类和含量。
5. 分光光度法:利用光谱仪测量溶液对特定波长的光的吸收或发射特性,来分析离子的含量和浓度。
6. 离子交换法:利用离子交换树脂对离子交换特性进行分析。

离子检验方法离子检验是一种常见的化学分析方法,通过对样品中离子的检测和分析,可以确定样品的成分和性质。
离子检验方法广泛应用于环境监测、食品安全、药物研发等领域。
下面将介绍几种常见的离子检验方法。
一、离子色谱法。
离子色谱法是一种通过色谱柱分离离子,并通过检测器检测的分析方法。
它可以对阳离子和阴离子进行分离和检测,具有分离效果好、灵敏度高、选择性强的特点。
离子色谱法广泛应用于水质分析、食品检测、药物分析等领域。
二、离子选择电极法。
离子选择电极是一种专门用于检测某种特定离子的电极。
通过将离子选择电极浸入待测样品中,可以测定样品中特定离子的浓度。
离子选择电极法具有操作简便、快速准确的特点,适用于实时监测和现场分析。
三、离子交换色谱法。
离子交换色谱法是一种利用离子交换树脂对离子进行分离和检测的方法。
它可以对不同价态的离子进行分离,并通过检测器进行定量分析。
离子交换色谱法在环境监测、生物医药、食品安全等领域有着广泛的应用。
四、离子选择性电极法。
离子选择性电极法是一种利用离子选择性电极对特定离子进行测定的方法。
它具有操作简便、灵敏度高、选择性强的特点,适用于对特定离子进行快速准确的测定。
五、离子色谱质谱联用法。
离子色谱质谱联用法是将离子色谱和质谱联用,通过色谱分离和质谱检测,可以对样品中的离子进行定性和定量分析。
它具有分离效果好、灵敏度高、选择性强的特点,适用于复杂样品的分析。
六、离子电泳法。
离子电泳法是一种利用电场对离子进行分离和检测的方法。
它具有分离效果好、操作简便、分析速度快的特点,适用于对离子进行快速准确的分析。
以上介绍了几种常见的离子检验方法,每种方法都有其特点和适用范围。
在实际应用中,可以根据样品的特点和分析要求选择合适的离子检验方法,以获得准确可靠的分析结果。
离子检验方法的不断发展和改进,将为化学分析领域带来更多的可能性和机遇。
高中化学检验各种离子的方法
高中化学是一门重要的自然科学学科,其中离子的检验是非常重要的内容之一。
离子是指具有电荷的化学物质,它们可以通过一些特定的化学反应进行检验。
一、硫酸根离子的检验
硫酸根离子是一种常见的阴离子,它可以通过加入钡离子进行检验。
当硫酸根离子和钡离子反应时,会产生一种白色沉淀,这就是硫酸钡。
这个反应可以用来检测硫酸根离子的存在。
二、氯离子的检验
氯离子是一种常见的阴离子,它可以通过加入银离子进行检验。
当氯离子和银离子反应时,会产生一种白色沉淀,这就是氯化银。
这个反应可以用来检测氯离子的存在。
三、碳酸根离子的检验
碳酸根离子是一种常见的阴离子,它可以通过加入盐酸或硫酸进行检验。
当碳酸根离子和盐酸或硫酸反应时,会产生一种气体,这就是二氧化碳。
这个反应可以用来检测碳酸根离子的存在。
四、铁离子的检验
铁离子是一种常见的阳离子,它可以通过加入硫氰化钾进行检验。
当铁离子和硫氰化钾反应时,会产生一种深红色溶液,这就是氰合铁离子。
这个反应可以用来检测铁离子的存在。
五、铜离子的检验
铜离子是一种常见的阳离子,它可以通过加入氢氧化钠进行检验。
当铜离子和氢氧化钠反应时,会产生一种蓝色沉淀,这就是氢氧化铜。
这个反应可以用来检测铜离子的存在。
六、铝离子的检验
铝离子是一种常见的阳离子,它可以通过加入氢氧化钠进行检验。
当铝离子和氢氧化钠反应时,会产生一种白色沉淀,这就是氢氧化铝。
这个反应可以用来检测铝离子的存在。
以上是高中化学检验各种离子的方法,这些方法在实际化学实验中非常有用,可以帮助我们快速准确地检测各种离子的存在。
在实验中,我们需要注意实验条件,严格按照实验步骤进行操作,以保证实验结果的准确性和可靠性。