不同产地丹参中丹酚酸B的含量测定
- 格式:pdf
- 大小:125.74 KB
- 文档页数:2

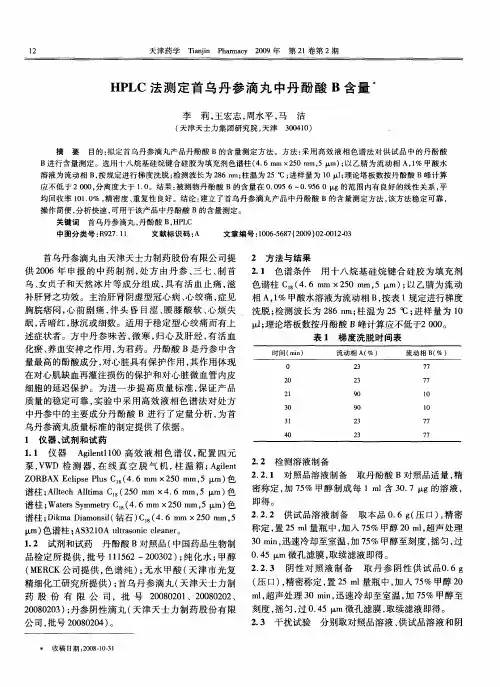
高效液相色谱法测定注射用丹参多酚酸盐中丹酚酸B 的含量注射用丹参多酚酸盐属于中药处方药,其80%为丹参乙酸镁。
临床上用于治疗心绞痛、冠心病和心血管内科病等疾病[1-2],具有通脉养心、活血化瘀、养血安神、活血消肿等功效。
注射用丹参多酚酸盐的主要的活性成分丹参素、原儿茶醛、原儿茶酸、咖啡酸、迷迭香酸、异阿魏酸、紫草酸以及丹酚酸A、B、C、E 等。
注射用丹参多酚酸盐的质量控制主要是以酚酸B的含量作为质控指标[3-5]。
目前,还未见对注射用丹参多酚酸盐的丹酚酸B活性成分含量控制的报道。
本文建立了高效液相色谱法测定注射用丹参多酚酸盐中丹酚酸B含量的方法,用以测定该药品的质量。
一、试验器材与方法1.试验仪器与试剂岛津高效液相色谱仪(LC-15C,四元泵,氘灯监测,可控温度,C18色谱柱);注射用丹参多酚酸盐(生产厂家:上海绿谷制药XX公司,规格:每瓶装量50mg,批号:13032821);丹酚酸B标准品(中国药品生物制品检定所提供,批号:111562-200302);甲醇、乙腈为色谱纯(国药);水为重蒸馏水;甲酸为分析纯(国药)。
2.色谱分析条件C18反相柱(5μm,100A250mm×46mm);柱温度30摄氏度;紫外检测器;流动相:甲醇-乙腈-甲酸-水(30:10:1:59);流量:1.0mL/min;检测波长286nm;进样量20μl。
3.试验方法(1)溶液的配制1)标准品品溶液的配制精密称取丹酚酸B标准品5mg,定量于50ml容量瓶中,加水定量到刻度值,摇匀后精密量取5ml溶液置于50ml容量瓶中,加水定量到刻度值,摇匀,既得10mg/L的标准品溶液。
2)供试品溶液的配制精密称取注液用丹参多酚酸盐5mg,定量于50ml容量瓶中,加水定量到刻度值,摇匀,即得供试品溶液。
3)对照品溶液的制备将2)中的丹参多酚酸盐换为等量的纯水,配置方法与2)相同。
(2)检测方法设置好色谱条件后,吸取过微滤膜的上述溶液各20μl,分别注入高效液相色谱仪,进行色谱分析,采用外标法以峰面积计算样品的含量,重复5次。

不同品种丹参质量比较张晓阳;李先恩;伊伟贞【期刊名称】《中国农学通报》【年(卷),期】2012(28)34【摘要】为了比较4个丹参品种(系)(99-2、99-3、‘陕黄’和山东丹参)的质量,采用HPLC-UV方法(Venusil ASB-C18柱),分别以甲醇-水、乙腈-0.01%磷酸水为流动相等度洗脱,流速为0.8mL/min,检测波长为270nm和286nm,测定了丹参中的6种成分(丹参酮I、隐丹参酮、丹参酮IIA、原儿茶酸、迷迭香酸、丹酚酸B)的含量。
结果表明,不同品种的丹参质量差异显著,所测6种成分中除迷迭香酸外,其余5种均在99-3中含量最高,迷迭香酸的含量也仅次于99-2;‘陕黄’中只检测到4种成分(隐丹参酮、原儿茶酸、迷迭香酸、丹酚酸B),其含量均低于其他3个品种;99-2的4种(丹参酮IIA、原儿茶酸、迷迭香酸、丹酚酸B)成分含量高于山东丹参。
HPLC-UV方法测定丹参化学成分含量简便可靠;4个丹参品种(系)中99-3品质佳,质量优于其他品种,具有较高的商业价值。
【总页数】6页(P238-243)【关键词】丹参;不同品种;质量;多成分;HPLC-UV【作者】张晓阳;李先恩;伊伟贞【作者单位】北京协和医学院/中国医学科学院/药用植物研究所【正文语种】中文【中图分类】R931.2【相关文献】1.不同丹参品种主要器官的显微结构比较 [J], 舒志明;梁宗锁;曹翠兰;叶正良;卫新荣;蒋传中;付亮亮;张兴悟2.不同提取工艺丹参浸膏的TLC比较及复方丹参片的质量控制 [J], 刘文峰;王千菊3.不同品种丹参中丹参酚酸B含量比较 [J], 孙磊;陈靖;王晶;张立明;权洪峰;张彩芳4.不同产地不同品种丹参药材内在质量评价 [J], 代云桃;秦雪梅;郭小青;王松柏5.对不同品种、不同产地丹参药材中原儿茶醛及丹参素含量的比较分析 [J], 马家燕因版权原因,仅展示原文概要,查看原文内容请购买。

以丹参为主药的制剂,其含量测定指标一般有脂溶性成分丹参酮Ⅱ和水溶性成分丹酚酸B、A和丹酚酸B含量控制丹参药材丹参素。
《中华人民共和国药典》(2005年版)以丹参酮ⅡA的含量,仅为0.18μg·m 的质量。
笔者也采用高效液相色谱法测定了骨健口服液中丹参酮ⅡAL-1。
由于骨健口服液采用水提醇沉的制备工艺,以水溶性成分的含量控制制剂的质量更为合理,故本实验确定以丹酚酸B为骨健口服液的含量测定指标。
(4.6 mm ×250mm,5μm)色谱柱,笔者在本实验中最初采用Zorbax Eclipse XDB-C18但丹酚酸B色谱峰拖尾严重,而加大流动相中甲酸比例时,pH值较低(接近2.0),对色谱柱损害较大。
考虑到各种型号色谱柱的适用性,故选择Zorbax Eclipse SB-C;:(4.6 mm× 150 mm,5m)色谱柱进行试验,结果峰形大大改善,分离度、理论塔板数、拖尾因子、18重复性等参数均符合系统适应性要求。
考虑到丹酚酸B为酸性物质,在中性流动相中易发生离解〕,使含量偏低且拖尾严重,故笔者在本实验中采用了反相离子抑制技术,在流动相中加入少量甲酸,抑制其离解并改善峰形。
本实验分别考察了甲醇-乙腈-甲酸-水(30:10:1: 59),甲醇-乙腈-甲酸-水(29:9:1.5:60.5),甲醇-乙腈- 甲酸-水(28:9:1.5:62.5),甲醇-乙腈-甲酸-水(27: 8:2:63)等流动相体系,结果发现当流动相为甲醇-乙腈-甲酸-水(27:8:2:63)时,能显著改善拖尾,丹酚酸B约稳定在10.5 min出峰,色谱峰形较好,分离度、理论塔板数、拖尾因子等系统适应性均符合要求。
根据丹酚酸B的理化性质,笔者考察了萃取溶剂、pH 值对丹酚酸B含量的影响。
发现以乙酸乙酯萃取供试品溶液丹酚酸B含量最高,乙醚次之,氯仿最低;并考察不同pH值萃取对丹酚酸B含量的影响,发现丹酚酸B的含量依次为:pH值 =3.0>pH值=4.0>pH值=1.0>pH值=2.0,故笔者在本实验中采用加0.1 mol·L-1盐酸调节pH值至3.0,再用乙酸乙酯萃取供试品的处理方法。

丹参片是一种中药制剂,常用于心脑血管疾病的治疗。
其主要成分是丹参酮酸和丹酚酸B等化合物。
准确测定丹参片中的有效成分含量对于药品的质量控制和疗效保证至关重要。
以下是一种常用的丹参片含量测定方法的介绍。
实验仪器和试剂:1.紫外分光光度计2.分析天平3.研钵和研针4.醇5.甲醇6.硅胶薄层板7.酚试剂8.苯胺试剂方法步骤:1.取丹参片样品20g,粉碎,过筛,称取约0.5g样品放入研钵中。
2.加入约10ml的醇,用研针将样品彻底研磨。
3.将样品研磨液转移至50ml量瓶中,用醇溶解至刻度线。
4.取等容量的样品溶液,经0.45μm滤膜过滤。
5.取适量过滤液放入紫外比色皿中,用甲醇稀释至适量浓度。
6.使用紫外分光光度计在276nm波长处进行吸光度测定,并在对照组的同时进行测定。
7.取约0.1g丹参片样品放入研钵中,用醇溶解,并用酚试剂和苯胺试剂分别进行显色反应。
8.将反应液在硅胶薄层板上进行显色点检,用无色比色台对照上机显色点进行定性和定量分析。
计算方法:1.根据紫外吸收度测定结果,根据丹酚酸B的摩尔吸光系数(ε)和溶液的比例系数(稀释倍数),计算样品中丹酚酸B的含量。
2.根据显色点的数量和质量关系,计算样品中丹参酮酸的含量。
实验注意事项:1.保持实验环境的清洁,避免样品受到污染。
使用无尘纱布、纸巾等物品进行实验操作。
2.实验操作中注意安全,避免溶液溅洒和皮肤接触。
3.正确选择仪器参数和试剂浓度,保证实验结果的准确性和重复性。
4.样品处理过程中严格控制温度和时间,避免样品的变化和降解。
5.使用标准品和对照品进行定量分析,确保结果的准确性和可靠性。
通过以上的丹参片含量测定方法,可以准确地测定样品中丹酚酸B和丹参酮酸等有效成分的含量。
这对于丹参片的质量控制和药品疗效的保证具有重要意义。
同时在实验操作过程中要注意安全和实验条件的控制,以确保最终的实验结果的准确可靠。

丹参酚酸B和丹参酮ⅡA在丹参根中的分布VO17N01Jan2005≤罄≯丹参酚酸B和丹参酮IIA在丹参根中的分布曲桂武㈧,解飞霞z,岳喜典㈧,刘影,李桂生(1.中国海洋大学,山东青岛266005;2.山东省天然药物工程技术研究中心,山东烟台264005;5.锦州医学院,辽宁锦,/t,iI2IO0I)【摘要J目的:探索丹参有效成分在根中的分布情况.方法:以丹参酮II和丹参酚酸B为检测指标,高效液相色谱法检测.结果:丹参酮II在丹参木栓层中含量为194%.在其余部分含量为001%.丹参酚酸B在木栓层中的含量为556%.在其余部分中的含量为428%.结论:丹参酮llA主要存在于丹参木栓层丹参酚酸B则在全根中均有分布木栓层中含量稍高.【关键词】丹参丹参酮ll,丹参酚酸B分布HPLC参Sa|v|a/W//t/Orrh/zaBge为唇形科鼠尾草属植物载于《神农本草经》列为上品【.1.药用部位为根及根茎,是具有活血化瘀活性的常用中药,I伍床用于治疗冠心病,心绞痛,缺血性中风,栓塞,肝脾肿大,化脓性感染等疾病【2.研究发现,丹参的有效成分主要包括以丹参酮II为代表的醇溶性菲醌类化合物和以丹参酚酸B为主的水溶性酚酸类化合物,丹参酮II具有增加冠脉流量,改善心肌功能,降低血小板聚集的功能,丹参酚酸B则具有抗氧化,抗凝抗血栓, 抗心肌缺血及调血脂作用,对多种实验性心,肝脾的损伤均具有保护作用.显微鉴别显示,丹参根横切面由外向内依次为木栓层,皮层,韧皮部,形成层和木质部五部分组成(见图1).木栓层为4-6列细胞, 内含紫褐色物质.皮层,韧皮部,形成层和木质部均为黄色或灰白色,是丹参根的主要结构组成部分,约占丹参根干重的9O%左右. 传统工艺多以丹参全根入药或提取.其中的醇溶性成分和水溶性成分均为提取对象,由于二者极I.本杵=层2.皮层3.轫皮部4.形成层5.本质郎6.射线圈1.丹参根横切面显徽圈Fig.1TheTransverseSectionofSalvia MiltiorrhizaBge.性差别较大,往往造成提取产物以某一类成分为主,而另一类成分损失较大.随着人们对丹参中有效成分了解的深入,尤其是单以丹参酮II等醇溶性成分和单以丹参酚酸B,丹参素等水溶性成分为主的药物制剂的开发利用,有必要对有效成分在丹参各部分的分布进行确认.显微鉴别发现,丹参红棕色的外栓层与黄色或灰白色的其余部分在外观上有显着的区别据此我们猜测,红色的丹参酮II和白色的丹参酚酸B这两种成分在丹参不同部位的含量可能有所差别,因此我们对这两种成分在丹参木栓层和其余部位中的含量进行了检测. 以便为合理利用丹参这一宝贵的药材资源提供参考.1仪器与试剂Agi{ent1100型高效液相色谱仪(包括一元泵柱温箱,手动进样器VWD检测器,HP—ChemStatIOn),1/1万电子分析天平(德国SartoriousBPI10s),KQ-1O00B型超声波清洗器(昆山市超声仪器有限公司)丹参酮II对照品(中国药品生物制品检定所),丹参酚酸B对照品(山东省天然药物工程技术研究中心现代中药室制备,经uV,{R,H.NMR口C.NMR分析确证为丹参酚酸B,纯度> 98%),乙腈甲醇(色谱纯,天津市四友生物医学技术有限公司)盐酸(化学纯,烟台三和化学试剂有限公司),冰醋酸(分析纯盐城益林化工厂).实验中所用水为去离子水.丹参购自安徽毫州药材市场,产地为山西,经鉴定为Sa/V/a/V///t/brrh/2aBge的干燥根.将丹参切片后用剪刀将木栓层沿与皮层交界处分离,分别收集并60.C干燥6h,粉碎至过3号筛,称量发现木震&foJlTCMIII栓层部分占总重的7.23%其余部分占9005%.损耗272%.2方法与结果2.1实验设计通过仪器精密度,溶液稳定性线性范围,结果重现性和加样回收率考察等方法学研究,确定卜PLC检测丹参酚酸B和丹参酮ll含量的方法可行性:将丹参木栓层,除去木栓层后剩余的丹参部分和未经剥离处理的丹参粉末(过3号筛)均按下面方法分~jIJN备丹参酮ll和丹参酚酸B的供试品溶液,高效液相法测定两种成分的含量.2.2对照品溶液和供试品溶液的制备221对照品溶液的制备取丹参酮ll对照品5mg精密称定置25ml棕色量瓶中加甲醇至刻度摇匀作为丹参酮ll对照品贮备液;取丹参酚酸B对照品25rag精密称定,置25ml棕色量瓶中,加01m0I/L盐酸溶液使溶解并稀释至刻度摇匀作为丹参酚酸B对照品贮备液.222供试品溶液的制取待测药材粉末03g精密称重,置具塞锥形瓶中,精密加入甲醇50m1.密塞称定重量加热回流1h放冷.密塞再称定重量,用甲醇补足减失的重量,摇匀用0.45m膜过AB024681012141618rnin024681012141618CD圈2.对照品和供试品的HPLc图谱A:丹参酮对照品;B:丹参酮II.供试品c:丹参酚酸B对照品;D:丹参酚酸Bl供试品Fig.2HPLCChromatogramsA:RefercncesubStanceofTanShinOneII:B:Samp1eSO1u¨OilforTanshinoneII.aa1ysec:RefercncesubStanceofSa1viano1iacidB:D:Samp1esO1utionforSa1VianolicacidBana1yse VO一7NO1dan2005i≥≯滤,取续滤液作为测定丹参酮l1的供试品溶液;另取待测药材粉末1g精密称重置具塞锥形瓶中加入20ml0.1m0l/L盐酸溶液密塞称定重量超声处理30rain静置,上清液用045m膜过滤取续滤液作为测定丹参酚酸B的供试品溶液.2.3方法学考察23.1色谱条件与系统适应性色谱柱:AgllentZORBAXEclfpse XDB—C.(46ramX150mm.5L【m) 柱温:35.C进样量:20l:检测丹参酮ll流动相为甲醇水(15:5v/v)检测波长270nm.流速05ml/min理论塔板数以丹参酮lj计不低干2000;检测丹参酚酸B流动相为甲醇一水一冰醋酸(3g:61./v/v)检测波长286nm流速05ml/min理论塔板数以丹参酚酸B计不低干4000 23.2溶液稳定性考察精密量取丹参酮ll对照品贮备液25m1.置25m1棕色量瓶中加甲醇至刻度. 摇匀作为溶液稳定性考察用丹参酮ll对照品溶液:精密量取丹参丹参酚酸B对照品贮备液25m[.置10mI棕色量瓶中加01mol/L盐酸溶液至刻度摇匀作为溶液稳定性考察用丹参酚酸B对照品溶液取丹参全根粉碎至过3号筛按供试品溶液的制备方法分别制备丹参酮ll供试品溶液和丹参酚酸B 供试品溶液.分别精密吸取上述供试品溶液和对照品溶液各20『.注入液相色谱仪记录色谱图然后每隔1h进样一次共测6次,比较丹参酮llA和丹参酚酸B的峰面积其RSD%分别为1.24,1572.30和1.76表明四种溶液在5h内比l2/震&1DnTCM一一一一^I一…~:1较稳定.可以满足含量测定对分析时间的要求.233仪器精密度考察取"溶液稳定性考察试验"中的两种对照品溶液.精密吸取20u1.注入液相色谱仪.记录色谱图.各连续进样6针.考察仪器的精密度.结果表明.丹参酮1I和丹参酚酸B的峰面积RSD%分别为1.74和1.65. 说明仪器具有良好的精密度.234线性范围考察精密量取丹参酮l】对照品溶液0.5,10, 203.0,40和50ml于25ml棕色量瓶中.加甲醇至刻度.摇匀各精密吸取20l1.注入液相色谱仪,测定,以丹参酮l】的峰面积为纵坐标,浓度为横坐标.Y=I31328X+38509.r=-O.9995.表明丹参酮l】在0.004-0.04mg/ml 之间线性关系良好:精密量取丹参酚酸B对照品溶液0.1.0,2.0 304.0和50ml于10ml棕色量瓶中,加01mol/1_盐酸溶液稀释至刻度,摇匀.各精密吸取20J.注入液相色谱仪.测定.以丹参酚酸B的峰面积为纵坐标.浓度为横坐标.Y=67452X+19356.r=-O9995表明丹参酚酸B在0.05-05mg/ml 之间线性关系良好.23.5重复性试验取丹参全根粉末,按供试品溶液的制备方法分别制备5份丹参酮ll供试品溶液和丹参酚酸B供试品溶液按各自的检测条件检测.并根据标准曲线计算供试品中丹参酮ll和丹参酚酸B的含量.结果显示二者RSD%分别为159和1.7g.2.3.6回收率试验取丹参全根粉末10份.已知其丹参酮ll含量为027%,丹参酚酸B含量为4.82%.其中5份按供试品制备方法制备成丹参酮II供试品溶液后加入浓度为005mg/ml的丹参酮l】对照品溶液10m1另5份制备成丹参酚酸B供试品溶液后加入浓度为01mg/mf的丹参酚酸B对照品溶液10ml,按各自的液相色谱检测条件进行检测.测得丹参酮l】和丹参酚酸B的回收率分别为9g78%和100.26%RSD分别为232%和2.08%.2.4样品测定精密称取丹参全根,木栓层部分和去木栓层部分适量.按供试品溶液的制备方法分别制备丹参酮II和丹参酚酸B供试品溶液.精密量取上述供试品溶液201按各自的色谱条件检测.将峰面积代入标准曲线.计算3种样品中丹参酮II和丹参酚酸B的含量.检测结果见表1.丹参酮II和丹参酚酸B均为表1丹参不同部位中丹参酮II和丹参酚酸B的含量测定结果Tab.1111eContentofTanshinone[[AandSalvianolicAcidBinThreeSamples %丹参中具有活血化瘀功能的有效成分目前有多种丹参制剂.如粉针剂滴丸剂注射液制剂等.不同的制剂由于工艺方面的原因.在处理丹参时对各有效成分的针对性并不相同.如在滴丸剂等口服制剂中.醇溶性化合物如丹参酮J}和水溶性化合物如丹参酚酸B均可作为提取对象而在一些注射剂型中.则主要以水溶性化合物为提取对象.通过对各成分在丹参不同部位分布的研究.可以指导我们在进行丹参制剂工艺研究中针对不同剂型采用丹参的不同部位,做到合理利用药材资源.另外.本实验的检测结果表明,丹参酮几乎全部分布于丹参的木栓层内.木栓层内丹参酚酸B的含量也比其余部分要高,这提示我们在丹参药材的采集,运输和贮藏过程中应尽量避免丹参木栓层的磨损和浸泡,醇溶性成分集中于木栓层.还可减少水溶性成分向周围环境中流失,因此建议丹参根尽量避免以切片的形式运输和贮藏.芍义献【1]康廷国.中药鉴定学【M].北京:中国中医药出版社,2002,l72一l75.【2]宋德明,苏海,吴美华,等.川芎嗪,丹参对心肌成纤维细胞胶原合成和细胞增殖的影响【J].中国中西医结合杂志,l998,18(7):423.【3]王荷碧,郭娟,顾洁,等.活血化瘀药物(764—3)对胶原生物合成影响的研究【J].中国药学杂志,l997,32(10):587. 【4]孙莉莎,吴航宇,徐江平,等.丹酚酸B对家兔血液流变性的影响【J].微循环学杂志,2003,13(1):19—20.【5]国家药典委员会.中国药典(2000年版一部)【s].北京:化学工业出版社, 2000,57.(下转第17页)R&IonTcM/13…一}}~一一一…#【37]MaurY aR.WazirV,Kapi1A,eta1.Cordifo1isideAai1dB.two FlewphenylPfopei1cdisaccharidesfro111 Tinospofacordifo1iapoSSeSSing fmmunoStimliantactivitY.NatProdLett.1996.8(1):7—10.【38]AfjunS,fieidrunN,}IildebertW.Phenylpropanoidg1ycosidesfro111 theAdaPtPgcnicPlantdrugs Tinosporacordifo1aandDrYPetes roxburghii【J].P1antaMed,1994,60, 596—597.【39]MichikoY,NaoillichiF, TakeatsuK.StudiesontheCOIlStitUCFItSofTiflosporasinellsis.1.Separationa11dstructureofthe newpheno1icglycosidetinosineS【J]. PlantaMed,1993,59,552—553. 【40]SongCO,Xi.iRS. PhYtoecdYsonesforii1therootof TinosPoracaPill1Pes.ChinCheii1 Lett,I99I,2(I):I3一I4.【41]Rakes11M,SukhdevSH. TiDOCOrdifolin.asesquiterpenefrom Tinosporacord1fo1ia【J]. PhYtocheillistrY1998.49(5):1343—1345.【42]RakeshM,KaflayaLD,Sukhdev SH.AsesquiterPeneg1ucos{defro111 TinosPoracordifo1ia【J]. PhytochelllistrY,1997,44(4):749—750.【43]SabriG,Vishwakarii1aRA. Tinocordiside.anewrearrangedcadii1ai1escsquitcrpc11cglycosidc fro111Tinosporacordifolia【J].JNat Prod.1997,60(8):839—841.【44]AttaurR,SafdarA,Su1tanA.eta1.AfuranoidditerPenefro111 TinosPoraii1a1abarica【J]. PhytochemistrY.1992.31(9):3155—3157.【45]郭幼莹,林连波.海南青龙胆化学成分的研究.药学,1998,33(5): 350—354.【46]林连波,符小文,郭幼莹等.海南青龙胆非生物碱成分的分离与鉴定. 中草药,2001,32(1):12—13.【47]张敏,李苑,李海棠.宽筋藤中L一1,2,4/3,5环已五醇的分离鉴定.中药材,1993,16(12):27—29.[48】MathewS.fmmunomoduIatorY and antitUmOUractivitiesofTiDospora cordifo1ia.FiloteraPia.1999.70 (1):35【49]孙备.心叶青龙胆和积雪草提取物的抗应激活性.国外医学:中医中药分册,1997,19(4):54—55.【50]李宗友.心叶青龙胆和积雪草提取物的抗溃疡活性.国外医学:中医中药V ol7NO1Jan2O05薹ll00分册1997,19(1):37.【51]NoofH.Pharnlacological charactersationoftheai1t-】1YPefglycaeii1icproPeftiesof TinosPoracrisPacxtfact.Ethi1oPhariliaco1,1998,62(1):7. 【52]钟鸣,朱红梅,余胜民等.金果榄醇提物的抗炎镇痛作用.中国中药杂志,1999(增刊):105—106.【53]华娟,周明康,周琼珍等.50种传统解毒药的抑菌实验,中药材,1995,18(5):255—258.(上接第13页)ThedistributionofsaIvianoIicacidBandtanshinonensa|via舶i|tiorrhizaBge.0UGui-wu',XlEFei—xia,YUEXi—dian'?,LlUYing.LlGui—sheng2.Ccean|vefs|ty.tC|mQ|ngd∞shando266.G3Ch|nShand.ngElneerlRese疆chCenterf.rNaturatDr.gsY anta|Shand.ng264.G3Ch{na=J|nZhoued}ca|Co}}egeJlnZh0uLla.nIng121..1Cn [Abstract]Object:T.determInethedIstrIbutI.n.feffectIvec.ntentsIn5/,,占^l/,,.砌,2曹BgeMethod:Thec.ntents.fTanshIn.nellandSalVIan.lIcacIdBweredetermInedbyHPLCResuIt:Thec.ntent.fTanshI n.neIjwas194?<Ine×.dermIsand001In.therpartsThec.ntent.fSalvIan.lIcacIdBwas5566Inex.dermIsand428 %In.therDarIsConchJsion:TanshIn.neIIAdIstrIbutesmainlyInex.dermIsandSalvian.IIcacIdBdIstributesall.verther..tbuthIqherIn e×.dermIsthanIn.therparts[Keywords]5//力l/,/臼BgeTanshfnonel】SaJvfanojjcacIdBdiscrIbuc』.nHPLCR&,o对rcM,l7。

丹参药材用不同水温超声提取后丹酚酸B的含量测定戴金明;林徐剑;施晓萍;沈莹【摘要】目的测定丹参药材用不同温度的水超声提取后丹酚酸B的含量,以及含量的稳定性考察,并分析含量变化的原因。
方法采用高效液相色谱法,色谱柱为Zorbax SB-C18,流动相为5%冰乙酸-乙腈(82∶18),流速为1.0 m L·min-1,柱温为25℃,检测波长为285 nm。
结果加入2060℃的温度的水所超声提取的丹酚酸B 的含量低且不稳定性,随时间延长而下降较快,而采用70100℃的温度的水所超声提取的丹酚酸B的含量高且较稳定。
结论丹参药材中的某种酶类或菌类物质在一定温度和有水的条件下会水解丹酚酸B,应尽量避免丹参药材与水的接触。
【期刊名称】《药学研究》【年(卷),期】2016(035)008【总页数】3页(P460-462)【关键词】丹参;丹酚酸B;不同水温;超声提取;含量测定;高效液相色谱法【作者】戴金明;林徐剑;施晓萍;沈莹【作者单位】正大青春宝药业有限公司,浙江杭州310023【正文语种】中文【中图分类】R927.2中药丹参(Salvia miltiorrhiza)以唇形科植物丹参的干燥根及根茎入药,在《神农本草经》中列为上品,具有活血祛瘀、通经止痛、清心除烦、凉血消痈的功效。
现代药理研究表明,丹参具有抑制血小板聚集和抗血栓形成、抗动脉粥样硬化、扩张冠状动脉和改善微循环、保护受损心肌、抗心律失常、调节脂质代谢、降血压、抗氧化等诸多功效[1-4]。
随着对丹参研究的深入,发现丹参中酚酸类成分才是其主要的活性成分,而丹酚酸B在丹参酚酸类成分中所占的比例最大[5-6]。
所以丹酚酸B的含量也是丹参药材质量的一个重要指标[7]。
我们在丹参药材炮制成饮片的过程中发现,原丹参药材中丹酚酸B的含量较高,以丹参药材干燥品计含量有7%左右,但炮制成饮片后丹酚酸B的含量只有1%。
通过一系列试验以及数据分析后我们发现,丹酚酸B的含量与炮制丹参药材时加水闷润的时间以及温度有关。
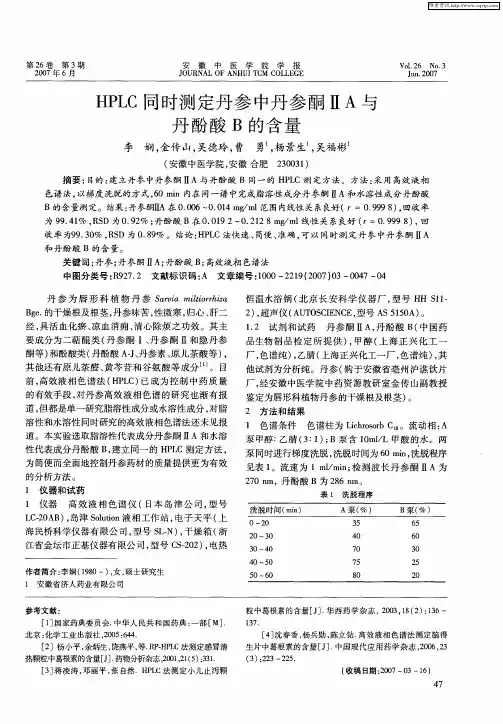

・研究报告・丹参药材提取液中丹酚酸B 稳定性影响因素的考察张 军3,王凤云,詹丽玲,赖小平(广州中医药大学,广东广州510405)[收稿日期] 2004205208[基金项目] 广州市科技攻关计划项目(2003232E5161)[通讯作者] 3张军,Tel :(020)36585812,Fax :(020)36586508,E 2mail :zhjxsh @yahoo 1com 1cn 丹参水溶性酚酸类包括丹酚酸A 、丹酚酸B 、丹酚酸C 、迷迭香酸、丹参素、原儿茶醛等。
药理研究表明丹参酚酸类具有抗凝、抗氧化的活性[123],其中丹酚酸B 是含量最高的活性成分,有文献提示丹酚酸B 的稳定性较差,其制剂工艺过程中稳定性影响因素有待探讨[4]。
本实验对丹参提取液施以不同影响因素,用HPLC 测定丹酚酸B 的含量,考察各种因素对其稳定性的影响。
1 仪器,试剂与样品DION EX SUMM IT 高效液相色谱仪;丹酚酸B 对照品(中国药品生物制品检定所,批号200201);丹参药材购于陕西商洛地区;乙腈为色谱纯;其余试剂均为分析纯。
2 方法与结果211 丹酚酸B 含量测定色谱条件与方法学考察21111 色谱条件 Kromasil C 18柱(416mm ×250mm ,5μm ),流动相乙腈2015%冰醋酸水溶液(20∶80),检测波长254nm ,柱温30℃,流速110mL ・min-1,理论塔板数按丹酚酸B 计算不低于3000。
21112 方法学考察 丹酚酸B 含量测定的线性回归方程为Y =709191X -101547,r =01999,线性范围01288~2188μg ;精密度试验RSD 015%,(n =6);重复性试验RSD 110%,(n =6);加样回收试验得平均回收率为9713%,RSD 118%(n =9)。
212 不同温度对丹参提取液中丹酚酸B 含量影响将丹参水提液分别置于50,60,100℃水浴中受热,每隔一定时间分别取出1份,测定其中丹酚酸B 的含量。

山东菏泽产丹参中4种指标性成分的质量检测
张梦蛟;李军;张文超;贾献慧;唐文照
【期刊名称】《食品与药品》
【年(卷),期】2023(25)1
【摘要】目的检测山东菏泽产丹参中指标性成分的含量是否符合药典标准。
方法
选取山东菏泽不同采收时间的丹参药材,利用HPLC测定药材中隐丹参酮、丹参酮I、丹参酮IIA和丹酚酸B的含量,同时与山东滨州、东营、莱芜,四川中江和陕西宝鸡
等产地的丹参进行比较。
结果山东菏泽产丹参中隐丹参酮的含量为0.10%~0.13%,丹参酮I的含量介于0.05%~0.10%,丹参酮IIA的含量0.07%~0.24%,3种丹参酮
类成分的总量为0.26%~0.43%,丹酚酸B的含量为3.02%~5.23%。
结论山东菏泽产丹参药材中4种指标性成分的含量符合现行药典标准,可在山东菏泽地区推广种
植丹参药材。
【总页数】5页(P76-80)
【作者】张梦蛟;李军;张文超;贾献慧;唐文照
【作者单位】山东第一医科大学药学与制药科学学院(药物研究所)
【正文语种】中文
【中图分类】R284
【相关文献】
1.滇产紫丹参,大紫丹参中丹参酮ⅡA的初步检测
2.不同采收期山东产丹参脂溶性
成分含量变化的研究3.山东省人民政府办公厅关于印发山东省农业“新六产”发
展规划和山东省农业“新六产”发展监测指标体系的通知4.山东道地药材丹参脂溶性成分指纹图谱及多指标成分同时定量研究5.山东产丹参遗传多样性的扩增片段长度多态性指纹分析
因版权原因,仅展示原文概要,查看原文内容请购买。

丹参饮片及其配方颗粒中丹参酮ⅡA与丹酚酸B的含量比较黄良永;张幼林;郑江萍
【期刊名称】《医药导报》
【年(卷),期】2011(30)3
【摘要】目的比较丹参饮片及其配方颗粒中丹参酮ⅡA和丹酚酸B的含量.方法采用高效液相色谱(HPLC)法测定丹参饮片及其配方颗粒中丹参酮ⅡA和丹酚酸B 的含量,比较二者含量差异.结果配方颗粒中丹参酮ⅡA和丹酚酸B的含量明显低于原丹参饮片的含量,与所标示的浓缩倍数不符.讨论原配方颗粒的生产工艺需要改进;配方颗粒需要建立完善的质量控制方法和合理的质量标准.
【总页数】3页(P369-371)
【作者】黄良永;张幼林;郑江萍
【作者单位】湖北医药学院附属太和医院药学部,湖北十堰,442000;湖北医药学院附属太和医院药学部,湖北十堰,442000;湖北医药学院附属太和医院药学部,湖北十堰,442000
【正文语种】中文
【中图分类】R286;R927.2
【相关文献】
1.不同产地丹参药材中丹参酮ⅡA和丹酚酸B含量比较 [J], 陈彻;王勇;王晶;李海龙;杨雅丽;王芳;楚惠媛
2.高效液相色谱法测定参斛颗粒剂中丹参酮ⅡA与丹酚酸B的含量 [J], 褚克丹;季
国路;施红;李煌;张玉琴
3.HPLC法测定丹参不同饮片中丹参酮ⅡA及丹酚酸B的含量 [J], 陈黄保
4.炮制对白花丹参饮片中丹参酮ⅡA和丹酚酸B的影响 [J], 毛淑敏;闫永亮;王峰祥;李奉举
5.HPLC法测定丹参和丹参配方颗粒中丹参酮ⅡA的含量的研究 [J], 谢胜新
因版权原因,仅展示原文概要,查看原文内容请购买。
不同产区丹参药材的质量评价
李涛;李军;徐丽华;林永强;李松涛;范令刚
【期刊名称】《药学研究》
【年(卷),期】2010(029)012
【摘要】目的对山东长清不同产区丹参药材进行质量研究,以确定优质丹参的产区.方法采用高效液相色谱法对不同地形与土壤状况栽培的14批丹参药材进行了丹参酮ⅡA和丹酚酸B的含量测定.结果与结论地形与土壤状况对丹参药材两个指标成分的含量有影响,为推广种植提供了参考依据.
【总页数】2页(P712-713)
【作者】李涛;李军;徐丽华;林永强;李松涛;范令刚
【作者单位】山东省药品检验所,山东,济南,250101;山东省药品检验所,山东,济南,250101;山东省药品检验所,山东,济南,250101;山东省药品检验所,山东,济
南,250101;山东医药技师学院,山东,泰安,271016;山东医药技师学院,山东,泰
安,271016
【正文语种】中文
【中图分类】S567
【相关文献】
1.不同产区穿心莲药材的质量评价 [J], 韦坤华;李林轩;林伟;雷小丹
2.不同产地丹参药材中丹参酮ⅡA及丹参素的含量比较 [J], 严红;高扬;郭伟;程筠
3.不同等级及不同部位的丹参原药材中丹参酮ⅡA含量考察 [J], 刘蕾;李静怡
4.不同产地不同品种丹参药材内在质量评价 [J], 代云桃;秦雪梅;郭小青;王松柏
5.对不同品种、不同产地丹参药材中原儿茶醛及丹参素含量的比较分析 [J], 马家燕
因版权原因,仅展示原文概要,查看原文内容请购买。