铁及其化合物氧化性与还原性
- 格式:docx
- 大小:18.36 KB
- 文档页数:5
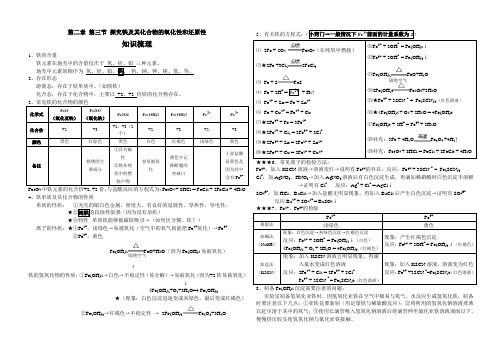
第二章 第三节 探究铁及其化合物的氧化性和还原性知识梳理1、铁的含量地壳中元素的顺序为 2、存在形态游离态:存在于铁单质中。
(如陨铁)化合态:存在于化合物中,主要以 +2、+3 价铁的化合物存在。
343 4 2 3 24、铁单质及其化合物的性质单质的性质: ①光亮的银白色金属,密度大,有良好的延展性、导热性、导电性。
★③特性--单质铁能够被磁铁吸引→(如何区分铜、铁?)离子的性质:★①Fe 2+:浅绿色→易被氧化(空气中的氧气就能把Fe 2+氧化)→Fe 3+②Fe 3+:黄色 Fe(OH)2FeO+H 2O (因为Fe(OH)2易被氧化)↑铁的氢氧化物的性质:①Fe(OH)2→白色→不稳定性(易分解)→易被氧化(因为+2铁易被氧化) ↓4Fe(OH)2+O 2+2H 2O=4 Fe(OH)3★(现象:白色沉淀迅速变成灰绿色,最后变成红褐色) ②Fe(OH)3→红褐色→不稳定性 → 2Fe(OH)3Fe 2O 3+3H 2O5、有关铁的方程式: 2Fe + SFeS23OFe 3+:加入KSCN 溶液→溶液变红→说明有Fe 3+的存在。
反应:Fe 3+ + 3SCN - = Fe(SCN)3Cl -:加AgNO3、HNO 3→加入AgNO 3溶液后有白色沉淀生成,再滴加稀硝酸时白色沉淀不溶解→证明有Cl - 反应:Ag + + Cl - = AgCl ↓SO 42-:加HCl 、BaCl 2→加入盐酸无明显现象,再加入BaCl 2后产生白色沉淀→证明有SO 42- 反应Ba 2+ + SO 42+ = BaSO 4↓ 2+3+8、制备Fe(OH)2沉淀需要注意的问题:实验室制备氢氧化亚铁时,因氢氧化亚铁在空气中极易与氧气、水反应生成氢氧化铁,制备时要注意以下几点:①亚铁盐要新制(用足量铁与稀硫酸反应);②将所用的氢氧化钠溶液煮沸以赶尽溶于其中的氧气;③使用长滴管吸入氢氧化钠溶液后将滴管伸至氯化亚铁溶液液面以下,慢慢挤压胶头使氢氧化钠与氯化亚铁接触。



第三节 氧化剂和还原剂(3)【学习目标】1.知道铁及其常见铁的化合物的物理性质。
2.通过实验探究,掌握金属铁、氯化亚铁、氯化铁之间的相互转化关系。
3.了解Fe 2+ 、Fe 3+的检验方法。
4. 了解铁及其化合物在一定条件相互转化的意义以及在生活生产中的广泛应用。
【自主学习】一、铁元素在地壳中的质量分数位于 、 和 之后,居第4位。
它在自然界中既可以以 态存在,又可以以 态存在,其化合价有 。
纯铁是 色的金属,铁在自然界里主要以 的形式存在,如黄铁矿、赤铁矿、磁铁矿等。
1.铁单质具有还原性 可被氧化为+2价、+3价铁的化合物。
① 与非金属反应:写出下列化学方程式:Fe +Cl 2:___ 现象 ;Fe +O 2(燃烧):___ 现象 ___ ; ②与非氧化性酸反应:写出下列化学方程式Fe +HCl : ;离子方程式: ;③与盐溶液反应:写出下列化学方程式Fe +CuSO 4溶液: ;离子方程式: ;2. +3价铁具有较强的氧化性铁盐(铁为+3价)具有 性,可以被还原剂(如 、 等)还原成 :FeCl 3+ Fe 化学方程式: ;离子方程式: ;FeCl 3+ Cu :(制印刷电路板的反应原理);化学方程式: 离子方程式: ;与碱(NaOH 溶液)反应:化学方程式: ;离子方程式: ;3. +2价铁既有氧化性又有还原性①亚铁盐(铁为+2价)具有 性,能被氧化剂(如 、 等)氧化成FeCl 2+Cl 2 化学方程式: ; 离子方程式: ;②亚铁盐(铁为+2价)具有 性,可以被还原剂(如 、 等)还原成FeCl 2+Zn 化学方程式: ;离子方程式: ;与碱(NaOH 溶液)反应:化学方程式: ;离子方程式: ;(二)用图示的方法,总结金属铁、氯化亚铁和氯化铁之间的相互转化关系(“铁三角”)。
二.Fe2+、Fe3+离子的检验方法1.Fe2+离子的检验:(1)观察溶液的颜色:Fe2+的溶液是色。
(2)强碱法:Fe2+的溶液中滴入NaOH溶液,先出现沉淀,迅速变成色沉淀,最后变成色沉淀。

一、主要试剂:10%三氯化铁溶液、硫酸亚铁晶体、KSCN 溶液、酸性高锰酸钾溶液、淀粉、0.1mol/L 碘化钾溶液、浓硝酸溶液、氢氧化钠溶液、5%硫酸铜溶液、铁丝、铁粉、锌片、铜丝、0.1M 铁氰酸钾溶液、镁条 二、实验内容1、铁单质的还原性(1)铁单质和硫酸铜溶液反应①5%硫酸铜溶液与铁粉反应的前后对比(反应前、反应后)②5%硫酸铜溶液和打磨过的铁丝反应(反应前、反应中、反应后)铁单质的存在形式铁粉打磨过的铁丝实验原理:Fe+6HNO3(浓)=Fe(NO3)3+3NO2↑+H2O实验现象:浓硝酸一接触到铁粉,及迅速产生大量红棕色气体,反应后溶液稀释液呈黄色。
实验结论:虽然该实验反应速度快,反应现象明显;但因实验中使用浓硝酸、产生二氧化氮气体,危险性强,不利于课堂教学的展示。
反思:操作层面,不应该在没有防护措施的情况下直接徒手进行操作;方案设计层面,可以在试管口上套一个透明的气球,通过观察气球膨胀与否与气球内气体的颜色了解实验情况。
2、铁盐的氧化性(1)10%的三氯化铁溶液与锌片、打磨过的锌片的反应及空白对照(反应中、反应后、滴加三滴KSCN溶液)(2)10%的三氯化铁溶液和铜丝反应(反应前、反应后)(3)10%的三氯化铁溶液与铁粉反应(反应前、反应后)(4)10%的三氯化铁溶液与碘化钾反应(反应前、反应后加入KSCN 溶液、加入KSCN 溶液后加入淀粉溶液)10%的三氯化铁锌片 铜丝 铁粉 碘化钾3、亚铁盐的氧化性和还原性(1)硫酸亚铁溶液与金属单质反应(打磨过的铝片,未打磨的铝片,打磨过的锌片,未打磨的锌片,空白对照)反应原理:活泼性在铁之前的金属单质可将亚铁溶液中的铁元素置换出来。
反应现象:五支试管在加热反应5min后均变浑浊,滴加铁氰酸钾溶液后,溶液均变为深蓝色,无明显差异。
实验结论:亚铁溶液与铝片、锌片在酒精灯加热条件下反应5min后无明显反应。
实验评价:该实验反应过慢,不适宜中学化学的课堂教学。

铁及其化合物笔记
一、铁单质的还原性
1.铁可以与铜离子发生置换反应,生成亚铁离子和铜单质。
2.铁在潮湿的空气中容易被氧化成铁氧化物。
二、铁盐的氧化性
1.铁离子具有氧化性,可以与碘离子发生氧化还原反应,生成亚铁离子和碘单质。
2.铁离子还可以与许多还原剂反应,表现出其氧化性。
三、亚铁盐的氧化性和还原性
1.亚铁离子具有还原性,可以与锌发生置换反应,生成锌离子和铁单质。
2.亚铁离子还具有氧化性,可以与强氧化剂如高锰酸钾反应,生成铁离子和其他产物。
四、铁离子的检验
1.铁离子可以与硫氰化钾(KSCN)溶液反应生成血红色的配合物,因此可以用KSCN溶液来检验铁离子的存在。
2.亚铁离子则不能与KSCN溶液反应生成血红色配合物,但可以通过加入氧化剂(如氯水)将其氧化为铁离子后再进行检验。
五、主要反应的化学方程式
1.铁与盐酸反应生成氯化亚铁和氢气。
2.铁与硫酸铜反应生成硫酸亚铁和铜单质(湿法炼铜)。
3.在氯化亚铁溶液中滴加氯水可以除去其中的氯化铁杂质。
4.氢氧化亚铁在空气中变质生成氢氧化铁。
5.在氯化铁溶液中加入铁粉可以生成氯化亚铁。
6.铜与氯化铁反应生成氯化亚铁和氯化铜。
铁及其化合物知识点总结一、铁元素的概述铁是一种常见的金属元素,原子序数为 26,位于元素周期表的第四周期第Ⅷ族。
在自然界中,铁主要以化合态的形式存在,如赤铁矿(主要成分是 Fe₂O₃)、磁铁矿(主要成分是 Fe₃O₄)等。
铁具有良好的导电性、导热性和延展性。
其物理性质包括银白色金属光泽(纯铁),但在通常情况下,铁表面容易生锈而呈现出黑色。
二、铁的化学性质1、与氧气反应在常温下,铁在干燥的空气中不易与氧气反应,但在潮湿的空气中容易生锈,生成铁锈(主要成分是 Fe₂O₃·xH₂O)。
在点燃的条件下,铁能在氧气中剧烈燃烧,生成黑色的四氧化三铁(Fe₃O₄),化学方程式为:3Fe + 2O₂点燃=== Fe₃O₄。
2、与酸反应(1)与非氧化性酸(如稀盐酸、稀硫酸)反应,生成亚铁盐和氢气。
Fe + 2HCl === FeCl₂+ H₂↑Fe + H₂SO₄=== FeSO₄+ H₂↑(2)与氧化性酸(如浓硫酸、浓硝酸)在常温下发生钝化,但在加热条件下可以反应。
3、与盐溶液反应铁能与比它活动性弱的金属的盐溶液发生置换反应,将其金属离子置换出来。
例如:Fe + CuSO₄=== FeSO₄+ Cu三、铁的氧化物1、氧化亚铁(FeO)黑色粉末,不稳定,在空气中加热时迅速被氧化为四氧化三铁。
2、氧化铁(Fe₂O₃)红棕色粉末,俗名铁红,可用作红色颜料。
3、四氧化三铁(Fe₃O₄)黑色晶体,具有磁性,俗名磁性氧化铁。
它们的化学性质如下:(1)都能与酸反应生成相应的盐和水。
(2)在一定条件下可以被还原为铁。
四、铁的氢氧化物1、氢氧化亚铁 Fe(OH)₂白色絮状沉淀,在空气中迅速被氧化,最终变为红褐色的氢氧化铁。
4Fe(OH)₂+ O₂+ 2H₂O === 4Fe(OH)₃2、氢氧化铁 Fe(OH)₃红褐色沉淀,具有两性,但碱性强于酸性。
制备氢氧化亚铁时,要注意隔绝空气,通常采用在溶液中加入植物油或苯等方法。
【考点定位】本考点考查铁及其化合物的性质实验,涉及Fe2+、Fe3+的性质与检验、探究铁及其化合物的氧化性和还原性,明确检验Fe2+和Fe3+时的注意事项及成功制备Fe(OH)2的关键。
【精确解读】实验一:铁及其化合物的性质实验实验项目实验操作实验现象结论Fe2+、Fe3+与NaOH溶液反应取两支试管,分别盛适量FeSO4、FeCl3溶液,加入适量NaOH溶对于FeSO4溶液,先生成的是白色沉淀,FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+2H2O+O2=4Fe(OH)3↓;FeCl3+3NaOH=Fe(OH)3↓+3NaCl实验二:探究铁及其化合物的氧化性和还原性④在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片)加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失2Fe3++Cu=2Fe2++Cu2+Fe3+具有氧化性【精细剖析】1.检验Fe2+、Fe3+的常用方法(1)用KSCN溶液和氯水(2)用NaOH溶液(3)含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验错误!错误!溶液变血红色,说明含有Fe3+错误!错误!KMnO4溶液紫红色褪去,说明含有Fe2+。
2.检验Fe2+和Fe3+时的注意事项(1)检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入到足量的新制氯水中(新制氯水可能氧化SCN-)。
(2)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性KMnO4,有干扰)。
(3)检验Fe2+、Fe3+的其他方法①检验Fe2+最好、最灵敏的试剂是铁氰化钾K3[Fe(CN)6]:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色)。
②检验Fe3+也可用苯酚(C6H5OH),在FeCl3溶液中滴加苯酚,溶液显紫色.3.成功制备Fe(OH)2的关键Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3。
《探究铁及其化合物的氧化性和还原性》教学设计
一、教材分析:
本节课选自鲁科版化学必修I第二章《元素与物质世界》中的第三节——《氧化剂和还原剂》,本节课是这一节的第三课时。
这节课内容的设计意图非常明显,就是要让学生达到学以致用的目的,让学生应用氧化还原反应知识,自主设计实验和有关的活动方案,探究铁及其化合物的性质。
在探究的过程中,注重发展学生学习化学的兴趣和培养他们科学探究的能力。
该案例从介绍自然界中常见的含铁元素的物质,并根据铁元素的化合价对物质进行分类导入,预测含有不同价态铁元素的各种物质哪些具有氧化性或还原性或即具有氧化性又具有还原性。
然后提出问题,怎么验证推测是否正确,并引导学生根据氧化还原反应理论设计验证方案来验证推测。
实施实验后,对实验结果进行分析、整理,确定含有不同价态铁元素物质具有的性质和相互转化关系。
二、学情分析:
(1)学生已有的认知基础
在知识层面,学生已经掌握单质铁的化学性质以及氧化还原反应的实质,这为探究铁的化合物的氧化还原性质提供了基础。
在能力层面上,学生已经具备了一定的信息提取与加工能力,也在以往学习过
程中积累了一定的实验设计经验,但利用所学知识设计实验的能力有待加强。
在情感层面,由于铁及其化合物在生活中的应用比较广泛,学生也对其用途有较多的关注,在本节课中应引导学生从铁及其化合物性质的角度出发,进一步关注其在生产生活中的用途。
(2)学生学习本课的困难
通过氧化还原反应实现二价铁离子与三价铁离子之间的转化是学生的难点所在
三、教学目标
知识与技能:
通过金属铁、氯化亚铁、氯化铁的氧化性和还原性的探究实验,使学生掌握金属铁、氯化亚铁、氯化铁之间的相互转化关系;了解Fe3+的检验方法
过程与方法:
通过金属铁、氯化亚铁、氯化铁的氧化性或还原性的探究实验,使学生学会预测物质的性质——设计实验方案进行实验并进行观察——分析实验现象,得出结论的科学探究方法。
通过预测与假设、方案设计、实验记录、分析归纳。
情感、态度和价值观:
使学生学会预测物质的性质,并通过实验探究得到证实,体验科
学探究成功的喜悦;同时培养他们善于与他人合作的良好心理品质。
并通过“身边的化学”等内容,认识铁在促进人体健康中的作用,了解化学知识在丰富人类生活方面的重要作用。
四、教学重难点
教学重点:知识重点是金属铁、氯化铁、氯化亚铁的性质以及相互转化方法,教会学生探究物质性质的科学方法。
教学难点:预测金属铁、氯化铁、氯化亚铁的氧化性、还原性并进行探究实验的设计。
五、教学过程。