化学二轮复习课后作业1-3
- 格式:doc
- 大小:141.00 KB
- 文档页数:10

2022高三化学二轮复习课时作业--专项1第2讲化学常用计量一、选择题(每小题5分,共50分)1.(双选)N A表示阿伏加德罗常数,下列判定正确的是( )A.在18g18O2中含有N A个氧原子B.1mol Cl2参加反应转移电子数一定为2N AC.1mol H2与1mol Cl2反应生成N A个HCl分子D.1mol Ca变成Ca2+时失去的电子数为2N AE.1mol羟基中电子数为10N AF.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3mol I2转移的电子数为6 N A解析:18g 18O2正好是0.5mol,1mol 18O2含有2mol氧原子,因此18g18O2中氧原子的物质的量为1mol 即为1N A,A项正确;1mol Cl2与金属、与氢气反应时,转移电子是2mol,与水、与碱反应时转移电子是1mol ,B项错;1mol H2与1mol Cl2反应生成2mol HCl,故C 项错;1mol Ca生成Ca2+时失去2mol电子,即2N A,D项正确;E项,1mol羟基中有9N A个电子;F项,在该反应中,每生成3mol I2,转移5N A个电子;本题选A、D。
答案:AD2.(2010·上海,7)N A表示阿伏加德罗常数,下列叙述正确的是( )A.等物质的量的N2和CO所含分子数均为N AB.1.7gH2O2中含有的电子数为0.9N AC.1mol Na2O2固体中含离子总数为4N AD.标准状况下,2.24L戊烷所含分子数为0.1N A解析:“等物质的量”并不一定是1mol,故A错误;B中所含电子数为1.7g34g/mol×18=0.9mol,故B正确;1mol Na2O2中所含的离子总数为3N A,其中包括2mol Na+和1mol O2-2,故C错误;标准状况下,戊烷是液体,故D错误。
答案:B3.(2011·泉州模拟)下列叙述中正确的是( )①在标准状况下,0.2mol任何物质的体积均为4.48L②当1mol气体的体积为22.4L时,它一定处于标准状况下③标准状况下,1L HCl和1L H2O的物质的量相同④标准状况下,1g H2和14g N2的体积相同⑤28g CO的体积为22.4L⑥同温同压下,气体的密度与气体的相对分子质量成正比A .①②③④B .②③⑥C .⑤⑥D .④⑥解析:①错在不是任何物质,只能是气体。
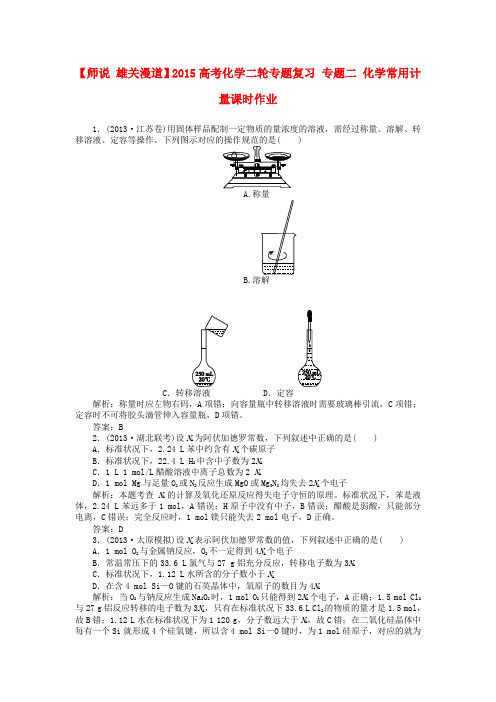
【师说雄关漫道】2015高考化学二轮专题复习专题二化学常用计量课时作业V4 V =n4n=15n4n×M×16 g·mol-1=30 g·mol相同时,气体的压强之比等于其物质的量之比,即pp4=nn4=11n4 n ×M11×16 g·mol-1=44 g·mol)∶n(O2)=a m总n总=2+32bm总n总=a a专题二VV m =NNm溶液SM+S=cV在进行上述各个量之间的换算时,要注意:.“一个中心”:必须以物质的量为中心。
.“两个前提”:在应用V m=22.4 L·mol有关阿伏加德罗常数正误判断类试题的“常见陷阱”只给出物质的体积,而不指明物质的状态,或者标准状况下物质的状态不为气体,3 mol电子转移时,判断生成气体的分子数。
为阿伏加德罗常数的值。
下列说法正确的是溶液中含有ClO-的数目为正确理解物质的量,才能正确使用,所以对物质的量概念的内涵和外延都应透彻理解,注意质量、摩尔质量、物质的量的单位、物质的量的适用范围等。
强化概念的灵活应用,是6.02×10 mol与阿伏加德罗常数等同起来而错选原子的质量是b g解有关阿伏加德罗定律及其推论类试题的关键点.对阿伏加德罗定律需要有哪些认识?阿伏加德罗定律是同温同压下,相同体积的任M1∶M2=m1∶m2。
下列关于同温同压下的两种气体物质的量浓度的计算方法在联系,根据关系式法、守恒法等方法进行综合分析求解。
4—1 血糖浓度表示,即mmol/L和mg/dL(1种数据:温度、质量和体积。
既可通过测量气体排出的液体体积来确定气体的体积实验室用氨气还原氧化铜的方法,通过测定反应物18m-16 m2[失分原因分析]第一:(1)问中由于不熟悉常见容量瓶的规格而错答“480 mL容量瓶”,由于没有按操作顺序思考用到的仪器,漏答“烧杯”。
第二:(2)计算错误且漏写单位。


专题一 原子结构作业纸 姓名:_________ 班级_________学号___________ 1.下列说法中正确的是 A 所有的电子在同一区域里运动 B 能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 C 处于最低能量的原子叫基态原子 D 同一原子中,1s、2s、3s所能容纳的电子数越来越多 2.一个电子排布为1s22s22p63s23p1的元素最可能的价态是A +1 B +2 C +3D -1 3.下列各原子或离子的电子排布式错误的是 ( )A Al 1s22s22p63s23p1B O2- 1s22s22p6C Na+ 1s22s22p6D Si 1s22s22p2 4.下列表达方式错误的是A 甲烷的电子式B 氟化钠的电子式C 硫离子的核外电子排布式 1s22s22p63s23p4D 碳-12原子 C 5.下图中,能正确表示基态硅原子的是 ( ) A B C D 6.具有下列电子排布式的原子中,半径最大的是A ls22s22p63s23p2B 1s22s22p3C 1s22s22p2D 1s22s22p63s23p4 7.当镁原子由1s22s22p63s2 1s22s22p63p2时,以下认识正确的是( ) A镁原子由基态转化成激发态,这一过程中吸收能量 B镁原子由激发态转化成基态,这一过程中释放能量 C转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同 D转化后镁原子与硅原子电子层结构相同,化学性质相似 (1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于__________ 周期 族;最高价氧化物的化学式为 ,砷酸钠的化学式是 . (2)已知下列元素在周期表中的位置,写出它们最外层电子构型和元素符号: ①第4周期ⅣB族 ; ②第4周期ⅦA族 . 9.按所示格式填写下表: 原子序数电子排布式价层电子排布周期族261s22s22p63d54s14ⅡB10.某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;元素符号为 。

最新高考化学复习资料课时作业(十)一、选择题1.(2013·江西联考)如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。
已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。
下列说法正确的是()A.反应③最多能产生0.05 mol O2B.反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑C.Na2O2中阴、阳离子数目之比为1∶1D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③解析:0.1 mol Na2O2与100 g H2O反应,H2O过量,反应③最多能产生0.05 mol O2,A正确;反应①的离子方程式应为2Na+2H 2O===2Na++2OH-+H2↑,B错误;Na2O2中阴、阳离子数目之比为1∶2,C错误;①、②、③充分反应后所得溶液中溶质(NaOH)的质量分数从大到小:③=②>①,D错误。
答案:A2.(2014·河北普通高中监测)在酸性或碱性较强的溶液中,铝均可发生溶解。
但在家庭里,用食盐腌制的食品亦不能长期存放在铝制品中,其主要原因是()A.铝能与NaCl直接发生反应而被氧化为氧化铝B.长期存放的NaCl与水反应,溶液不再呈中性,可与铝发生反应C.铝与其中的杂质、NaCl溶液形成原电池,铝被氧化D.铝与其中的杂质、NaCl溶液形成原电池,铝被还原解析:铝制品不能长时间存放食盐腌制的食品,是因为氯离子对氧化膜有破坏作用,若氧化膜被破坏,则由于铝制品不纯,铝与其中的杂质、NaCl溶液形成原电池,铝失电子,被氧化,C项正确。
答案:C3.(2014·贵州六校联考)为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L -1NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。

2013年高考化学二轮复习考点研习训练:1-3-1元素及其化合物1.(2012年高考北京卷)下列用品的有效成分及用途对应错误的是( )解析:本题在解答时,首先看用品的名称和有效成分是否对应,再看用途是否正确。
小苏打的有效成分为NaHCO3,而不是Na2CO3,Na2CO3的俗名为苏打。
答案:B2.(2012年深圳模拟)下列对生产、生活中有关化学问题的分析正确的是( )A.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝C.明矾净水是利用了Al3+的水解性和氧化性D.液氯罐中的液氯泄漏时,可将其移入水塘中,并向水塘中加入生石灰解析:因BaCO3溶于胃酸生成剧毒的BaCl2,故钡餐不用BaCO3而用不溶于酸的BaSO4;工业制铝用电解法,不用焦炭还原法;明矾净水利用Al3+的水解性,Al3+不表现氧化性。
答案:D3.(2011年高考上海卷)过氧化钠可作为氧气的来源。
常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(N A表示阿伏加德罗常数)( )解析:2Na2O2+2CO2===2Na2CO3+O2Δm转移电子2 mol 2 mol 56 g 2 mol1 mol 1 mol 28 g 1 molA、C项正确。
答案:AC4.(2012年苏州模拟)某溶液中含有NH+4、SO2-3、SiO2-3、Br-、CO2-3、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )①反应前后,溶液中离子浓度基本保持不变的有NH+4、Na+②有胶状物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化还原反应A.①②③④B.②③④C.①③⑤ D.②④⑤解析:该溶液中通入过量的Cl2与水发生反应生成HCl和HClO,SO2-3被HClO氧化成SO2-4,SiO2-3与H+反应生成H2SiO3胶状物,Br-被Cl2氧化成Br2,溶液变成褐色,CO2-3与H+反应生成CO2气体,由此得出选项A正确。
微专题热练3 反应循环图与化学反应1. 在太阳能作用下,以CO 2为原料制备炭黑的反应机理如图所示。
下列说法正确的是( )A. 过程Ⅰ中反应的活化能大于ΔHB. Fe 3O 4为该制备反应的催化剂C. CO 2(g)C(s)+O 2(g)为放热反应D. FeO 的俗名为铁红2.工业上除去电石渣浆(含CaO)上清液中的S 2-,并制取石膏(CaSO 4·2H 2O)的常用流程如下:下列说法正确的是( )A. Mn(OH)2、MnO 2-3在过程Ⅰ、Ⅱ中均起催化剂作用B. 过程Ⅰ中,反应的离子方程式:2Mn(OH)2 +O 2 +4OH -===2MnO 2-3 +4H 2OC. 将10 L 上清液中的S 2 -转化为SO 2-4(S 2-浓度为480 mg/L),理论上共需要0.03 mol 的O 2D. 常温下,56 g CaO 溶于水配成1 L 溶液,溶液中Ca 2+的数目为6.02 ×1023个3. 乙烯还原脱硝(NO)原理如图所示,下列说法错误的是( )A. 催化剂是Cu +,可以加快脱硝速率B. 温度升高,可能导致吸附在Cu +表面的气体减少,使反应速率减小C. 发生的总方程式:C 2H 4+2O 2+2NO =====催化剂2CO 2+N 2+2H 2OD. 上述反应能有效减少空气中氮氧化物的含量,减少酸雨,提高空气质量4. 利用某分子筛作催化剂,NH 3可脱除废气中的NO 和NO 2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )A. 反应过程中NO 2、NH +4之间的反应是氧化还原反应B. 上述历程的总反应:2NH 3+NO +NO 2=====催化剂2N 2+3H 2OC. X 是HNO 2,是还原产物D. [(NH 4)(HNO 2)]+是反应过程中的催化剂5. 碘循环工艺不仅能吸收SO 2降低环境污染,同时又能制得氢气,具体流程如下:下列说法正确的是( )A. 分离器中的物质分离操作为过滤B. 膜反应器中,增大压强有利于提高速率和HI 的平衡转化率C. 该工艺中I 2和HI 的相互转化体现了“碘循环”D. 碘循环工艺的总反应:2SO 2+4H 2O +I 2===H 2+2H 2SO 4+2HI6.一种新型的合成氨的方法如图所示,下列说法错误的是( )A. 反应①属于“氮的固定”B. 反应②属于非氧化还原反应C. 反应③可通过电解LiOH 水溶液实现D. 上述三步循环的总结果:2N 2+6H 2O===4NH 3+3O 27.斯坦福大学的研究人员提出的一种基于CH 3OH 的碳循环(如图所示),下列说法正确的是( )A. 图中能量转化方式只有2种B. CO 2、CH 3OH 均属于有机化合物C. 制取CH 3OH 反应:CO 2+3H 2――→催化剂△CH 3OH +H 2O 的原子利用率为100% D. 利用CO 2合成CH 3OH 燃料有利于减少对化石能源的依赖并减少碳排放8.科学工作者研发了一种SUNCAT 的系统,借助锂循环可持续合成氨,其原理如图所示。
专题一物质的组成、性质、分类及化学用语一、选择题1.“化学是人类进步的关键”。
下列有关说法能反映正确化学观点的是() A.改变物质的性质不一定要通过化学变化B.天然物质都比人造物质好C.一种元素可有多种离子,但只有一种原子D.根据分散系是否具有丁达尔效应,分散系分为溶液、胶体和浊液2.下列情况不能用胶体知识加以解释的是() A.氯化铝溶液中加入小苏打溶液会产生白色沉淀和无色气体B.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗C.水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染D.牛油与烧碱溶液共热,向反应所得溶液中加入食盐,则有固体析出3.(2010·上海,5)下列判断正确的是() A.酸酐一定是氧化物B.晶体中一定存在化学键C.碱性氧化物一定是金属氧化物D.正四面体分子中键角一定是109°28′4.下列各组物质的分类都正确的是(括号里的是类别) () A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质)C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)5.生活中遇到的某些问题,常常涉及化学知识,下列各项叙述不正确的是() A.鱼虾放置时间过久,会产生令人不愉快的腥臭味,应当用水冲洗,并在烹调时加入少量食醋B.“酸可以除锈”、“洗涤剂可以去油”都是发生了化学变化C.被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时立即涂抹稀氨水或碳酸氢钠溶液,则可以减轻疼痛D.苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固6.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。
第四十五讲实验探究——提高篇2017新题赏析题一:某化学兴趣小组设计了如图所示的装置,对纯碱(Na2CO3)和小苏打(NaHCO3)两种固体进行实验探究。
(1)写出甲、乙两种仪器的名称:甲__________,乙__________。
(2)在实验过程中,观察到乙仪器中的澄清石灰水没有变浑浊,丙仪器中的澄清石灰水变浑浊,请写出丙仪器中发生反应的化学方程式____________________________。
(3)该实验探究利用的科学方法是________________________________(填“控制变量法”、“对比观察法”或“定量分析法”),实验目的是_______________________。
题二:在上化学课时,小明同学听化学老师讲到,做蛋糕时常用到一种白色粉末状物质,它既能中和发酵过程中产生的酸,又能起发泡作用,这种白色粉末状物质是碳酸氢钠(NaHCO3)。
他对此颇感兴趣,决定对其进行探究。
于是他与化学兴趣小组的同学们一起进行如下探究:【实验1】:探究碳酸氢钠溶液的酸碱性,取少量新配制的碳酸氢钠溶液于洁净的试管中,用pH试纸测试溶液的pH为10,由此可知碳酸氢钠溶液呈________性。
【实验2】:小明认为蛋糕膨胀,是由于制作过程中产生了大量的二氧化碳气体所致,他对二氧化碳的来源作了两种猜想:猜想①:二氧化碳可能是由碳酸氢钠与面团中的酸性物质反应产生的;猜想②:二氧化碳可能是由碳酸氢钠受热分解产生的。
针对以上猜想,小明设计了以下实验,请你完成下列表格中的空白。
实验步骤实验现象结论实取少量该白色粉________________ 猜验一末于试管中,加适量盐酸并把产生的气体通入澄清石灰水中想①正确实验二______________ ①有小水滴产生②____________猜想②正确【小结】碳酸氢钠与盐酸反应的化学方程式是________________________。
【应用】在炸油条时,通常在发酵后的面团中加入小苏打(NaHCO3)的目的是________________。
(对应学生用书P21) 一、选择题 1.(2013·福建高中质检)不涉及氧化还原反应的是( ) A.海水提镁 B.明矾净水 C.工业固氮 D.电池充电 [解析] A项海水提镁涉及到Mg2+的还原反应,B项明矾净水,利用的是Al3+水解,生成胶状Al(OH)3吸附水中的杂质,不涉及氧化还原反应。C项工业固氮,氮由游离态转化为化合态。D项电池充电为电解池的原理,发生氧化还原反应。 [答案] B 2.(2013·山东济南高三调研)下列说法中,正确的是( ) A.酸性高锰酸钾溶液具有强的氧化性,配制时用盐酸酸化 B.用25.00 mL碱式滴定管量取20.00 mL酸性高锰酸钾溶液 C.将KI溶液滴入酸性KMnO4溶液中,溶液的紫色能褪去 D.将SO2通入酸性高锰酸钾溶液,溶液紫色褪去,是SO2漂白性的表现 [解析] A项中,酸性KMnO4可以将Cl-氧化为Cl2,故KMnO4
酸化用稀H2SO4,A项错误。B项中,酸性KMnO4具有强氧化性,
可腐蚀碱式滴定管的橡胶管,B项错误。C项中,I-可被KMnO4氧化为I2,溶液的紫色会褪去,C项正确。D项中,SO2使酸性KMnO4
溶液褪色,是SO2还原性的表现,D项错误。
[答案] C 3.(2013·山东泰安高三期中)在pH=1的无色溶液中,下列各离子组因发生氧化还原反应而不能共存的是( ) A.NH+4、K+、Na+、CO2-3、NO-3 B.K+、Na+、Fe2+、SO2-4、NO-3 C.NH+4、K+、Na+、HCO-3、AlO-2 D.NH+4、K+、Na+、NO-3、I- [解析] 根据无色溶液,B项中Fe2+有颜色,不符合题意;A、C不能共存但不发生氧化还原反应,不符合题意;D项中NO-3、H+氧化I-,不能共存,符合题意。 [答案] D 4.(2013·河北唐山一中第二次月考)①14Cu2++5FeS2+
12H2O===== 7Cu2S+5Fe2++24H++3SO2-4 ②Mn2++S2O2-8+H2O===MnO-4+SO2-4+H+ 对上述两个反应判断正确的是( ) A.①②反应中SO2-4都是氧化产物 B.两个反应中电子转移数目都是10 mol C.①反应中的硫元素既被氧化又被还原 D.氧化性:MnO-4>S2O2-8
[解析] 在14CuSO4+5FeS2+12H2O===== 7Cu2S+5FeSO4+12H2SO4反应中,Cu元素的化合价由+2降低为+1,部分S元素的化合价由-1降低到-2,得到电子总数为21,显然部分S元素的化合价由-1升高到+6价,则Cu2S只是还原产物,5 mol FeS2参加反应转移电子数为21 mol,部分SO2-4为氧化产物,FeS2既是作氧化剂,又作还原剂。A.①反应中SO2-4是氧化产物;②SO2-4是还原产物;B.两个反应中电子转移数目都是10 mol;C.①反应中的硫元素被还原;D.氧化性:S2O2-8>MnO-4。 [答案] B 5.(2013·荆州高中质检(Ⅰ))物质氧化性、还原性的强弱不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质由于浓度不同而发生不同的氧化还原反应的是( ) ①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 A.①③ B.③④ C.①② D.①③④ [解析] ①铜与浓硝酸反应生成二氧化氮,铜与稀硝酸反应生成一氧化氮,正确;②无论氯化铁溶液浓度大小,只发生反应:2Fe3+
+Cu===2Fe2++Cu2+,错误;③锌与浓硫酸反应生成二氧化硫,锌与稀硫酸反应生成氢气,正确;④无论盐酸浓度大小,与铁反应只生成氯化亚铁:Fe+2H+===Fe2++H2↑,错误。 [答案] A 6.(2013·陕西五校高三第三次模拟)将4.48 g Fe溶于1 L 0.1 mol·L-1的稀硫酸,再加入50 mL 0.4 mol·L-1 KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO-3也完全反应,生成一种氮氧化物NyOx。则该氮氧化物的化学式是( ) A.N2O B.NO C.N2O3 D.NO2 [解析] 4.48 g Fe为0.08 mol,与稀硫酸反应后生成Fe2+,且H2SO4有剩余,再加入KNO3溶液,NO-3在酸性条件下将Fe2+全部氧化为Fe3+,NO-3完全反应,则Fe2+失电子数等于NO-3得电子数,设还原产物中N元素为+n价,列式计算:50×10-3×0.4×(5-n)=0.08,得n=+1。所以还原产物为N2O,A项正确。 [答案] A 7.(2013·浙江名校新高考研究联盟第一次联考)某反应的反应物与生成物有:K2Cr2O7、KCl、CrC13、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,则下列说法不正确的是( ) A.Cl2是该反应的氧化产物 B.氧化剂和还原剂的物质的量之比为1∶14 C.当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol D.由该反应可知还原性:HCl>CrCl3 [解析] 根据题中提供的反应物与生成物及氧化性:K2Cr2O7>Cl2,得出该反应的化学方程式为K2Cr2O7+14HCl===2KCl+2CrCl3+3Cl2↑+7H2O。Cl2是该反应的氧化产物,A项正确;氧化剂和还原剂的物质的量之比为1∶6,B项错误;当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol,C项正确;CrCl3为还原产物,依据氧化还原反应规律,可知还原性:HCl>CrCl3,D项正确。 [答案] B 8.(2013·广东湛江高中调研)(双选)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-2+
A.2Fe3++SO2+2H2O===2Fe2++SO2-4+4H+ B.Cl2+SO2+2H2O===H2SO4+2HCl C.H2O2+2H++SO2-4===SO2↑+O2↑+2H2O D.2I2+H2O2===2H2O+O2↑+4I- [解析] SO2的还原性比Fe2+强,符合强制弱原理,该氧化还原反应能发生,故A错误;SO2的还原性比Cl-强,符合强制弱原理,该氧化还原反应能发生,故B错误;H2O2的还原性比SO2弱,违反强制弱原理,该氧化还原反应不能发生,故C正确;H2O2的还原性比I-弱,违反强制弱原理,该氧化还原反应不能发生,故D正确。 [答案] CD 9.(2013·山西高三诊断)LiNi0.25Co0.75O2是锂离子电池的一种高性能的二元正极活性材料,其制备原理可表示为4Ni0.25Co0.75(OH)2
+4LiOH+O2===4LiNi0.25Co0.75O2+6H2O(已知Ni与Co的化合价均
有+2和+3)。下列说法不正确的是( ) A.Ni0.25Co0.75(OH)2中Ni的化合价是+2 B.LiNi0.25Co0.75O2中Co的化合价是+3 C.该反应中LiOH是还原剂 D.该反应中O2是氧化剂 [解析] 根据化合物中化合价代数和为0的原则, Ni0.25Co0.75(OH)2中Ni和Co的化合价均是+2, LiNi0.25Co0.75O2中Ni和Co的化合价均是+3,A、B项正确;该反应中LiOH既不是氧化剂,也不是还原剂,C项错误;O2得电子化合价降低,O2是氧化剂,D项正确。 [答案] C 二、非选择题 10.(2013·浙江乐清二中高三月考)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成SeO2以回收Se。 完成下列填空: (1)Se和浓硝酸反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓硝酸反应的化学方程式___________ _________________________________________________________。 (2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O 2SO2+SeO2+2H2O===Se+2SO2-4+4H+ SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________。 (3)回收得到的SeO2的含量,可以通过下面的方法测定: ①SeO2+KI+HNO3―→Se+I2+KNO3+H2O ②I2+2Na2S2O3===Na2S4O6+2NaI 配平方程式①,标出电子转移的方向和数目。 (4)实验中,准确称量SeO2样品0.1500 g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为______。 [解析] (1)根据已知反应物和生成物并根据电子得失守恒和质量守恒定律可知,反应的化学方程式是Se+2HNO3(浓)===H2SeO3
+NO↑+NO2↑
(2)在氧化还原反应中氧化剂的氧化性大于氧化产物的,所以根据反应的化学方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。 (3)在反应①中Se元素的化合价从+4价降低到0价,而碘元素的化合价从-1价升高到0价,所以根据电子的得失守恒,配平后的方程式是SeO2+4KI+4HNO3===Se+2I2+4KNO3+2H2O。 (4)根据反应①②及电子的得失守恒可知,SeO2~4Na2S2O3,所以参加反应的SeO2的物质的量是0.2000 mol·L-1×0.025 L÷4=0.00125 mol,因此所测定的样品中SeO2的质量分数为111 g·mol-1×0.00125 mol0.1500 g×100%=92.5%。
[答案] (1)Se+2HNO3(浓)===H2SeO3+NO↑+NO2↑ (2)H2SO4(浓)>SeO2>SO2