胞浆异柠檬酸脱氢酶(ICDHc)试剂盒说明书
- 格式:doc
- 大小:61.50 KB
- 文档页数:2

人乳酸脱氢酶(LDH)ELISA试剂盒应用方法人乳酸脱氢酶(LDH)ELISAKit人乳酸脱氢酶(LDH)ELISA试剂盒:(用于血清、血浆、细胞培养上清液和其它生物体液内)原理本试验采用双抗体夹心ABCELISA法。
用抗人LDH单抗包被于酶标板上,标准品和样品中的LDH与单抗结合,加入生物素化的抗人LDH,形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin与生物素结合,加入底物工作液显蓝色,最终加停止液硫酸,在450nm处测OD值,LDH浓度与OD值成正比,可通过绘制标准曲线求出标本中LDH浓度。
试剂盒构成(28℃保管)酶标板(CoatedWells) 96孔酶标抗体工作液(EnzymeConjugate) 12ml 10×标本稀释液(SampleBuffer)12ml 20×浓缩洗涤液(WashBuffer)50ml标准品(Standards):80U/瓶 2瓶底物工作液(TMBSolution) 12ml第一抗体工作液(BiotinylatedAntibody) 12ml 停止液(StopSolution)12ml准备试剂与收集血样1.收集标本:血清、血浆(EDTA、柠檬酸盐、肝素抗凝)、细胞培养上清液、组织匀浆等尽早检测,28℃保管48小时;更长时间须冷冻(20℃或70℃)保管,躲避反复冻融。
2.标准品液配制:使用前加入1ml蒸馏水混匀,配成80000U/L的溶液。
设标准管8管,第一管加标本稀释液900ul,第二至第八管加入标本稀释液500ul。
在第一管中加入80000U/L的标准品溶液100ul混匀后用加样器吸出500ul,移至第二管。
如此反复作对倍稀释,从第七管中吸出500ul弃去。
第八管为空白对照。
3.10×标本稀释液用蒸馏水作1:10倍稀释(示例:1ml浓稀释液 9ml蒸馏水)。
4.洗涤液:用重蒸水1:20稀释(示例:1ml浓缩洗涤液加入19ml的重蒸水)检测程序1.加样:每孔各加入标准品或待测样品100ul,将反应板充分混匀后置37℃120分钟。


谷氨酸脱氢酶(GDH)活性检测试剂盒说明书微量法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC1465规格:100T/96S产品内容:提取液:液体100mL×1瓶,4℃保存;试剂一:液体20mL×瓶,4℃保存;试剂二:粉剂×1瓶,-20℃保存;产品说明:GDH(EC 1.4.1.2)广泛分布于植物中,和谷氨酸合成酶(GOGAT)共同参与谷氨酸的合成,在氨同化和转化成有机氮化合物的代谢中起重要作用。
+、α-酮戊二酸和NADH,生成谷氨酸和NAD+,引起340nm吸光度下降。
通过测定340nm吸GDH催化NH4光度的下降速率,计算GDH活性。
试验所需自备的仪器和用品:紫外分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔UV板、研钵、冰和蒸馏水。
操作步骤:一、粗酶液提取:1、收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入1mL提取液,超声波破碎细菌或细胞(功率20%,超声3秒,间隔10秒,重复30次);8000g4℃离心10分钟,取上清,置冰上待测。
2、称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
8000g4℃离心10分钟,取上清,置冰上待测。
二、测定步骤:1、紫外分光光度计或酶标仪预热30min以上,调节波长至340nm,蒸馏水调零。
2、样本测定(1)在试剂二中加入19mL试剂一充分溶解混匀,置于37℃(哺乳动物)或25℃(其它物种)水浴5min;(2)在微量石英比色皿或96孔UV板中加入10μL样本和190μL试剂二,混匀,立即记录340nm处20s 时的吸光值A1和5min20s后的吸光值A2,计算ΔA=A1-A2。
注:当ΔA大于0.5时,将样本进行稀释后测量。
三、GDH活性计算:a.用微量石英比色皿测定的计算公式如下(1)按样本蛋白浓度计算:单位的定义:每mg组织蛋白每分钟消耗1nmol NADH定义为一个酶活力单位。

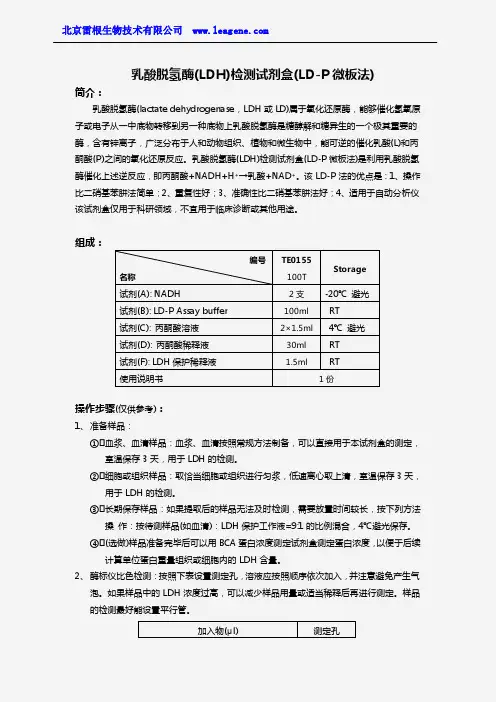
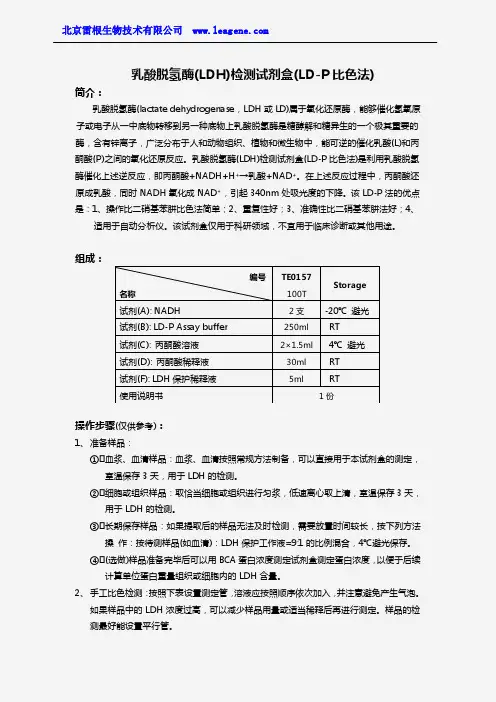
乳酸脱氢酶(LDH)细胞毒性检测试剂盒一站式解决方案乳酸脱氢酶(lactate dehydrogenase,LD 或LDH ,EC1.1.1.27 )是一类NAD依赖性激酶,有LDHA、LDHB、LDHC三种亚基,可构成6种四聚体同工酶。
动物乳酸脱氢酶是由4个亚单位组成的四聚体,常见的A、B 两种亚基构成的5种LDH同工酶(LDH1-5),C亚基则仅组成一种LDH同工酶即LDH-C4。
乳酸脱氢酶为含锌离子的金属蛋白,分子量为135-140kD,是糖无氧酵解及糖异生的重要酶系之一,可催化丙酸与L-乳酸之间的还原与氧化反应,也可催化相关的α-酮酸。
LDH广泛存在于人体组织中,以肾脏含量最高,其次是心肌和骨肌。
红细胞内LDH约为正常血清的100倍。
一、乳酸脱氢酶分类1.根据结合辅酶的不同,微生物体一般包含两种乳酸脱氢酶,NAD-依赖型乳酸脱氢酶(NAD-dependent lactate dehydrogenases,nLDHs)和NAD-非依赖型乳酸脱氢酶(NAD-independent lactate dehydrogenases,iLDHs)两大类。
2.按其催化底物的构型不同,NAD-依赖型乳酸脱氢酶可以分为NAD依赖型-L-乳酸脱氢酶(L-NAD-依赖型乳酸脱氢酶)和NAD依赖型-D-乳酸脱氢酶(D-NAD-依赖型乳酸脱氢酶)两大类,分别催化丙酮酸合成L-乳酸和D-乳酸。
3.根据天然电子受体的不同,可以将NAD-非依赖型乳酸脱氢酶分为三类。
第一类为膜蛋白,利用膜醌类作为外部的电子受体;第二类直接利用O2作为电子受体,根据氧化终产物的不同,又将其细分为乳酸氧化酶(Lactate oxidase,LOX)和乳酸单氧酶(Lactate monooxygenases,LMO),其中前者产生丙酮酸和H2O2,而后者产生乙酸、CO2和H2O;第三类是硫胺b2(flavocytochrome b2),存在于真菌中,它天然的电子受体为细胞色素c。

谷氨酸脱氢酶(GDH)试剂盒说明书谷氨酸脱氢酶(Glutamate dehydrogenase,GDH)试剂盒说明书微量法100管/96样注意:正式测定前务必取23个预期差异较大的样本做预测定测定意义:GDH(EC 1.4.1.2)广泛分布于植物中,和谷氨酸合成酶(GOGAT)共同参与谷氨酸的合成,在氨同化和转化成有机氮化合物的代谢中起重要作用。
测定原理:GDH催化NH4+、α酮戊二酸和NADH,生成谷氨酸和NAD+,引起340nm吸光度下降。
通过测定340nm吸光度的下降速率,计算GDH活性。
需自备的仪器和用品:紫外分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔板、研钵、冰和蒸馏水。
试剂组成和配制:提取液:液体100mL×1瓶,4℃保存;试剂一:液体20mL×1瓶,4℃保存;试剂二:粉剂×2瓶,4℃保存;粗酶液提取:细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
血清(浆)样品:直接检测。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至340nm,蒸馏水调零。
2、样本测定(1)在试剂二中加入10mL试剂一充分溶解混匀,置于37℃(哺乳动物)或25℃(其它物种)水浴5min;现配现用(配好后12h内用完);(2)在微量石英比色皿或96孔板中加入10μL样本和190μL试剂二,混匀,立即记录340nm处20s时的吸光值A1和 5min20s后的吸光值A2,计算ΔA=A1A2。

湖南谷氨酸脱氢酶检测试剂盒说明书GDH(EC 1.4.1.2)广泛分布于植物中,和谷氨酸合成酶(GOGAT)共同参与谷氨酸的合成,在氨同化和转化成有机氮化合物的代谢中起重要作用。
GDH催化NH;、a-酮戊二酸和NADH,生成谷氨酸和NAD',引起340nm吸光度下降。
通过测定340nm吸光度的下降速率,计算GDH活性。
试验所需自备的仪器和用品:
紫外分光光度计、台式离心机、水浴锅、移液器、1mL石英比色皿、研钵、冰和蒸馏水。
操作步骤:
1、收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入l ml提取液,超声波破碎细
菌或细胞(功率20%,超声3秒,间隔10秒,重复30次);8000g4℃离心10分钟,取上清,置冰上待测。
2、称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。

葡萄糖脱氢酶(GCDH)活性检测试剂盒说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC2690规格:50T/48S产品简介:GCDH(EC 1.1.1.47)催化D-葡萄糖和NAD(P)生成D-葡萄糖酸和NAD(P)H,主要存在于多种微生物和高等动物的肝脏中。
GCDH是一种制备高含量低聚果糖的理想用酶,同时也是临床血糖测定的诊断用酶,可广泛用于食品工业及医药工业领域中。
GCDH催化D-葡萄糖和NAD生成D-葡萄糖酸和NADH,利用NADH在340nm处吸光值的变化即可反映葡萄糖脱氢酶的活性。
试验中所需的仪器和试剂:紫外分光光度计、台式低温离心机、水浴锅、1mL石英比色皿、可调式移液枪、研钵/匀浆器、冰和蒸馏水。
产品内容:提取液:液体60mL×1瓶,4℃保存。
试剂一:液体50mL×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃保存。
临用前加入15mL试剂一溶解,用不完的试剂4℃保存。
试剂三:粉剂×2瓶,-20℃避光保存。
临用前每瓶加入5mL试剂一溶解,用不完的试剂建议分装后-20℃避光保存,避免反复冻融。
操作步骤:一、粗酶液提取:组织:按照组织质量(g)︰提取液体积(mL)为1︰5~10的比例(建议称取约0.1g组织,加入1mL 提取液)进行冰浴匀浆,然后,8000g,4℃,离心10min,取上清置于冰上待测。
细胞或细菌:先收集细胞或细菌到离心管内,离心后弃上清;按照细胞数量(104个)︰提取液体积(mL)为500~1000︰1的比例(建议500万个细胞或细菌加入1mL提取液),冰浴超声波破碎细胞或细菌(功率20%或200W,超声3s,间隔7s,总时间5min);然后8000g,4℃,离心10min,取上清置于冰上待测。
血浆(清):直接检测。
二、测定步骤:1、分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2、工作液的配制:按照试剂一︰试剂二︰试剂三为4︰3︰2的体积比例充分混匀,备用,用前37℃预热10min。

乳酸脱氢酶(LDH)释放法细胞繁殖与毒性定量检测试剂盒产品说明书(中文版)主要用途乳酸脱氢酶(LDH)释放法细胞繁殖与毒性定量检测试剂是一种旨在通过酶联连续反应系统检测由于细胞损伤导致的细胞内稳定的乳酸脱氢酶释放到细胞外,使四唑盐染料碘硝基氯化四氮唑(INT)还原为红色甲臜(farmazan),即比色法定量测定酶活性,以评价活体细胞繁殖的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
适用于各种药物、化学、环境因子和营养因子处理的贴壁或悬浮生长中的动物或人体细胞。
替代传统的同位素[51 Cr]释放检测的最佳选择。
产品严格无菌,即到即用,简捷敏感,性能稳定,显色清晰,检测准确,重复性好。
技术背景细胞凋亡或坏死而造成的细胞膜结构的损害或完全裂解导致细胞浆内的酶释放外泄到培养液里,其中包括活性稳定的乳酸脱氢酶。
乳酸脱氢酶(lactate dehydrogenase;LDH)释放法的测定是基于在乳酸脱氢酶的作用下,还原NAD+反应生成的NADH,再与氧化型2-(4-碘苯)-3-(4-硝基苯)-5-苯四唑(Iodonitrotetrazolium;INT)在硫辛酰胺脱氢酶(diaphorase)的催化下反应生成红色生色产物甲臜(formazan),在490nm波长下产生吸收峰,从而确定释放的乳酸脱氢酶的活性,作为细胞膜完整性的标志:吸光值与细胞死亡或毒性程度成线性正相关。
酶联连续反应系统为:lactate dehydrogenaseNAD+ + Lactate → Pyruvate + NADHdiaphoraseNADH + INT → NAD++ Formazan(red)产品内容裂解液(Reagent A)1毫升补充液(Reagent B)1毫升反应液(Reagent C)5毫升显色液(Reagent D)1毫升终止液(Reagent E)1毫升标准液(Reagent F)20微升产品说明书1份保存方式保存在-20℃冰箱里,反应液(Reagent C)和显色液(Reagent D)避免光照;有效保证6月用户自备96孔细胞培养板:用于细胞操作的容器细胞培养箱:用于孵育反应孔板离心机:用于沉淀细胞酶标仪:用于定量检测染色后的细胞实验步骤一、贴壁细胞检测1.准备96孔细胞培养板的待测细胞(每孔100微升):包括未处理的对照细胞(样品对照孔),未处理的后续裂解的细胞(样品最大酶活性对照孔),以及药物处理的细胞(处理样品孔),并做好标记(细胞密度为每孔2 X 103至2 X 104细胞)2.到规定的检测时间点前1小时,从湿润的细胞培养箱里取出待测的96孔细胞培养板(注意:确保细胞培养液维持在100微升容量)3.加入10微升裂解液(Reagent A)到未处理的后续裂解的细胞孔里(样品最大酶活性对照孔)4.同时加入10微升补充液(Reagent B)到其余所有检测孔里5.放回湿润的细胞培养箱里,继续培养1小时,即规定检测时间6.从湿润的细胞培养箱里取出待测的96孔细胞培养板7.放进孔板离心机离心10分钟,速度为250g8.分别小心移取50微升上清液到新的96孔板的相应孔里,避免触摸细胞颗粒,同时注意做好标记9.分别加入50微升反应液(Reagent C)(注意:使用前,须混匀)10.分别加入10微升显色液(Reagent D)11.摇动96孔板混匀12.在室温下孵育30分钟,避免光照13.(选择步骤)分别加入10微升终止液(Reagent E)14.即刻放进酶标仪里测读:波长490nm15.计算处理样品实际吸光读数:处理样品孔吸光读数-样品对照孔吸光读数16.计算样品细胞最大酶活性的实际吸光读数:样品最大酶活性对照孔吸光读数-样品对照孔吸光读数17.计算细胞毒性或死亡率(%):(处理样品实际吸光读数÷样品细胞最大酶活性的实际吸光读数)X 10018.或绘制细胞生长曲线:纵座标(Y轴)为实际吸光读数(A);横坐标(X轴)为细胞数或时间点或药物浓度;据此计算其LD50二、悬浮细胞检测1.准备96孔细胞培养板的待测悬浮细胞(每孔100微升):包括未处理的对照细胞(样品对照孔),未处理的后续裂解的细胞(样品最大酶活性对照孔),以及药物处理的细胞(处理样品孔),并做好标记(细胞密度为每孔5 X 103至5 X 104细胞)2.到规定的检测时间点前1小时,从湿润的细胞培养箱里取出待测的96孔细胞培养板(注意:确保细胞培养液维持在100微升容量)3.加入10微升裂解液(Reagent A)到未处理的后续裂解的细胞孔里(样品最大酶活性对照孔)4.同时加入10微升补充液(Reagent B)到其余所有检测孔里5.放回湿润的细胞培养箱里,继续培养1小时,即规定检测时间6.从湿润的细胞培养箱里取出待测的96孔细胞培养板7.放进孔板离心机离心10分钟,速度为250g8.分别小心移取50微升上清液到新的96孔板的相应孔里,避免触摸细胞颗粒,同时注意做好标记9.分别加入50微升反应液(Reagent C)(注意:使用前,须混匀)10.分别加入10微升显色液(Reagent D)11.摇动96孔板混匀12.在30℃温度下孵育30分钟,避免光照13.(选择步骤)分别加入10微升终止液(Reagent E)14.即刻放进酶标仪里测读:波长490nm15.计算处理样品实际吸光读数:处理样品孔吸光读数-样品对照孔吸光读数16.计算样品细胞最大酶活性的实际吸光读数:样品最大酶活性对照孔吸光读数-样品对照孔吸光读数)17.计算细胞毒性或死亡率(%):(处理样品实际吸光读数÷样品细胞最大酶活性的实际吸光读数)X 10018.或绘制细胞生长曲线:纵座标(Y轴)为实际吸光读数(A);横坐标(X轴)为细胞数或时间点或药物浓度;据此计算其LD50注意事项1.本产品为100次(1个96孔板)操作2.操作时须戴手套3.整个操作须无菌操作4.建议每个样品安排3个孔,即重复3次,计算时取其平均值5.检测体系相应增加,试剂用量按比例相应增加:例如200微升检测体系,试剂用量增加1倍6.每孔中的培养液需100微升,避免使用周边培养孔(常常液体蒸发而减少)7.系统测试,可以加入2至5微升标准液(Reagent G)到50微升无细胞的细胞培养液里,然后按照说明书加入反应液(Reagent C)和显色液(Reagent D)即可8.细胞裂解效果不佳,可以使用20微升裂解液(Reagent A)处理9.孵育时,须避光10.染色完成后,建议即刻检测,最迟不得超过1小时11.细胞培养和处理时,避免使用草酸(OXALATE),草氨酸(OXAMATE)和EDTA,否则影响检测的准确性12.血清含有乳酸脱氢酶,建议使用浓度不要超过1%13.细胞过度生长、密度过高、离心速度过大、培养箱内外温差过大等因素会造成细胞自然释放乳酸脱氢酶14.酚红会干扰检测15.样品最大酶活性对照孔或最大OD吸光读数与细胞裂解程度密切相关16.如果用户没有孔板离心机,则移取上清液时格外小心17.如果用户没有匹配的波长,可以使用波长470nm至570nm之间的任一波长替代18.本公司提供系列细胞繁殖检测试剂产品质量标准1.本产品经鉴定性能稳定2.本产品经鉴定检测敏感使用承诺杰美基因秉着“信誉至上、客户满意、质量承诺”的宗旨为我们的用户提供优质产品和服务。

琥珀酸脱氢酶(SDH)测试盒说明书(货号:A02250T/48样)一、测定原理:琥珀酸脱氢酶(SDH)催化底物反应,FAD 是该反应的辅基,FAD 被还原成FADH,该反应与2,6-DPIP 的还原相偶联,测定2,6-DPIP 的还原速度可以推算出SDH 的活力。
二、试剂组成与配制:(50T/48样)试剂一:液体60ml×2瓶,4℃冷藏3个月;试剂二:液体6ml×1瓶,避光4℃冷藏3个月;试剂三:液体6ml×1瓶,避光4℃冷藏3个月;试剂四:液体6ml×2瓶,避光4℃冷藏3个月;试剂五:液体6ml×1瓶,避光-20℃冷藏3个月,如需分多次使用,建议老师将试剂五分装后冷冻保存,避免多次的反复冻融;试剂六:液体6ml×1瓶,4℃冷藏3个月。
工作液的配制:按试剂一:试剂二:试剂三:试剂四:试剂五:试剂六=2:0.1:0.1:0.2:0.1:0.1的比例进行配制,用多少配多少,现用现配,配好后一定要避光保存。
三、操作步骤:a 、将可见分光光度计于600nm 处,1cm 光径比色皿,以双蒸水调零(比色皿准备两只,一只用于调零,一只用于测定)。
b 、将工作液,37℃预温5分钟以上。
c、往相应编号的试管中加入100μl 待测样本,用5ml 移液器吸取2.6ml 工作液迅速冲入试管中,立即混匀并计时。
d、迅速倒入比色皿中在可见分光光度计600nm 处比色,5秒时读取吸光度值(A 1值),在1分5秒时再次测定吸光度值(A 2值);e、求出2次吸光度差值(△A=A 1-A 2)。
注意点:①、工作液一定要避光保存,测定过程中工作液同样要避光;②、比色皿必须用自来水冲洗干净,再用双蒸水洗2~3次后,才能对下一个样本进行检测;③、在比色皿中加完样后,下一步加试剂与按秒表需同步;④、在比色皿中加完试剂后,必须快速放入分光光度计的比色槽中;⑤、试剂二、试剂三、试剂四、试剂五必须避光冷藏;⑥、配好的混合试剂在测定前必须预温。
乳酸脱氢酶同工酶1测定试剂盒(速率法)适用范围:本产品用于体外定量测定人血清中乳酸脱氢酶同工酶1的活性。
1.1规格具体产品规格见下表:1.2组成成分试剂1:二乙醇胺缓冲液 160mmol/L1,6-己二醇 524mmol/L试剂2:Tris缓冲液 50mmol/LNAD+ 10mmol/L2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色澄清透明液体;2.1.3 试剂2:无色或淡黄色澄清透明液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在主波长340nm、副波长410nm、37℃条件下,试剂空白吸光度小于0.6。
2.3.2 试剂空白吸光度变化率在主波长340nm、副波长410nm、37℃条件下,试剂空白吸光度变化率不大于0.002。
2.4 线性2.4.1 线性范围[30,750]U/L,r>0.990。
2.4.2 线性偏差(100,750]U/L线性范围内,相对偏差不超过±10%;[30,100]U/L线性范围内,绝对偏差不超过±20U/L。
2.5 分析灵敏度检测浓度为75U/L的样本时,吸光度变化率不小于0.003。
2.6 重复性测试新鲜人血清或质控品,重复测试至少20次,CV≤10%。
2.7 批间差用三个不同批号的试剂测试(75±15)U/L的同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度相关系数r>0.990;样本小于等于100U/L时绝对偏差不大于±20U/L;大于100U/L时相对偏差不超过±10%,95%检测样本应符合上述要求。
2.9 稳定性原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品符合2.3、2.4和2.8的要求。
谷氨酸脱氢酶测定试剂盒(酶速率法)说明书【产品名称】通用名称:谷氨酸脱氢酶测定试剂盒(酶速率法)英文名称:GLDH Determination Kit【包装规格】试剂1a/试剂1b/试剂2:72ml×3/8ml×3/60ml×1、72ml×1/8ml×1/20ml×1、54ml×4/6ml×4/60ml×1、54ml×2/6ml×2/30ml×1、54ml×1/6ml×1/15ml×1、45ml×4/5ml×4/50ml×1、45ml×2/5ml×2/25ml×1、36ml×1/4ml×1/10ml×1、18ml×1/2ml×1/5ml×1【预期用途】本试剂用于体外定量测定人血清中谷氨酸脱氢酶的活性,临床上主要用于肝脏疾病分化程度的辅助诊断。
【检验原理】GLDHα-酮戊二酸+ NH3 + NADH L-Glutamate + H2O + NAD+在上述反应中,NADH被氧化成NAD+的速度与GLDH的活性成正比,在340nm波长测定NADH的下降速度,即可计算出GLDH的活性。
【主要组成成分】试剂1 Tris-HCl缓冲液100mmol/L pH 7.5、乙二胺四乙酸二钠(EDTA-2Na)2.6mmol/L、烟酰腺嘌呤二核苷酸(NADH)0.25mmol/L、乙酸铵100mmol/L试剂2 α-酮戊二酸 6.6mmol/L【储存条件及有效期】1.试剂在2~8℃密封避光保存,有效期12个月。
2.已开瓶试剂注意避免污染,2~8℃可稳定28天。
【适用仪器】本产品适用于所有开放式半自动或全自动生化分析仪。
【样本要求】新鲜血清样本:用真空采血管静脉采血,采集后尽快(2h内)分离,避免溶血,送检应及时并注意密封;22℃保存不超过8h,如不能完成应转入2~8℃冰箱保存,在48h内不能完成或者需贮存48h以上,应于-20℃保存;保持密封,避免反复冻融。
货号:MS2627 规格:100管/96样葡萄糖脱氢酶(Glucose dehydrogenase,GCDH)试剂盒说明书微量法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:GCDH(EC 1.1.1.47)催化D-葡萄糖和NAD(P)生成D-葡萄糖酸和NAD(P)H,大量存在于高等动物的肝脏和弱氧化醋杆菌中。
在低聚果糖生产中使用GCDH,不仅能去除低聚果糖中的葡萄糖提高低聚果糖的含量,而且生成的葡萄糖酸与钙离子结合生成的葡萄糖酸钙是一种理想的补钙制剂。
因而,GCDH已成为制备高含量低聚果糖的理想用酶。
测定原理:GCDH催化D-葡萄糖和NAD生成D-葡萄糖酸和NADH,在340nm下测定NADH上升速率,即可反映GCDH活性。
自备实验用品及仪器:紫外分光光度计/酶标仪、台式离心机、可调式移液器、微量石英比色皿/96孔板、研钵、冰和蒸馏水。
试剂的组成和配制:提取液:100mL×1瓶,4℃保存;试剂一:液体19 mL×1瓶,4℃保存;试剂二:粉剂×1瓶,-20℃保存;样本的前处理:组织的前处理:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
细菌或培养细胞的前处理:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至340nm,蒸馏水调零;2、工作液的配制:临用前将试剂二转移到试剂一中混合溶解待用;用不完的试剂4℃可保存一周;3、将工作液置于37℃预热5分钟。
乳酸脱氢酶同工酶1测定试剂盒(乳酸底物法)适用范围:适用于体外定量测定人血清中乳酸脱氢酶同工酶1的含量。
1.1 产品规格1.2 主要组成成分注:质控品具有批间、赋值特异性,具体值详见靶值单。
2.1外观2.1.1试剂盒标签标识清晰,外包装完整无破损;2.1.2试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.3试剂2为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.4质控品:无色或浅黄色干粉,复溶后不得有任何沉淀及絮状悬浮物。
2.2净含量净含量不低于标示值。
2.3试剂空白2.3.1空白吸光度测定待检试剂在在主波长340nm、副波长405nm、37℃条件下:A≤0.6。
2.3.2空白吸光度变化率试剂空白吸光度变化率△A/min≤0.002。
2.4线性范围(25,600)U/L范围内,相关系数r≥0.990;(25,100]U/L范围内,绝对偏差不超过±10U/L;(100,600)U/L范围内,相对偏差不超过±10.0%。
2.5分析灵敏度在产品说明书规定参数设定条件下,测定浓度为200U/L样本,△A/min ≥0.010。
2.6 精密度2.6.1批内重复性CV≤10.0%。
2.6.2 批间差相对极差R≤10.0%。
2.7 准确度与已上市产品比对:(25,600)U/L范围内,相关系数r≥0.990;(25,100]U/L范围内,绝对偏差不超过±10U/L;(100,600)U/L范围内,相对偏差不超过±10.0%。
2.8 质控品2.8.1赋值有效性:测定值在质控靶值范围内;2.8.2 均一性:CV≤5.0%;2.8.3 瓶间差:CV≤5.0%。
2.8.4 开瓶稳定性:开瓶后3天,测定值在质控靶值范围内。
2.9 稳定性未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测, 检测结果应满足2.3、2.4、2.5、2.6.1、2.7和2.8.1的要求。
Focusonyourresearch Serviceforlifescience乳酸脱氢酶(LDH)比色法测试盒货号:E-BC-K046-M方仪器:酶标仪(440-460nm)规格:96T(40sFocusonyourresearchServiceforlifescience基本信息用途本试剂盒合用于检测血清、血浆、胸水、组织、细胞等样本中LDH活力。
检测范围及敏捷度检测范围:6-1000U/L敏捷度:6U/L背景介绍乳酸脱氢酶(EC,LDH)是一种氧化复原酶,它催化丙酮酸和乳酸的互相转变,同时将NADH氧化成NAD+[1]。
LDH是一种四聚体分子,由两个亚基构成,分别为H亚基和M亚基[2]。
在组织损害或红细胞溶血后,细胞将LDH开释到血液中。
细胞外的LDH活性用于检测细胞损害或细胞死亡[3]。
检测原理以辅酶I为递氢体,LDH催化乳酸产生丙酮酸,丙酮酸与 2,4-二硝基苯肼作用生成丙酮酸二硝基苯腙,后者在碱性溶液中呈棕红色,颜色的深浅与丙酮酸的浓度呈正比,经过测定OD值,可计算LDH的活力。
本试剂盒测组织和细胞样本时,需测定总蛋白浓度,介绍使用 BCA法(货号:E-BC-K318-M)。
乳酸脱氢酶(LDH)比色法测试盒供给试剂和物件编号名称规格(size)保留方式(96T)(Storage)试剂一基质液5mL×1瓶2-8℃保留6个月(Reagent1)(SubstrateBuffer)试剂二辅酶I粉剂×1支2-8℃保留6个月(Reagent2)(CoenzymeI)试剂三显色剂5mL×1瓶2-8℃避光保留6(Reagent3)(ChromogenicAgent)个月试剂四碱溶液5mL×1瓶2-8℃保留6个月(Reagent4)(AlkaliReagent)试剂五2μmol/mL丙酮酸标准品1mL×1支2-8℃保留6个月(Reagent5)(2μmol/mLPyruvicAcidStandard)96孔酶标板1板96孔覆膜2张样本地点标志表1张注:试剂严格按上表中的保留条件保留,不一样试剂盒中的试剂不可以混用。
琥珀酸脱氢酶(SDH )活性检测试剂盒说明书可见分光光度法注意:本产品试剂有所变动,请注意并严格按照该说明书操作。
货号:BC0950 规格:50T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称 规格 保存条件 试剂一 液体60 mL×1瓶 -20℃保存 试剂二 液体0.6 mL×1支 -20℃保存 试剂三 液体5 mL×1瓶 2-8℃保存 试剂四 液体4mL×1瓶 2-8℃保存 试剂五液体3mL×1瓶2-8℃保存溶液的配制:1、 试剂二:为易挥发试剂,用完后尽快密封,-20℃保存; 产品说明:SDH (EC 1.3.5.1)广泛存在于动物、植物、微生物和培养细胞中。
SDH 是线粒体的一种标志酶,位于线粒体内膜上的一种膜结合酶,是连接呼吸电子传递和氧化磷酸化的枢纽之一。
此外,为多种原核细胞产能的呼吸链提供电子。
SDH 催化琥珀酸脱氢生成延胡索酸,脱下的氢通过吩嗪二甲酯硫酸(PMS )传递还原2,6-二氯酚靛酚(DCPIP ),并且在600nm 处具有特征吸收峰,通过600nm 吸光度的变化,测定2,6-DCPIP 的还原速度,代表SDH 酶活性。
Succinic Acid + FAD Fumaric Acid + FADHFADH + PMS FAD + PMSH 2PMSH 2 + Dichlorophenolindophenol (600nm) PMS + Reduced Dichlorophenolindophenol 注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、水浴锅、台式离心机、可调式移液器、1 mL 玻璃比色皿、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1. 组织样本:称取约 0.1g 组织,加入1mL 试剂一和 10μL 试剂二,用冰浴匀浆器或研钵匀浆充分研磨,4℃11000g 离心10min ,取上清,置冰上待测。
货号: QS1103 规格:50管/48样胞浆异柠檬酸脱氢酶(ICDHc)试剂盒说明书
紫外分光光度法
正式测定前务必取 2-3 个预期差异较大的样本做预测定
测定意义:
ICDHc(EC 1.1.1.42)广泛存在于动物、植物、微生物和培养细胞中,催化异柠檬酸脱氢脱羧生成α-酮戊二酸,同时还原NADP+生成NADPH。
ICDHc是细胞质中除了磷酸戊糖途径外又一种NADPH重要来源,在逆境中该酶活性通常会发生显著变化。
测定原理:
利用ICDHc催化NADP+还原成NADPH反应,在340 nm下测定NADPH浓度的增加。
自备实验用品及仪器:
紫外分光光度计、恒温水浴锅、台式离心机、可调式移液器、1 mL石英比色皿、研钵、冰和蒸馏水。
试剂的组成和配制:
提取液:60mL×1瓶,4℃保存;
试剂一:液体50 mL×1瓶,4℃保存;
试剂二:粉剂×1支,4℃保存;
试剂三:粉剂×1支,4℃保存;
试剂四:粉剂×1支,-20℃保存;
样本的前处理:
1、细菌、细胞或组织样品的制备:
细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
2、血清(浆)样品:直接检测。
测定步骤:
1、分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2、将试剂二转移至试剂一中充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴中预热
10min左右;用不完的试剂4℃保存。
3、在试剂三中加入550μL蒸馏水充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴
中预热10min左右;用不完的试剂分装后-20℃保存,禁止反复冻融。
4、在试剂四中加入550μL蒸馏水充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴
中预热10min左右;用不完的试剂分装后-20℃保存,禁止反复冻融。
5、操作表:
第1页,共2页
340nm波长下记录20s时的初始吸光度A1和2min20s时的吸光度A2,计算ΔA=A2-A1。
注意事项:
1、若A2-A1大于0.5,需将酶液用提取液稀释,使A2-A1小于0.5,可提高检测灵敏度。
计算
公式中乘以相应稀释倍数。
2、若A2-A1小于0.005,可延长反应时间到5min或10min。
ICDHc活力单位的计算:
1、血清(浆)ICDHc活力的计算:
单位的定义:每mL血清(浆)每分钟生成1 nmol NADPH定义为一个酶活力单位。
ICDHc(nmol/min/mL)=[ΔA×V反总÷(ε×d)×109]÷V样÷T=2143×ΔA
2、组织、细菌或细胞中ICDHc活力的计算:
(1)按样本蛋白浓度计算:
单位的定义:每mg组织蛋白每分钟生成1 nmol NADPH定义为一个酶活力单位。
ICDHc(nmol/min /mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr) ÷T=2143×ΔA÷Cpr (2)按样本鲜重计算:
单位的定义:每g组织每分钟生成1 nmol NADPH定义为一个酶活力单位。
ICDHc(nmol/min /g 鲜重)=[ΔA×V反总÷(ε×d)×109]÷(W× V样÷V样总) ÷T=2143×ΔA÷W
(3)按细菌或细胞密度计算:
单位的定义:每1万个细菌或细胞每分钟生成1 nmol的NADPH定义为一个酶活力单位。
ICDHc(nmol/min /104)=[ΔA×V反总÷(ε×d)×109]÷(500×V样÷V样总) ÷T=4.285×ΔA V反总:反应体系总体积,8×10-4 L;ε:NADPH摩尔消光系数,6.22×103 L / mol /cm;d:比色皿光径,1cm;V样:加入样本体积,0.03 mL;V样总:加入提取液体积,1 mL;T:反应时间,2 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g;500:细菌或细胞总数,500万。
第2页,共2页。