身边的化学物质命题点6溶液的形成溶液的浓度 配套练习(新人教版)
- 格式:doc
- 大小:121.50 KB
- 文档页数:12

第九单元溶液课题1溶液的形成第1课时溶液01知识管理1.溶液的概念概念:一种或几种物质________分散到另一种物质里,形成的________的、________的________。
特征:具有________性和________性。
均一是指:溶液中各部分的性质都________;稳定是指:只要外界条件不改变,组成溶液的成分不会________。
注意:(1)溶液不一定是无色的。
如硫酸铜溶液呈蓝色,含铁离子的溶液呈黄色,含亚铁离子的溶液呈浅绿色,高锰酸钾溶液呈紫红色等。
(2)溶液是一种混合物,水、酒精等纯净物尽管也是均一、稳定的液体,但都不是溶液。
2.溶液的组成组成:________的物质叫溶质;能____________的物质叫溶剂。
关系:溶液中,________的质量+________的质量=________的质量。
溶剂判断:(1)若是固体、气体溶于液体,把固体、气体看作________,液体看作________;(2)若两种液体互相溶解时,一般把量多的一种叫做________,量少的一种叫做________;(3)若两种液体中有一种是水,则无论水量多少,一般把水叫做________;(4)不指明溶剂的溶液,一般是________为溶剂的溶液。
02基础题1.(鄂州中考)把少量下列物质分别放到水中,充分搅拌,不能得到溶液的是( )A.面粉 B.食盐C.白酒 D.蔗糖2.通常状况下,下列溶液的溶质为液体的是( )A.蔗糖溶液 B.酒精溶液C.氯化钠溶液 D.澄清石灰水3.在工农业生产中,许多化学反应都在溶液中进行的主要原因是( )A.便于观察现象B.溶液间的反应不需要加热C.水是反应的催化剂D.溶液中分子或离子接触充分,反应速率快4.指出下列溶液中的溶质和溶剂。
(1)澄清石灰水中,溶质是________,溶剂是________。
(2)医用酒精溶液中,溶质是________,溶剂是________。

需要水的质量为490 g-50 g=440 g答:需要水440 g。
03中档题9.(20xx·株洲)除质量分数以外,人们有时也用体积分数来表示溶液的浓度。
例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇。
下列溶液的浓度属于用体积分数来表示的是(D)A.0.9%的生理盐水B.5%的葡萄糖注射液C.10%的氢氧化钠溶液D.75%的医用酒精10.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是(A)11.(20xx·沈阳)按下列方法配制的溶液,其溶质质量分数为5%的是(A)A.称取5.0 g氯化钾,溶解在95 mL水中,充分搅拌B.称取5.0 g生石灰,放入95 mL水中,充分搅拌C.量取5.0 mL浓盐酸,倒入95 mL水中,充分搅拌D.称取5.0 g二氧化锰,放入95 mL水中,充分搅拌12.(20xx·临沂)A、B两种物质的溶解度曲线如图所示,下列说法错误的是(D)A.在t2℃时A的溶解度大于B的溶解度B.A、B两种物质的溶解度都随温度的升高而增大C.t1℃时,A、B两种物质的饱和溶液中,溶质质量分数相等D.t2℃时,A的饱和溶液中溶质质量分数为30%13.(河南中招)如图是甲、乙两种固体的溶解度曲线。
下列说法中不正确的是(D)A.t1℃时,甲和乙的溶解度相等B.t1℃时,30 g乙加到100 g水中形成饱和溶液C.t2℃时,各100 g饱和溶液降温至t1℃析出固体甲多于乙D.t2℃时,75 g甲的饱和溶液中加100 g水得到20%的溶液14.如图为甲、乙两物质的溶解度曲线。
下列说法正确的是(C)。

人教版2020年九年级化学下册配套练习之溶液的形成(原卷版)1.(2020·山东初三期末)将厨房中的食盐、白糖、花生油、白醋四种物质分别取少量,加入适量水充分搅拌,不能形成溶液的是A.白糖B.花生油C.食盐D.白醋2.(2020·辽宁初三期末)下列物质溶解或稀释过程中,溶液温度没有明显改变的是()A.NaOH B.NH4NO3C.浓硫酸D.NaCl3.(2019·广西初三期中)厨房中的物质放入足量的水中,充分搅拌,不能形成溶液的是A.食用油B.白醋C.白糖D.食盐4.(2020·北京初三期末)下列物质中,属于溶液的是A.蔗糖水B.牛奶C.米粥D.豆浆5.(2018·广东初三课时练习)下列过程中,有一个去污原理与其他三个不同的是()A.用洗涤剂洗去餐具上的油脂B.用酒精除去附着在试管内壁的碘C.用汽油除去衣服上的油污D.用热水洗去附着在烧杯底部的硝酸钾6.(2019·南京师范大学附属中学江宁分校初三月考)衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如下表所示:由表中提供的信息判断,洗净衣服上的碘污渍的最佳选择是A.水B.酒精C.汽油D.苯7.(2019·福建初三月考)把下列厨房里的调味剂分別放入水中,充分搅拌,不能形成溶液的是A.味精B.花生油C.蔗糖D.食盐8.(2020·河北初三期末)下列洗涤或除污过程应用乳化原理的是A.用纯碱溶液除去油污B.用水洗去手上的汗渍C.用洗洁精洗去餐具上的油污D.用刷子刷除杯子上的污垢9.(2020·江苏初三期末)溶液的知识广泛用于生产、生活。
下列说法正确的是A.洗涤剂去油污的原理是溶解B.植物油加入水可得溶液C.均一稳定的液体一定是溶液D.溶质可以是固体、液体和气体10.(2020·河北初三期末)如果把厨房中的①食盐、②料酒、③豆油、④白糖、⑤面粉、⑥面酱分别放入水中充分搅拌,能够得到溶液的是A.①②④B.①②⑥C.④D.③11.(2018·衡阳市逸夫中学初三月考)下列物质加入水中,不能形成溶液的是A.蔗糖B.硝酸钾C.植物油D.高锰酸钾12.(2020·河北初三期末)下列有关溶液的叙述,不正确的是()A.溶液是均一、稳定的混合物B.溶液中的溶质只能是液体或固体C.溶液中各部分性质完全相同D.硝酸铵溶于水时,溶液温度降低13.(2020·海林市朝鲜族中学初三期末)下列有关溶液的说法,正确的是()A.溶液通常是液体,溶质一定是固体B.凡是溶液一定是混合物C.一种物质分散到另一种物质中,形成的液体是溶液D.无色透明的液体是溶液14.(2018·广西初三)下列关于溶液的说法正确的是A.无色澄清液体一定是溶液B.70%的医用酒精的溶剂是酒精C.溶液的质量等于溶剂和溶质的质量之和D.一杯蔗糖溶液的下部分比上部分要甜15.(2019·江苏初三期中)下列关于溶液的说法,正确的是A.溶液都是无色透明的B.面粉与水混合可形成溶液C.饱和溶液不能再溶解任何物质D.硝酸铵溶解在水中,溶液温度会降低16.(2020·山东初三期末)下列利用了乳化原理的是A.用汽油除去衣服上的油污B.用稀硫酸除铁锈C.用洗洁精除去餐具上的油污D.用盐酸除去水垢17.(2018·广东初三课时练习)下列说法正确的是( )A.均一稳定的液体一定是溶液B.饱和溶液一定是浓溶液C.汽油洗涤油污属于乳化现象D.浓H2SO4稀释后,溶液温度升高18.(2019·广西初三期中)医院里用碘酒作消毒剂,它是用碘和酒精配制而成的,其中碘是_____(填“溶质”或“溶剂”);把10克酒精和5克水混在一起其中溶质是_____;通常不指明溶剂的溶液,一般溶剂指的是_____。
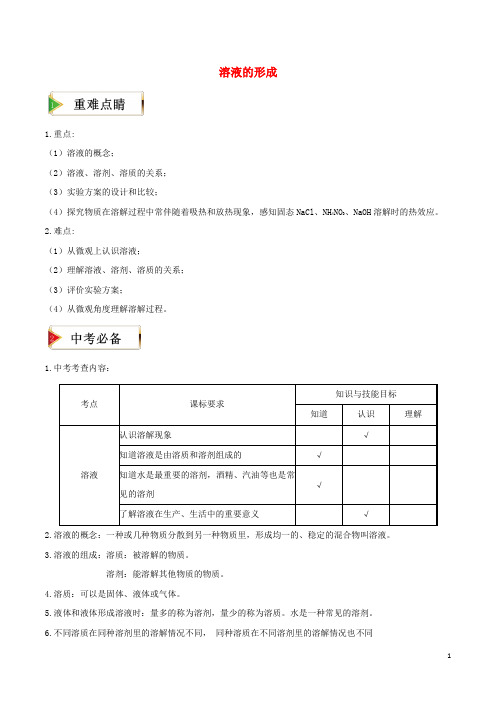
溶液的形成1.重点:(1)溶液的概念; (2)溶液、溶剂、溶质的关系; (3)实验方案的设计和比较;(4)探究物质在溶解过程中常伴随着吸热和放热现象,感知固态NaCl 、NH 4NO 3、NaOH 溶解时的热效应。
2.难点:(1)从微观上认识溶液; (2)理解溶液、溶剂、溶质的关系; (3)评价实验方案;(4)从微观角度理解溶解过程。
1.中考考查内容:7.乳化现象(1)乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。
(2)乳化现象:使植物油分散成无数细小的液滴,而不聚集成大的油珠,这些细小的液滴能随着水流走,这个现象叫乳化现象。
8.溶解时的放热和吸热现象备注:(1)溶解时放热、吸热现象(2)溶解吸热:如NH4NO3溶解(3)溶解放热:如NaOH溶解、浓H2SO4溶解(4)溶解没有明显热现象:如NaCl一、选择题:1.下列关于溶液的叙述,正确的是( )A.无色透明的液体一定是溶液B.溶液中各部分的性质均相同C.植物油分散到水中可以形成溶液D.溶液中只能有一种溶质【答案】B【解析】2.下列烹饪用的调味品与足量水充分搅拌,不能形成溶液的是( )。
A.食盐 B.黄酒 C.白糖 D.橄榄油【答案】D3.硫酸铜溶液的特征是( )A.均一、稳定、无色B.蓝色、均一、稳定、不透明C.均一、稳定、蓝色、透明D.浑浊、均一、不透明、不稳定【答案】C【解析】硫酸铜溶液呈蓝色,它的性质很稳定,具有溶液的均一、稳定性,光线能够透过,所以是透明的液体。
4.可以作为溶质的()A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以【答案】D【解析】溶液是均一稳定的混合物,所以溶液、溶质、溶剂的状态都可能是气体、液体、固体5.下列各种应用中,不属于溶液应用的是( )A.医院里使用消毒酒精对皮肤消毒B.熟石灰粉配制成喷涂墙壁的涂料C.马拉松运动员运动途中喝葡萄糖水来补充能量D.如果皮肤上生了疖子,可用碘酒涂抹患处【答案】B【解析】熟石灰粉配制的涂料属于悬浊液。

九年级化学下册第九单元溶液课题3 溶液的浓度跟踪训练(新版)新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(九年级化学下册第九单元溶液课题3 溶液的浓度跟踪训练(新版)新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为九年级化学下册第九单元溶液课题3 溶液的浓度跟踪训练(新版)新人教版的全部内容。
课题3 溶液的浓度一、选择题(每小题只有一个选项符合题意)1.将50g20%氯化钾溶液稀释到200g,稀释后所得溶液中溶质的质量分数是( )A.1% B。
5% C。
10% D.20%2.用氯化钠固体配制100 g质量分数为5%的氯化钠溶液。
下列仪器中必需用到的是( )A。
②④⑥⑦ B。
①④⑤⑥ C.①③⑤⑦ D.①②④⑦3。
现有一杯20℃的饱和硝酸钾溶液,欲改变其溶质质量分数,下列方法可行的是( ) A。
加入一定量的水 B。
恒温蒸发部分水C.升温到60℃D.加入一定量的硝酸钾4。
将60℃饱和的硝酸钾溶液降温至20℃,没有发生变化的是()A.溶液的质量 B。
溶液里溶质的质量C。
溶液里溶剂的质量 D。
溶液里溶质的质量分数5。
20℃时,NaCl溶解于水的实验数据如下表。
则下列叙述正确的是()实验序号水的质量(g)加入NaCl的质量(g)溶液的质量(g)①10212②10313③10413。
6④10513.6A.②中所得溶液是饱和溶液B.20℃时10g水最多能溶解4g NaClC。
①所得溶液的溶质质量分数为20%D。
③④溶液的溶质质量分数相等6。
甲、乙两物质的溶解度曲线如右图所示。
下列叙述中,正确的是( )A.t1℃时,甲和乙的饱和溶液的质量分数均是30%B.t2℃时,甲和乙的饱和溶液中溶质质量分数相等C.从0℃至t1℃时,甲物质的溶解度大于乙物质的溶解度D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和7。

溶液的浓度1.重点:(1)溶质的质量分数的有关计算; (2)配制16%的氯化钠溶液。
2.难点:(1)溶质的质量分数的有关计算; (2)溶质的质量分数与溶解度的关系; (3)溶质质量分数的含义。
1.溶液的浓度:溶液的浓度是指一定量的溶液中所含溶质的量。
(1)溶质的质量分数:溶质质量与溶液质量之比,叫做溶质的质量分数,通常以百分比表示。
(2)公式:① ×100%溶质的质量溶质的质量分数=溶液的质量② 溶液的质量=溶质的质量+溶剂的质量=溶液的体积×溶液的密度=溶质的质量÷溶质的质量分数③ 一定温度下某饱和溶液中:×100%100g 溶解度溶质的质量分数=+溶解度注意:(1)溶质的质量分数是溶液组成的一种表示方法,所指溶液可以是饱和溶液,也可以是不饱和溶液;既可以是稀溶液,也可以是浓溶液。
(2)溶质的质量分数是质量比,用百分数来表示,一般与温度无关。
(3)对于有颜色的溶液,颜色越深,浓度越大(即溶质的质量分数越大)。
2.有关溶液的稀释、浓缩和混合问题的计算依据 (1)加水稀释:稀释前后溶液中的溶质质量不变;(2)加溶质增浓:原溶液中的溶质与加入的溶质(只算溶解的部分,未溶解的部分不算)的质量之和等于溶解后溶液中的溶质的质量;(3)蒸发溶剂浓缩:蒸发前后(没有溶质析出)溶液中的溶质质量不变; (4)溶液混合:混合前各溶液中的溶质质量之和等于混合后溶液中溶质的质量。
3.溶质、溶液质量的判断(1)当物质不与溶剂发生化学反应且全部溶解时,投入溶剂中的物质的质量就是溶质的质量;(2)当物质不与溶剂发生反应且未全部溶解时,只有溶解了的物质的质量才是溶质的质量;(3)如果把某物质投入溶剂中,该物质与溶剂发生化学反应,则所得溶液中溶质为反应生成的能溶的物质。
应先根据化学方程式求出溶质的质量,然后才能计算溶液中溶质的质量分数;(4)在涉及溶液中发生化学反应的计算时,应注意:①计算时要将纯物质的质量带入化学方程式中,不能将溶液的质量直接代入计算,要将溶液的质量换算成溶质的质量再带入化学方程式进行计算;②求溶质质量分数时,一定要弄清楚溶质是什么,再根据题意逐一计算出溶质的质量和溶液的质量;③要分析已知量,找出能带入化学方程式中进行计算的有用数据,如对于固体、液体之间反应有气体生成的,反应前后敞口容器内减少的质量就是生成气体的质量;④注意溶质的来源可能有多种,既有反应生成的,又有原来就存在的,需要求和;(5)求所得溶液的质量有两种方法:①溶液组成法:即分别找出溶质的质量和溶剂的质量,然后求和;②质量守恒法:即反应后溶液的质量=反应前所有物质的质量总和-生成沉淀的质量-生成气体的质量-其他不参加反应且不溶的物质的质量。
课题3 溶液的浓度备 用 例 题1.某温度时,蒸干35 g 氯化钾溶液,得到10 g 氯化钾,求该溶液中溶质的质量分数。
指导建议:寻找溶质和溶液质量。
根据题意可知:溶质质量=10 g ,溶液质量=35 g ,所以,溶质的质量分数=35gg 10×100%=28.6%。
2.把100 g 质量分数为98%的浓硫酸稀释成10%的稀硫酸,需水多少克?指导建议:此题为加水稀释的题目,可设需加水的质量为x ,则:100 g×98%=(100 g +x )×10%x =%10%98100⨯-100 g =880 g所以需加水880 g 。
3.某工厂化验室配制5 000 g 20%的盐酸,需要38%的盐酸(密度是1.19 g/cm 3)多少毫升?指导建议:此题仍然是溶液稀释问题,只是所求不是加入水的质量,而是母液的体积。
母液的体积最好通过ρmV =这个公式来解决,所以应先求出母液的质量:设需38%的盐酸质量为x ,x ×38%=5 000 g×20%x =%3820%g 5000⨯ =2 631.6 g 所以V (HCl)=3g/cm 1.19g 6.2631=2 211.4毫升。
4.配制500 mL 质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm 3),需要氢氧化钠和水各多少克?指导建议:先将体积换成质量,再进行计算。
500 mL×1.1 g/cm 3=550 g ,则m (NaOH)=550 g ×10%=55 gm (H 2O)=550 g -55 g =495 g所以需氢氧化钠55 g ,需水495 g 。
5.100 g 某硫酸恰好与13 g 锌完全起反应,试计算这种硫酸中溶质的质量分数。
指导建议:此题是溶液计算与化学方程式计算的综合运用,硫酸溶液中的溶质就是参加了化学反应的硫酸,所以先求纯硫酸质量。
设溶液中硫酸质量为x ,Zn +H 2SO 4=ZnSO 4+H 2↑65 9813 g xx98g 1365= x =65g 1398⨯=19.6 g 所以这种硫酸中ω(H 2SO 4)=g 100g 6.19×100%=19.6%。
第九单元溶液课题1 溶液的形成一、选择——基础知识运用1.下列物质不属于溶液的是()A.矿泉水 B.生理盐水 C.硬水 D.冰水2.有一瓶室温下长期密封放置的氯化钠稀溶液,下列说法正确的是()A.接近瓶口的溶液较稀 B.瓶底附近的溶液较浓C.瓶内溶液各部分密度相同 D.瓶底会析出少量氯化钠固体3.下列关于溶液的说法正确的是()A.溶质一定是固体 B.溶剂一定是水C.溶液一定是混合物 D.凡均一、稳定的液体一定是溶液4.配制溶液时,下列溶剂中最常用的是()A.酒精 B.水 C.汽油 D.植物油5.很多化学反应都在溶液中进行的主要原因是 ( )A.反应速率快 B.易于操作 C.不需加热 D.设备简单6.下列溶液中,不是以水作溶剂的是()A.10g硝酸铵跟8g水组成的溶液 B.10g水跟8g硝酸铵组成的溶液C.1g水跟9g酒精组成的溶液 D.100g酒精跟5g碘组成的溶液7.下列反应完毕后的混合物不是溶液的是()A.二氧化碳与澄清石灰水恰好完全反应B.纯净的碳酸钙粉末与足量的稀盐酸反应C.锌粒与足量的稀硫酸反应D.二氧化碳通入足量的水中二、解答——知识提高运用8. 蔗糖(C12H22O11)和食盐能溶于水形成溶液,在蔗糖溶液中,溶质的微粒是__________,而食盐溶液溶中质的微粒是____________________。
9. 写出下列溶液中溶质的化学式:(1)石灰水__________,(2)硫酸铜溶液__________,(3)碘酒__________,(4)食盐水__________,(5)80mL酒精与20mL水组成的溶液__________。
10. 0.056克氧化钙溶于100克水中,所得溶液中溶质的化学式为__________,其质量为__________g,溶剂的的化学式为__________,其质量为__________g,溶液的质量为__________g第九单元溶液课题1 溶液的形成第1课时一课一练参考答案一、选择——基础知识运用1.【答案】D【解析】溶液是混合物,冰和水都是H2O分子构成,为纯净物;不符合溶液概念。
第九单元溶液课题1溶液的形成第1课时溶液01知识管理1.溶液的概念概念:一种或几种物质分散到另一种物质里,形成的__均一__的、__稳定__的__混合物__。
特征:具有__均一__性和__稳定__性。
均一是指:溶液中各部分的性质都__相同__;稳定是指:只要外界条件不改变,组成溶液的成分不会__分离__。
注意:(1)溶液不一定是无色的。
如硫酸铜溶液呈蓝色,含亚铁离子的溶液呈浅绿色等。
(2)溶液是一种混合物,水、酒精等纯净物虽然也是均一、稳定的液体,但都不是溶液。
2.溶液的组成组成:__被溶解__的物质叫溶质;能__溶解其他物质__的物质叫溶剂。
关系:溶液中,__溶质__的质量+__溶剂__的质量=__溶液__的质量。
溶剂判断:(1)若是固体、气体溶于液体,把固体、气体看作__溶质__,液体看作__溶剂__;(2)若两种液体互相溶解时,一般把量多的一种叫做__溶剂__,量少的一种叫做__溶质__;(3)若两种液体中有一种是水,则无论水量多少,一般把水叫做__溶剂__;(4)不指明溶剂的溶液,一般是以__水__为溶剂的溶液。
02基础题考点1溶液的形成1.(2018·潍坊)下列物质不属于溶液的是(D)A.碘酒 B.矿泉水C.白醋 D.蒸馏水2.溶液与我们的日常生活密切相关,下列关于溶液的说法正确的是(B)A.溶液一定是无色透明的B.溶液一定是混合物C.豆浆、牛奶都是溶液D.溶液的上层浓度小,下层浓度大考点2溶液的组成3.通常状况下,下列溶液的溶质为液体的是(B)A.蔗糖溶液 B.酒精溶液C.氯化钠溶液 D.澄清石灰水4.指出下列溶液中的溶质和溶剂。
(1)澄清石灰水中,溶质是__氢氧化钙__,溶剂是__水__。
(2)医用酒精溶液中,溶质是__酒精__,溶剂是__水__。
(3)白磷溶解在二硫化碳液体中所得的溶液里,溶质是__白磷__,溶剂是__二硫化碳__。
(4)铁和稀硫酸恰好完全反应后的溶液里,溶质是__硫酸亚铁__,溶剂是__水__。
课题3 溶液的浓度一、选择题(每小题只有一个选项符合题意)1.将50g20%氯化钾溶液稀释到200g,稀释后所得溶液中溶质的质量分数是( )A.1%B.5%C.10%D.20%2.用氯化钠固体配制100 g质量分数为5%的氯化钠溶液。
下列仪器中必需用到的是( )A.②④⑥⑦B.①④⑤⑥C.①③⑤⑦D.①②④⑦3.现有一杯20℃的饱和硝酸钾溶液,欲改变其溶质质量分数,下列方法可行的是( )A.加入一定量的水B.恒温蒸发部分水C.升温到60℃D.加入一定量的硝酸钾4.将60℃饱和的硝酸钾溶液降温至20℃,没有发生变化的是( )A.溶液的质量B.溶液里溶质的质量C.溶液里溶剂的质量D.溶液里溶质的质量分数5.20℃时,NaCl溶解于水的实验数据如下表。
则下列叙述正确的是( )A.②中所得溶液是饱和溶液B.20℃时10g水最多能溶解4g NaClC.①所得溶液的溶质质量分数为20%D.③④溶液的溶质质量分数相等6.甲、乙两物质的溶解度曲线如右图所示。
下列叙述中,正确的是( )A.t1℃时,甲和乙的饱和溶液的质量分数均是30%B.t2℃时,甲和乙的饱和溶液中溶质质量分数相等C.从0℃至t 1℃时,甲物质的溶解度大于乙物质的溶解度D.t 2℃时, 分别在100 g 水中各溶解20 g 甲、乙,同时降低温度,甲先达到饱和A.20℃时,氯化铵饱和溶液中氯化铵的质量分数是25%B.20℃时,70g 氯化铵的饱和溶液升温至40℃得到不饱和溶液C.40℃时,75g 氯化铵的饱和溶液中加入25g 水后氯化铵的质量分数为30%D.80℃时,84g的氯化铵饱和溶液降温至60℃时有10g 氯化铵析出 8.右图是a 、b 两种固体的溶解度曲线,下列说法正确的是( )A.a 、b 两种物质的溶解度都随温度的升高而增大B.在t 2℃时,b 的溶解度比a 的溶解度大C.在t 1℃时,a 、b 两种饱和溶液的溶质的质量分数相等D.在t 2℃时,将20 g a 物质加到100 g 水中,得到是饱和溶液 9.已知KNO 3的溶解度随温度的升高而增大。
第一部分 考点研究 模块一 身边的化学物质 命题点6 溶液的形成、溶液的浓度 (时间:30分钟 分值:28分)
一、选择题 1. (2016常州)下列饮品中,属于溶液的是( ) A. 牛奶 B. 白酒 C. 豆浆 D. 咖啡 2. (2016云南) 下列溶液中,溶剂不是水的是( ) A. 蔗糖溶液 B. 生理盐水 C. 碘的酒精溶液 D. 稀盐酸 3. (2016牡丹江)下列生活中的应用能体现乳化现象的是( ) A. 汽油洗去衣服上的油污 B. 加入洗涤剂的水洗去餐具上的油污 C. 食醋除去热水瓶中的水垢 D. 水洗去抹布上的泥土 4. (2016贺州)下列有关溶液的说法正确的是( ) A. 溶液均是无色的、透明的 B. 可溶性物质溶于水时一定会放出热量 C. 石灰水的溶质是石灰 D. 溶液的均一性是指同一溶液各部分的性质、组成相同 5. (2016永州) 在装有水的烧杯中分别加入以下物质,其中形成的溶液温度降低的是( ) A. 生石灰 B. 氢氧化钠 C. 氯化钠 D. 硝酸铵 6. (2016安徽中考名校调研卷)如图试管中盛放的是室温时硝酸钾、氯化钠、氯化氢、熟石灰的饱和溶液中的一种。现向烧杯内的水中加入硝酸铵晶体,试管中立即有大量的晶体析出,则试管中盛放的溶液的溶质是( )
第6题图 A. 硝酸钾 B. 氯化钠 C. 氯化氢 D. 熟石灰 二、填空和简答题 7. (2015益阳)如图所示,广口瓶中盛有少量饱和澄清石灰水,小试管和U形管中均有适 量水,现向小试管中注入适量浓硫酸。 第7题图 请回答: (1)可观察到饱和澄清石灰水____________________。 (2)U形管中a、b液面变化情况是________(选填序号)。 A. a液面上升,b液面下降 B. a液面下降,b液面上升 8. (2016牡丹江)小明同学配制一定溶质质量分数的氯化钠溶液,配制过程如下:
第8题图 (1)仪器①的名称是__________。
(2)用玻璃棒搅拌的作用是__________________。 (3)读取量筒内液体体积时,视线要与_________________________。 (4)配制溶液的烧杯用水洗过,烧杯内有水残留,此操作导致配制的溶液溶质的质量分数 ________(填“偏大”“偏小”或“不变”)。 三、计算题 9. (2016吉林)将一定质量的NaHCO3溶液与100 g稀盐酸混合,二者恰好完全反应,溶液的总质量减少8.8 g。求:稀盐酸中溶质的质量分数。 10. 某兴趣小组为测定某品牌白醋含醋酸的质量分数,进行了如下实验:取10.0 g白醋样品并向其中滴加溶质质量分数为2.0%的氢氧化钠溶液,当消耗氢氧化钠溶液15.0 g时,恰好完全反应。计算该品牌白醋中醋酸的质量分数。 [提示:CH3COOH+NaOH=== CH3COONa+H2O,忽略白醋中其他物质与氢氧化钠的反应。] 1. B 【解析】溶液是一种或多种物质分散到另一种物质中形成均一、稳定的混合物。牛奶、豆浆、咖啡都不均一、不稳定,不属于溶液,A、C、D错误;白酒是均一、稳定的混合物,属于溶液,B正确。 2. C 【解析】蔗糖溶液中溶质是蔗糖,溶剂是水,A错误;生理盐水中溶质是氯化钠,溶剂是水,B错误;碘的酒精溶液中溶质是碘,溶剂是酒精,C正确;稀盐酸中溶质是氯化氢,溶剂是水,D错误。 3. B 【解析】汽油洗去衣服上的油污,是因为汽油能溶解油污,不属于乳化现象;洗涤剂具有乳化作用,可用于清洗油污,属于乳化现象;水垢的主要成分是碳酸钙,碳酸钙能与食醋中的醋酸反应,因此可用食醋除去水垢,不属于乳化现象;泥土与水混合形成悬浊液,泥土会随水流走,不属于乳化现象;故选B。 4. D 【解析】
A × 溶液不一定是无色的,如高锰酸钾溶液是紫红色的 B × 物质溶于水,有的放出热量、有的吸收热量、有些既不吸热也不放热 C × 澄清的石灰水是指氢氧化钙的水溶液,所以石灰水的溶质是氢氧化钙,化学式为Ca(OH)2
D √ 溶液的均一性是指溶液各部分的性质完全相同 5. D 【解析】生石灰和水反应放热;氢氧化钠溶于水放热;氯化钠溶于水温度基本不变;硝酸铵溶于水后溶液的温度降低;故选D。 6. A 【解析】硝酸铵溶于水时吸收热量,会使试管中溶液的温度降低,向烧杯中加入硝酸铵晶体后,试管中立即有大量晶体析出,说明试管中溶液的溶质是固体,C错误;且该固体的溶解度是随温度升高而增大,且受温度影响较大,A正确;氯化钠的溶解度受温度影响较小,B错误;熟石灰是氢氧化钙的俗称,氢氧化钙的溶解度随温度升高而减小;D错误。 7. (1)变浑浊(合理即可) (2)B 【解析】小试管中进行的相当于浓硫酸的稀释,浓硫酸在稀释时会放出热量,而广口瓶内盛装的是饱和澄清石灰水,氢氧化钙的溶解度随温度的升高而降低,因此会出现浑浊。由于瓶内温度升高,瓶内气体受热膨胀,U形管内的液面就会出现a液面下降,b液面上升的现象。 8. (1)药匙 (2)加速氯化钠的溶解 (3)量筒内液体凹液面的最低处保持相平 (4)偏小 【解析】(1)根据常见仪器的名称和用途分析,仪器①是药匙。(2)氯化钠溶解过程中需要用玻璃棒搅拌,目的是加速氯化钠的溶解。(3)量筒内液体读数时,视线要与量筒内液体凹液面的最低处保持相平。(4)烧杯中有水残留,可造成溶剂的质量增大,最终导致配制的溶液的溶质质量分数偏小。 9. 解:稀盐酸中溶质的质量为x NaHCO3+HCl=== NaCl+H2O+CO2↑ 36.5 44 X 8.8g 36.5x=448.8 g
x=7.3 g
稀盐酸中溶质的质量分数为7.3 g100 g×100%=7.3% 答:稀盐酸中溶质的质量分数为7.3%。 10. 解:设10.0 g白醋样品中含醋酸的质量为x CH3COOH+NaOH=== CH3COONa+H2O 60 40 x 15.0 g×2.0% 6040=x15.0 g×2.0%
x=0.45 g
该品牌白醋中含醋酸的质量分数为0.45 g10.0 g×100%=4.5% 答:该品牌白醋中含醋酸的质量分数为4.5%。
第一部分 考点研究 模板一 身边的化学物质 命题点2 氧气的制取 (时间:30分钟 分值:30分) 一、选择题 1. 下列有关氧气的制取、收集、验满、性质的实验中错误的是( ) 二、填空和简答题 2. 根据如图所示装置,结合所学知识回答下列问题。
第2题图 (1)写出图中仪器①的名称:________________。 (2)实验室用A装置制取氧气,写出反应的化学方程式______________________________。 (3)实验室用B、C、E装置制取并收集干燥的氧气,则E中应盛放的试剂是____________。 (4)实验室用D装置收集氧气,当______________时开始收集。 (5)E装置中充满水时,也可以作为氧气的收集装置,则氧气应从_____(填“a”或“b”)端通入。 3. (2016泰州改编)同学们利用如图所示装置进行气体的制备实验(A~F为装置编号)。
第3题图 (1)写出D装置中甲仪器的名称________。 (2)用A装置加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式为__________________,其中二氧化锰起____________作用;收集氧气可以选择________(填装置编号)。 (3)若用高锰酸钾制氧气,指出制取装置中明显的不足之处___________________________。 (4)制取气体前应先检查装置的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是________(填序号)。 a. 将烧杯换成水槽 b. 导管伸入水中位置过深,气体无法逸出 c. 将水换成冰水 d. 先用手捂住试管壁,再将导管另一端插入水中 4. (2016青岛)根据下列装置,回答问题:
第4题图 (1)写出图中标号仪器的名称①______________;②____________。 (2)实验室用过氧化氢溶液和二氧化锰制取氧气时,发生反应的化学方程式为___________,从控制反应速率和节约药品的角度考虑,发生装置最好选用_______(填装置序号)。 (3)因为氧气不易溶于水,所以可以利用装置______(填装置序号)收集 。如果要做铁丝在氧气中燃烧的实验,用这种装置收集氧气时应注意____________。 5. (2015遵义)FeCl3溶液能对过氧化氢的分解起催化作用。某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。
写出本实验发生反应的化学方程式 ____________________________________ 。 Ⅰ. 分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3
溶液,如图观察到____________________ ,就可以粗略判断,得出实验结果。
为进一步判断上述实验结论的准确性,运用上图,小刚同学进行了如下实验方案设计。 Ⅱ. [方案一]在不同过氧化氢浓度下,测定收集相同体积气体所需时间。 [方案二]在不同过氧化氢浓度下,测定________________________________ 。 方案二的实验测量结果:
物理量实序号 30%H2O2溶液的体积(mL) 2%FeCl3溶液的体积(mL) 加入H2O的体积(mL) 反应的时间 (min) 生成O2的体积(mL)
1 5 x 20 5 V1 2 10 3 15 y V2 表中x=________ ,y________ ; 实验结论:通过测量,若V1________V2(填“>”、“=”或“<”),说明