镁及其化合物
- 格式:doc
- 大小:107.50 KB
- 文档页数:4

镁及其化合物的化学方程式和离子方程式一、镁1、镁在氧气中燃烧:2Mg+O22MgO2、镁在氯气中燃烧:Mg+Cl2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H+Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe 12、镁和硫酸铜溶液反应:Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O 3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O 4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2Cl-+Ag+AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2OMgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2OMg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO2↑+H2O。


镁及其重要化合物的主要性质及应用【要点解读】 1.镁的性质(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性。
(2)化学性质:①与非金属反应⎩⎪⎨⎪⎧与O 2反应:2Mg +O 2=====点燃产生强烈白光与Cl 2反应:Mg +Cl 2=====点燃MgCl 2与N 2反应:3Mg +N 2=====点燃Mg 3N2②与CO 2反应:2Mg +CO 2=====点燃2MgO +C ③与H 2O 反应:Mg +2H 2O=====煮沸Mg(OH)2+H 2↑ ④与H +反应:Mg +2H +===Mg 2++H 2↑。
2.海水提镁沉淀Mg 2+→Mg 2++2OH -===Mg(OH)2↓ ↓制MgCl 2→Mg(OH)2+2HCl===MgCl 2+2H 2O ↓电解得Mg →MgCl 2(熔融)=====电解Mg +Cl 2↑ 3.用途生产合金,冶金工业上用作还原剂和脱氧剂。
4.镁的重要化合物【重难点指数】★★★【重难点考向一】镁及其化合物的转化关系【典型例题1】某同学通过系列实验探讨Mg 及其化合物的性质,操作正确且能达到目的的是( )A .将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg 的活泼性B .将NaOH 溶液缓慢滴入MgSO 4溶液中,观察Mg(OH)2沉淀的生成C .将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D .将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl 2固体 【答案】B【解析】本题考查镁及其化合物的性质、常见的基本实验操作。
稀释浓硫酸时,应将浓硫酸沿着器壁或玻璃棒慢慢加入水中,并及时搅拌,A 是错误的;过滤时需要用玻璃棒引流,因此C 不正确;蒸发溶液时应该用蒸发皿而不是表面皿,2固体,所【重难点考向二】镁的提取工艺及原理【典型例题1】【2014·高考全国卷Ⅱ,36(1)(3)(4)】将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。
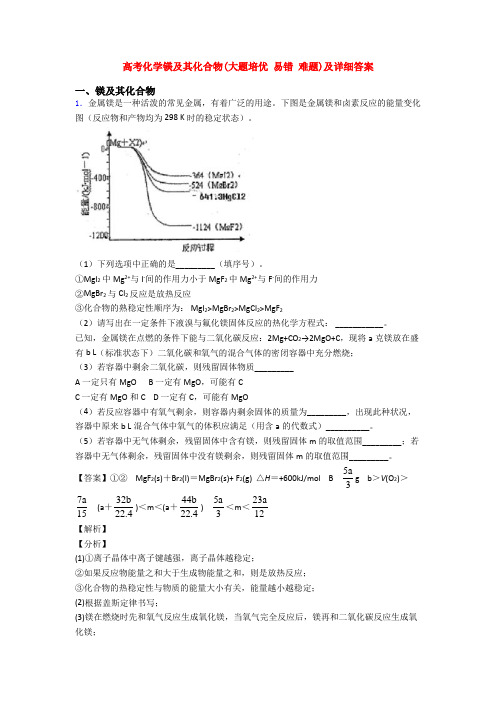
高考化学镁及其化合物(大题培优易错难题)及详细答案一、镁及其化合物1.金属镁是一种活泼的常见金属,有着广泛的用途。
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力②MgBr2与Cl2反应是放热反应③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将a克镁放在盛有b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;(3)若容器中剩余二氧化碳,则残留固体物质_________A 一定只有MgOB 一定有MgO,可能有CC 一定有MgO和CD 一定有C,可能有MgO(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来b L混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
【答案】①② MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol B 5a3g b>V(O2)>7a 15 (a+32b22.4)<m<(a+44b22.4)5a3<m<23a12【解析】【分析】(1)①离子晶体中离子键越强,离子晶体越稳定;②如果反应物能量之和大于生成物能量之和,则是放热反应;③化合物的热稳定性与物质的能量大小有关,能量越小越稳定;(2)根据盖斯定律书写;(3)镁在燃烧时先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁;(4)若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒计算;采用极限的方法计算;(5)若容器中无气体剩余,残留固体中含有镁,假设气体全部为氧气或二氧化碳,然后采用极限的方法解答;若容器中无气体剩余,残留固体中没有镁剩余,说明二者完全反应。


化学镁的知识点总结一、镁的性质1. 物理性质镁是一种银白色的金属,具有良好的延展性和导电性。
其密度为1.738g/cm³,熔点为650℃,沸点为1090℃。
镁的硬度较低,可以用刀片削割。
在空气中,镁会被氧化形成一层氧化膜,从而防止进一步氧化。
镁的电负性较低,化合物一般呈碱性。
2. 化学性质镁在常温下不与水反应,但在高温下会与水发生化学反应,生成氢气。
在空气中,镁会被氧化形成氧化镁。
镁可以与非金属元素发生化学反应,例如与氧气反应生成氧化镁、与硫反应生成硫化镁。
此外,镁还可以与酸发生反应,生成相应的盐和氢气。
二、镁的化合物1. 氧化镁氧化镁是镁与氧发生化学反应生成的一种化合物,化学式为MgO。
氧化镁是一种无色的晶体固体,具有良好的光学性能和绝缘性能,是一种重要的无机材料。
氧化镁可用于制备电工陶瓷、耐火材料、精密陶瓷等。
2. 氯化镁氯化镁是镁与氯发生化学反应生成的一种化合物,化学式为Mg Cl₂。
氯化镁是一种重要的无机盐,可用于制备镁的其他化合物,也可作为防冻剂、消防剂、金属镁的生产原料等。
3. 硫化镁硫化镁是镁与硫发生化学反应生成的一种化合物,化学式为MgS。
硫化镁是一种黑色晶体固体,具有良好的光学性能和光电性能,可用于制备光电器件、激光器件等。
三、镁的应用1. 金属镁金属镁是镁最常见的形态,可用于制备铝镁合金、镁合金等。
铝镁合金具有良好的力学性能和耐热性能,广泛应用于航空航天、汽车制造、电子设备等领域。
镁合金具有较轻的密度和良好的强度,可用于制备手机壳、摄像头壳体等产品。
2. 氧化镁氧化镁可用于制备陶瓷制品、炼钢石灰、精密陶瓷等,具有良好的耐高温性能和绝缘性能,广泛应用于冶金、制陶、电力等行业。
3. 医药和生活用品氯化镁可用于制备医药产品、防腐剂、消毒剂等,具有良好的抗菌和抗炎性能,广泛应用于医药及日常生活用品中。
4. 其他应用硫化镁可用于制备光电器件、激光器件等,具有良好的光学性能和光电性能,广泛应用于光电通讯、激光雷达等领域。
镁及其重要化合物(建议完成时间:45分钟实际完成时间:_______分钟)目录考点一镁及其化合物的结构、性质及应用考点二镁及其化合物制备的工艺流程考点三镁及其化合物的有关计算考点一镁及其化合物的结构、性质及应用1下列关于镁的叙述正确的是()A.镁在氮气中不能燃烧B.镁与水不能反应释放出氢气C.镁在氯气中燃烧会产生白烟D.镁可在二氧化碳气体中燃烧,只生成白色固体【答案】C【解析】A.Mg能在N2中燃烧生成Mg3N2,A项错误;B.在加热条件下,Mg与H2O反应生成H2,B项错误;C.镁在氯气中燃烧会产生白色的氯化镁,故C正确;D.Mg与CO2反应生成MgO和C,D项错误。
故选:C。
2(2023秋·陕西西安·高三西安市铁一中学校考期末)金属钛可用下列方法提炼:TiCl4+2Mg 高温2MgCl2+Ti。
下列叙述正确的是A.该反应属于复分解反应B.该反应中镁元素被氧化C.该反应中Ti是还原剂D.该反应中TiCl4发生了氧化反应【答案】B【解析】A.根据反应方程式的特点,该反应属于置换反应,不属于复分解反应,故A错误;B.该反应中Mg元素的化合价由0价→+2价,化合价升高,被氧化,故B正确;C.单质Ti是产物,Ti元素的化合价降低,即单质Ti是还原产物,故C错误;D.Ti元素的化合价降低,TiCl4属于氧化剂,发生还原反应,故D 错误;答案为B。
3(2023春·河北保定·高三河北安国中学校联考)科学家已经发现火星的沉积层内存在数量众多的硫酸镁水合盐(MgSO4⋅nH2O),从而证实了这个红色星球早期存在水。
下列说法错误的是A.硫酸镁是离子化合物B.无水硫酸镁可作干燥剂C.硫酸镁既是镁盐也是硫酸盐D.水合盐中存在极性键和氢键等化学键【答案】D【解析】A.硫酸镁含离子键,属于离子化合物,故A正确;B.无水硫酸镁可吸收水形成水合盐,可作干燥剂,故B正确;C.硫酸镁由硫酸根离子、镁离子构成,则硫酸镁既是镁盐也是硫酸盐,故C正确;D.氢键不属于化学键,水合盐含离子键、极性共价键,故D错误;故选:D。
2020-2021高考化学镁及其化合物(大题培优易错难题)及详细答案一、镁及其化合物1.以硼镁泥(主要成分为MgSiO3、Fe2O3及少量A l2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:己知:①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:pH值Mg(OH)2Mn(OH)2MnO(OH)2Fe(OH)2Al(OH)3Fe(OH)3开始沉淀时9.37.17.87.6 3.7 2.3沉淀完全时10.810.89.89.6 4.7 3.7②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取(2)“浸取”时,MgSi O3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;过滤3所得滤渣中含有MnO(OH)2和__________。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。
【答案】ac MgSi O3+2HCl+(n-l)H2O=MgCl2+Si O2·n H2O4.7<pH<7.1Mn2++H2O2+2O H-=MnO(OH)2↓+H2O Mg(OH)2氨水挥发加剧,导致溶液中氨水浓度降低。
【解析】(1)此处主要考查反应速率的影响因素,所以要想加快酸溶解速率可以从外因浓度、温度、接触面积等考虑,可以采取升温、把硼镁泥粉碎、搅拌等措施,答案选ac。
(2)根据滤渣1可知:MgSiO3与盐酸反应生成SiO2·nH2O,还有产物MgCl2、H2O方程式为MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2·nH2O(3)加入双氧水后,Fe2+转化为Fe3+,要使Fe3+、Al3+完全沉淀,pH必须大于或等于4.7,Mn2+不沉淀,pH小于或等于7.1,所以答案为4.7<pH<7.1(4)Mn2+在碱性下被H2O2氧化生成MnO(OH)2,H2O2被还原为H2O,离子方程式为Mn2++H2O2+2OH-=MnO(OH)2↓+H2O 。
2020-2021高考化学镁及其化合物(大题培优易错难题)含答案解析一、镁及其化合物1.已知A为单质,B、C、D、E为化合物,它们之间存在如下转化关系:(1)若A为非金属单质,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,D为无色气体,在空气中可变成红棕色,C与HCl气体反应生成E时产生大量白烟,则B 的化学式为,由C转化为D的化学方程式为,上述反应中属于氧化还原反应的有。
(2)若A为生活中常见的金属单质,B为A与盐酸反应的产物,C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则由B转化为C的离子方程式为,加热蒸干并灼烧C的溶液可得D的原因是。
【答案】(1)Mg3N24NH3+ 5O2 4NO +6H2O ①②③⑤(2)2Fe2++Cl2= 2Fe3++2Cl-FeCl3水解吸热,且水解产物HCl易挥发,从而彻底水解生成Fe(OH)3,灼烧时分解生成Fe2O3。
【解析】试题分析:(1)镁条在空气中燃烧的主要产物有氧化镁和氮化镁,因B可与水反应生成气体C,所以A为N2,B为Mg3N2,C为NH3,D在空气中由无色变红棕色,故D为NO,NH3与HCl气体反应生成NH4Cl时产生大量白烟,所以E为NH4Cl。
根据反应过程中是否存在元素化合价变化,可判断出氧化还原反应有①②③⑤。
(2)由C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,且B为A与盐酸反应的产物,可判断A为Fe,B为FeCl2,C为FeCl3,D为Fe2O3,E为Fe(OH)3。
考点:元素化合物2.已知X溶液有如图所示转化关系:(1)根据上述转化关系,写出下列物质的化学式:X_____、Y_______、Z________、试剂甲________,试剂乙__________。
(2)写出上述各步反应①~④的离子方程式:①__________________________________;②____________________________;③___________________________________;④_____________________________。
聊聊镁和它的那些“小伙伴”——镁化合物
嘿,朋友们,今天咱们来聊聊一个听起来挺高端,其实跟咱们生活息息相关的东西——镁,还有它的那些“小伙伴”,也就是镁的化合物们。
镁啊,你可别小看它,虽然它在元素周期表里不起眼,但在咱们的世界里,那可是扮演着举足轻重的角色呢!
首先说说镁本身吧。
镁,它是个银白色的金属,轻飘飘的,放在手里感觉就像拿着一块小云朵。
不过,别看它轻,它的作用可大了去了。
在咱们的身体里,镁可是个重要的矿物质,参与了好多生物化学反应,帮助咱们维持心脏健康、调节神经肌肉功能,还跟骨骼健康有着密切的关系呢。
所以啊,平时多吃点儿富含镁的食物,比如坚果、绿叶蔬菜啥的,对身体可是大有裨益的。
再来说说镁的化合物吧。
这些家伙啊,简直就是镁的“变形金刚”,各有各的本事。
比如氧化镁,它是一种白色的粉末,别看它不起眼,但它可是个优秀的耐火材料,能在高温下保持稳定,保护咱们的设备不被烧坏。
还有氢氧化镁,它是一种碱性的化合物,可以用来中和胃酸,缓解胃痛。
再来说说硫酸镁吧,这家伙在医学上可是个宝,能用来治疗便秘、缓解痉挛,还能作为导泻剂使用呢。
除了这些常见的镁化合物外啊,还有很多其他的种类呢。
它们在不同的领域里发挥着各自的作用,比如工业上用
来制造合金、催化剂;农业上作为肥料、杀虫剂;甚至在环保领域里也有它们的身影呢!
所以啊朋友们啊看到没镁和它的化合物们虽然听起来高大上但其实跟咱们的生活是紧密相连的。
它们默默地在背后支持着咱们的生活和工作让咱们的世界变得更加美好和便利。
所以啊咱们可得好好珍惜和利用它们哦!。
镁及其化合物的化学方程式和离子方程式
一、镁
1、镁在氧气中燃烧:2Mg+O22MgO
2、镁在氯气中燃烧:Mg+Cl2MgCl2
3、镁在氮气中燃烧:3Mg+N2Mg3N2
4、镁在二氧化碳中燃烧:2Mg+CO22MgO+C
5、镁与硫共热:Mg+S MgS
6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑
7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑
Mg+2H+Mg2++H2↑
8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑
Mg+2CH3COOH2CH3COO-+Mg2++H2↑
9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑
Mg+2NH4+Mg2++2NH3↑+H2↑
10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2
Mg+2Fe3+Mg2++2Fe2+
11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe
3Mg+2Fe3+3Mg2++2Fe
12、镁和硫酸铜溶液反应:Mg+CuSO4MgSO4+Cu
Mg+Cu2+Mg2++Cu
13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O
14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2O
Mg+4H++2NO3-Mg2++2NO2↑+2H2O
15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O
3Mg+8H++2NO3-Mg2++2NO ↑+4H2O
二、氧化镁
1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2O
MgO+2H+Mg2++H2O
2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2O
MgO+2CH3COOH Mg2++2CH3COO-+H2O
3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2O
MgO+2NH4+Mg2++2NH3↑+H2O
4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)3
3MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁
1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2O
Mg(OH)2+2H+Mg2++2H2O
2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2O
Mg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O
3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2O
Mg(OH)2+2NH4+Mg2++2NH3↑+2H2O
4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)3
3Mg(OH)2+2Fe3+3Mg2++2Fe(OH)3
5、氢氧化镁受热分解:Mg(OH)2MgO+H2O
四、氯化镁
1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2
Cl-+Ag+AgCl ↓
2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
Mg2++2OH-Mg(OH)2↓
3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4Cl
Mg2++2NH3·H2O Mg(OH)2↓+2NH4+
4、氯化镁溶液中加入偏铝酸钠溶液:
MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaCl
Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓
5、电解氯化镁的熔融液:MgCl2Mg+Cl2↑
6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑
Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑
五、碳酸镁
1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2O
MgCO3+2H+===Mg2++CO2↑+H2O
2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O
MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2
MgCO3+CO2+H2O===Mg2++2HCO3-
4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑
3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑
MgCO3+2NH4+===Mg2++2NH3↑+CO2↑
6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑
六、碳酸氢镁
1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2O
HCO3-+H+===CO2↑+H2O
2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3
Mg2++2OH-===Mg(OH)2↓
3、碳酸氢镁与过量的氢氧化钠溶液反应:
Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2O
Mg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O
4、碳酸氢镁与澄清石灰水反应:
Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O
Mg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
5、碳酸氢镁受热分解:Mg(HCO3)2△
MgCO3↓+CO2↑+H2O。