镁及其化合物
- 格式:ppt
- 大小:419.00 KB
- 文档页数:15

镁及其化合物的化学方程式和离子方程式(总3页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--镁及其化合物的化学方程式和离子方程式一、镁1、镁在氧气中燃烧:2Mg+O22MgO2、镁在氯气中燃烧:Mg+Cl2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H+Mg2++H2↑8、镁和醋酸反应: Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应: Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中: Mg+2FeCl32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中: 3Mg+2FeCl33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe 12、镁和硫酸铜溶液反应: Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反应: Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应: Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应: 3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反应: MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中: MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O4、氧化镁投入到氯化铁溶液中: 3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O2、氢氧化镁和醋酸反应: Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中: Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O 4、氢氧化镁投入到氯化铁溶液中: 3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解: Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2Cl-+Ag+AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液: MgCl2Mg+Cl2↑6、电解氯化镁的溶液: MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2OMgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2OMg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△3↓+CO2↑+H2O。

镁高中相关知识点总结一、镁的基本性质1. 原子结构:镁的原子含有12个质子和12个电子。
其电子排布方式为2, 8, 2,这使得镁的电子排布符合稳定的惰性气体氩的外层电子排布。
2. 物理性质:镁是一种银白色的有光泽的金属,具有较低的密度和较高的熔点。
它是地壳中第八丰度的金属元素。
3. 化学性质:镁易与氧气发生反应,生成氧化镁。
它能和许多酸性物质反应,产生相应的盐和氢气。
二、镁的化合物1. 氧化镁:氧化镁是一种白色的粉状固体,主要用于制造耐火材料和水泥。
氧化镁具有较高的熔点和较好的抗腐蚀性,因此在工业上有广泛的应用。
2. 氯化镁:氯化镁是一种重要的盐类化合物,常用作融雪剂和镁制品的原料。
此外,氯化镁还可以用于制备其他镁盐和有机化合物。
3. 碳酸镁:碳酸镁是镁的碳酸盐,常见的矿物形式为菱镁矿。
碳酸镁常用于制造镁盐、陶瓷和橡胶等工业产品。
三、镁的应用1. 合金材料:镁和其他金属元素(如铝、锌、锰等)可以合成多种合金材料,这些合金具有轻质、高强度和耐腐蚀的特性,被广泛用于航空航天、汽车和电子产品等领域。
2. 耐火材料:氧化镁和氢氧化镁等化合物具有较高的熔点和耐高温性能,被用作制造耐火砖、耐火浇铸料和隔热材料。
3. 医药用途:镁盐可用于制备镁剂,镁剂在医学上被广泛用于治疗镁缺乏症、心肌梗死和高血压等疾病。
四、镁的环境影响1. 镁的开采和加工会产生大量的废水和废渣,对周围环境造成污染。
2. 镁的生产和使用会排放大量二氧化碳和氨等有害气体,导致大气污染和温室效应。
3. 廢棄的或不當處理的鎂金屬及其化合物会對土壤和水體中的生物產生毒害。
五、镁的安全注意事项1. 镁粉在空气中容易燃烧,因此在使用时需谨慎防火。
2. 镁和一些强氧化性物质(如漂白剂)反应会产生剧烈的燃烧,应避免混合使用。
3. 镁制品在加工时可能产生粉尘,应采取有效的通风和防护措施,避免吸入和接触。
以上便是有关镁高中相关知识点的总结,其详细信息及相关知识点可以根据高中化学教材的相关章节进行更深入的学习。


镁及其重要化合物的主要性质及应用【要点解读】 1.镁的性质(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性。
(2)化学性质:①与非金属反应⎩⎪⎨⎪⎧与O 2反应:2Mg +O 2=====点燃产生强烈白光与Cl 2反应:Mg +Cl 2=====点燃MgCl 2与N 2反应:3Mg +N 2=====点燃Mg 3N2②与CO 2反应:2Mg +CO 2=====点燃2MgO +C ③与H 2O 反应:Mg +2H 2O=====煮沸Mg(OH)2+H 2↑ ④与H +反应:Mg +2H +===Mg 2++H 2↑。
2.海水提镁沉淀Mg 2+→Mg 2++2OH -===Mg(OH)2↓ ↓制MgCl 2→Mg(OH)2+2HCl===MgCl 2+2H 2O ↓电解得Mg →MgCl 2(熔融)=====电解Mg +Cl 2↑ 3.用途生产合金,冶金工业上用作还原剂和脱氧剂。
4.镁的重要化合物【重难点指数】★★★【重难点考向一】镁及其化合物的转化关系【典型例题1】某同学通过系列实验探讨Mg 及其化合物的性质,操作正确且能达到目的的是( )A .将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg 的活泼性B .将NaOH 溶液缓慢滴入MgSO 4溶液中,观察Mg(OH)2沉淀的生成C .将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D .将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl 2固体 【答案】B【解析】本题考查镁及其化合物的性质、常见的基本实验操作。
稀释浓硫酸时,应将浓硫酸沿着器壁或玻璃棒慢慢加入水中,并及时搅拌,A 是错误的;过滤时需要用玻璃棒引流,因此C 不正确;蒸发溶液时应该用蒸发皿而不是表面皿,2固体,所【重难点考向二】镁的提取工艺及原理【典型例题1】【2014·高考全国卷Ⅱ,36(1)(3)(4)】将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。
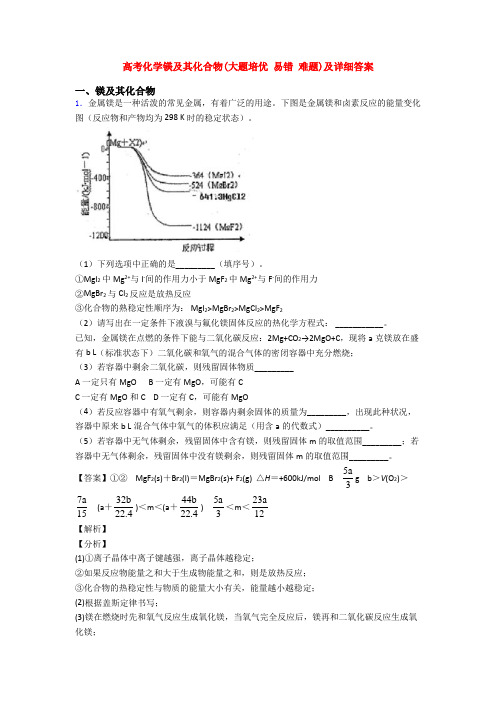
高考化学镁及其化合物(大题培优易错难题)及详细答案一、镁及其化合物1.金属镁是一种活泼的常见金属,有着广泛的用途。
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力②MgBr2与Cl2反应是放热反应③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将a克镁放在盛有b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;(3)若容器中剩余二氧化碳,则残留固体物质_________A 一定只有MgOB 一定有MgO,可能有CC 一定有MgO和CD 一定有C,可能有MgO(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来b L混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
【答案】①② MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol B 5a3g b>V(O2)>7a 15 (a+32b22.4)<m<(a+44b22.4)5a3<m<23a12【解析】【分析】(1)①离子晶体中离子键越强,离子晶体越稳定;②如果反应物能量之和大于生成物能量之和,则是放热反应;③化合物的热稳定性与物质的能量大小有关,能量越小越稳定;(2)根据盖斯定律书写;(3)镁在燃烧时先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁;(4)若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒计算;采用极限的方法计算;(5)若容器中无气体剩余,残留固体中含有镁,假设气体全部为氧气或二氧化碳,然后采用极限的方法解答;若容器中无气体剩余,残留固体中没有镁剩余,说明二者完全反应。

镁及其化合物一、镁1、镁的物理性质物态固态密度(接近室温)1.738 g·cm?3熔点 650 °C沸点 1091 °C比热容24.869 J·mol?1·K?1镁是地壳中含量高,分布广的元素之一,位于第八位,约占地壳质量的2.4%。
在自然界中,镁只以化合物形态存在。
镁属于元素周期表上的IIA族碱土金属元素。
具有银白色光泽,略有延展性。
镁的密度小。
2、镁的物理性质具有比较强的还原性,能与沸水反应放出氢气,燃烧时能产生眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中,镁能直接与氮、硫和卤素等化合,包括烃、醛、醇、酚、胺、脂和大多数油类在内的有机化学药品与镁仅仅轻微地或者根本不起作用。
但和卤代烃在无水的条件下反应却较为剧烈(生成格氏试剂)镁能和二氧化碳发生燃烧反应,因此镁燃烧不能用二氧化碳灭火器灭火。
镁由于能和N?和O?反应,所以镁在空气中燃烧时,剧烈燃烧发出耀眼白光,放热,生成白色固体。
在食醋中的变化为快速冒出气泡,浮在醋液面上,逐渐消失。
一些烟花和照明弹里都含有镁粉,就是利用了镁在空气中燃烧能发出耀眼的白光的性质。
镁元素在化学反应中的化合价通常为+2价。
中的化合价通常为+2价。
1.与非金属单质的反应:2Mg+O ? 2MgO3Mg+N? Mg?N?Mg+Cl?2.与水的反应:Mg+2H2O(热水) Mg(OH)?+H?↑3.与酸的反应:Mg+2HCl=MgCl ?+H ?↑Mg+H ?SO ?=MgSO ?+H ?↑4.与氧化物的反应:2Mg+CO 2MgO+C 5.镁与氯化铵反应:[3]镁与氯化铵的反应,究其本质,还是镁与酸的反应。
氯化铵溶液中铵根离子水解,溶液显酸性。
当加入镁粉之后,镁与溶液中的氢离子反应,放出氢气,同时放出大量的热。
铵根离子的水解产物——氨水,受热之后,则发生分解。
故此反应可以得到两种气体。
镁的单质及其化合物化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。
镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图:。
物理性质:具有银白色光泽,略有延展性。
镁的密度小,离子化倾向大。
在空气中,镁的表面会生成一层很薄的氧化膜,使空气很难与它反应。
化学性质:镁具有比较强的还原性,能与沸水反应放出氢气,燃烧时能产生眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中。
镁的日常用途医疗用途:治疗缺镁和痉挛。
体育用途:在紧张运动几小时前注射镁化合物,或在紧张运动后注射以弥补镁的流失。
体操运动员常涂碱式碳酸镁来增加摩擦力。
医疗中:如果注射镁盐速度太快,会造成发烧和全身不适。
金属镁能与大多数非金属和酸反应;在高压下能与氢直接合成氢化镁;镁能与卤化烃作用合成格氏试剂,广泛应用于有机合成。
镁具有生成配位化合物的明显倾向。
氧化镁:化学式MgO是镁的氧化物,一种离子化合物。
常温下为一种白色固体。
氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:总反应:MgCl2(熔融)Mg+Cl2↑Mg-2e-==Mg2+②镁与非金属反应O2+2Mg2MgOCl2+Mg MgCl2S+Mg MgS3Mg+N2Mg3N2说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。
由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。
③镁与酸反应2HCl+Mg==MgCl2+H2↑2H++Mg==Mg2++H2↑镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。
④镁跟某些氧化物反应2Mg+CO2C+2MgO⑤镁跟水反应Mg+2H2O Mg(OH)2+H2↑说明:镁跟冷水反应非常缓慢.2白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色Mg(OH)2(s)Mg2+(aq)+2OH-(aq)①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O②热稳定性差,受热容易分解Mg(OH)2MgO+H2O。
镁及其重要化合物(建议完成时间:45分钟实际完成时间:_______分钟)目录考点一镁及其化合物的结构、性质及应用考点二镁及其化合物制备的工艺流程考点三镁及其化合物的有关计算考点一镁及其化合物的结构、性质及应用1下列关于镁的叙述正确的是()A.镁在氮气中不能燃烧B.镁与水不能反应释放出氢气C.镁在氯气中燃烧会产生白烟D.镁可在二氧化碳气体中燃烧,只生成白色固体【答案】C【解析】A.Mg能在N2中燃烧生成Mg3N2,A项错误;B.在加热条件下,Mg与H2O反应生成H2,B项错误;C.镁在氯气中燃烧会产生白色的氯化镁,故C正确;D.Mg与CO2反应生成MgO和C,D项错误。
故选:C。
2(2023秋·陕西西安·高三西安市铁一中学校考期末)金属钛可用下列方法提炼:TiCl4+2Mg 高温2MgCl2+Ti。
下列叙述正确的是A.该反应属于复分解反应B.该反应中镁元素被氧化C.该反应中Ti是还原剂D.该反应中TiCl4发生了氧化反应【答案】B【解析】A.根据反应方程式的特点,该反应属于置换反应,不属于复分解反应,故A错误;B.该反应中Mg元素的化合价由0价→+2价,化合价升高,被氧化,故B正确;C.单质Ti是产物,Ti元素的化合价降低,即单质Ti是还原产物,故C错误;D.Ti元素的化合价降低,TiCl4属于氧化剂,发生还原反应,故D 错误;答案为B。
3(2023春·河北保定·高三河北安国中学校联考)科学家已经发现火星的沉积层内存在数量众多的硫酸镁水合盐(MgSO4⋅nH2O),从而证实了这个红色星球早期存在水。
下列说法错误的是A.硫酸镁是离子化合物B.无水硫酸镁可作干燥剂C.硫酸镁既是镁盐也是硫酸盐D.水合盐中存在极性键和氢键等化学键【答案】D【解析】A.硫酸镁含离子键,属于离子化合物,故A正确;B.无水硫酸镁可吸收水形成水合盐,可作干燥剂,故B正确;C.硫酸镁由硫酸根离子、镁离子构成,则硫酸镁既是镁盐也是硫酸盐,故C正确;D.氢键不属于化学键,水合盐含离子键、极性共价键,故D错误;故选:D。