镁及其化合物的化学方程式和离子方程式
- 格式:doc
- 大小:73.00 KB
- 文档页数:3

镁及其重要化合物的主要性质及应用【要点解读】 1.镁的性质(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性。
(2)化学性质:①与非金属反应⎩⎪⎨⎪⎧与O 2反应:2Mg +O 2=====点燃产生强烈白光与Cl 2反应:Mg +Cl 2=====点燃MgCl 2与N 2反应:3Mg +N 2=====点燃Mg 3N2②与CO 2反应:2Mg +CO 2=====点燃2MgO +C ③与H 2O 反应:Mg +2H 2O=====煮沸Mg(OH)2+H 2↑ ④与H +反应:Mg +2H +===Mg 2++H 2↑。
2.海水提镁沉淀Mg 2+→Mg 2++2OH -===Mg(OH)2↓ ↓制MgCl 2→Mg(OH)2+2HCl===MgCl 2+2H 2O ↓电解得Mg →MgCl 2(熔融)=====电解Mg +Cl 2↑ 3.用途生产合金,冶金工业上用作还原剂和脱氧剂。
4.镁的重要化合物【重难点指数】★★★【重难点考向一】镁及其化合物的转化关系【典型例题1】某同学通过系列实验探讨Mg 及其化合物的性质,操作正确且能达到目的的是( )A .将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg 的活泼性B .将NaOH 溶液缓慢滴入MgSO 4溶液中,观察Mg(OH)2沉淀的生成C .将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D .将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl 2固体 【答案】B【解析】本题考查镁及其化合物的性质、常见的基本实验操作。
稀释浓硫酸时,应将浓硫酸沿着器壁或玻璃棒慢慢加入水中,并及时搅拌,A 是错误的;过滤时需要用玻璃棒引流,因此C 不正确;蒸发溶液时应该用蒸发皿而不是表面皿,2固体,所【重难点考向二】镁的提取工艺及原理【典型例题1】【2014·高考全国卷Ⅱ,36(1)(3)(4)】将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。

海水制镁五个化学方程式
当海水中的镁离子和其他化学物质发生反应时,可能会产生多
种化学方程式。
以下是五个可能的化学方程式:
1. 镁和盐酸反应,Mg + 2HCl → MgCl2 + H2。
在这个方程式中,海水中的镁和盐酸反应,产生氯化镁和氢气。
2. 镁和硫酸反应,Mg + H2SO4 → MgSO4 + H2。
当海水中的镁和硫酸反应时,会产生硫酸镁和氢气。
3. 镁和碳酸氢钠反应,Mg + NaHCO3 → MgCO3 + Na + H2O + CO2。
这个方程式描述了镁和碳酸氢钠反应,产生碳酸镁、钠、水和
二氧化碳。
4. 镁和氯气反应,Mg + Cl2 → MgCl2。
这个方程式表示镁和氯气反应,生成氯化镁。
5. 镁和氧气反应,2Mg + O2 → 2MgO.
当镁和氧气反应时,会生成氧化镁。
这些方程式展示了海水中镁可能发生的不同化学反应,产生不同的化合物和产物。
这些方程式从不同的化学角度展示了镁在海水中的化学性质。

镁及其化合物的化学方程式和离子方程式一、镁1、镁在氧气中燃烧:2Mg+O22MgO2、镁在氯气中燃烧:Mg+Cl2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H+Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2Cl-+Ag+AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2OMgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O2++2HCO-+2Ca2++4OH-↓+2CaCO↓+2H8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。

点燃 △电解 四.学测考试化学方程式和离子方程式(学测必备材料4)一、钠及其化合物1、钠与氧气(常温): 4Na+O 2=2Na 2O2、钠与氧气(燃烧): 2Na+O 2 Na 2O 23、钠与水反应: 2Na+2H 2O =2NaOH+H 2↑ 2Na + 2H 2O = 2Na + +2OH - + H 2↑4、氧化钠与水反应: Na 2O+H 2O==2NaOH5、碳酸氢钠与氢氧化钠溶液: NaHCO 3 + NaOH== Na 2CO 3+ H 2OHCO 3- + OH - == CO 32- + H 2O6、碳酸氢钠与盐酸: HCl +NaHCO 3=NaCl+H 2O+CO 2↑HCO 3- + H + == CO 2↑ + H 2O7、碳酸氢钠固体加热: 2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O8、碳酸钠溶液通入二氧化碳: Na 2CO 3+CO 2+H 2O==2NaHCO 3 CO 32- + CO 2+H 2O==2HCO 3-9、大理石与与盐酸反应: CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑CaCO 3 + 2H + == Ca 2+ + CO 2↑+ H 2O二、镁及其化合物 10、镁在氧气中燃烧: 2Mg+O 2 2MgO11、氯化镁溶液与石灰水: MgCl 2 + Ca(OH)2 = CaCl 2+ Mg(OH)2↓ Mg 2+ + 2OH - = Mg(OH)2↓12、氢氧化镁与盐酸反应: Mg(OH)2 + 2HCl = MgCl 2 +2H 2OMg(OH)2 + 2H + = Mg 2+ + 2H 2O 13、电解熔融氯化镁: MgCl 2 Mg + Cl 2↑14、碳酸镁与盐酸: MgCO 3 +2HCl = MgCl 2 + CO 2↑+ H 2OMgCO 3 + 2H + == Mg 2+ + CO 2↑+ H 2O三、铝及其化合物 (Al 2O 3是两性氧化物Al(OH)3是两性氢氧化物15、铝热反应: Fe 2O 3 + 2Al Al 2O 3+2Fe16、铝与盐酸: 2Al + 6HCl = 2AlCl 3 + 3H 2↑2Al + 6H + == 2Al 3+ + 3H 2↑17、铝与氢氧化钠溶液: 2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑ 2Al + 2OH - + 2H 2O =2AlO 2- + 3H 2↑18、氧化铝与盐酸: Al 2O 3+6HCl=2AlCl 3+3H 2O Al 2O 3 + 6H + = 2Al 3+ + 3H 2O19、氧化铝与氢氧化钠溶液: Al 2O 3+2NaOH =2NaAlO 2+H 2OAl 2O 3 + 2OH - =2AlO 2- + H 2O20、氢氧化铝与盐酸: Al(OH)3+3HCl=AlCl 3+3H 2OAl(OH)3 + 3H + =Al 3+ + 3H 2O21、氢氧化铝与氢氧化钠溶液: Al(OH)3+NaOH =NaAlO 2+2H 2OAl(OH)3 + OH - =AlO 2- + 2H 2O22、加热氢氧化铝: 2Al(OH)3 Al 2O 3+3H 2O 23、电解熔融氧化铝: 2Al 2O 3 4Al+3O 2↑ 点燃 △ 电解24、二氧化碳通入偏铝酸钠溶液中: NaAlO 2+CO 2+2H 2O =Al(OH)3↓+NaHCO 3CO 2 + AlO 2- + 2H 2O == Al(OH)3↓+ HCO 3-25、氯化铝与少量氢氧化钠溶液: AlCl 3+3NaOH =Al(OH)3↓+3NaClAl 3+ + 3OH - == Al(OH)3↓26、氯化铝与过量氢氧化钠溶液反应:AlCl 3 + 4NaOH = NaAlO 2+ 3NaCl + 2H 2OAl 3+ + 4OH - == AlO 2- + 2H 2O27、氯化铝与氨水: AlCl 3+3NH 3·H 2O =Al(OH)3↓+3NH 4Cl Al 3+ + 3NH 3.H 2O == Al(OH)3↓+ 3NH 4+28.明矾净水原理: Al 3++3 H 2O Al(OH)3(胶体) + 3H +四、铁及其化合物29、铁在与氯气中燃烧: 2Fe + 3Cl 2 2FeCl 330、铁在氧气中燃烧: 3Fe + 2O 2 点燃Fe 3O 431、铁与盐酸反应: Fe+2HCl =FeCl 2+H 2↑Fe + 2H + = Fe 2+ + H 2↑32、铁与氯化铁溶液: 2FeCl 3+Fe =3FeCl 2Fe + 2Fe 3+ == 3Fe 2+33、铜与氯化铁溶液: 2FeCl 3+Cu =2FeCl 2+CuCl 2Cu + 2Fe 3+ == 2Fe 2+ + Cu 2+34、氯化铁溶液与氢氧化钠溶液: FeCl 3+3NaOH == Fe(OH)3↓+ 3NaCl Fe 3+ + 3OH - == Fe(OH)3↓35、氯化铁溶液与硫氰化钾溶液: FeCl 3 + 3KSCN == Fe(SCN)3 + 3KClFe 3+ + 3SCN - == Fe(SCN)3(血红色)36、氯水(或氯气)与氯化亚铁溶液: Cl 2 +2FeCl 2 =2FeCl 3Cl 2 + 2Fe 2+ == 2Fe 3+ + 2Cl - 37、氧化铁与一氧化碳: Fe 2O 3 + 3CO △2Fe+3CO 238、氢氧化亚铁与氧气反应: 4Fe(OH)2 + O 2 + 2H 2O == 4 Fe(OH)339、氢氧化铁固体加热: 2F e(OH)3△Fe 2O 3 + 3H 2O (Al 、Fe 在冷、浓的H 2SO 4、HNO 3中钝化)五、铜及其化合物40、铜与氧气反应: 2Cu +O 2△2CuO 41、氢氧化铜固体加热: Cu(OH)2 △ CuO + H 2O42、氢氧化铜与硫酸反应: Cu(OH)2+H 2SO 4=CuSO 4+2H 2OCu(OH)2+ 2H + == Cu 2+ +2 H 2O六、硅及其化合物43、二氧化硅与氢氧化钠溶液: SiO 2+2NaOH =Na 2SiO 3+H 2O SiO 2 + 2OH - = SiO 32-+ H 2O44、二氧化硅与氢氟酸: 4HF+SiO 2=SiF 4↑+2H 2O45、工业上生产普通玻璃的反应: SiO 2+Na 2CO 3 高温Na 2SiO 3+CO 2↑点燃七、硫及其化合物46、硫与氧气:S+O2点燃SO247、二氧化硫被氧气氧化:2SO2+O2△2SO348、二氧化硫与水:SO2+H2O H2SO349、稀硫酸与氢氧化钡溶液:Ba(OH)2+ H2SO4= BaSO4↓ + 2H2OBa2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O50、浓硫酸与碳共热:2H2SO4(浓)+C △CO2↑+2SO2↑+2H2O(浓H2SO4只作氧化剂)51、浓硫酸与铜共热:Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(H2SO4既表现氧化性又表现酸性)52、工业上接触法制硫酸(1)、以黄铁矿为原料:4FeS2+11O2催化剂△2Fe2O3+8SO22SO2+O2催化剂高温高压2SO3SO3+H2O==H2SO4八、氮气及其化合物53、工业氮气与氢气合成氨气:N2+3H2催化剂高温高压2NH354、氮气与氧气在放电条件下反应:N2+O22NO55、一氧化氮与氧气:2NO+O2=2NO256、二氧化氮与水:3NO2+H2O=2HNO3+NO57、实验室制NH3:2NH4Cl(固)+Ca(OH)2(固)△CaCl2+2NH3↑+2H2O58、氨与氯化氢:NH3+HCl=NH4Cl(白烟)59、氨气与水反应:NH3 + H2O NH3·H2O一水合氨电离NH3·H2O NH4+ + OH-(氨水呈碱性)或:NH3 + H2O NH3·H2O NH4+ + OH60、硝酸的见光、受热分解:4HNO3△4NO2↑+O2↑+2H2O61、稀硝酸与铜:3Cu+ 8HNO3=3Cu (NO3)2+2NO↑+4H2O3Cu +2NO3- + 8H+ == 3Cu2++ 2NO↑+ 4H2O 62、浓硝酸与铜:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2OCu +2NO3- + 4H+ == Cu2+ + 2NO2↑+ 2H2O63、浓硝酸与碳共热: 4HNO3(浓)+C △CO2↑+4NO2↑+2H2O64、工业氨的催化氧化制硝酸:(1). 4NH3+5O24NO +6H2O(2)2NO+O2==2NO2(3) 3NO2+H2O=2HNO3+NO九、氯、溴、碘及其化合物65、二氧化锰与浓盐酸共热(实验室制取氯气):4HCl(浓)+MnO 2△MnCl2+Cl2+2H2OMnO2 + 4H++ 2Cl-△Mn2+ + Cl2↑+ 2H2O66、氢气在氯气中燃烧:Cl2 +H22HCl (光照或点燃)67、氯气溶于水:Cl2+H2O HCl +HClOCl2+H2O H++Cl—+HClO68、氯水与碘化钾溶液反应:Cl2 +2KI= 2 KCl+ I2Cl2 + 2I- == 2Cl- + I269、氯气与氢氧化钠溶液反应:Cl2+2NaOH=NaCl+NaClO+H2OCl2 + 2OH- == Cl- + ClO- + H2O70、氯气与石灰乳反应(工业制取漂白粉):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O71、漂白粉的漂白原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO十、原电池和电解池72、由铜、锌、稀硫酸构成的铜锌原电池(写出两极现象)电极反应式:正极:2H+ + 2e- == H2↑(有气泡放出)负极:Zn - 2e- == Zn2+(锌片溶解)电池总反应的化学方程式:Zn +H2SO4=ZnSO4+H2↑离子方程式:Zn + 2H+ == Zn2+ + H 2↑73、钢铁在潮湿的空气中发生电化学腐蚀电极材料:正极:碳,负极:铁正极:O2 + 2H2O + 4e - == 4OH-负极:2Fe - 4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2Fe(OH)2十一、烃74、甲烷与氯气混合光照:(取代反应)CH4 + Cl 2CH3Cl + HCl 等75、乙烯通入溴的四氯化碳溶液中:(加成反应)CH2=CH2 + Br2 CH2BrCH2Br(褪色)76、乙烯与氯化氢在催化剂作用下反应(加成反应):CH2=CH2 +HCl CH3CH2Cl77、乙烯与水在催化剂作用下反应生成乙醇(加成反应):CH2=CH2 + H2O CH3CH2OH78、乙烯在催化剂作用下生成聚乙烯(加聚反应):n CH2=CH279、苯与浓硝酸和浓硫酸的混酸共热(取代反应):+HO-NO2+ H2O十三、食品中的有机化合物80、乙醇的催化氧化(氧化反应):2CH3CH2OH+O2 2CH3COOH+2H2O81、乙醛的催化氧化:2CH3CHO + O 22CH3COOH82、.乙酸与乙醇发生酯化反应:CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O83、淀粉的水解:(C6H10O5)n (淀粉) + nH2O n C6H12O6(葡萄糖)Cu。

一、 金属钠及其重要化合物的相互转化(括号内写离子方程式)1、 4 Na + O 2 === 2 Na2O 2、 2 Na +O 2 △Na 2O 2 3、 2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) 5、2 Na 2O 2 +2 H 2O = 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑)6、呼吸面具中提供氧气2 Na 2O 2 + 2 CO 2 = 2 Na2CO 3+O 2 7、2 NaOH + CO 2 = Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O )8、Na 2CO 3+CO 2+H 2O = 2 NaHCO 3 (CO 32—+ CO 2 + H 2O = 2 HCO 3—) NaOH →NaHCO 3:NaOH +CO 2 = NaHCO 3 (OH —+ CO 2 = HCO 3—) 9、NaOH + HCl === NaCl +H 2O (OH —+ H += H 2O) 10、土法制碱Na 2CO 3+Ca(OH)2=2NaOH+CaCO 3↓ (CO 32-+Ca 2+ = CaCO 3↓ ) 11、逐滴滴加盐酸、逐滴滴加盐酸Na 2CO 3+HCl =NaHCO 3+NaCl (CO -23+ H += HCO 3-)NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO 3-+H +=CO 2↑+H 2O )12、Na 2CO 3+H 2SO 4=Na 2SO 4+CO 2↑+H 2O (CO -223+ 2H += CO 2↑ + H 2O )13、工业制碱、工业制碱 2NaCl + 2H 2O 电解电解2NaOH + H2↑+ Cl 2↑ ( 2Cl - + 2H 2O 电解电解2OH - + H 2↑+↑+ Cl Cl 2↑) 14、侯氏制碱、侯氏制碱 NH 3+NaCl+H 2O+CO 2=NaHCO 3↓+NH 4Cl (NH 3+Na ++H 2O+CO 2=NaHCO 3↓+NH 4+) 15、2 NaHCO 3△Na 2CO 3+CO 2↑+H 2O 或NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO-3+OH-=CO-23+H 2O )16、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H += CO 2↑ + H 2O ) 17、2NaHCO 3+H 2SO 4=Na 2SO 4+2CO 2↑+↑+22H 2O (HCO -3+ H += CO 2↑ + H 2O ) Na 2O Na ① NaCl NaHCO 3 Na 2CO 3 NaOH Na 2O 2 ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾ ⑿ ⒀ NaSO 4 ⒁ ⒂ ⒃ ⒄二、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃点燃2Al 2O 3 2Al+Fe 2O 3 高温高温 Al 2O 3+2Fe 2.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H2↑)3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al3++3H 2↑)↑) 或2Al+3Cl 2 点燃点燃2AlCl 34.2Al 2O 3(熔融)电解电解4Al+3 O4Al+3 O2↑5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H ++=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O ) 7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H += Al 3++3H 2O ) 8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH -= AlO 2-+2H 2O ) 9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ ) 10、AlCl 3 + 4NaOH = NaAlO 2 + 3NaCl +2H 2O (Al 3+ + 4OH - = AlO 2- 2H 2O )11、NaAlO 2 + 4HCl = AlCl 3 + NaCl +2H 2O (AlO 2- + 4H + = Al 3+ +2H 2O )12、NaAlO 2 + CO 2+2H 2O = Al (OH )3 ↓+NaHCO 3 或 2NaAlO 2 + CO2+3H 2O = 2Al (OH )3 ↓+Na 2CO 3 13、(Al 3++3H 2O ≒ Al (OH )3 (胶体)+3H +) 其他遗漏方程式:其他遗漏方程式:3NaAlO 2+AlCl 3 +6H 2O = 4Al (OH )3 ↓+3NaCl 2 Al (OH )3△Al 2O 3+3H 2O Al Al (OH )3 NaAlO 2Al 2O 3 AlCl 3①O 2;Fe 2O 3② ③HCl HCl;;Cl 2 ④⑤ ⑥ ⑦⑧KAl(SO 4)2•12H 2O ⑿CO 2⑨NH 3•H 2O⑩⑾ ⒀⒀CO CO;;Al Al 高温高温点燃点燃高温2Fe(OH)32O+Fe 2O 3•xH 2O (铁锈主要成分)(铁锈主要成分) ⒁吸氧⒁吸氧腐蚀腐蚀Fe FeS FeCl 2 4 FeO Fe 2O 3 Fe 3O 4 FeCl Fe(OH)② ① ③ ④⑤⑥⑦⑧⑨⑩ ⑾ ⑿⒂Cl 2点燃 +3Mg2 MgO + HMgCO MgCl MgCO Mg(HCO Mg 3N 2 ①O 2②CO 2 ⑩⑧⑥ ⑾⑿⑨ ⑦⒀⒁ ⒂煮沸⒂煮沸)+Cu 电解电解 Cu+CO OH+CuO、火法炼铜:Cu 222 2CuO+H CH Cu Cu 2S CuSO 4 Cu(NO 2 CuO ⒄H 2S ③⑧ ⑥④⑦H 2;CO CO;;C 2H 5OH OH①⒅⒀⒁ ⑤电解⑤电解②另外:另外:酸与活泼金属反应的化学方程式锌跟稀盐酸反应: Zn + 2HCl = ZnCl2 + H2 ↑ 有气泡产生,锌粒逐渐减少。
高一年级必修一化学方程式及离子方程式总汇一、钠及其化合物有关反应方程式(一)与金属钠有关的反应方程式:1.钠与氧气在常温下反应钠在氧气中燃烧:2.钠在氯气中燃烧:3.钠与硫粉研磨发生轻微爆炸:4.钠与水反应:5.钠与稀盐酸反应:6.钠与CuSO4溶液反应:(二)与钠的氧化物有关的反应方程式:1.Na2O2与水反应:2.Na2O2与CO2反应:3.Na2O2与稀盐酸反应:4.Na2O与水反应:5.Na2O与CO2反应:6.Na2O与SO2反应:7.Na2O与稀盐酸反应:二、铁及其化合物有关反应方程式(一)与铁有关的反应方程式1.铁与氯气反应:2.铁在氧气中燃烧:3.铁与硫粉反应:4.铁与水蒸气反应:5.铁与稀硫酸反应:6.铁与CuSO4溶液反应:7.少量铁与稀硝酸反应:8.过量铁与稀硝酸反应:(二)与铁的氧化物有关的反应方程式:1.FeO与稀盐酸反应:2.Fe2O3与稀盐酸反应:3.Fe3O4与稀盐酸反应:4.FeO与稀硝酸反应:5.Fe3O4与稀硝酸反应:6.FeO与酸性KMnO4溶液反应:7.Fe3O4与与KMnO4溶液反应:(三)与铁的氢氧化物有关的反应方程式:1.Fe(OH)3与稀盐酸反应:2.Fe(OH)2与稀盐酸反应:3.Fe(OH)2与稀硝酸反应:4.Fe(OH)2在空气中久置:5.Fe(OH)3受热分解:(四)与亚铁盐或铁盐有关的反应方程式:1.FeCl2溶液与氯气反应:2.FeCl2溶液与稀硝酸反应:3.FeCl2溶液与酸性KMnO4溶液反应:4.FeCl3溶液与铁粉反应:5.FeCl3溶液与铜粉反应:6.FeCl3溶液与H2S气体反应:7.FeCl3溶液与SO2气体反应:8.FeCl3溶液与KSCN溶液反应:9.将饱和FeCl3溶液滴加到沸水中制取Fe(OH)3胶体:三、铝及其化合物有关的反应方程式(一)与铝单质有关的反应方程式:1.铝与氧气反应:2.铝与氯气反应:3.铝与Fe2O3反应:4.铝与稀硫酸反应:5.铝与NaOH溶液反应:(二)与氧化铝有关的反应方程式:1.Al2O3与稀硫酸反应:2.Al2O3与NaOH溶液反应:3.Al2O3熔融电解制备金属铝:(三)与氢氧化铝有关的反应方程式:1.Al(OH)3与稀盐酸反应:2.Al(OH)3与NaOH溶液反应:3.Al(OH)3受热分解:(四)与铝盐有关的反应方程式:1.AlCl3与少量NaOH溶液反应:AlCl3与过量NaOH溶液反应:2.AlCl3与过量的氨水反应:3.AlCl3与NaHCO3溶液反应:(五)与四羟基合铝酸盐有关的反应方程式:1.Na[Al(OH)4]溶液与少量稀盐酸反应:2.Na[Al(OH)4]溶液与过量稀盐酸反应:3.Na[Al(OH)4]溶液与少量CO2反应:Na[Al(OH)4]溶液与过量CO2反应:4.Na[Al(OH)4]溶液与AlCl3溶液反应:四、镁及其化合物有关反应方程式(一)与镁单质有关的反应方程式:1.镁在氧气中燃烧:2.镁在氯气中燃烧:3.镁与沸水反应:4.镁在CO2中燃烧:5.镁与稀硫酸反应6.镁与稀硝酸反应:7.镁与浓硫酸反应:8.镁与CuSO4溶液反应(二)与氧化镁有关的反应方程式:1.MgO与稀盐酸反应:(三)与氢氧化镁有关的反应方程式:1.Mg(OH)2与稀盐酸反应:2.Mg(OH)2受热易分解:(四)与镁盐有关的反应方程式:1.MgCl2与NaOH溶液反应:2.MgCl2与氨水反应:五、铜及其化合物有关反应方程式:(一)与铜单质有关的反应方程式:1.铜在氧气中燃烧:2.铜与硫粉共热反应:3.铜在氯气中燃烧:4.铜在潮湿空气中锈蚀变为铜绿:2Cu +O2+H2O+CO2==Cu2(OH)2CO35.铜与浓硫酸反应:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O6.铜与浓硝酸反应:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O Cu+4H++2NO3-==Cu2++2NO2↑+ 2H2O 铜与稀硝酸反应:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O3Cu+8H++2NO3-==3Cu2++2NO↑+ 4H2O7.铜与AgNO3溶液反应:Cu+2AgNO3==Cu(NO3)2+2Ag Cu+2Ag+==Cu2++2Ag8.铜与FeCl3溶液反应:2FeCl3+Cu==2FeCl2+CuCl2 2Fe3++Cu==2Fe2++Cu2+(二)与氧化铜有关的反应方程式:1.CuO与氢气共热反应:H2+CuO Cu+H2O2.CuO与铝粉共热反应:3CuO+2Al3Cu+Al2O33.CuO与CO共热反应:CO+CuO CO2+Cu4.CuO与稀硫酸反应:CuO+H2SO4==CuSO4+H2O CuO+2H+ ==Cu2++H2O(三)与氢氧化铜有关的反应方程式:1.Cu(OH)2与稀硫酸反应:Cu(OH)2+H2SO4==CuSO4+2H2O Cu(OH)2+2H+==Cu2++2H2O2.Cu(OH)2受热分解:Cu(OH)2CuO+H2O(四)与铜盐有关的反应方程式:1.CuCl2与NaOH溶液反应:CuCl2+2NaOH=Cu(OH)2↓+2NaCl Cu2++2OH-==Cu(OH)2↓2.CuCl2溶液与H2S气体反应:CuSO4+H2S=CuS↓+H2SO4Cu2+ +H2S=CuS↓+2H+ 3.CuCl2溶液与铁粉反应:CuCl2+Fe==FeCl2+Cu六、氯及其化合物有关反应方程式(一)与氯气有关的反应方程式:1.铁丝在氯气中燃烧:2Fe+3Cl22FeCl32.铜丝在氯气中燃烧:Cu+Cl2CuCl23.氢气在氯气中燃烧:H2+Cl22HCl4.红磷在氯气中燃烧:2P+3Cl2(少量)2PCl3 2P+5Cl2(过量)2PCl55.氯气与水反应:Cl2+H2O==HCl +HClO Cl2+H2O==H++Cl-+HClO6.氯水与SO2反应:Cl2+SO2+2H2O==H2SO4+2HCl Cl2+SO2+2H2O==2Cl-+SO42−+4H+7.氯气与NaOH溶液反应:Cl2+2NaOH==NaCl+NaClO+H2O Cl2+2OH−==Cl−+ClO−+ H2O8.氯气与澄清石灰水反应:2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Cl2+2OH-==Cl−+ClO−+ H2O 9.氯气与KI溶液反应:Cl2+2KI==2KCl+I2Cl2+2I−==2Cl−+ I210.氯气与NaBr溶液反应:Cl2+2NaBr==2NaCl +Br2Cl2+2Br−==2Cl−+Br211.氯气与Na2S溶液反应:Cl2+Na2S==2NaCl +S↓Cl2+2S2−==2Cl−+S↓12.氯气与FeCl2溶液反应:Cl2 +2FeCl2==2FeCl3Cl2+2Fe2+==2Fe3++2Cl-13.氯气与Na2SO3溶液反应:Cl2+SO32−+H2O==SO42−+2H++2Cl−(二)与含氯化合物有关的反应方程式:1.稀盐酸与AgNO3溶液反应:AgNO3+HCl==AgCl↓+HNO3Ag++Cl+==AgCl↓2.稀盐酸与铁粉反应:Fe+2HCl==FeCl2+H2↑Fe+2H+==Fe2++H2↑3.稀盐酸与NaHCO3溶液反应:NaHCO3+HCl==NaCl+H2O+CO2↑HCO3−+H+== H2O+CO2↑4.Na2CO3与少量稀盐酸反应:Na2CO3+HCl==NaHCO3+NaCl CO32-+H+== HCO3−Na2CO3与过量稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑CO32-+2H+== H2O+CO2↑5.稀盐酸与Ca(ClO)2溶液反应:Ca(ClO)2+2HCl==CaCl2+2HClO ClO−+H+==HClO6.Ca(ClO)2溶液与少量CO2反应:Ca(ClO)2+CO2+H2O==CaCO3↓+2HClOCa2++2ClO−+CO2+H2O==CaCO3↓+2HClOCa(ClO)2溶液与过量CO2反应:Ca(ClO)2+2CO2+2H2O==Ca(HCO3)2+2HClOClO−+CO2+H2O==HClO+HCO3−七、溴及其化合物有关反应方程式(一)与溴单质有关的反应方程式:1.溴与铁粉反应:2Fe+3Br2==2FeBr32.溴与NaOH溶液反应:Br 2+2NaOH==NaBr +NaBrO+H2O Br 2+2OH−==Br−+BrO−+H2O3.溴与氢硫酸溶液反应:Br2+H2S==2HBr+S↓Br2+H2S==2H++2Br−+S↓4.溴水与SO2反应:Br 2+SO2+2H2O==H2SO4+2HBr Br 2+SO2+2H2O==2Br−+SO42−+4H+5.溴与Na2SO3溶液反应:Na2SO3+Br2+H2O==Na2SO4+2HBr SO32-+Br2+H2O==SO42-+2H++2Br-(二)与溴化物有关的反应方程式:1.NaBr溶液与氯气反应:2NaBr+Cl2==2NaCl+Br22Br−+Cl2==Br2+2Cl−2.NaBr溶液与AgNO3溶液反应:AgNO3+NaBr==AgBr↓+NaNO3 Ag++Br−==AgBr↓八、碘及其化合物有关反应方程式(一)与碘单质有关的反应方程式:1.碘与铁粉反应:Fe+I2==FeI22.碘与氢硫酸溶液反应:I2+H2S==2HI+S↓I2+H2S==2H++2I−+S↓4.碘水与SO2反应:I 2+SO2+2H2O==H2SO4+2HI I2+SO2+2H2O==2I-+SO42-+4H+5.碘与亚硫酸钠溶液反应:SO32-+I2+H2O==SO42-+2H++2I−(二)与碘化物有关的反应方程式:1.NaI溶液与氯气反应:2NaI+Cl2==2NaCl+I22I−+Cl2==I2+2Cl−2.NaI钠溶液与溴水反应:2NaI+Br2==2NaBr+I22I-+Br2==I2+2Br−3.NaI溶液与AgNO3溶液反应:AgNO3+NaI==AgI↓+NaNO3 Ag++I−==AgI↓九、碳及其化合物有关反应方程式(一)与碳单质有关的反应方程式:1.碳与氧气反应:2C+O2(少量)2CO C+O2(足量)CO22.碳与CO2在高温下反应:C+CO2高温2CO3.碳与水蒸气在高温下反应:C+H2O高温CO+H2(水煤气)4.碳与二氧化硅在高温下反应:2C+SiO2高温Si+2CO↑5.碳与CuO在高温下反应:2CuO+C高温2Cu +CO2↑6.碳与Fe2O3在高温下反应:2Fe2O3+3C高温4Fe +3CO2↑7.碳与浓硫酸在加热时反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O8.碳与浓硝酸在加热时反应:C +4HNO3(浓)CO2↑+4NO2↑+2H2O(二)与碳的氧化物有关的反应方程式:1.CO在氧气中燃烧:2CO+O22CO22.CO与Fe2O3在高温下反应:3CO+Fe2O3高温2Fe+3CO23.CO与CuO在高温下反应:CO+CuO 高温Cu+CO24.CO2与Na2O反应:Na2O+CO2==Na2CO35.CO2与Na2O2反应:2Na2O2+2CO2==2Na2CO3+O26.少量CO2与澄清石灰水反应:CO2+Ca(OH)2==CaCO3↓+H2O CO2+Ca2++2OH−==CaCO3↓+H2O 过量CO2与澄清石灰水反应:2CO2+Ca(OH)2==Ca(HCO3)2CO2+ OH−==HCO3−7.少量CO2与Na2SiO3溶液反应:SiO32−+CO2+H2O==H2SiO3↓+ CO32−过量CO2与Na2SiO3溶液反应:SiO32−+2CO2+2H2O==H2SiO3↓+2HCO3−8.少量CO2与Na[Al(OH)4]溶液反应:CO2+2[Al(OH)4]−==2Al(OH)3↓+CO32−+H2O 过量CO2与Na[Al(OH)4]溶液反应:CO2+[Al(OH)4]−==Al(OH)3↓+HCO3−9.CO2与Na2CO3溶液反应:Na2CO3+CO2+H2O==2NaHCO3 CO32−+CO2+H2O==2HCO3−(三)与碳酸盐有关的反应方程式:1.Na2CO3溶液与过量醋酸溶液反应:CO32−+2CH3COOH═=2CH3COO−+H2O+CO2↑2.CaCO3与过量醋酸溶液反应:CaCO3+2CH3COOH═=Ca2++2CH3COO−+H2O+CO2↑3.Na2CO3溶液与澄清石灰水反应:Na2CO3+Ca(OH)2==CaCO3↓+2NaOH CO32−+Ca2+==CaCO3↓4.Na2CO3溶液与氯化钡溶液反应:CO32−+Ba2+==BaCO3↓5.Na2CO3溶液与过量SO2反应:2SO2 +CO32−+H2O==2HSO3−+CO26.NaHCO3溶液与醋酸溶液反应:HCO3−+CH3COOH═=CH3COO−+H2O+CO2↑7.NaHCO3溶液与氢氧化钠溶液反应:NaHCO3+NaOH==Na2CO3+H2O HCO3−+OH−==CO32−+H2O 8.NaHCO3溶液与少量澄清石灰水反应:2HCO3−+ Ca2+ +2OH−==CaCO3↓+ CO32−+H2O NaHCO3溶液与过量澄清石灰水反应:HCO3−+ Ca2+ +OH−==CaCO3↓+H2O9.NaHCO3加热分解:2NaHCO3Na2CO3+H2O+CO2↑十、氮及其化合物有关反应方程式(一)与N2有关的反应方程式:1.镁条在氮气中燃烧:N2+3Mg Mg3N22.工业上合成氨:N2+3H2催化剂高温高压2NH33.氮气与氧气在放电时反应:N2+O22NO(二)与NO有关的反应方程式:1.NO与氧气反应:2NO+O2==2NO22.NO2与水反应:3NO2+H2O==2HNO3+NO 3NO2+H2O==2H++2NO3−+NO3.NO2与NaOH溶液反应:2NO2+2NaOH==NaNO2+NaNO3+H2O 2NO2+2OH-==NO2−+NO3−+H2O 4.NO、NO2混合气体与NaOH溶液反应:NO+NO2+2OH−==2NO2−+H2O(三)与NH3有关的反应方程式:1.氨气与氧气催化氧化反应:4NH3+5O2催化剂△4NO+6H2O2.少量氨气与氯气反应:3Cl2+2NH3==6HCl+N2过量氨气与氯气反应:3Cl2+8NH3==6NH4Cl+N23.氨气与水反应:NH3+H2O NH3·H2O NH4+ +OH-4.氨气与CuO反应:3CuO + 2NH33Cu + N2 + 3H2O5.氨气与浓盐酸反应:NH3+HCl==NH4Cl(白烟)6.氨气与浓硝酸反应:NH3+HNO3==NH4NO3(白烟)7.氨气与浓硫酸反应:2NH3+H2SO4==(NH4)2SO4(四)与硝酸有关的反应方程式:1.硝酸见光或受热分解反应:4HNO34NO2↑+O2↑+2H2O2.铜与浓硝酸反应:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O Cu+4H++2NO3−==Cu2++2NO2↑+ 2H2O 3.铜与稀硝酸反应:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O3Cu+8H++2NO3-==3Cu2++2NO↑+ 4H2O4.碳与浓硝酸反应:C+4HNO3(浓)CO2↑+4NO2↑+2H2O5.硫与浓硝酸反应:S+6HNO3(浓)H2SO4+6NO2↑+2H2O6.FeO与稀硝酸反应:3FeO+10H++NO3−==3Fe3++NO↑+5H2O7.SO2与稀硝酸反应:3SO2+2NO3−+2H2O==2NO↑+4H++3SO42-8.Fe(OH)2与稀硝酸反应:3Fe(OH)2+10H++NO3−==3Fe3++NO↑+8H2O9.FeCl2溶液与稀硝酸反应:3Fe2++4H++NO3−==3Fe3++NO↑+2H2O10.Na2S溶液与稀硝酸反应:3S2−+8H++2NO3−==2NO↑+3S↓+4H2O11.Na2SO3溶液与稀硝酸反应:3SO32-+2H++2NO3−==3SO42−+2NO↑+H2O(五)与铵盐有关的反应方程式:1.NH4HCO3分解反应:NH4HCO3NH3↑+H2O+CO2↑2.NH4Cl分解反应:NH4Cl NH3↑+HCl↑3.NH4Cl固体与消石灰加热反应:2NH4Cl + Ca(OH)2CaCl2 +2NH3↑+ 2H2O4.NH4Cl溶液与NaOH溶液反应:NH4Cl+NaOH==NH3∙H2O+NaCl NH4++OH−==NH3∙H2O 5.NH4HCO3溶液与过量的NaOH溶液加热时反应:NH4++HCO3−+2OH−NH3↑+ CO32−+2H2O十一、硫及其化合物有关反应方程式(一)与硫单质有关的反应方程式:1.硫粉与铁粉加热反应:Fe+S FeS2.硫粉与铜粉加热反应:2Cu+S Cu2S3.硫与氢气加热反应:S+H2H2S4.硫在氧气中燃烧:S+O2SO25.硫与浓硝酸加热反应:S+6HNO3(浓)H2SO4+6NO2↑+2H2O6.硫与浓硫酸加热反应:S+2H2SO4(浓)3SO2↑+2H2O7.硫与热浓NaOH溶液反应:3S+6NaOH2Na2S+Na2SO3+3H2O 3S+6OH−2S2−+SO32−+ 3H2O (二)与SO2的有关反应方程式:1.SO2与氧气反应:2SO2+O2催化剂加热2SO32.SO2与氯水反应:SO2+Cl2+2H2O==H2SO4+2HCl SO2+Cl2+2H2O==4H++SO42−+2Cl−3.SO2与水反应:SO2+H2O H2SO34.SO2与CaO反应:SO2+CaO CaSO35.少量SO2与澄清石灰水反应:SO2+Ca(OH)2==CaSO3↓+H2O SO2+Ca2++2OH−==CaSO3↓+H2O 过量SO2与澄清石灰水反应:2SO2+Ca(OH)2==Ca(HSO3)2SO2+ OH−==HSO3−6.SO2与稀硝酸反应:3SO2+2NO3-+2H2O==2NO↑+4H++3SO42−7.SO2与FeCl3溶液反应:2Fe3++ SO2+2H2O==2Fe2++4H++SO42−8.SO2与酸性KMnO4溶液反应:5SO2+2MnO4-+2H2O==5SO42−+2Mn2++4H+9.SO2与H2S 反应:SO2+2H2S==3S↓+2H2O11.SO2与双氧水溶液反应:SO2+H2O2==H2SO4 SO2+H2O2==2H++SO42−(三)与硫化物有关的反应方程式:1.H2S与氧气在点燃时反应:2H2S+5O2(过量) 2H2O+4SO2 2H2S+O2(少量)2H2O+4S 2.H2S与氯气反应:H2S+Cl2==S+2HCl3.H2S与SO2反应:SO2+2H2S==3S↓+2H2O4.H2S与稀硝酸反应:3H2S+2HNO3==4H2O+ 3S↓+ 2NO↑3H2S+2H++NO3−==4H2O+ 3S↓+ 2NO↑5.H2S与氯化铁溶液反应:2FeCl3+H2S==2FeCl2+S↓+2HCl 2Fe3++H2S==2Fe2++S↓+2H+6.FeS与稀硫酸反应:FeS+H2SO4==H2S↑+FeSO4 FeS+2H+==Fe2++H2S↑7.FeS与稀硝酸反应:FeS+4H++NO3-==Fe3++S↓+NO↑+2H2O(四)与浓硫酸有关的反应方程式:1.浓硫酸与氨气反应:2NH3+H2SO4==(NH4)2SO42.H2S与浓硫酸反应:H2S+H2SO4(浓)==S↓+SO2↑+2H2O3.HI与浓硫酸反应:2HI+H2SO4(浓)==2H2O+I2+SO2↑4.铜与浓硫酸加热反应:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O5.铁与浓硫酸加热反应:2Fe+6H2SO4(浓)Fe2(SO4)3 +3SO2↑+6H2O6.锌与浓硫酸常温下反应:Zn+2H2SO4(浓)==ZnSO4+SO2↑+2H2O7.碳与浓硫酸加热反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O8.硫与浓硫酸加热反应:S+2H2SO4(浓)3SO2↑+2H2O9.Na2SO3粉末与浓硫酸反应:Na2SO3+H2SO4(浓)==Na2SO4+ SO2↑+ H2O(五)与硫酸盐有关的反应方程式:1.CuSO4溶液与Ba(OH)2溶液反应:CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓Cu2++SO42−+Ba2++2OH−==BaSO4↓+Cu(OH)2↓2.NaHSO4溶液与Ba(OH)2溶液混合呈中性:2H++SO42−+2OH−+Ba2+=BaSO4↓+2H2O 向NaHSO4溶液中滴加Ba(OH)2溶液至SO42−沉淀完全:Ba2++SO42−+H++OH−==BaSO4↓+ H2O十二、硅及其化合物有关反应方程式(一)与硅单质有关的反应方程式:1.硅与氧气反应:Si+O2SiO22.硅与氯气反应:Si+2Cl2SiCl43.硅与碳反应:Si+C SiC4.硅与氢氟酸反应:Si+4HF==SiF4↑+2H2↑5.硅与NaOH溶液反应:Si+2NaOH+H2O==Na2SiO3+2H2↑Si+2OH-+H2O==SiO32−+2H2↑(二)与二氧化硅有关的反应方程式:1.SiO2与碳反应:2C+SiO2Si+2CO↑2.SiO2与CaO反应:SiO2+CaO高温CaSiO33.SiO2与氢氟酸反应:SiO2+4HF==SiF4+2H2O4.SiO2与NaOH溶液反应:SiO2+2NaOH==Na2SiO3+H2O SiO2+2OH−==SiO32−+H2O5.SiO2与Na2CO3高温反应:SiO2+Na2CO3高温Na2SiO3+CO2↑6.SiO2与CaCO3高温反应:SiO2+CaCO3高温CaSiO3+CO2(三)与硅酸盐有关的反应方程式:1.Na2SiO3溶液与少量CO2反应:Na2SiO3+CO2+H2O==H2SiO3↓+ Na2CO3 SiO32−+CO2+H2O==H2SiO3↓+ CO32−2.Na2SiO3溶液与过量CO2反应:Na2SiO3+2CO2+2H2O==H2SiO3↓+ 2NaHCO3 SiO32−+2CO2+2H2O==H2SiO3↓+2HCO3−。
高中化学镁化学篇一:2016高考化学一轮复习考点集训镁的化学性质镁的化学性质【知识点的知识】一、Mg、Al的化学性质对比1、与非金属反应(1)与O2反应:常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能.镁、铝都能在空气中燃烧:2Mg+O2点燃ˉ2MgO,4Al+3O2点燃ˉ2Al2O3与卤素单质、硫等反应:Mg+Cl2点燃ˉMgCl2,2Al+3Cl2点燃ˉ2AlCl32Al+3S△ˉAl2S3 (用于工业制备Al2S3),Mg+S△ˉMgS特别提醒:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧.镁在空气中燃烧时有三个反应发生:2Mg+O2点燃ˉ2MgO,3Mg+N2点燃ˉMg3N2,2Mg+CO2点燃ˉ2MgO+C;②燃烧时都放出大量的热,发出耀眼的白光.利用镁的这种性质来制造照明弹;③集气瓶底部都要放一些细纱,以防止集气瓶炸裂.2、与H2O反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气Mg+2H2O△ˉMg(OH)2+H2↑ 2A1+6H2O△ˉ2A1(OH)3+3H2↑3、与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2SO4,冷浓硝酸中发生钝化现象.所以可用铝制容器贮存冷的浓硫酸或浓硝酸.4、与某些氧化物反应(1)镁与二氧化碳反应:2Mg+CO2点燃ˉ2MgO+C;[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂.铝热反应:2Al+Fe2O3高温ˉ2Fe+Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等.[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、MnO2等.②铝热反应的特点是反应放出大量的热,使生成的金属呈液态.③要使用没有氧化的铝粉,氧化铁粉末要烘干.④KClO3作为引燃剂,也可以用Na2O2代替.实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃.5、与碱反应镁不与碱反应,铝与碱液反应:2Al+2NaOH+6H2O=2NaAlO2+4H2O+3H2↑二、工业制备镁和铝:1、工业制备镁:电解熔融状态的氯化镁制取镁阳极反应:2Cl-e-═Cl2↑;阴极反应:Mg2++2e-═Mg总反应:MgCl2(熔融)通电ˉMg+Cl2↑说明:氧化镁比氯化镁熔点高,为了降低能耗,工业电解制取镁采用的原料是氯化镁而不是氧化镁.2、工业制备铝:电解熔融状态的氧化铝和冰晶石的混合物阳极反应:6O2e-═3O2↑;阴极反应:4Al3++12e-═4Al总反应式:2Al2O3(熔融)通电ˉ4Al+3O2↑说明:虽然氧化铝比氯化铝的熔点高,但由于氯化铝是共价化合物,熔融状态不能得到Al单质,因此需要电解氧化铝,但由于氧化铝的熔点很高,因此加入冰晶石降低熔点.一、选择题(共15小题)1.某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生,为探究该反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是()选项实验及现象结论A 将湿润的红色石蕊试纸放在试管口,试纸变蓝反应中有NH3产生B 收集产生的气体并点燃,火焰呈淡蓝色反应中有H2产生C 收集气体的同时测得溶液的pH为8.6 弱碱性溶液中Mg也可被氧化D 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生弱碱性溶液中OH氧化了MgA. A B. B C. C D. D2.下列实验中,不能观察到明显变化的是()A.把一段打磨过镁带放入冷水中B.把铝条放入NaOH溶液中C.把绿豆大的钠投入到KCl溶液中D.把溴水滴加到淀粉KI溶液中3.根据陈述的知识,类推得出的结论正确的是()A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2OB.乙烯(CH2=CH2)可使酸性高锰酸钾溶液褪色,则丙烯(CH3﹣CH=CH2)也可以使其褪色C. CO2和SiO2化学式相似,则CO2与SiO2的物理性质也相似D.金刚石的硬度大,则C60的硬度也大﹣4.下列物质能跟镁反应并生成氢气的是()A.常温下在蒸馏水中 B.氢氧化钠溶液C.氯化铵溶液 D.碳酸钠溶液5.工业上制镁粉是将镁蒸气在某种冷却剂中冷却而制得的,下列(来自: 小龙文档网:高中化学镁化学)物质:①空气;②CO2;③Ar;④H2;⑤N2;⑥H2O中,可做冷却剂的是()A.①② B.③④ C.③⑥ D.③⑤6.下列说法正确的是()A.通过电解氯化钠水溶液可制得金属钠和氯气B.氯化铁溶液能腐蚀铜制容器C.在食品袋中放置盛有铁粉、碳、氯化钠等物质的透气小袋,可防止食物氧化变质D.点燃的镁条伸入二氧化碳气体会氮气中都能继续燃烧7.分别取等质量的Mg、Fe细小颗粒进行下列操作:I.将镁铁混合均匀后,一次性加入足量的稀硫酸,得到图A、B;II.分别向盛镁铁的两试管中逐滴缓慢滴入等浓度稀硫酸(滴速相同),得到关系为C、D,则下列图示正确的是()A.B.C.D.8.点燃的镁条在下列气体中完全熄灭的是()A. N2 B. CO2 C. Ar D. Cl29.在CO2中,Mg燃烧生成MgO和C.下列说法正确的是()A.该反应属于置换反应B.C和C是碳元素的两种同素异形体C.该反应中化学能全部转化为热能D.在该反应条件下,C的还原性强于Mg的还原性10.取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该实验下列说法不正确的是()A.温度越高,镁与水反应的速率越快B.镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑C.氢氧化镁显碱性,且在水中有一定的溶解性D.氢氧化镁是离子化合物,它的电子式可表示为:11.Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L.下列推断中不正确的是()A.参加反应的Mg、Al共0.2 mo1B.参加反应的HC1为0.4molC. Mg、Al在反应中共失去0.4 mol电子D.若与足量的稀硫酸反应能产生0.2molH212.下列实验中,不能观察到明显变化的是()A.把一段打磨过的镁带放入少量冷水中B.把Cl2通入FeCl2溶液中C.把绿豆大的钾投入到水中D.把溴水滴加到KI淀粉溶液中13.如图是实验室制取无水氯化镁的装置图,下列有关表述正确的是()A.装置A中圆底烧瓶中可以换成固体MnO2B.如果直接加热MgCl2?6H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgOC.尾气吸收可以用浓硫酸作为吸收剂进行吸收D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火14.把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示.下列说法中不正确的是()A. a的取值范围为0≤a<50B.的最大值为2.5C.若将关系图改为B图时,则a的取值范围为80<a<90 D.若将关系图改为C图时,则a的取值范围为75<a<9015.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是()A. 2mol/L H2SO4 溶液 B. 18mol/L H2SO4溶液﹣1﹣1 C. 6mol/L KOH 溶液 D. 3mol/L HNO3溶液二、填空题(共5小题)16.如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:(1)实验中观察到的现象是.A.试管中镁片逐渐溶解B.试管中产生无色气泡C.烧杯外壁变冷D.烧杯底部析出少量白色固体试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).(3)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.﹣1﹣117.简要回答下列问题(并写出问题1、2、4的方程式)(1)镁燃烧时不能用二氧化碳来扑灭,其原因是.为什么不能用铜制容器盛氯化铁溶液?.(3)当人误食重金属盐时,可以喝大量牛奶、蛋清或生豆浆解毒.重金属盐使人中毒的原因是:.(4)冬季,渔民常在放干水的池塘里遍撒一些漂白粉,其目的是.18.如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:(1)实验中能观察到的现象是.(选填代号)A.试管中镁片逐渐溶解 B.试管中产生无色气泡C.烧杯外壁变冷 D.烧杯底部析出少量白色固体篇二:镁及其化合物的化学方程式和离子方程式镁及其化合物的化学方程式和离子方程式一、镁1、镁在氧气中燃烧:2Mg+O22、镁在氯气中燃烧:Mg+Cl23、镁在氮气中燃烧:3Mg+N24、镁在二氧化碳中燃烧:2Mg+CO25、镁与硫共热:Mg+S6、镁与水共热:Mg+2H2O7、镁和盐酸反应:Mg+2HClMg+2H+2MgO MgCl2 Mg3N22MgO+CMgSMg(OH)2 +H2 ↑ MgCl2+H2 ↑ Mg2+H2 ↑+8、镁和醋酸反应: Mg+2CH3COOHMg+2CH3COOH9、镁和氯化铵溶液反应: Mg+2NH4ClMg+2NH4+(CH3COO)2Mg+H2 ↑ 2CH3COO+Mg2+H2 ↑-+MgCl2+2NH3 ↑+H2 ↑ Mg2+2NH3 ↑+H2 ↑+10、将少量的镁投入到氯化铁溶液中: Mg+2FeClMg+2Fe3+2FeCl2+MgCl2 Mg2+2Fe2++11、将过量的镁投入到氯化铁溶液中: 3Mg+2FeCl 33Mg+2Fe312、镁和硫酸铜溶液反应: Mg+CuSO4Mg+Cu213、镁和浓硫酸反应: Mg+2H2SO414、镁和浓硝酸反应: Mg+4HNO3Mg+4H+2NO3+-++3MgCl2+2Fe 3Mg2+2FeMgSO4+Cu Mg2+Cu+MgSO4+SO2 ↑+2H2O Mg(NO3)2 +2NO2 ↑+2H2O Mg2+2NO2 ↑+2H2O+15、镁和稀硝酸反应: 3Mg+8HNO3+3Mg(NO3)2 +2NO ↑+4H2O-3Mg+8H+2NO3二、氧化镁1、氧化镁与盐酸反应:MgO+2HClMgO+2H+Mg2+2NO ↑+4H2O+MgCl2+H2O Mg2+H2O2、氧化镁和醋酸反应: MgO+2CH3COOHMgO+2CH3COOH3、氧化镁溶于氯化铵溶液中: MgO+2NH4ClMgO+2NH4+(CH3COO)2Mg+H2O Mg2+2CH3COO+H2O+-MgCl2+2NH3 ↑+H2O Mg2+2NH3 ↑+H2O+4、氧化镁投入到氯化铁溶液中: 3MgO+2FeCl3+3H2 O3MgO+2Fe3+3H2O+3MgCl2+2Fe(OH)3 3Mg2+2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2 +2HClMg(OH)2 +2H+MgCl2+2H2O Mg2+2H2O+2、氢氧化镁和醋酸反应: Mg(OH)2 +2CH3 COOHMg(OH)2 +2CH3COOH3、氢氧化镁溶于氯化铵溶液中: Mg(OH)2+2NH4 ClMg(OH)2 +2NH4+(CH3COO)2Mg+2H2O 2CH3COO+Mg2+2H2O-+MgCl2+2NH3 ↑+2H2O Mg2+2NH3 ↑+2H2O4、氢氧化镁投入到氯化铁溶液中: 3Mg(OH)2 +2FeCl33Mg(OH)2 +2Fe35、氢氧化镁受热分解: Mg(OH)2四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO3Cl+Ag-++3MgCl2+2Fe(OH)3 3Mg2+2Fe(OH)3+MgO+H2O2AgCl ↓+Mg(NO3)2AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2 ↓+2NaClMg2+2OH+Mg(OH)2 ↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2OMg2+2NH3·H2O+Mg(OH)2 ↓+2NH4Cl Mg(OH)2 ↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液: MgCl2+2NaAlO2+4H2 OMg2+2AlO2+4H2O+-Mg(OH)2 ↓+2Al(OH)3 ↓+2NaCl Mg(OH)2 ↓+2Al(OH)3 ↓Mg+Cl2 ↑Mg(OH)2 ↓+H2 ↑+Cl2 ↑Mg(OH)2 ↓+H2 ↑+Cl2 ↑5、电解氯化镁的熔融液: MgCl26、电解氯化镁的溶液:MgCl2+2H2OMg2+2Cl+2H2O+-五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2O++MgCO3+2H===Mg2+CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg +CO2↑+H2O-+MgCO3+2CH3COOH===2CH3COO+Mg2+CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2+-MgCO3+CO2+H2O===Mg2+2HCO34、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑++3MgCO3+2Fe3+3H2O===3Mg2+2Fe(OH)3↓+3CO2↑ 5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑++MgCO3+2NH4===Mg2+2NH3↑+CO2↑ 6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2O-+HCO3+H===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3+-Mg2+2OH===Mg(OH)2↓ 3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3 +2H2O+---Mg2+2HCO3+4OH===Mg(OH)2↓ +2CO32+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3 ↓+2H2O+-+-Mg2+2HCO3+2Ca2+4OH===Mg(OH)2↓ +2CaCO3↓+2H2O 5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO2↑+H2O篇三:鲁科版高一化学知识点总结-镁及其化合物2.镁〖化学性质〗(1)与非金属反应(发出耀眼的白光,生成淡黄色固体)+(2)与酸反应a.与非氧化性酸反应产生氢气:+=+ (发出耀眼的白光,生成白色固体)b.与硝酸、浓硫酸等具有强氧化性的酸在常温下也反应,但不生成氢气(3)与非金属氧化物反应(发出耀眼的白光,生成白色和黑色固体)3.从海水中提取镁第一步:先将贝壳煅烧成生石灰,并制成石灰乳第二步:将石灰乳加入海水沉淀池得到氢氧化镁第三步:将氢氧化镁与盐酸反应生成六水合氯化镁,再在氯化氢气流中加热脱水,使其转化为氯化镁(+=+)第四步:电解熔融的氯化镁得到金属镁和氯气4.氧化镁〖物理性质〗白色固体,熔点高〖化学性质〗。
Na 、Mg 、Al 、Fe 及其化合物的化学方程式和离子方程式一、Na 及其化合物的化学方程式和离子方程式 (1)Na 的反应 1、钠和水反应:方程式: 2Na+2H 2O=2NaOH+H 2↑ 离子方程式: 2Na+2H 2O=2Na +2OH -+H 2↑ 2.钠分别和氧气、硫、氯气: 2Na+O 2点燃Na 2O 2 (或加热) 4Na+O 2 = 2Na 2O2Na+S =Na 2S 2Na+Cl 2 点燃2NaCl3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑ 方程式: 2Na+H 2SO 4=Na 2SO 4+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑方程式:2Na+2CH 3COOH=2CH 3COONa+H 2↑ 离子方程式: 2Na+2CH 3COOH=2CH 3COO -+2Na ++H 2↑ 4.钠分别和硫酸铜溶液、氯化铁溶液方程式: 2Na +2H 2O+CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑ 离子方程式: 2Na +2H 2O+Cu 2+=Cu(OH)2↓+2Na ++H 2↑ 方程式: 6Na +6H 2O+2FeCl 3=2Fe(OH)3↓+6NaCl+3H 2↑ 离子方程式: 6Na +6H 2O+2Fe 3+=2Fe(OH)3↓+6Na ++3H 2↑(2)Na 的氧化物反应 1.氧化钠分别与水、盐酸方程式: Na 2O+H 2O=2NaOH 离子方程式: Na 2O+H 2O=2Na ++2OH - 方程式: Na 2O+2HCl=2NaCl+H 2O 离子方程式: Na 2O+2H +=2Na ++H 2O 2.过氧化钠分别与盐酸、水方程式: 2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑ 离子方程式: 2Na 2O 2+4H + =4Na ++2H 2O+O 2↑ 方程式: 2Na 2O 2+2H 2O=4NaOH+O 2↑ 离子方程式: 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ 3.过氧化钠分别与二氧化碳:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 (3)Na 2CO 3、NaHCO 3盐的反应1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na 2CO 3、NaHCO 3的方法)碳酸钠受热不分解 2NaHCO 3△Na 2CO 3+H 2O+CO 2↑2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na 2CO 3+HCl =NaHCO 3 +NaCl CO 32-+H +=HCO 3-NaHCO 3+HCl =NaCl+CO 2↑+H 2O HCO 3-+H +=CO 2↑+H 2O过量的盐酸时:Na2CO3+2HCl=2NaCl+CO2↑+H2O CO32-+2H+=CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量的醋酸时:Na2CO3+CH3COOH=NaHCO3+CH3COONaCO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2OCO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2ONaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+ Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或 CO2+ Na2CO3+H2O=2 NaHCO3↓ CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合 (类似:澄清石灰水可以改为氢氧化钡溶液)少量澄清石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO32 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量澄清石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOHHCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合方程式: NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑ 2NaCl+2H2O 电解Cl2↑+H2↑+2NaOH 2Cl-+2H2O电解Cl2↑+H2↑+2OH-9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么(用方程式或离子方程式表示) 溶液呈红色CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3+ OH-溶液呈碱性二、Mg 、Al 及其化合物的化学方程式和离子方程式 (1)Mg 的反应1.镁在空气中燃烧2Mg + O 2 2MgO 3Mg +N 2 Mg 3N 2 2Mg + CO 2 2MgO + C 2.镁能溶解在氯化铵溶液中Mg + 2NH 4Cl = MgCl 2 + H 2↑+ NH 3↑ Mg + 2NH 4+= Mg 2++ H 2↑+ NH 3↑ (2) Al 的反应3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明:4Al+3O 2=2Al 2O 3 在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。
化学方程式和离子方程式钠及其化合物一、钠1、钠在氧气中燃烧:2Na+O 2Na2O22、钠在氯气中燃烧:2Na+Cl 22NaCl3、钠常温条件下和氧气反应:4Na+O 22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H +2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl 44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO 2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H +2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl 3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO 22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H +4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH -Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH -5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH -2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO 2Na2CO3+H2O2OH-+CO 2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO 2NaHCO3 OH-+CO 2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO 2Na2SO3+H2O2OH-+SO 2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO 2NaHSO3 OH-+SO 2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH -2PO43-+3H2O 12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH -NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH -2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO 2Na2SiO3+H2O2OH-+SiO 2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH -SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O H++OH -H2O 17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH -CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH -S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH -HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH -H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH -PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH -AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH -AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH -Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH -Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH -Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH -AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH -NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH -NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH -CO32-+NH3↑+2H2O 31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH -CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH -CaCO3+CO32-+2H2O 34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH -Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O Mg2++2HCO32-+4OH -Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO 3AgCl↓+NaNO3Cl-+Ag +AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO 4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl 2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H +HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H +CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O CO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H +CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O HCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl 3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl 3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH -CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH -CaCO3↓+CO32-+2H2O 9、碳酸氢钠受热分解:2NaHCO 3Na2CO3+CO2↑+H2O镁及其化合物一、镁1、镁在氧气中燃烧:2Mg+O 22MgO2、镁在氯气中燃烧:Mg+Cl 2MgCl23、镁在氮气中燃烧:3Mg+N 2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO 22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H +Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl 32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl 33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO 4MgSO4+CuMg+Cu2+Mg2++Cu 13、镁和浓硫酸反应:Mg+2H2SO 4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO 3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO 33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H +Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O 4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H +Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl 33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO 32AgCl ↓+Mg(NO3)2Cl-+Ag +AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH -Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O==Mg(OH)2↓+2Al(OH)3↓+2NaCl Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl 2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO 3-+4OH-===Mg(OH)2↓+2CO32-+2H2O 4、碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O Mg2++2HCO 3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO 2↑+H2O 铝及其化合物一、铝1、铝在氧气中燃烧:4Al+3O 22Al2O32、铝在氯气中燃烧:2Al+3Cl 22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH +2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO 4Al2(SO4)3+3H2OAl2O3+6H +2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O3、电解氧化铝的熔融液:2Al2O 34Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2OAl(OH)3+3H+Al3++3H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-==2AlO2-+3BaSO4↓+4H2O 7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O 9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O==2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O==2Al(OH)3↓+3Na2SO4+3H2S↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O==2Al(OH)3↓+3Na2SO4+6H2S↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O==2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-冰晶石电解2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O===3Al(OH)3↓+Fe(OH)3↓+3NaCl 3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
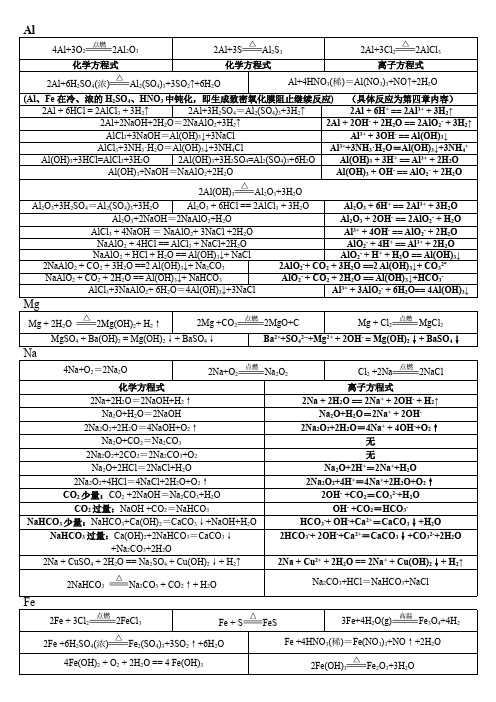
镁及其化合物的化学方程式和离子方程式
一、镁
1、镁在氧气中燃烧:2Mg+O22MgO
2、镁在氯气中燃烧:Mg+Cl2MgCl2
3、镁在氮气中燃烧:3Mg+N2Mg3N2
4、镁在二氧化碳中燃烧:2Mg+CO22MgO+C
5、镁与硫共热:Mg+S MgS
6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑
7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑
Mg+2H+Mg2++H2↑
8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑
Mg+2CH3COOH2CH3COO-+Mg2++H2↑
9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑
Mg+2NH4+Mg2++2NH3↑+H2↑
10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2
Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe
3Mg+2Fe3+3Mg2++2Fe 12、镁和硫酸铜溶液反应:Mg+CuSO4MgSO4+Cu
Mg+Cu2+Mg2++Cu
13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O
14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2O
Mg+4H++2NO3-Mg2++2NO2↑+2H2O
15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O
3Mg+8H++2NO3-Mg2++2NO ↑+4H2O
二、氧化镁
1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2O
MgO+2H+Mg2++H2O
2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2O
MgO+2CH3COOH Mg2++2CH3COO-+H2O
3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2O
MgO+2NH4+Mg2++2NH3↑+H2O
4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)3
3MgO+2Fe3++3H2O3Mg2++2Fe(OH)3
三、氢氧化镁
1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2O
Mg(OH)2+2H+Mg2++2H2O
2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2O
Mg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O 3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2O
Mg(OH)2+2NH4+Mg2++2NH3↑+2H2O 4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)3
3Mg(OH)2+2Fe3+3Mg2++2Fe(OH)3
5、氢氧化镁受热分解:Mg(OH)2MgO+H2O
四、氯化镁
1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2
Cl-+Ag+AgCl ↓
2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
Mg2++2OH-Mg(OH)2↓
3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4Cl
Mg2++2NH3·H2O Mg(OH)2↓+2NH4+
4、氯化镁溶液中加入偏铝酸钠溶液:
MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaCl
Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓
5、电解氯化镁的熔融液:MgCl2Mg+Cl2↑
6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑
Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑
五、碳酸镁
1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2O
MgCO3+2H+===Mg2++CO2↑+H2O
2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O
MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O
3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2
MgCO3+CO2+H2O===Mg2++2HCO3-
4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑
3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑
MgCO3+2NH4+===Mg2++2NH3↑+CO2↑
6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑
六、碳酸氢镁
1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2O
HCO3-+H+===CO2↑+H2O
2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3
Mg2++2OH-===Mg(OH)2↓
3、碳酸氢镁与过量的氢氧化钠溶液反应:
Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2O
Mg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O
4、碳酸氢镁与澄清石灰水反应:
Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O
Mg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
5、碳酸氢镁受热分解:Mg(HCO3)2△
MgCO3↓+CO2↑+H2O。