有机化学(武汉大学)7 解题分析
- 格式:ppt
- 大小:603.00 KB
- 文档页数:37

第七章1. 什么是化学反应的平均速率,瞬时速率?两种反应速率之间有何区别与联系? 答2. 分别用反应物浓度和生成物浓度的变化表示下列各反应的平均速率和瞬时速率,并表示出用不同物质浓度变化所示的反应速率之间的关系。
这种关系对平均速率和瞬时速率是否均适用?(1) N 2 + 3H 2 → 2NH 3 (2) 2SO 2 + O 2 →2SO 3 (3) aA + Bb → gG + hH 解 (1)V =tN △△][2= t H △△][2=t NH △△][3V 瞬=0lim→t △t N △△][2 = 0lim →t △t H △△][2 =0lim→t △t NH △△][3V 2N =31V 2H =21V 3NH 两种速率均适用。
(2)(3)(同1)。
3. 简述反应速率的碰撞理论的理论要点。
答4. 简述反应速率的过渡状态理论的理论要点。
答3级,910K时速率常数为5.反应C2H6→C2H4+ H2,开始阶段反应级数近似为2γ(以1.13dm1.5·mol5.0-·s1-。
试计算C2H6(g)压强为1.33×104Pa时的起始分解速率0 [C2H6]的变化表示)。
解6.295K时,反应2NO + Cl2→2 NOCl,其反应物浓度与反应速率关系的数据如下:(2)写出反应的速率方程;(3)反应的速率常数为多少?解7.反应2 NO(g)+ 2 H2(g)→N2(g)+ 2 H2O其速率方程式对NO(g)是二次、对H2(g)是一次方程。
(1)写出N2生成的速率方程式;(2)如果浓度以mol·dm—3表示,反应速率常数k的单位是多少?(3)写出NO浓度减小的速率方程式,这里的速率常数k和(1)中的k的值是否相同,两个k值之间的关系是怎样的?解8.设想有一反应Aa + bB + cC →产物,如果实验表明A,B和C的浓度分别增加1倍后,整个反应速率增为原反应速率的64倍;而若[A]与[B]保持不变,仅[C]增加1倍,则反应速率增为原来的4倍;而[A]、[B]各单独增大到4倍时,其对速率的影响相同。

武汉大学化学与分子科学学院《有机化学》期末试卷2 0 0 4——2 0 0 5年度第一学期2 0 0 4年1月6日一.选择题,每一问或说明有四个可供选择的答案,请选择最符合题意的答案,每题2分,共2 0分1.有关周环反应的说法,以下哪种说法不正确?A.是协同反应; B .通过环状过渡态进行;C .反应的动力是光和热;D .极性溶剂能加速反应;2 .在水溶液中,甲胺(a ),二甲胺(b ),苯胺(c ),对硝基苯胺(d )的碱性大小次序是:A. a > b > c > d ; B . b > a > c > d ;C . c > b > a > d : D. d > c > b > a ;4. Choose the best series of reaction for accomplishing the reactionClCHsNH?a2CuCN H2FeCI;KCN NiHNO3Fe Cl2 1.HNO2,H2SO4H30*H2SO4HC;FeCI;2.CUCN.KCNHNO3Cl2Fe 1. HNO2,H2SO4 1.UAIH4H2SO4 Fe—HCI 2. CuCN, KCN 2 H2OHNO3 FeCI2FeCI3H2SO4HCI5. 从苯中除去嗟酚的最好办法是A.层析法;B、蒸馆法;C、硫酸洗涤法;D、溶剂提取法;6. 制多肽时,活化竣基的试剂是A. N B S ; B、D C C ; C、PhCHOCOC 1; D . 红磷 + B r 27. 鉴定a—氨基酸常用A. To liens 试剂:B、水台■面三酮:C.Benedict's 试剂;D V 》一N=C=S8.在下列各糖中,具有还原性的糖是A.淀粉和纤维素;B、甲基葡萄糖昔;C、蔗糖;D、甘露糖9 .咲喃(a ),毗咯(b ),曝吩(c )和苯(d )的稳定性大小次序是A. a > b > c > d ; B . a > c > d > b ;C . b > c > a > d : D. d > c > b > a ;1 0 •下列各化合物,能与重氮盐起偶联反应的是:CH3A- Q-NH严H3 ; B. H 3C~^~N(CH 3)2O CH3_ ✓NO2C- N(CH3)2 D. SO3H填空题,写出每一个字母所代表的结构式或最符合题意的答案,每空2分,共3 0分1 .前线轨道理论认为,周环反应中、最重要的分子轨道是_丄和上;2 •组成蛋白质的基本单位是_C;3 .妻芽糖是由两个_□ 糖以上昔键相连的二糖;4 . D - p毗喃葡萄糖捋a w。

有机化学大学真题答案解析一直是许多大学生头疼的科目之一。
近年来,大学考试的难度也越来越大,考生们需要具备深厚的理论知识和实际操作能力。
本文将从几个典型的题目入手,解析其答案,帮助考生更好地备考。
第一题是关于有机化合物的命名。
通常来说,我们需要了解一些命名规则,如丙酮、乙醇等,这些是比较简单的,容易记忆和辨认的有机化合物。
但在实际考试中,往往会涉及一些复杂的有机化合物,需要我们深入理解的原理和规律。
例如,题目给出了一个结构式,让我们给出命名。
这个题目需要考生掌握不同官能团的命名规则,同时要了解有机化合物的结构特点。
通过将有机化合物的官能团和相应的命名规则联系起来,我们可以正确地命名这个复杂的有机化合物。
第二题是有关化学反应机理的问题。
在中,我们经常遇到各种各样的化学反应,如取代反应、加成反应、消除反应等。
对于这些化学反应的机理,我们需要通过实验和理论知识相结合来进行分析。
例如,题目给出了一个反应方程式,让我们推测反应的具体机理。
对于这个题目,考生需要先了解该反应的类型,然后结合已有的实验结果和理论知识,推断出可能的反应机理。
通过分析反应物和产物的结构特点,我们可以推断出反应的可能机理,并进行解析。
第三题是有关有机合成的问题。
有机合成是的重要内容之一,也是考察考生解决实际问题能力的一个重要方面。
在有机合成中,我们需要根据给出的反应方程式和条件,设计合成路线,完成所需有机化合物的合成。
例如,题目给出了一个目标化合物,让我们设计合成路线。
对于这个题目,考生需要先确定首次发生的反应类型,然后考虑需要进行的反应和合成步骤,最后得到所需的有机化合物。
通过思考和分析,我们可以得到最终的合成方案,并进行解析。
作为一门重要的基础科学,除了在大学中学习和应用之外,也在许多行业中发挥着重要的作用。
的知识和技能不仅对于化学专业的学生来说是必备的,对于其他专业的学生也有重要的借鉴意义。
因此,学好,不仅仅是为了应付考试和取得好成绩,更是为了将来工作中的实际应用和发展。


第1章 分析化学概论1. 称取纯金属锌0.3250g ,溶于HCl 后,定量转移并稀释到250mL 容量瓶中,定容,摇匀。
计算Zn 2+溶液的浓度。
解:2130.325065.390.0198825010Zn c mol L +--==⨯ 2. 有0.0982mol/L 的H 2SO 4溶液480mL,现欲使其浓度增至0.1000mol/L 。
问应加入0.5000mol/L H 2SO 4的溶液多少毫升?解:112212()c V c V c V V +=+220.0982/0.4800.5000/0.1000/(0.480)mol L L mol L V mol L L V ⨯+⨯=⨯+ 2 2.16V mL =4.要求在滴定时消耗0.2mol/LNaOH 溶液25~30mL 。
问应称取基准试剂邻苯二甲酸氢钾(KHC 8H 4O 4)多少克?如果改用22422H C O H O ⋅做基准物质,又应称取多少克? 解:844:1:1NaOH KHC H O n n =1110.2/0.025204.22/ 1.0m n M cV M mol L L g mol g ===⨯⨯=2220.2/0.030204.22/ 1.2m n M cV Mmol L L g mol g ===⨯⨯=应称取邻苯二甲酸氢钾1.0~1.2g22422:2:1NaOH H C O H O n n ⋅= 1111210.2/0.025126.07/0.32m n M cV M mol L L g mol g ===⨯⨯⨯=2221210.2/0.030126.07/0.42m n M cV M mol L L g mol g ===⨯⨯⨯=应称取22422H C O H O ⋅0.3~0.4g6.含S 有机试样0.471g ,在氧气中燃烧,使S 氧化为SO 2,用预中和过的H 2O 2将SO 2吸收,全部转化为H 2SO 4,以0.108mol/LKOH 标准溶液滴定至化学计量点,消耗28.2mL 。

高中化学必修二第七章有机化合物考点题型与解题方法单选题1、下列互为同分异构体的一组是A.氕和氘B.金刚石和石墨C.正丁烷和异丁烷D.甲烷和乙烷答案:C解析:A.氕和氘的质子数相同、中子数不同,互为同位素,A不符合题意;B.金刚石和石墨均是C元素组成的单质,互为同素异形体,B不符合题意;C.正丁烷和异丁烷的分子式均为C4H8,但结构不同,互为同分异构体,C符合题意;D.甲烷和乙烷都是烷烃,结构相似,相差1个CH2,互为同系物,D不符合题意;答案选C。
2、第24届冬季奥林匹克运动会在北京市和张家口市成功举办。
下列不属于化学变化的是A B C DA.冬奥场馆使用CO2跨临界直接制冰(“水立方”场馆中的水冰转换)B.北京冬奥会菜单上有678道菜,其中工作人员对食材进行的煎、炒、烹、炸C.冬奥会开幕式中火炬“飞扬”中氢燃料的燃烧D.冬奥会上采用紫外杀菌技术使蛋白质变性答案:A解析:A.冬奥场馆使用CO2跨临界直接制冰是利用二氧化碳状态转化过程中的能量变化,使水冰转换,为物理变化,A项符合题意;B.北京冬奥会菜单上有678道菜,其中工作人员对食材进行的煎、炒、烹、炸过程发生了化学反应,为化学变化,B项不符合题意;C.冬奥会开幕式中火炬“飞扬”中氢燃料的燃烧是发生了化学反应,为化学变化,C项不符合题意;D.冬奥会上采用紫外杀菌技术使蛋白质变性,发生了化学反应,为化学变化,D项不符合题意;故选:A。
3、下图结构是某高分子化合物的结构片断,则其单体是A.CH2=CH2.CH2=CHCOOHB.CH2=CH-CH=CHCH3.CH2=CHCOOHC.CH2=CH2.CH2=CHCOOH、CH2=CHCH3D.CH2=CHCH2CH2CH3.CH2=CHCOOH答案:B解析:该高分子化合物主链上全部是碳原子,所以它是加聚反应的产物,根据“单键变双键、双键变单键”的原则,可写出其单体为CH2=CH-CH=CHCH3和CH2=CHCOOH,故选B。
光谱分析导论习题解答1、解:(1)72101067.6101050.111⨯=⨯⨯==-λσ(2)14981047.4107.670/100.3/⨯=⨯⨯==-λνc(3)303010103300/1192=⨯⨯==-σλ(4)80.1)10602.1(1095.6889100.310626.6/1910834=⨯÷⨯⨯⨯⨯===---λνhc h E2、解:由计算公式λν/hc h E ==以及各能级跃迁所处的波长范围可得能量范围分别如下:跃迁类型 波长范围 能量范围/eV 原子内层电子跃迁 10-3nm ~10nm 1.26⨯106~1.2⨯102原子外层电子跃迁 200nm ~750nm 6~1.7 分子的电子跃迁 200nm ~750nm 6~1.7 分子振动能级的跃迁 2.5μm ~50μm 0.5~0.02 分子转动能级的跃迁50μm ~100cm2⨯10-2~4⨯10-7由上表可以看出分子电子能级跃迁1~20eV 分子振动能级跃迁0.05~1eV 分子转动能级跃迁<0.05eV ,其电子光谱,振动光谱以及转动光谱所对应的波长范围分别在紫外-可见区,红外区和远红外微波区。
3、解:棱镜的分光原理是光折射。
由于不同波长的光有其不同的折射率,据此能把不同波长的光分开。
光栅的分光原理是光的衍射与干涉的总效果。
不同波长的光通过光栅作用各有相应的衍射角,据此把不同波长的光分开。
光栅光谱棱镜光谱Sin φ与波长成正比,所以光栅光谱是一个均匀排列的光谱色散率与波长有关,为非均匀排列的光谱 光的波长越短则衍射角越小,因此其谱线从紫到红排列波长越短,其偏向角越大,因此其谱线从红到紫排列复合光通过光栅后,中央条纹(或零级条纹)为白色条纹,在中央条纹两边,对称排列着一级、二级等光谱,由于谱线间距离随光谱级数的增加而增加,出现谱级重叠现象没有谱级重叠现象光栅适用的波长范围比棱镜宽4、解:v cn r i ==θθsin sin ,式中n 为折射率,i θ为入射角,r θ为折射角,c 为光速,v 为玻璃介质中的传播速度。


《仪器分析》作业参考答案第2章 光谱分析法导论2-1 光谱仪一般由几部分组成?它们的作用分别是什么? 参考答案:(1)稳定的光源系统—提供足够的能量使试样蒸发、原子化、激发,产生光谱; (2)试样引入系统(3)波长选择系统(单色器、滤光片)—将复合光分解成单色光或有一定宽度的谱带; (4)检测系统—是将光辐射信号转换为可量化输出的信号; (5)信号处理或读出系统—在显示器上显示转化信号。
2-2 单色器由几部分组成,它们的作用分别是什么? 参考答案:(1)入射狭缝—限制杂散光进入;(2)准直装置—使光束成平行光线传播,常采用透镜或反射镜; (3)色散装置—将复合光分解为单色光;(4)聚焦透镜或凹面反射镜—使单色光在单色器的出口曲面上成像; (5)出射狭缝—将额定波长范围的光射出单色器。
2-5 对下列单位进行换算:(1)150pm Z 射线的波数(cm -1) (2)Li 的670.7nm 谱线的频率(Hz )(3)3300 cm -1波数对应的波长(nm ) (4)Na 的588.995nm 谱线相应的能量(eV ) 参考答案:(1)171101067.61015011---⨯=⨯==cm cm λσ (2))(1047.4)(107.670100.314710Hz Hz c⨯=⨯⨯==-λν (3))(3030)(1003.3)(3300114nm cm cm =⨯===-νλ (4))(1.2)(10602.110995.588100.310625.6199834eV eV ch E =⨯⨯⨯⨯⨯⨯==---λ 2-6 下列种类型跃迁所涉及的能量(eV )范围各是多少?(1)原子内层电子跃迁; (4)分子振动能级跃迁; (2)原子外层电子跃迁; (5)分子转动能级跃迁; (3)分子的电子跃迁 参考答案跃迁类型 波长范围 能量范围/eV 原子内层电子跃迁 10-1 ~ 10nm 1.26×106 ~1.2×102原子外层电子跃迁 200 ~ 750nm 6~1.7 分子的电子跃迁 200 ~ 750nm 6~1.7 分子振动能级跃迁 0.75 ~ 50μm 1.7~0.02 分子转动能级跃迁50 ~ 1000μm2×10-2~4×10-7第10章 吸光光度法(上册)2、某试液用2cm 吸收池测量时,T=60%。

武汉大学2005-2006学年度第一学期《分析化学》期末考试试卷(A)一.填空(每空1分。
共35分)1.写出下列各体系的质子条件式:(1)c1(mol/L) NH4H 2PO4(2)c1(mol/L)NaAc+c 2(mol/L)H3BO32.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长,透射比。
3. 检验两组结果是否存在显著性差异采用检验法,检验两组数据的精密度是否存在显著性差异采用检验法。
4.二元弱酸H2B,已知pH=1.92时,δH2B=δHB-;pH=6.22时δHB-=δB2-, 则H2B的p K a1=,p K a2=。
5.已知ϕΦ(Fe3+/Fe2+)=0.68V,ϕΦ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为,化学计量点电位为,电位突跃范围是。
6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由_________变为__________。
7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg,则Fe3+在两相中的分配比= 。
8.容量分析法中滴定方式有 , ,和。
9.I2与Na2S2O3的反应式为。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最大处的波长叫做,可用符号表示。
11.紫外可见分光光度计主要由 , ,, 四部分组成.12.桑德尔灵敏度以符号表示,等于;桑德尔灵敏度与溶液浓度关,与波长关。
13.在纸色谱分离中,是固定相。
14..定量分析过程包括,,,和。
二、简答题(每小题 4分,共20 分,答在所留空白处)1.什么是基准物质?什么是标准溶液?2.分别简单阐述酸碱滴定指示剂,络合滴定指示剂, 氧化还原滴定指示剂和沉淀滴定指示剂指示滴定终点的原理.3.在进行络合滴定时,为什么要加入缓冲溶液控制滴定体系保持一定的pH?4.吸光光度法中测量条件的选择应注意哪几点?5. 分析化学中常用的分离和富集方法有哪些?(回答不能少于8种方法)三、分析方法设计(共15分,写在答题纸上)1. 设计测定含有中性杂质的Na2CO3与Na3PO4混合物中二组分质量分数的分析方案。
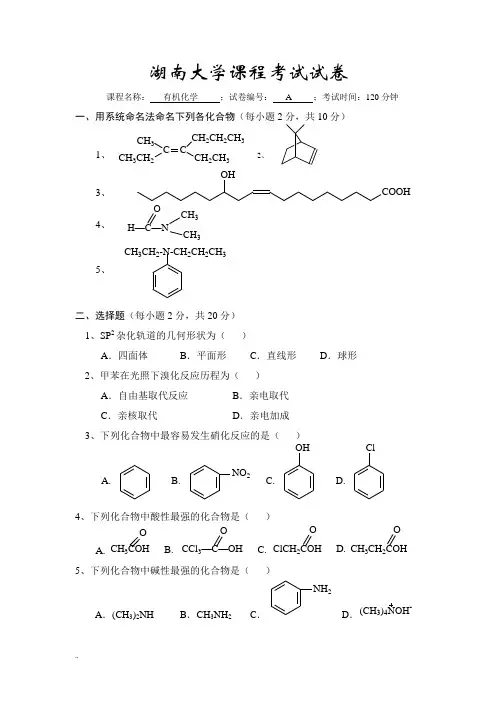
湖南大学课程考试试卷课程名称: 有机化学 ;试卷编号: A ;考试时间:120分钟一、用系统命名法命名下列各化合物(每小题2分,共10分)CH 3C CH 3CH2C2CH 2CH 3CH 2CH31、 2、OHCOOH3、H —C —NCH 3CH 3O4、CH 3CH 2-N-CH 2CH 2CH 35、二、选择题(每小题2分,共20分) 1、SP 2杂化轨道的几何形状为( )A .四面体B .平面形C .直线形D .球形2、甲苯在光照下溴化反应历程为( )A .自由基取代反应B .亲电取代C .亲核取代D .亲电加成3、下列化合物中最容易发生硝化反应的是( )A.B.NO 2C.OHD.Cl4、下列化合物中酸性最强的化合物是( )A.CH 3COH OB. CCl 3—C —OH OC.ClCH 2COH O OD.CH 3CH 2COH 5、下列化合物中碱性最强的化合物是( )A .(CH 3)2NHB .CH 3NH 2C .NH 2D .(CH 3)4NOH -6、下面的碳正离子中稳定的是( )A .CH 3CH 2CH 2+B .33CHC HCH +C .(CH 3)3C +D .CH 3+7、下列化合物按S N 1历程反应速度最快的是( )A. CH 3CH 2CH 2CH 2BrB.CH 2BrCH 2CH 2BrC.D.CH 3CH 2—CH —CH 3Br8、克莱森缩合反应通常用于制备( ) A .β—酮基酯 B .γ—酮基酯 C .β—羟基酯D .γ—羟基酯9、可用下列哪种试剂将醛酮的—C —O还原成—CH 2—( ) A .Na + CH 3CH 2OH B .Zn + CH 3COOH C .Zn – Hg/HClD .NaBH 4/EtOH10、威廉姆森合成法可用于合成( ) A .卤代烃 B .混合醚C .伯胺D .高级脂肪酸三、完成下列反应,写出主要产物(每空2分,共20分)四、分离与鉴别题(12分)1、用化学方法鉴别下列化合物OCH3CCH2CH2CH3,OCH3CH2CCH2CH3,CH3—CHCH2CH2CH3OH2、用化学方法鉴别下列化合物CH2CH3HC=CH2CH2C CH 3、用化学方法分离下列混合物OH,CO2H,NH2五、合成题(除指定原料外,其它试剂可任选)(共24分)1、由四个碳及以下的烃为原料合成ClClO2、由CH2=CH2合成CH3CH2CH2CH2CHCH2CH2CH3OH由合成OCH 3Br3、4、由CH 3CCH 2COC 2H 5O O 合成CH 3C —CHCH 2CH 3OCH 3六、推断题(14分)1、某烃A ,分子式为C 5H 10,它与溴水不发生反应,在紫外光照射下与溴作用只得一种产物B(C 5H 9Br)。
第二章 误差和分析数据处理1、 指出下列各种误差是系统误差还是偶然误差?如果是系统误差,请区别方法误差、仪器和试剂误差或操作误差,并给出它们的减免方法。
答:①砝码受腐蚀:系统误差(仪器误差);更换砝码。
②天平的两臂不等长:系统误差(仪器误差);校正仪器。
③容量瓶与移液管未经校准: 系统误差(仪器误差);校正仪器。
④在重量分析中,试样的非被测组分被共沉淀: 系统误差(方法误差);修正方法,严格沉淀条件。
⑤试剂含被测组分:系统误差(试剂误差);做空白实验。
⑥试样在称量过程中吸潮:系统误差(操作误差);严格按操作规程操作。
⑦化学计量点不在指示剂的变色范围内: 系统误差(方法误差);另选指示剂。
⑧读取滴定管读数时,最后一位数字估计不准: 偶然误差;严格按操作规程操作,增加测定次数。
⑨在分光光度法测定中,波长指示器所示波长与实际波长不符: 系统误差(仪器误差);校正仪器。
⑩在HPLC 测定中,待测组分峰与相邻杂质峰部分重叠 系统误差(方法误差);改进分析方法6、两人测定同一标准试样,各得一组数据的偏差如下:② 为什么两组数据计算出的平均偏差相等,而标准偏差不等; ③ 哪组数据的精密度高? 解:①nd d d d d 321n++++=0.241=d 0.242=d12i -∑=n d s 0.281=s 0.312=s②标准偏差能突出大偏差。
③第一组数据精密度高。
7、测定碳的相对原子质量所得数据:12.0080、12.0095、12.0099、12.0101、12.0102、12.0106、12.0111、12.0113、12.0118及12.0120。
求算:①平均值;②标准偏差;③平均值的标准偏差;④平均值在99%置信水平的置信限。
解:①12.0104i=∑=nx x ②0.00121)(2i =--∑=n x x s③0.00038==ns s④0.00120.000383.25 25.3t 92-2 0.01±=⨯±==±±==时,,查表置信限=f nstns tx u8、在用氯丁二烯氯化生产二氯丁二烯时,产品中总有少量的三氯丁二烯杂质存在。
第7章 醇酚醚习题P173~175:1.(1)(2)(6)(8)2.(4)(5)(6) 5.(1)(3)(5)(9) 9.(3) 10. P332~334: 1.(2)(3)(4) 2.(1)(5)(7)3.(2) 6.补充题:1.写出下列化合物的结构式或用系统命名法命名下列化合物(1) 2,3-二甲基-4-异丙基-2-庚醇; (2) 3-甲基-2,3-辛二醇(3) 2-甲基-5-庚烯-3-醇 (4)OH ClHO(5) CH 3CH(CH 3)2OH (6)CH 2OHCH 2CH 3H 3C2.比较下列化合物的性质,并按由强(大)到弱(小)的顺序排列 (1)乙醇(A )、异丙醇(B )、和叔丁醇(C )发生分子内脱水的反应活性 。
(2)苯甲醇(A )、环已醇(B )、叔丁醇(C )、丙醇(D )与HBr 反应的活性 。
(3)对-硝基苯酚(A )、碳酸(B )、甲醇(C )、苯酚(D )、对-甲基苯酚(E )的酸性 。
3.写出下列化学反应的主要产物(1)CHCH 2CH 2OHOHHCl ZnCl 2(2)(CH 3)2CHCHCH 2CH 3OH[O](3)CH 3CH=CHCH 2CHCH(CH 3)2OH 2(4)CH 3CH 2OHOH NaOHCO 2(5)CH OH [O]4.用简单的化学方法鉴别下列各组化合物 (1) 丙烯(A )、丙炔(B )、3-氯-1-丁烯(C )、正丙醇(D ) (2) 3-甲基-2-丁醇(A )、2-甲基-3-丁烯-1-醇(B )、2-甲基-2-丁烯-1-醇(C )、叔丁醇(D ) 5.两种醇A 和B 的分子式均为C5H12O ,他们氧化后均得到酸性产物。
A 和B 脱水后再氢化得到同一种烃。
A 的脱水产物用酸性高锰酸钾氧化后,得到一种羧酸和CO2。
B 的脱水产物用酸性高锰酸钾氧化后,得到一种酮和CO2。
试写出A 和B 的结构式。
Br (CH 3)2CH-OH (CH 3)2C=O②H 2O C-CH 3OH CH3C CH 2CH 3CH 3OHC CHCH 3CH3(CH 3)3CCH 2(CH 3)2CCH 2CH 3Br + H OCH 3OH + I -CH 3OH CrO 3/吡啶O CH 3CH 2-C=C-CH 2CH 3H 3C CH 3CH 3CH=CHCH 2CH 3CH 3H 2C=CCH3OH OCH 3CH 2-CH=CH 2COOH OH OH HO OH OCH 3+ CH 2=CHCH 2Br23CH 3COCH 3OCH 2CH=CH 2OCH3COOH OH COOH OC-CH 3O OH OH CH 3H 3C 2O O CH 3H 3C OH NO 2C 2H 5BrOC 2H 5NO 2②NaOH OC 2H 5NH 2(CH CO)O OC 2H 5NH-C-CH 3O第7章 醇酚醚习题参考答案P173~175:1.(1)4-甲基-2-戊醇 (2)3,5-二甲基-3-己醇(6)苯乙醚 (8)7-甲基-6-乙基-5-甲氧基-2-辛烯2.(4)(CH 3)2SO (5)O (6)O5.(1)(3)(5)(9)9.(3)10.(1) (2)(3) (4)P332~334:1.(2) (3) (4)3-乙基-4-硝基苯酚2.(1)(5) (7)3.(2)(B )>(E )>(C )>(F )>(D )>(A ) 6.(—)H 3C C CH 褪白—)CH 2=CHCH 3H 2C=CHCHCH ClCH 3CH 2CH 2OH白(CH 3)3C-OH(—)CH 3CH-CHCH 3白OH CH 3CH 2=CH-CHCH 2CH 3CH 3CH=CCH 2OHCH 3几分长时间白立即CH 3CH 2-CHCH 2OHCH 3HOCH 2CH 2-CHCH 3CH 3补充题1.(1) (2) (3)(4)4-氯-1,3-环己二醇 (5)3-甲基-2-异丙基苯酚 (6)5-甲基-2-乙基苄醇 2.(1)(C )>(B )>(A ) (2)(A )>(C )>(B )>(D ) (3)(B )>(A )>(D )>(E )>(C ) 3.4.(1)(2)5.A 、 B 、CH 3-C-CH-CH-CH 2CH 2CH 3CH 3OHCH 3CH(CH 3)2CH 3-CH-C-(CH 2)4CH 3OH OH CH 3CH 3-CH-CH-CH 2CH=CHCH 3CH 3OH。