有机化学武汉大学2碳正离子97页PPT
- 格式:ppt
- 大小:8.51 MB
- 文档页数:97


有机活性中间体——碳正离子的研究一、碳正离子的生成在有机化学反应中碳正离子可以通过不同的方法产生,主要有以下三种。
1、直接离子化[1]在化合物的离解过程中,以共价键的异裂方式产生碳正离子。
最常见的为卤代烃的异裂,在离解过程中,与碳原子相连的卤原子带着一对电子离去,产生碳正离子。
R—X →R+ +X-在这个反应中,极性溶剂的溶剂化作用是生成碳正离子的重要条件。
反应是可逆的,反应生成难溶物或用SbF5作为Lewis酸生成稳定SbF6一,会使反应向右进行,有利于碳正离子的生成。
R—Br+ Ag+→R++ AgBr ;R—F+SbF5→R++SbF6-。
但是醇、醚、酰卤在酸或Lewis酸的催化下也可以离解为碳正离子。
R一0H →R+-OH2→R++H20 ;CH3COF+BF3-→CH3CO++BF4-利用超强酸可以从非极性化合物如烷烃中,夺取负氢离子而生成碳正离子。
(CH3)3CH + SbF5·FSO3H →(CH3)3C++ SbF5·FSO3-+H22、间接离子化[2]主要由其它正离子对中性分子加成而产生的碳正离子,最常见的为烯烃的亲电加成反应和芳环上的亲电取代反应。
C CH;+NO223、其它生成的途径由其它较容易获得的碳正离子转换成较稳定的难以获得的碳正离子。
常见的有重氮基正离子脱N2而生成碳正离子。
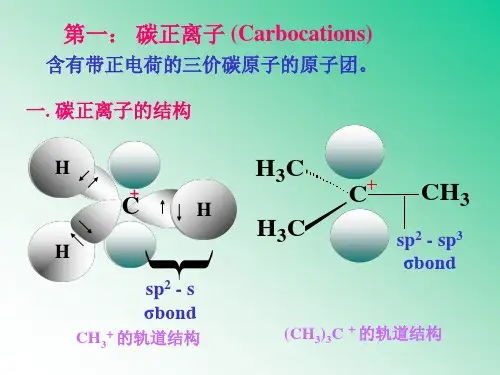
RN R +N2;N 2+N2二、碳正离子的结构碳正离子带有正电荷,其结构是由其本身所决定的,碳正离子的中心碳原子为三价,价电子层仅有六个电子,根据杂化轨道理论,其构型有两种可能:一种是中心碳原子处于sp 3杂化状态下的角锥构型,另一种是中心碳原子处于sp 2杂化状态下的平面构型(见下图)。
SP 3杂化角锥构型 SP 2杂化平面构型在这两种构型中,以平面构型比较稳定,这一方面是由于平面构型中与碳原子相连的三个基团相距最远,空间位阻最小;另一方面是sp2杂化的s成份较多,电子更靠近于原子核,也更为稳定;再一方面空的P轨道伸展于平面两侧,便于溶剂化。





碳正离子碳正离子是一种带正电的极不稳定的碳氢化合物。
分析这种物质对发现能廉价制造几十种当代必需的化工产品是至关重要的。
欧拉教授发现了利用超强酸使碳正离子保持稳定的方法,能够配制高浓度的碳正离子和仔细研究它。
他的发现已用于提高炼油的效率、生产无铅汽油和研制新药物。
碳正离子与自由基一样,是一个活泼的中间体。
碳正离子有一个正电荷,最外层有6个电子。
带正电荷的碳原子以SP2杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。
碳原子剩余的P轨道与这个平面垂直。
碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。
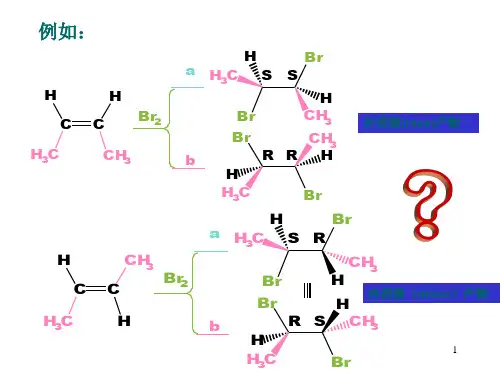
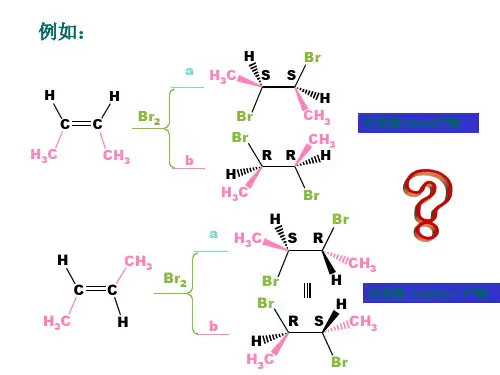
它们稳定性的一般规律如下:(1)苄基型或烯丙型一般较稳定;(2)其它碳正离子是:3°>2°>1°;碳正离子越稳定,能量越低,形成越容易,加成速度也越快,可见碳正离子的稳定性决定烯烃加成的取向。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子碳负离子(Carbanion)指的是含有一个连有三个基团,并且带有一对孤对电子的碳的活性中间体。
碳负离子带有一个单位负电荷,通常是四面体构型,其中孤对电子占一个sp3 杂化轨道。
通过比较相应酸的酸性大小,可以大致判断碳负离子的稳定性大小。
一般地,具有能稳定负电荷的基团的碳负离子具有较高的稳定性。
这些基团可以是苯基、电负性较强的杂原子(如O,N,基团如-NO2、-C(=O)-、-CO2R、-SO2-、-CN和-CONR2等)或末端炔烃(也可看作电负性的缘故),例如,三苯甲烷、三氰基甲烷、硝基甲烷和1,3-二羰基化合物具有较强的酸性。
除此之外,不同于缩酮,缩硫酮的α氢也具有较强的酸性。
这可以用硫的3d轨道与C-S键σ*轨道的超共轭效应来解释。